Il legame covalente.
description
Transcript of Il legame covalente.

Il legame covalente.
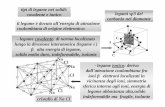
Variazione dell'energia potenziale del sistema biatomico AB in funzione della distanza r fra gli atomi: nel caso a si forma il legame chimico, nel caso b non si forma.

Quando due atomi isolati vengono portati vicino, si originano nuove forze di
attrazione e di repulsione
repulsione
attrazione

Il legame covalente.
Se si ha formazione di legame, abbiamo la sovrapposizione dei due orbitali atomici di partenza con formazione di un nuovo orbitale che comprende i due nuclei e in cui la densità elettronica si concentra fra essi.

Il legame covalente
Legame chimico covalente = sovrapposizione di due orbitali atomici di due atomi per dare luogo ad un orbitale di legame contenente due elettroni a spin antiparallelo.

Un legame covalente è formato da una coppia di elettroni a
spin antiparallelo in compartecipazione fra due
atomi

Formazione di legami a partire da orbitali atomici
s s
pz pz

Il legame covalente di tipo
sovrapposizione s-s
sovrapposizione s-pz
sovrapposizione pz-pz
La sovrapposizione degli orbitali avviene lungo l’asse congiungente i nuclei (asse z)

Il legame covalente di tipo La sovrapposizione degli orbitali avviene lungo
l’asse congiungente i nuclei (asse z)
L’orbitale di legame risultante ha alta densità elettronica fra i due nuclei.
La densità elettronica ha simmetria cilindrica intorno all’asse di legame.
La sovrapposizione non diminuisce per rotazione intorno a questo asse.
Il legame è forte.
Due atomi sono legati covalentemente se fra loro esiste un legame .
Tra due atomi può esistere un unico legame covalente di tipo

Il legame .

Il legame covalente di tipo Avviene per sovrapposizione laterale di due orbitali
atomici di tipo p.
L’orbitale di legame risultante ha densità elettronica pari a zero lungo l’asse di legame, e diversa da zero
al di sopra e al di sotto di questo .
La densità elettronica non ha simmetria cilindrica intorno all’asse di legame.
Per rotazione intorno all’asse di legame la sovrapposizione diminuisce.
Il legame è più debole del legame .
Si stabilisce fra atomi già legati via legame .Tra due atomi possono esserci fino a due legami di
tipo

La molecola HF
Orbitali 2px e 2 py pieni
Orbitale 2pz con un e- spaiato Sovrapposizione s-pz
=legame
H-FFormalismo di Lewis: coppie di legame e di non legame

Il legame e nelle molecole e ioni biatomici

Ordine di legame
• Un legame semplice ha ordine 1
• Un doppio legame ha ordine 2
• Un triplo legame ha ordine 3
• In generale i doppi legami sono piu’ corti di quelli semplici, e i legami tripli lo sono ancora di piu’

Energia di dissociazione
energia di dissociazione = - energia potenzialeenergia di dissociazione > 0
Energiapotenziale
-436 kJ/mol-104 kcal/mol
Forze repulsive
Forze attrattive
Distanza di legame
0

Lunghezza di legame ed energia di dissociazione
Legame Lunghezza
(pm)
Energia di dissociazione
(kJ mol-1)
C-C 154 343
C=C 133 615
CC 120 812
N-N 147 159
N=N 125 418
NN 110 946
C-N 147 293
C=N 125 615
CN 115 879

La geometria in molecole e ioni poliatomici
La regola delle repulsioni nelle molecole poliatomiche
VSEPR Valence Shell Electron Pair Repulsion

VSEPR
Le regioni di elevata concentrazione elettronica si respingono a vicenda.
Disposizione di cariche elettriche dello stesso segno sulla superficie di una sfera.


Sruttura delle molecole
• Le regioni di elevata concentrazione elettronica si respingono a vicenda.
• Es. : AXn
• AX2 BeCl2
• AX3 BF3
• AX4 CH4
• AX5 PCl5
• AX6 SF6

Coppie di non legame e geometria molecolare
• Numero di regioni di elevata concentrazione elettronica
=
numero complessivo delle coppie di legame e delle coppie di non legame che si trovano intorno all’atomo centrale.
• La coppia di non legame esercita una repulsione maggiore delle coppie di legame e quindi la geometria sarà leggermente distorta.
coppia di legame
coppia di
non legame

Molecola AXnEm
dove n = numero di atomi legati
all’atomo centralem = numero di coppie di non legame sull’atomo centrale

n+m Disposizione
coppie elettroniche
n m Classe di molecola
Forma della molecola esempi
2 Lineare 2 0 AX2 Lineare BeH2
BeCl2
3 Triangolo equilatero
3
2
0
1
AX3
AX2E
Triangolo equilatero
Angolare
BF3
SnCl2
4 Tetraedro 4
3
2
0
1
2
AX4
AX3E
AX2E2
Tetraedro
Piramide triangolare
Angolare
CH4
NH3
H2O
5 Bipiramide trigonale
5
4
3
2
0
1
2
3
AX5
AX4E
AX3E2
AX2E3
Bipiramide trigonale
Bisfenoide
Forma a T
Lineare
PCl5
SF4
ClF3
XeF2
6 Ottaedro 6
5
4
0
1
2
AX6
AX5E
AX4E2
Ottaedro
Piramide quadrata
Quadrata planare
SF6
BrF5
XeF4

Le molecole a bipiramide trigonaleIl tetraedro e l’ottaedro sono poliedri regolari con vertici
equivalenti; ciascuno vede lo stesso numero di vicini più prossimi alla stessa distanza.
Nella bipiramide trigonale i cinque vertici non sono equivalenti: quelli apicali hanno tre vicino a 90°; quelli equatoriali vedono due vicini a 90° e altri due a 120°.Quindi le posizioni assiali sono più “costipate “di quelle equatoriali. Le posizioni equatoriali saranno occupate di preferenza dalle coppie di non legame, che sono più ingombranti.

Regole semplici per la scrittura delle formule di struttura
• Calcolare il numero di elettroni di valenza e quindi delle coppie elettroniche
• Decidere l’atomo centrale• Unire con legame l’atomo centrale agli atomi periferici• Distribuire sugli atomi periferici le ulteriori coppie elettroniche
(fino a completamento dell’ottetto*)• Aggiungere le eventuali ulteriori coppie elettroniche di non
legame sull’atomo centrale• Decidere la disposizione delle coppie n+m secondo la regola della
repulsione delle coppie elettroniche• Decidere la forma della molecola• Valutare la possibilita’ di formazione di legami multipli dando
luogo a formule di risonanza**

Regola dell’ottettoRegola dell’ottettoOgni atomo che utilizza nel legame i soli orbitali
s e p tende ad assumere in un composto una configurazione elettronica esterna con otto
elettroni

Regola dell’ottetto• Nel formare un composto gli atomi tendono a conseguire la
configurazione di un gas nobile.• Ottetto perché, ad eccezione di He, i gas nobili hanno
configurazione elettronica esterna ns2 np6.• Più propriamente si può dire che nel formare legami gli
atomi utilizzano gli orbitali energeticamente accessibili.• Quindi la regola dell’ottetto vale in forma stretta solo per
gli elementi del secondo periodo.• Si può utilizzare però nella scrittura di formule di
struttura per decidere il numero di coppie sugli atomi periferici, con l’eccezione di H (che ha un solo orbitale a disposizione e quindi non può avere coppie di non legame).

Formule di strutturaFormule di struttura

Calcolo del numero di elettroni della configurazione elettronica esterna addizionato del numero di eventuali cariche negative o diminuito di eventuali cariche positive nel caso di ioni poliatomici:
4 (C) + 1 (H)• 4 = 8
Numero di coppie elettroniche:8/2 = 4
Individuazione dell’atomo centrale:C
C
H
HH
H
Metano - CHMetano - CH44Metano - CHMetano - CH44
Disposizione di legami semplici tra l’atomo centrale e gli altri atomi costituenti la molecola:

Disposizione geometrica degli atomi legati all’atomo centrale secondo il principio di minima repulsione:
C
H
H
H
H
Controllo che il numero di coppie elettroniche disposte sia uguale al totale e disporre le eventuali restanti coppie sugli atomi periferici :
4 coppie contate = 4 coppie disposte
109.5°
Configurazione tetraedrica regolare

Ammoniaca - NHAmmoniaca - NH33Ammoniaca - NHAmmoniaca - NH33
Numero di coppie elettroniche:8/2 = 4
Individuazione dell’atomo centrale:N
N H
H
H
Disposizione delle coppie di legame tra l’atomo centrale e gli altri atomi costituenti la molecola:
Calcolo del numero di elettroni della configurazione elettronica esterna addizionato del numero di eventuali cariche negative o diminuito di eventuali cariche positive nel caso di ioni poliatomici:
5 (N) + 1 (H)• 3 = 8

• Controllare che il numero di coppie elettroniche disposte sia uguale al totale e disporre le eventuali restanti coppie sugli atomi periferici:
4 coppie totali = 3 coppie disposte
• La quarta coppia va messa sull’atomo centrale dato che i periferici sono atomi di H e non hanno altri orbitali a disposizione:
N H
H
H

Le coppie solitarie occupano regioni dello spazio mediamente più vicine all’atomo centrale rispetto alle coppie di legame che sono sono più centrate lungo gli assi di legame
Disposizione tetraedrica distortaForma della molecola: piramidale triangolare
Disposizione geometrica degli atomi legati all’atomo centrale e delle coppie non di legame secondo il principio di minima repulsione:
NH
H
H107°

Penta cloruro di fosforo- PClPenta cloruro di fosforo- PCl55Penta cloruro di fosforo- PClPenta cloruro di fosforo- PCl55
Numero di coppie elettroniche:40/2 = 20
Individuazione dell’atomo centrale:P
P Cl
Cl
Cl
Disposizione delle coppie di legame tra l’atomo centrale e gli altri atomi costituenti la molecola:
Calcolo del numero di elettroni della configurazione elettronica esterna addizionato del numero di eventuali cariche negative o diminuito di eventuali cariche positive nel caso di ioni poliatomici:
5 (P) + 7 (Cl)• 5 = 40
Cl
Cl

Controllare che il numero di coppie elettroniche disposte sia uguale al totale e disporre le eventuali restanti coppie sugli atomi periferici:
20 coppie totali = 5 coppie disposte
Le altre 15 coppie vanno disposte sugli atomi periferici e si controlla che la regola dell’ottetto sia soddisfatta:
P Cl
Cl
ClCl
Cl

Disposizione geometrica degli atomi legati all’atomo centrale e delle coppie non di legame secondo il principio di minima repulsione, modello di Sidgwick e Powell:
P Cl
Cl
Cl
Cl
Cl
Configurazione Bipiramide trigonale

Tetra floruro di zolfo- SFTetra floruro di zolfo- SF44Tetra floruro di zolfo- SFTetra floruro di zolfo- SF44
Numero di coppie elettroniche:34/2 = 17
Individuazione dell’atomo centrale:S
S F
F
F
Disposizione delle coppie di legame tra l’atomo centrale e gli altri atomi costituenti la molecola:
Calcolo del numero di elettroni della configurazione elettronica esterna addizionato del numero di eventuali cariche negative o diminuito di eventuali cariche positive nel caso di ioni poliatomici:
6 (S) + 7 (F)• 4 = 34
F

Controllare che il numero di coppie elettroniche disposte sia uguale al totale e disporre le eventuali restanti coppie sugli atomi periferici:
17 coppie totali = 4 coppie disposte
Delle altre 13 coppie, 12 vanno disposte sugli atomi periferici così che la regola dell’ottetto sia soddisfatta, l’ultima coppia si dispone sullo S come coppia non di legame perché quest’ultimo può utilizzare gli orbitali d:
S F
F
FF

Disposizione geometrica degli atomi legati all’atomo centrale e delle coppie non di legame secondo il principio di minima repulsione:
S F
F
F
F
Disposizone delle coppie:Bipiramide trigonaleForma della molecola: Bisfenoide