Il legame chimico legame ionico Legame covalente Regola ottetto e Lewis Parametri del legame...
-
Upload
elena-serafini -
Category
Documents
-
view
218 -
download
0
Transcript of Il legame chimico legame ionico Legame covalente Regola ottetto e Lewis Parametri del legame...

Il legame chimico
• legame ionico
• Legame covalente
• Regola ottetto e Lewis
• Parametri del legame covalente
• Carica formale

GLI ATOMI TENDONO A LEGARSI SPONTANEAMENTE
FRA DI LORO
OGNI QUAL VOLTA QUESTO PROCESSO PERMETTE
LORO DI RAGGIUNGERE UNA CONDIZIONE DI
MAGGIORE STABILITA’ ENERGETICAMAGGIORE STABILITA’ ENERGETICA.
QUESTO PROCESSO
DA’ LUOGO AL LEGAME CHIMICO
Esso permette la formazione di molecole
IL LEGAME CHIMICO

IL LEGAME CHIMICO
• Gli atomi interagiscono tra di loro a formare molecole. L’eccezione sono i gas nobili, monoatomici
• Teoria di Lewis:– Gli elettroni esterni, di valenza, sono implicati nel
legame chimico– Se gli elettroni vengono trasferiti si ha legame ionico– Se gli elettroni sono in compartecipazione si ha legame
covalente– Gli atomi tendono ad assumere la configurazione
elettronica dei gas nobili, regola dell’ottetto

IL LEGAME CHIMICO TRA ATOMI COINVOLGEGLI IL LEGAME CHIMICO TRA ATOMI COINVOLGEGLI
ELETTRONI PERIFERICIELETTRONI PERIFERICI, ,
DETTI ELETTRONI DI DETTI ELETTRONI DI VALENZAVALENZA DEGLI ATOMI STESSI DEGLI ATOMI STESSI
Elettroni di valenza

CASI LIMITE IDEALI DEI TRE PRINCIPALI TIPI DI LEGAME CHIMICO
Li
H2 CsF
100% METALLICO
100% IONICO100% COVALENTE
COVALENTE POLARIZZATO
Legame tra atomi adelettroni delocalizzati
condivisi da tutti gli atomidel reticolo cristallino
Legame tra atomi in cuivengono condivise una o
più coppie di elettroni di valenza
Legame tra ioni dotati di carica elettrostatica (+,-)
opposta

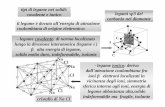
Curve di energia potenziale (E) di un sistema biatomico in funzione della distanza interatomica r
Energia di dissociazione
del legame
Distanza media di legame
Buca di potenziale
Energia repulsiva tra atomi in assenza di legame

IL LEGAME IONICO • Il legame ionico è l'attrazione che si stabilisce tra le
cariche opposte di cationi ed anioni.
• un atomo di K e un atomo di Cl si avvicinano, il K perde un elettrone (K+), mentre Cl acquista un elettrone diventando (Cl- )
• Poi gli ioni si uniscono a formare un solido con diminuzione di energia; per l'attrazione che nel solido ogni catione ha per ogni anione, al netto della repulsione tra ioni dello stesso segno
• L'entalpia reticolare di un solido ionico è la variazione standard di entalpia che si accompagna alla trasformazione del solido in un gas costituito dai suoi ioni

-Basso potenzialedi ionizzazione
Alta affinitàelettronica
Trasferimento elettronico
He
Ne
Ar
Kr
Xe
Rn
{ {

-+
He
Ne
Ar
Kr
Xe
Rn

Formazione di NaCl
Na + Cl Na+ + Cl -
Na+ + Cl - NaClLa formula NaCl fornisce solo informazioni sul rapporto tra ioni sodio e ioni cloro all’interno del solido cristallino. Essa non descrive una molecola, intesa come entità chimica individuale. Inoltre, l’energia della singola coppia ionica non raggiunge il minimo di energia possibile.
+-

Qual’e lo ione sodio ?
Na+Cl-

L’ energiaenergia reticolarereticolare (o di lattice) è data dalla sommatoria delle energie attrattive e repulsive degli ioni nel cristallo tridimensionale.
Ecoul = 1/(4o)(- 6e2/d + 12e2/2d - 8e2/3d + 6e2/4d - 24e2/5d ...)
Eab: energia tra due cariche Za, Zb
separate dalla distanza rab
Il valore è negativo se Za e Zb hanno
segno opposto, è positiva se le due
cariche hanno ugual segno.

Hf (NaCl, s)Entalpia di formazione
Hsubl (Na, s)Entalpia di sublimazione
Hdiss (Cl, g)Entalpia di dissociazione
EI1 (Na)Energia di ionizzazione
AE (Cl)Affinità elettronica
Energia
reticolare
Ciclo di Born-Haber

+ 107+ 107
+ 122+ 122
+ 496+ 496
- 349- 349
- 786- 786
- 410- 410
Energia di formazione = 107 + 122 + 496 – 349 – 786 = - 410
Energia di formazione della coppia ionica= 496 – 349 = + 47

Fattori che favoriscono i legami ionici
• bassa energia di ionizzazione dell'elemento catione (bassa elettronegatività)
• alta affinità elettronica dell'elemento anione (alta elettronegatività)
• elementi fortemente elettropositivi ed elettronegativi.
• Ioni di piccole dimensioni e con numero di carica elevato, i quali possono stabilire forti interazioni determinano elevate energie reticolari.
• I composti ionici sono formati da cationi nella sinistra della tavola periodica e da anioni alla destra della tavola

Simboli elettronici.
K e Cl raggiungono la configurazione s2 p 6 dell’Argon: un ottetto di elettroni.
Gli elettroni di valenza possono essere rappresentati da punti, le coppie occupano lo stesso orbitale
La formazione di cloruro di potassio
Alcuni elementi hanno valenza variabile, es.
Fe: [Ar]3d64s2 Fe2+: [Ar]3d6 Fe3+: [Ar]3d5

Legami covalenti
• Un legame covalente è costituito da una coppia di elettroni messa in compartecipazione tra due atomi.
– ciascuno dei due atomi fornisce uno degli elettroni che costituiscono
– entrambi gli elettroni sono forniti dallo stesso atomo.

Teoria del legame di valenza o Valence Bond (VB)Teoria del legame di valenza o Valence Bond (VB)
Postulato di Lewis: Postulato di Lewis: due atomi si legano ogni qual volta possono mettere in due atomi si legano ogni qual volta possono mettere in comune 2 elettroni.comune 2 elettroni.Requisiti da soddisfare:Requisiti da soddisfare:· Ognuno dei due atomi che si legano deve · Ognuno dei due atomi che si legano deve contribuirecontribuire alla formazione del legame con un suo alla formazione del legame con un suo orbitale atomicoorbitale atomico..· Le energie dei due orbitali coinvolti non devono · Le energie dei due orbitali coinvolti non devono essere troppo diverse tra loro.essere troppo diverse tra loro.· La · La differenza di elettronegativitàdifferenza di elettronegatività dei 2 atomi non deve dei 2 atomi non deve essere maggiore di 2 (altrimenti il legame assume carattere essere maggiore di 2 (altrimenti il legame assume carattere ionico).ionico).· Gli atomi devono · Gli atomi devono congiungersi lungo una direzionecongiungersi lungo una direzione che permette la massima sovrapposizione degli che permette la massima sovrapposizione degli orbitali.orbitali.


- - Possono essere usati Possono essere usati solo gli orbitali di solo gli orbitali di valenzavalenza di ciascun atomo. di ciascun atomo.
- - Un atomo forma Un atomo forma tanti legami covalenti tanti legami covalenti quanti sono i suoi quanti sono i suoi elettroni spaiatielettroni spaiati (in (in modo da raggiungere nel livello più modo da raggiungere nel livello più
esterno la configurazione elettronica esterno la configurazione elettronica dell’ottetto).dell’ottetto).
Teoria del legame di valenza o Valence Bond (VB)Teoria del legame di valenza o Valence Bond (VB)
La configurazione elettronica più esterna con otto elettroni è tipica dei gas nobili

Formalismo simbolico di LewisFormalismo simbolico di Lewis
-rappresentazione conveniente degli elettroni di valenza-permette indicare gli elettroni di valenza coinvolti in un legame-consiste nel simbolo chimico dell’elemento più un puntino per
ogni elettrone di valenza-Es.: Zolfo
-Configurazione elettronica [Ne]3s23p4, quindi ci sono 6 elettroni
di valenza. Il suo simbolo secondo Lewis è:
N.B. I puntini (rappresentanti gli elettroni) sono disposti ai quattro lati del simbolo atomico. Ciascun lato può contenere sino a due puntini (elettroni).Il numero degli elettroni di valenza generalmente corrispondono al gruppo di appartenenza nella tabella periodica



Formazione legame covalente H-H
H separati,
gli e- si appaiano
formazione del legame

Gli elettroni hanno il massimo di probabilità di trovarsi tra i due nuclei:
le forze attrattive sono più forti di quelle repulsive
Le forze repulsive hanno il sopravvento su quelle attrattive:
destabilizzazione del legame

LEGAMI COVALENTI OMOPOLARI : coinvolgono atomi uguali

In generale, a maggiore ordine di legame corrisponde maggiore energia di legame e
minore distanza.

Rottura del legame covalente
L’energia del legame è misurata dall’energia per romperlo

LEGAMI COVALENTI ETEROPOLARI: coinvolgono atomi differenti
Gli atomi hanno diversa elettronegatività.
Questa è un indice della capacità dell’atomo di attrarre gli elettroni di legame.
Più alta è la differenza di elettronegatività, maggiore la polarità del legame.

Momenti dipolari nei legami covalenti.
• La coppia elettronica di legame si sposta verso l’atomo con maggiore elettronegatività, quindi si ha la separazione di frazioni di carica o cariche parziali
• In un dipolo elettrico una carica positiva è in prossimità di una carica negativa di uguale intensità. momento elettrico dipolare; viene misurato in unità Debye
• Un legame polare covalente è tra atomi che recano cariche parziali di segno opposto
• vi è una relazione tra il momento dipolare di una molecola AB e la differenza di elettronegatività, tra gli atomi A e B;

Elettronegativita’
Mulliken: = k(EI+A)
La media tra la Energia di prima ionizzazione e la Affinità elettronica
E’ una proprietà periodicaTanto più sono alte queste energie, tanto maggiore sarà la
“resistenza” di un atomo a perdere elettrone, ovvero la sua tendenza ad acquisirli.
Espressa in funzione di un indice arbitrario tra 0 e 4
Tendenza di un atomo ad attrarre la coppia di elettroni di legame

Polarità dei legami covalenti
• Tanto più un atomo è elettronegativo rispetto all’altro, tanto più attira a sé gli elettroni di legame.
• La densità di carica degli elettroni di legame è maggiore nelle vicinanze dell’atomo più elettronegativo.

Polarità dei legami

I legami non sono totalmente ionici o covalenti
Legami ionici
Gli atomi e gli anioni che vanno incontro a deformazioni della loro nuvola elettronica sono definiti polarizzabili (larghi, es. I-)
I cationi che sono capaci di provocare forti deformazioni sono invece detti avere un elevato potere polarizzante (piccoli con alta densità di carica, Es. Al3+)
i composti costituiti da piccoli cationi con carica elevata e da grossi anioni facilmente polarizzabili presentano legami che hanno un carattere più covalente.

Modello ionico e covalente
NaCl H2

Parametri del legame covalente
Forza o entalpia di legame: energia che si libera con la rottura del legame considerato.
H2(g)2H(g)
H = + 436 kj
Dipende dalla coppia di atomi e dall’ordine di legame
Lunghezza del legame la distanza tra i nuclei di due atomi uniti da un legame covalente.
E’ correlata al raggio atomico e alla forza di
legame.

CASI LIMITE IDEALI DEI TRE PRINCIPALI TIPI DI LEGAME CHIMICO
Li
H2 CsF
100% METALLICO
100% IONICO100% COVALENTE
COVALENTE POLARIZZATO
Legame tra atomi adelettroni delocalizzati
condivisi da tutti gli atomidel reticolo cristallino
Legame tra atomi in cuivengono condivise una o
più coppie di elettroni di valenza
Legame tra ioni dotati di carica elettrostatica (+,-)
opposta

La tabella

Lewis: Regola dell'ottetto
• Gli atomi tendono il più possibile a completare i loro ottetti mediante coppie di elettroni messi in compartecipazione.
funziona bene per gli elementi del secondo periodo, come C, N, O e F
Quando invece vi sono orbitali d disponibili, più di otto elettroni possono essere sistemati intorno ad un atomo e la regola non funziona bene

Atomi del 2° periodo e relativi composti con l'idrogeno.
C nello stato fondamentale avrebbe 2 elettroni nel 2s e due spaiati nei 2p, uno dei due elettroni 2s viene "promosso" al 2p libero perché ciò permette di ottenere 4 legami a
Un trattino che congiunge due atomi rappresenta un legame covalente, uno accostato all'atomo rappresenta un doppietto di elettroni non impegnato in legame (detto anche doppietto libero).
Ne non può fare legami poiché tutti gli orbitali sono occupati da un doppietto.


Molecole insature: molecole con legami multiplici: doppi o tripli. Exempi: cloruro di nitrosile (NOCl), il nitrato e il “fosgene" (cloruro di carbonile, COCl2).

molecole electron-deficienti non hanno abbastanza elettroni per soddifare la regola dell’ottetto. Esempio: tricloruro di boro.

Molecole con l’ottetto espanso. Avviene per gli atomi centrali del periodo superiore al secondo. Un esempio è il tricloruro di fosforo :

Per elementi del 3° periodo, la regola dell’ottetto può non essere valida, come succede, per esempio per PF5, ClF3, SF6,...In questi atomi sono disponibili gli orbitali d, disponibili ad alcuni elettroni, così da permettere la formazione di un maggior numero di legami covalenti:
Esempi di espansione dell'ottetto. A sinistra la configurazione senza espansione, a destra quelle con espansione, che comporta la promozione di uno o più elettroni 3s o 3p in orbitali 3d. La promozione comporta una spesa di energia, abbondantemente compensata dalla possibilità di formazione di più legami.

Come scrivere le strutture di Lewis.
1. Calcola il numero totale di elettroni di valenza ed il numero di coppie elettroniche.
2. Individua l’atomo centrale 3. Disponi gli atomi terminali intorno all'atomo centrale. Gli
atomi H saranno legati ad atomi di ossigeno oppure all'atomo centrale, se non c’è ossigeno.
4. Disponi prima le coppie di elettroni per formare legami semplici tra gli atomi. Poi in modo da completare gli ottetti. Se necessario forma doppi o tripli legami con l'atomo centrale. (gli alogeni formano soltanto legami semplici).
5. Calcola la carica formale di ogni atomo6. Descrivi formule di risonanza
(esempi CO2, H2CO)

Ottetti espansi
non espanso espanso Lo ione solfato è un ibrido di risonanza
Gli elementi del blocco p del terzo periodo hanno a disposizione gli orbitali d di energia accessibile. Possono espandere l’ottetto a 10, 12 o più elettroni

Risonanza Utilizzando le regole indicate si ottengono spesso strutture
asimmetriche, ovvero strutture dove atomi uguali hanno un ordine di legame diverso
Questo NON corrisponde alla realtà fisica, che si puo’ misurare sperimentalmente
Ione nitrato: NO3-
La risonanza: la vera formula molecolare è intermedia fra le formule limite possibili. Le formule limite hanno uguale Le formule limite hanno uguale disposizione spaziale degli atomidisposizione spaziale degli atomi

Il contributo relativo delle formule limite alla descrizione della struttura
molecolareLa formula limite con minore separazione di carica formale è quella a minore energia, è cioè la più stabile e contribuisce di più alla descrizione della formula vera del composto
N O
O
O
]] _-1
-1
0+1
La carica formale su un atomo è data dalla differenza fra il numero di elettroni dell’atomo libero e quello attribuitogli formalmente in una formula di struttura
La somma delle cariche formali deve essere uguale alla carica della molecola

Formule limiti NON equivalenti
Se le formule limiti sono equivalenti (Es: NO3-) esse
contribuiscono nello stesso modo alla descrizione della struttura molecolare
Se esse NON sono equivalenti, esse contribuiranno DIVERSAMENTE alla descrizione della struttura molecolare. Le formule ad ENERGIA PIU’ BASSA sono quelle che contribuiranno di piu’
Es: 2 formule limite dove una contribuisce al 80% e l’altra al 20%. E’ come se la molecola avesse per 80% del tempo la struttura A e per il 20% la struttura B.

OZONO O3
Ione carbonato CO32-

PROTOSSIDO D’AZOTO
ANIDRIDE SOLFOROSA
Altri esempi di strutture risonanti.

molecole con numero dispari di elettroni
• NO, la molecola contiene 11 elettroni di valenza. • Un radicale è un frammento di molecola con
almeno un elettrone spaiato. Es. radicale ossidrile HO, .OH.
• sono molto reattivi ed hanno vita assai breve,

Ordine di legame Il numero di legami dipende dal numero di elettroni di cui
ha bisogno per completare il suo ottetto.
Una coppia solitaria di elettroni (doppietto elettronico) è una coppia di elettroni di valenza che non partecipano al legame. si respingono reciprocamente
• Un legame semplice è costituito da una sola coppia di elettroni messa in compartecipazione.
• Un doppio legame è costituito da due coppie di elettroni messe in compartecipazione.
• Un triplo legame è costituito da tre coppie di elettroni messe in compartecipazione.

Il legame nelle molecole biatomiche
H2Cl2

Il legame nelle molecole biatomiche
N2O2

Conclusioni
• Il legame chimico coinvolge gli elettroni di valenza
• I legami covalenti formano le molecole
• Alla formazione di legami covalenti partecipano principalmente i non-metalli
• La polarità dei legami influenza le molecole.
Orb. Mol.