8-il legame ionico -...
Transcript of 8-il legame ionico -...

1
Il legame ionicoIl legame ionico
Il legame ionico è il legame che si realizza quando un atomo d’un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo d’un elemento fortemente elettronegativo (e quindi caratterizzato da una elevata affinità elettronica).
Nel modello descrittivo dl legame ionico vengono fatte due assunzioni:
1. Gli ioni che formano il reticolo cristallino sono considerarti sferici e indeformabili;
2. Il trasferimento di carica fra gli atomi viene considerato completo (gli ioni sono considerati aventi carica +1,+2,… o al contrario -1,-2,…).
È il tipo più semplice di legame chimico, sia dal punto di vista concettuale, sia da quello della sua descrizione analitica, essendo interpretabile in base alle leggi classiche dell’elettrostatica.

2

3

4
Il legame ionicoIl legame ionico
Attrazione elettrostatica fra ioni di carica opposta
11Na 17Cl
Analisi strutturale ai raggi X di NaCl (densità elettronica)
10 elettroni
18 elettroni
Na+
Na+
Na+
Cl--
Cl--
Cl--
Na+
Cl--
Cl--

5
Il legame ionicoIl legame ionico
Na+
Na+
Na+
Cl--
Cl--
Cl--
Na+
Cl--
Cl--
Na: [Ne]3s1
Cl: [Ne]3s23p5
Na+ : [Ne]Cl- : [Ne]3s23p6 = [Ar]
Na• •• ••Cl •••[Na]+ •• ••Cl
••
••-

6
Requisiti per la formazione del legame ionicoRequisiti per la formazione del legame ionico
M → Mn+ + n e-
X + n e- → Xn-M � bassa energia di ionizzazione
X � elevata affinità elettronica

7

8
Andamento dell’energia nella molecola di NaCl in funzione della distanza tra i due ioni
ER = 6 . B . e –ar
E tot = Ecoulomb + ER
re
E2
coulomb −=

9
Il cristallo di NaClIl cristallo di NaCl
Bilancio dell’energia in gioco nella formazione di una mole di NaCl cristallino:
1. Na(s) Na(g)
∆EΙ = 26 Kcal/mol (calore di vaporizzazione)
2. 1/2Cl2(g) Cl(g)
∆EΙΙ = 28,6 Kcal/mol (1/2 energia di dissociazione)
3. Na(g) + e
∆EIII = 118 Kcal/mol (energia di ionizzazione)
+(g)Na

10
Il cristallo di NaClIl cristallo di NaCl
4. Cl(g) + e
∆EIV = -88,2 Kcal/mol (affinità elettronica)
Facendo un bilancio parziale dell’energia in gioco si ottiene:
∆EI + ∆EII + ∆EIII + ∆EIV =
26 + 28,6 + 118 - 88,2 = 84,4 Kcal/mol
Cl-(g)

11
Calcolo dellCalcolo dell’’energia reticolareenergia reticolare
Chiamiamo “energia reticolare” l’energia liberata nella formazione del “reticolo cristallino” dagli ioni componenti portati da distanza infinita a distanza di legame.L’energia reticolare risulta uguale alla somma di tre termini:
Eretic = EM + ER + EL
EM = energia di Madelung
ER = energia di repulsione interelettronica
EL = energia di London

12
Energia di MadelungEnergia di Madelung
........26
38
212
6E0
2
0
2
0
2
0
2
M +⋅+⋅−⋅+⋅−=re
re
re
re
Il valore dell’energia di Madelung, che costituisce il termine preponderante dell’energia reticolare, viene calcolato considerando le interazioni elettrostatiche tra gli ioni costituenti il cristallo :
In forma più semplice :
0
2
0
2
M ......26
38
212
6Ere
re α−=�
�
�+−+��
� −−=
α = costante di Madelung; è funzione della struttura del cristallo considerato (per NaCl α = 1,7476 e ha lo stesso valore per: LiF, KCl, CaO).

13
Il legame ionico Il legame ionico -- Energia reticolareEnergia reticolare
Na+
Reticolo cristallino di NaCl
Numero di coordinazione = 6
Cl-
(6)(12)
(6) (8)0r
0r2 ⋅0r3 ⋅
0r2 ⋅

14
Energia di MadelungEnergia di Madelung
0
21ME
rqq ⋅⋅−= α
eZq ⋅= 22
Equazione generale per il calcolo dell’energia di Madelung:
sono le cariche in valore assoluto degli ioni di segno opposto.
( )2ZZZ 222OMgCa === −++
0
221
M reZZ
�E⋅⋅⋅−=
eZq ⋅= 11

15
Calcolo di ECalcolo di EMM per NaCl ( 1 mole)per NaCl ( 1 mole)
α=1,7476
Z1 = Z2 = 1
r0 = 2,79 Angstron
Ioni con carica unitaria
Distanza tra Na+ e Cl-
nel cristallovalore assoluto carica elettrone in Franklin
( ) ( )ioneergE NaClM
128
210
1043,141079,2
108,47476,1 −
−
−
⋅−=⋅
⋅⋅−=
Energia di interazione coulombiana di un singolo ione con tutti gli altri ioni costituenti il cristallo.
Per ottenere l’energia complessiva per 1 mole di NaCl dobbiamo moltiplicare per il numero di Avogadro.

16
Energia di repulsioneEnergia di repulsione
L’energia di repulsione viene calcolata usando l’equazione di Born-Meyer:
In genere il valore assoluto di questa energia di repulsione equivale al 10-15% dell’energia di Madelung.
Energia di interazione di LondonEnergia di interazione di London
Rappresenta l’energia associata alle forze di London, le quali sono attive a distanze ridottissime e sono dovute al movimento dei nuclei e delle nuvole elettroniche attorno alle loro posizioni di equilibrio.L’energia che deriva da queste forze, di tipo attrattivo, è inferiore in valore assoluto anche all’ER.
06 arR ebE −⋅⋅=

17
Energia reticolare di NaClEnergia reticolare di NaCl
−+ + (g)(g) ClNa
(Eret)NaCl = EM + ER + EL = -208 + 25 – 5 = - 188 Kcal/mol
−+(g)ClNa
∆EV = - 188 Kcal/mol
Quindi la quantità di energia complessivamente in gioco nella formazione di 1 mole di NaCl cristallino partendo da una mole diNa metallico e da mezza mole di Cl2 gassoso è uguale a:
∆Etot = ∆EI + ∆EII + ∆EIII + ∆EIV + ∆EV =
= - 103,6 Kcal/mol

18
-162-172-6+17-183NaI
-173-182-5+21-198NaBr
-218-221-4+35-252NaF
-156-162-12+18-168CsCl
-160-164-8+20-176RbCl
-168-170-7+22-185KCl
-186-188-5+25-208NaCl
Esper
(sperimentale)Ecalc
(calcolata)
EL
(Forze di London)
Er
(repulsione)EM
(Madelung)cristallo

19
Ciclo di BornCiclo di Born--HaberHaber
∆E= Qvap + 1/2 Ediss (Cl
2) + Eion (Na) + E a. el.
(Cl) + E retic
Na (s) + 1/2 Cl2 (g) Na+Cl- (s)∆E
Na (g) + Cl (g)
Qvap 1/2 Ediss (Cl
2)
Eion (Na)
Na+ (g) + Cl- (g)
Eretic
Ea. el. (Cl)
Eretic = ∆E - Q vap - 1/2 Ediss (Cl
2) - E ion (Na) - Ea. el.
(Cl)

20
Il legame ionico Il legame ionico -- La valenza ionicaLa valenza ionica
Na(s) → Na(g) ∆E1 = Esubl = 109 kJ/mol
Cl2(g) → 2 Cl(g) ∆E2 = ED(Cl-Cl) = 247 kJ/mol
Na(g) → Na+(g) + e- ∆E3 = E’ion = 497 kJ/mol
Na+(g) → Na2+
(g) + e- ∆E4 = E’’ion = 4561 kJ/mol
2 Cl(g) + 2 e- → 2 Cl-(g) ∆E5 = 2 Ea.e. = -698 kJ/mol
Na2+(g) + 2 Cl-(g) → NaCl2(s) ∆E6 = Eret = -2155 kJ/mol
____________________
Na(s) + Cl2(g) → NaCl2(s)
∆E1 + ∆E2 + ∆E3 + ∆E4 + ∆E5 + ∆E6 = ∆Eform = 2558 kJ/mol
NaCl2 ??? Non esiste !

21
Le proprietà dei composti ionici
�Danno origine a solidi cristallini;�Hanno alte temperature di fusione;�Sono ben solubili in acqua e in solventi
polari;�Sono insolubili in solventi apolari;�Sono isolanti allo stato solido;�Sono conduttori allo stato fuso;�Sono duri, ma fragili

22
I solidi ionici sono fragili!
[da P. Atkins e L. Jones Chimica generale Zanichelli]

23

24
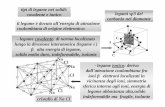
I protoni addizionali nei nuclei degli elementi di transizione esercitano un’attrazione eccezionalmente forte perché gli elettroni d e fschermano scarsamente la carica nucleare. Questa maggiore carica nucleare effettiva influenza gli elementi del blocco p nei periodi 4÷6, come si può vedere confrontando le proprietà del gruppo 3 (3B), il primo gruppo dopo il blocco s, con quelle del gruppo 13 (3A), il primo gruppo dopo il blocco d.
A. Raggio atomico. Nel gruppo 3, il raggio aumenta in modo regolare mentre nel gruppo 13 i raggi di Ga e Tl sono più piccoli del previsto.
B. Energia di ionizzazione totale di E3+. Le deviazioni del raggio atomico determinano deviazioni dell’energia di ionizzazione (Ei) totale (Ei1 + Ei2 + Ei3). Si noti la diminuzione regolare per il gruppo 3 e i valori inaspettatamente più alti per il Ga e il Tl nel gruppo 13.
C. Elettronegatività. Le deviazioni del raggio atomico, inoltre, rendono Ga e Tl piùelettronegativi del previsto.
D. Calore di formazione di EBr3. I più alti valori dell’energia di ionizzazione per Ga e Tl significano che viene liberato meno calore in seguito alla formazione del composto ionico e, quindi, i valori assoluti di ∆Hf
0 per GaBr3 e TlBr3 sono più piccoli del previsto.
Andamento delle proprietà periodiche: elementi del gruppo 13