Legame ionico Legame covalente Legame metallico · ÀTiene uniti ioni di carica opposta mediante...
-
Upload
truongdang -
Category
Documents
-
view
225 -
download
0
Transcript of Legame ionico Legame covalente Legame metallico · ÀTiene uniti ioni di carica opposta mediante...

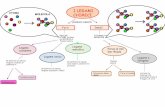
Il legame chimicoIl legame chimico
Legame ionicoLegame ionico: un atomo cede elettroni e un altro li acquista con formazione di ioni di carica opposta che vengono tenuti insieme da forze elettrostatiche.
Legame covalenteLegame covalente: si realizza mediante la sovrapposizione degli orbitali dei due atomi e messa in comune degli elettroni che occupano questi orbitali.
Legame metallicoLegame metallico: si ha con elementi a bassa energia di ionizzazione per messa in comune tra tutti gli atomi degli elettroni di valenza con formazione di una serie di ioni positivi tenuti insieme da un “mare “ di elettroni.

Principi di architettura molecolare

La curva a corriponde alla formazione di un legame.La curva b corriponde ad una situazione di repulsione tra i due atomi e non si ha formazione di legame; succede, per esempio, se tutti gli orbitali atomici sono pieni. E0 = energia di legamer0 = distanza di legame Il valore 0 per E corrisponde all'energia dei due atomi a distanza infinita: perciò E0 è negativa e rappresenta una energia di stabilizzazione.

IL LEGAME IONICOE’ un legame di natura elettrostatica e si forma quando si combinano tra loro due elementi aventi, rispettivamente, una bassa energia di ionizzazione e un’alta affinità elettronica.

Tiene uniti ioni di carica opposta mediante forze elettrostatiche .
Si forma tra ioni (o gruppi di atomi) diversi, il primo dei quali ha una forte propensione a cedere elettroni e il secondo ad acquistarli.
L’interazione si estende in tutte le direzioni e porta ad una continua alternanza di ioni positivi e negativi sia allo stato solido che allo stato liquido (dove però gli ioni sono liberi di muoversi).
E’ un legame forte.
Na + Cl Na+ + Cl- NaCl

E’ determinante il raggiungimento di uno stato a maggiore stabilità corrispondente a uno stato a minore energia.E’ necessario che nella formazione del cristallo ionico dagli elementi costituenti venga liberata energia sotto forma di calore.
Na(s) + ½ Cl2(g) NaCl(s)
∆Hf = -410 kJ/mol





Elettronegatività


Il legame covalente: compartecipazione di elettroni
Quando due elementi sono tra loro uguali o simili in energia di ionizzazione e affinità elettronica si combinano non cedendo ma mettendo in compartecipazione gli elettroni del livello più esterno.
Questi elettroni vengono detti “elettroni di valenza” quelli cioè che danno all’atomo la potenzialità di reagire.

Sovrapposizione degli orbitali atomici: possono essere condivisi soltanto due elettroni a spin opposto.
Perché il legame si formi la sovrapposizione degli orbitali atomici deve portare ad una stabilizzazione del sistema.
Il legame covalente è direzionale poiché gli orbitali atomici hanno una precisa orientazione nello spazio.
Il legame covalente si può formare tra atomi uguali, e anche tra atomi diversi.
Si possono formare molecole piccole o grandi (idrogeno e emoglobina), oppure reticoli di atomi collegati tra loro (diamante e quarzo).

Gli atomi tendono a circondarsi di 8 elettroni esterni (H soltanto di 2) tendendo ad assumere la configurazione (STABILE!!!) di un gas raro: regola dell’OTTETTO.
I legami possono essere semplici, doppi o tripli. (H è sempre terminale).

Simbologia di LewisGli elettroni del guscio di valenza di un atomo sono rappresentati da punti collocati intorno al simbolo dell’elemento.
IA ns2
IIA ns2
IIIA ns2np1
IVA ns2 np2
VA ns2 np3
VIA ns2 np4
VIIA ns2 np5
VIIIA ns2 np6
Secondo periodo
Li•
•Be•
•B• •
• •C• •
• •N• ••
•• •O• ••
•• •F•• ••
•• ••Ne•• ••
Terzo periodo
Na•
•Mg•
•Al• •
• •Si• •
• •P• ••
•• •S• ••
•• •Cl•• ••
•• ••Ar•• ••

La struttura di Lewis può essere prevista costruendo lo scheletro della molecola, contando gli elettroni coinvolti e assegnandoli ai legami e ai vari atomi rispettando la regola dell’ottetto.

il bilancio energetico totale deve comportare una riduzione della energia totale del sistema. Un trattino che congiunge due atomi rappresenta un legame covalente, cioè un doppietto di elettroni condiviso; un doppietto accostato all'atomo rappresenta un doppietto di elettroni non impegnato in legame (detto anche doppietto libero). Ne non può fare legami poiché tutti gli orbitali sono occupati da un doppietto

Gli elettroni (sostituiti due a due dalle barrette) si accoppiano nelle strutture molecolari in modo da portare a strutture elettroniche stabili

La forma delle molecole
Le strutture di Lewis ci aiutano a prevedere la geometria tridimensionale delle molecole e degli ioni.
Modello VSEPR: Valence Shell Electron Pair Repulsion.Teoria della minima repulsione delle coppie di elettroni dello strato di valenza.
Le coppie di elettroni leganti e non leganti nel guscio di valenza di un atomo si respingono l’un l’altra e si dispongono pertanto alla massima distanza possibile.

La forma delle molecole




La geometria di semplici molecole poliatomiche può essereprevista a priori (toeria della minima repulsione dei doppietti elettronici).
Numero dilegami
forma formula Geometria 3D
2 lineare BeF2
3 trigonaleplanare
BF3
4 tetraedrica CH4
5 bipiramidale PCl5
6 ottaedrica SF6

Molecole biatomiche OMONUCLEARI (atomi uguali) H2
La differenza di energia tra i due atomi isolatie la molecola corrisponde all’energia di legame, mentre la distanza tra i centri dei nuclei misura la distanza di legame.

Molecole biatomiche eteronucleari (due atomi diversi). HCl
La densità di carica è nettamentespostata verso il cloro che è molto più elettronegativo dell’idrogeno.



I legami multipli
Esistono anche molecole che, oltre ai legami semplici, contengono legami doppi e tripli, che corrispondono alla messa in comune di 4 o 6 elettroni. Nel caso di legami multipli un legame siforma sempre lungo l’asse internucleare gli altri si formano in regioni opposte rispetto alla congiungente i nuclei.

Polarità molecolare




Proprietà del legame chimico: ordine, distanza ed energia di legame