Il tipo di legame chimico influenza in maniera ... · 2 Nei materiali si distinguono cinque tipi...
Transcript of Il tipo di legame chimico influenza in maniera ... · 2 Nei materiali si distinguono cinque tipi...
1
Il tipo di legame chimico influenza in maniera fondamentale le caratteristiche macroscopiche del materiale.
2
Nei materiali si distinguono cinque tipi di legame. Nei ceramici solo tre sono importanti: ionico, covalente e “idrogeno”.
Il legame è ionico (basato quindi sull’attrazione elettrostatica, non direzionale) se la differenza di elettronegatività è infinita, altrimenti si parla di percentuale di ionicità (e, quindi, covalenza). Il legame covalente è direzionale.
In generale la forza di legame segue lo schema: covalente > ionico > idrogeno
Tale regola non è assoluta poiché la forza di legame è influenzata anche dal tipo di atomi coinvolti nel legame.
3
Esempio dell’influenza del legame chimico sulle proprietà macroscopiche dei materiali: rapporto tra forza di legame e temperatura di fusione.
4
Parametro importante nella definizione del tipo di legame è l’elettronegatività ovvero la tendenza ad attrarre elettroni. L’elettronegatività di un atomo può assumere valori tra 0 e 4. Nella tabella periodica l’elettronegatività degli elementi chimici cresce in generale spostandosi in alto e verso destra. La differenza di elettronegatività fra due elementi è causa di un certo grado di ionicità del legame.
Il grado di ionicità non è mai uguale a uno nemmeno con F o O (per esempio per NaCl ℑ = 0,8, ovvero si ha l’80% di ionicità); pertanto permane sempre nel legame un minimo grado di covalenza.
5
Altro esempio di rapporto tra tipo di legame e caratteristiche macroscopiche: la durezza (ovvero la resistenza offerta da un materiale alla penetrazione) che diminuisce in genere se aumenta la ionicità del legame oppure se sono presenti legami “idrogeno”
Note: * Nel caso dell’altra forma allotropica del carbonio, la grafite, vi sono legami di Van der Waals fra i piani cristallini (2D) che sono causa di bassa durezza ** SiO2 = quarzo: rappresenta un’eccezione: infatti forma un minor numero di legami nello spazio (anche se più covalenti, cioè più forti) dello zaffiro o del topazio; per questo la sua durezza risulta minore.
Pertanto, la durezza di un materiale è legata non solo al tipo, ma anche al numero dei legami presenti nello spazio.
6
Le strutture cristalline più semplici possono essere immaginate costituite da atomi tutti uguali, assimilati a sfere rigide.
A seconda della disposizione spaziale si hanno percentuali diverse di spazi vuoti.
L’analisi delle strutture cristalline semplici fornisce utili risultati applicabili allo studio dell’impacchettamento di polveri (e di conseguenza a quello dei materiali ceramici che di solito sono prodotti proprio a partire da polveri impaccate).
Le strutture cristalline più semplici sono quelle cubiche. Queste possono essere semplici (costituite per quasi la metà da vuoto) o compatte (costituite solo per un quarto da vuoto).
7
La struttura cubica a facce centrate (fcc) rappresenta una configurazione di massimo impacchettamento (spazio vuoto = 26%).
Nella cella unitaria ci sono 4 atomi in totale e 2 tipi di interstizi: tetraedrico e ottaedrico; 8 siti tetraedrici (più piccoli) sono interni alla cella, 4 siti ottaedrici (più grandi) si trovano sugli spigoli e al centro.
8
Una seconda configurazione a massimo impacchettamento è quella esagonale compatta (hcp). Anche in questa si hanno uno spazio vuoto pari al 26% e siti tetraedrici e ottaedrici.
Le strutture fcc e hcp sono ottenibili entrambe da piani di massimo impacchettamento sovrapposti variando solo la sequenza di impilaggio.
9
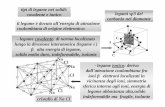
In genere le strutture cristalline di interesse nel settore dei ceramici fanno riferimento alla presenza di atomi diversi. Per cristalli con grado di ionicità elevato (legami non direzionali), la struttura finale dipende dal bilancio tra l’energia di attrazione (ioni di segno diverso) e quella di repulsione (ioni dello stesso segno e nubi elettroniche).
Le configurazioni cristalline (ioniche) presenti in natura sono “ottenute” seguendo le regole di Pauling. Le più importanti e le più utili sono certamente le prime due.
10
Prima regola di Pauling A seconda del rapporto tra i raggi ionici si hanno configurazioni stabili o instabili. In quest’ultime, la riduzione del numero di coordinazione porta a una maggiore stabilità del sistema.
11
Possono essere definiti, sulla base di semplici calcoli geometrici, i valori critici del rapporto tra i raggi ionici per ogni numero di coordinazione.
Se rc/ra = 1 si hanno strutture compatte fcc o hcp.
Risulta chiara quale deve essere la dimensione massima di un atomo per poter entrare in un interstizio. Lo stesso discorso vale più in generale per un aggregato di polveri.
12
Su molti testi sono tabulati i raggi ionici degli elementi in funzione del numero di coordinazione.
14
Il numero di coordinazione previsto non sempre coincide con quello osservato. Un classico esempio è quello degli ossidi. Corrispondentemente varia anche la forza del legame ionico (vedi pagina successiva). L’anomalia osservata dipende dalla deformabilità degli ioni e dal carattere covalente (direzionale) dei legami.
15
Seconda regola di Pauling
E’ applicabile solo se ℑ >> 0. Tale regola è utile per calcolare la coordinazione dei cationi.