tentir biokim respirasi
-
Upload
gusti-ahmad-faiz -
Category
Documents
-
view
253 -
download
7
description
Transcript of tentir biokim respirasi
BIOKIMIATransport O2 dan CO2
Compound of Air% Composition, inhaled air% composition exhaled air
OxygenAbout 21%About 16,4%
Carbon dioxideAbout 0,03%About 4,0%
NitrogenAbout 78,0%About 78,0%
Water VaporVariable (rarely saturated)Saturated
Oksigen terutama diangkut dalam bentuk terikat dengan hemoglobin ke kapiler jaringan. Di sel jaringan tersebut, oksigen bereaksi dengan berbagai bahan makanan sehingga menghasilkan karbon dioksida dalam jumlah besar. Karbon dioksida tersebut akan masuk ke kapiler jaringan dan diangkut kembali ke paru. Pengiriman oksigen ke dalam jaringanPengiriman oksigen ke dalam jaringan membutuhkan kerjasama antara sistem respirasi daengan sistem kardiovaskular. Banyaknya oksigen yang dapat didistribusikan ke dalam jaringan tertentu ditentukan oleh banyaknya oksigen yang memasuki paru-paru, pertukaran gas paru yang adekuat, aliran darah ke jaringan, dan kemampuan darah untuk membawa oksigen. Aliran darah ditentukan oleh derajat konstriksi vaskular bed dan cardiac output sedangkan banyaknya oksigen dalam darah ditentukan oleh jumlah oksigen terlarut, hemoglobin dan afinitas hemoglobin untuk oksigenReaksi Hemogblobin
Perhatikan Fe2+ yang terdapat ditengah cincin porfirin mempunyai 6 ikatan koordinasi dimana 1-4 untuk terikat pada N gugus pirol dan ke 5 terikat pada histidin dari helix F globin dan yang terakhir berikatan dengan oksigen.
Gambar. Molekul myoglobin (monomer) dan hemoglobin (tetramer)Hb merupakan pembawa O2 yang baik. Hb merupakan proteun yang tersusun dari 4 subunit yang masing-masing berisi heme yang separuhnya menempel pada rantai polipeptida. Pada orang dewasa yang normal, kebanyakan Hb berisi 2 rantai alfa dan 2 rantai beta. Heme merupakan kompleks cincin reversibel dapat mengikat satu molekul oksigen. Besi tersebut selalu dalam bentuk ferrous sehingga reaksi tersebut dinamakan oksigenasi, bukan oksidasi. Reaksi Hn dengan O2 adalah Hb + O2 Hb02Karena berisi 4 deoksihb, molekul hb juga direpresentasikan sebagai Hb4 dan sebenarnya bereaksi dengan 4 molekul O2 untuk membentuk Hb408. Reaksi tersebut berlangsung sangat cepat hanya kurang dari 0,01 detik. Begitu juga dengan deoksogenasi Hb4O8 juga berlangsung dengan sangat cepat.Struktur kuarter Hb tersebut menetukan afinitas O2. Pada deoksiHb, unit globin terikat secara kuat pada tense (T) configuration, yang mengurangi afinitas molekul terhadap O2. Saat O2 pertama terikat, iakatan yang menahan unit globin dilepaskan, menghasilkan relaxed (R) configuration yang mengekspos lebih banyak tempat ikatan O2. Hasilnya, afinitasnya dapat meningkat sampai 5000 kali. Pada jaringan, reaksiini berbalik, yaitu pelepasan oksigen. Transisi dari satu keadaan ke keadaan lainnya diperkirakan terjadi sampai 108 kali sepanjang masa hidup sel darah merah. PO2 jaringan ditentukan oleh laju pengangkutan oksigen ke jaringan dan laju pemakaian oksigen oleh jaringan. Jika aliran darah dalam suatu jaringan meningkat, lebih banyak oksigen yang diangkut ke jaringan dalam periode tertentu sehingga PO2 meningkat. Sementara penggunaan oksigen untuk metabolisme jaringan akan menurunkan nilai PO2 cairan interstisium.Faktor yang Mempengaruhi Afinitas Hb untuk OksigenAda empat kondisi penting yang mempengaruhi kurva disosiasi oksigen-hb, yaitu pH, tekanan parsial karbon dioksida, suhu dan konsentrasi 2,3 bifosfogliserat (2,3 BPG). Peningkatan suhu atau penurunan pH akan menggeser kurva ke kanan. Pada keadaan ini, semakin tinggi PO2 yang dibutuhkan oleh Hb untuk mengikat oksigen. Peningkatan keasaman akan meningkatkan pelepasan oksigen dari hemoglobin. Asam utama yang dihasilkan jaringan yang aktif secara metabolik diantaranya adalah asam laktat dan asam karbonar. Pengurangan afinitas hb saat pH turun disebut bohr. Efek bohr bekerja dengan 2 jalur yaitu 1. Peningkatan H+ dalam sarah akan menyebabkan O2 terlepas dari hb 2. Pengikatan O2 oke hb menyebabkan pelepasan H+ dari hemoglobin. Namun, jika berikatan dengan asam amino dalam hb, H+ akan mengubah struktur darii Hb sehingga kemampuannya dalam membawa O2 akan turun. Protein pengikat oksigen : Myoglobin Hemoglobin Sitokrom Oksigen ditranspor dari paru ke berbagai jaringan dalam ikatan dengan hemoglobin Di otot hemoglobin memberikan oksigen ke myoglobin yang mempunyai afinitas yang lebih besar daripada hemoglobin Kurva saturasi oksigen terhadap hemoglobin berbentuk sigmoid sedangkan kurva saturasi terhadap myoglobin hiperbolik Sitokrom berperan pada reaksi-reaksi redoks dirantai pernafasan sebagai komponen rantai transpor elektron
Struktur hemoglobin : Hemoglobin terdapat dalam sdm Hb merupakan protein oligomerik yang merupakan 2 dimer alfabeta sehingga terbentuk 4 polipeptida yaitu alfa1 beta1 alfa2 beta2 Berat masa Hb 64500 Rantai alfal 141 aa, rantai beta 146 aa Bentuk 3D dari satu subunit Hb sama dengan myoglobin yang hanya terdiri dari 1 subunit dan mempunyai 7(a) dan 8(b) alfa helix Pada setiap subunit terdapat suatu kantung yang terisi dengan gugus prostetik yaitu hem
TRANSPORT O2 DAN CO2 DALAM DARAH : O2 dan CO2 diangkut dalam darah dalam bentuk lain, dan bukan hanya yang terlarut Oksigen diangkut dalam bentuk berikatan dengan gugus prostetik Hb, yaitu pada bagian-bagian hem-nya Hampir seluruhnya (97-98%) oksigen diangkut dalam bentuk ini Pengangkutan CO2 yang terutama adalah dalam bentuk bikarbonat dan dan hanya sebagian kecil yang diangkut dalam bentuk berikatan dengan Hb (ikatan bukan pada hem tapi dengan proteinnya : carbonat bound = karbamat Hb)TRANSPOR O2 DALAM DARAH : Sebagai gas yang larut dalam darah Sebagai HbO2 (97-98%)TRANSPOR CO2 DALAM DARAH : Sebagai gas yang larut dalam darah (6%) Sebagai ion bikarbonat (HCO3-), hasil disosiasi asam karbonat (yang terdisosiasi = 99,9%) Sebagai karbamat yang terikat dengan valin aa terminal Hb
Macam-macam Hb normal :1. HbF (pada fetus/janin)2. HbA (beberapa minggu setelah kelahiran)
Beda HbF dan HbA : Struktur terdiri atas 2 alfa-globin dan 2 gama globin Komposisi aa pada rantai gama berbeda dengan pada beta yaitu timbul perubahan struktural/konformasi yang menyebabkan afinitas HbF terhadap 2,3 BPG (bifosfogliserat) < dibanding HbASebaliknya afinitas terhadap O2 > daripada HbA sehingga akibatnya O2 yang dilepas oleh HbA Ibu mudah diikat oleh HbF janin.
Hb fetal (HbF) berbeda dengan Hb pada ornag dewasa (HbA) dalam struktur dan afinitasnya terhadap O2. HbF memiliki afinitas yang lebih tinggi untuk oksigen karena kurang mengikat BPG dibanding HbA. Saat PO2 rendah, HbF dapat mengangkut 30% oksigen lebih banyak dibandingkan HbA maternal. Transfer oksigen terjadi di plasenta. Sementara itu, PO2 di plasenta sangat rendah sehingga HbF sangat penting untuk mencegah janin mengalami hipoksia.
Hemoglobin janin terdiri dari 2 rantai alfa globulin dan 2 alfa gamma globulin. Dalam beberapa minggu setelah kelahiran, barulah HbF tersebut digantukan HbA (alfa2 dan beta2). Perbedaan rantai tersebut yang menyebabkan perbedaan kemampuan afinitas terhadap 2,3 BPG berbeda. Bentuk kurva untuk Hb : sigmoid sedangkan mioglobin : hiperbolik Hb mengikat O2 di paru (pO2 tinggi) dan melepas O2 di jarin
Kurva Saturasi : Menggambarkan jumlah oksigen yang terikat dengan protein Hb/mioglobin terhadap tekanan parsial O2 Bentuk kurva untuk Hb : sigmoid sedangkan mioglobin : hiperbolik Hb mengikat O2 di paru (PO2 tinggi) dan melepas O2 di jaringan (PO2 rendah) Mioglobin tetap jenuh dengan O2 pada jaringan -> sehingga pada otot yang istirahat mengikat O2 yang dilepas oleh Hb, sedangkan pada otot yang beraktivitas (PO2 tinggi)Transpor O2 oleh Hb
Koordinasi Sub Unit Hb dalam Pengikatan O2
Sebelum mengikat O2 subunit-subunit Hb dalam konformasi T (tense = tegang), pada keadaan ini menolak pengikatan O2 Sewaktu mengikat O2, subunit mengubah konformasi sehingga kemungkinan pengikatan O2 meningkat. Koordinasi subunit ini menghasilkan kurva saturasi O2 berbentuk sigmoid Sewaktu O2 terikat, konformasi Hb berubah dari T menjadi R (rileks)
Ikatan Hb dengan CO CO terikat secara kompetitif pada situs pengikatan O2 efek kooperativitas & efek Bohr O2 Afinitas Hb terhadap CO = 200 x O2 Afinitas hem (tanpa globin) terhadap CO = 25.000 x O2 tidak terjadi dalam Hb karena ada His E7 (distal) Batas toleransi tubuh sangat ( 1 % situs pengikatan O2 ditempati CO) Keracunan CO juga berpengaruh terhadap Katalase dan sitokrom C
Pengikatan Hb dengan CN- CN- dapat terikat secara ireversibel pada Hb dan metmyoglobin Normal : Methemoglobin ( Fe3+ ) HbO ( Fe2+ ), oleh Methemoglobin reduktase Methemoglobin + CN- sianmetHb (tidak dapat direduksi) Pemaparan CN- dalam waktu singkat mengganggu transpor O2
Bahan yang Mempengaruhi Pengikatan O2 Yang menurunkan afinitas Hb terhadap O2: (menggeser kurva disosiasi oksigen Hb kekanan)1. 2,3- BISFOSFOGLISERAT (2,3-BPG) pada HbF 2,3-BPG rendah sehingga afinitas HbF terhadap O2 pada tempat yang tinggi, konsentrasi Hb; 2,3-BPG & eritrosit sehingga afinitas HbA terhadap O2 terjadi pelepasan O2 di jaringan2. ION HIDROGENseiring dengan penurunan pH (H+) afinitas Hb terhadap O2 menurun menimbulkan EFEK BOHR3. IKATAN KOVALEN dengan CO2 CO2 hasil metabolisme di jaringan dibawa ke paru sebagai BIKARBONAT, sebagian berikatan dengan Hb, membentuk: KARBAMAT Hb
SIKLUS RAPOPORT-LUEBERINGSINTESIS 2,3-BPG DI ERITROSIT
Efek pH pada kurva saturasi O2
EFEK BOHR
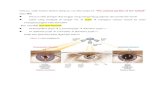
DI JARINGAN PERIFER CO2 + H2O H2CO3 , dengan adanya enzim karbonat anhidrase berdisosiasi H+ + HCO3- H+ menyebabkan pH menurun selanjutnya H+ diikat oleh Hb.4O2 2H+.Hb + O2 (DeoksiHb bertindak sbg bufer di eritrosit) O2 dilepas ke jaringan perifer EFEK BOHR
DI PARU 2H+.Hb mengikat O2 dg melepaskan H+ yang akan berikatan dengan ion bikarbonat membentuk H2CO3 H2O & CO2 CO2 diekhalasi keluar EFEK HALDANE
EFEK PENURUNAN TEKANAN OKSIGEN Ingat HUKUM DALTON utk gas campuran HIPOKSIA : - disebabkan PO2 menurun - efek: gangguan penglihatan, sakit kepala, mual, kecakapan mental menurun, kejang dan koma. Tempat yg tinggi: ventilasi paru , eritrosit kapasitas difusi paru , kardiak output & respon sel (mitokondria)
Pengaruh akibat tekanan yang rendah dari oksigen : Hipoksia : - disebabkan oleh tekanan oksigen yang rendah (PO2 < misal di pegunungan yang tinggi > 10000 kaki)- efek yang ditimbulkan : mengantuk, sakit kepala, nausea, penurunan profisiensi mental, kejang-kejang dan koma.(pada kenyataannya gejala ini disebabkan oleh kekurangan CO2 karena pernafasan yang cepat yang bermaksud untuk meningkatan pemasukan oksigen) --> hiperventilasi Aklimatisasi : Peningkatan ventilasi pulmoner, penambahan jumlah sdm, peningkatan kapasitas difusi dari paru dan peningkatan cardiac output disertai dengan efek seluler seperti peningkatan mitokondria(adaptasi), produksi 2,3-BPG meningkat. SISTEM BUFER DI DALAM DARAH1. protein plasma2. bufer hemoglobin3. bikarbonat 4. bufer fosfat
EFEK CO2 TERHADAP pH DARAHAsam karbonat dibentuk hasil kerja enzim karbonat anhidrase, yg akan berdisosiasi sbb:H2CO3 H+ + HCO3- + B BHCO3- + H+pH darah 7,4 ratio [HCO3-] / H2CO3 = 20 : 1Dari rumus : HENDERSON HASELBALCH Bila pH darah 7,4; pKa as karbonat= 6,1 maka : 7,4 = 6,10 + log garam (bikarbonat)/asam 1,30 = log [HCO3-] / H2CO3 antilog 1,30 = 20Ratio dipertahankan sehingga pH darah tdk berubah dr 7,4. Perubahan ratio menyebabkan gangguan keseimbangan asam basa terjadi ASIDOSIS atau ALKALOSIS. Perubahan ventilasi paru mempunyai pengaruh besar terhadap pH darah. Bila, PCO2 karena produksi di jaringan perifer at hipoventilasi [H2CO3] ratio 1,30 ALKALOSIS RESPIRATORIK
HEMOGLOBINOPATI Penyakit genetik Perubahan struktur rantai globin Karena mutasi gen pembentuk globin 1 asam amino diganti oleh asam amino lain Hb yang terbentuk sifat berbeda Dapat terjadi pada rantai atau rantai CONTOH HEMOGLOBINOPATII. HbS Asam amino valin non polar menggantikan permukaan polar residu Glu6 dari subunit rantai - membentuk suatu hidrofobik sticky patch pada oksi HbS maupun deoksi HbS.Nah penggambaran tentang sticky patch diilustrasikan sebagai berikut:
II. HbC Hbpati no 2 paling sering di AS Glu 6 rantai diganti lysin HbC membentuk kristal dalam sdm
III. HbM pe metHb di dalam darah Fe2+ juga dioksidasi jadi Fe3+ His F8 diganti dengan tyr F8 pada rantai atau rantai Tidak dapat mengikat O2
METHEMOGLOBIN, ciri-ciri: Fe 2+ teroksidasi menjadi Fe 3+ tdk dpt mengikat O2 MetHb dpt terbentuk oleh karena:1. Efek samping senyawa sulfonamida yang dapat mengoksidasi Fe 2+ Fe 3+ pada kelainan herediter HbM (histidin F8 diganti tirosin)2. Akibat menurunnya aktivitas enzim metHb reduktase, yang secara normal dapat mereduksi Fe 3+ Fe 2+, apabila terdapat senyawa-senyawa yang dapat mereduksi Fe2+.
Mohon maaf jika terdapat kesalahan atau kurang lengkap, jujur materi ini sangat sulit (mengartikan slide dan perkataan dr. nya juga sulit). Jika ada saran dan masukkan bisa langsung menghubungi departemen biokim. Terima kasih ^_^
Siklus KREBS
E.karbonatanhidrase
CO2 + H20
2 H+ + 2 HCO3-
2 H2CO3
4 O2
Hb. 4O2
Hb. 2H+
PARU-PARU
2HCO3- + 2H+
2 H2O + 2 CO2
2 H2CO3
DIHEMBUSKAN
E.karbonat anhidrase
BUFER
4 O2
JARINGAN PERIFER