CLASSIFICAZIONE DEI LEGAMI CHIMICI LEGAME IONICO LEGAME ... · classificazione dei legami chimici...
Transcript of CLASSIFICAZIONE DEI LEGAMI CHIMICI LEGAME IONICO LEGAME ... · classificazione dei legami chimici...

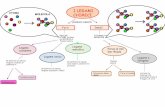
CLASSIFICAZIONE DEI LEGAMI CHIMICI
• LEGAME IONICO
• LEGAME COVALENTE
• LEGAME METALLICO
• LEGAME A IDROGENO
• INTERAZIONI DI VAN DER WAALS
• INTERAZIONI IONE-DIPOLO, DIPOLO-DIPOLO1

2
Quando 2 atomi si avvicinano, il loro assetto elettronico può subiredelle modificazioni. Giuseppe La Regina, Corso di Analisi
Legami chimici
Può accadere che il sistema costituito dall’insieme dei 2 atomiraggiunga uno stato più stabile rispetto al sistema costituito dai 2atomi isolati.
In questo caso, tra i 2 atomi si stabilisce una forza di attrazione, nota come legame chimico.
Nella formazione di questi legami, ogni atomo tende ad assumere unaconfigurazione elettronica completa, cioè generalmente unaconfigurazione elettronica esterna con 8 elettroni (ottetto, s2p6).
Vi sono vari tipi di legami chimici, ma si possono prima di tuttodistinguere il legame ionico ed il legame covalente.
Il legame ionico è caratterizzato da un trasferimento di elettroni da un atomo all’altro.
Il legame covalente è costituito da elettroni messi a comune dagliatomi.

Legami chimici
I vari tipi di legami possono essere spiegati in termini di elettronegatività deglielementi coinvolti nel legame stesso. Giuseppe La Regina, Corso di Analisi
Elettronegatività: tendenza che ha un atomo ad attrarre verso di se gli elettronidi legame. Giuseppe La Regina, Corso di Analisi
In generale: Gli atomi di piccole dimensioni esercitano un’attrazione per gli elettroni di
legame maggiore rispetto agli atomi di dimensioni maggiori. La Regina, Corso di Analisi
Gli atomi che hanno gli orbitali esterni quasi completi esercitano un’attrazioneper gli elettroni di legame maggiore rispetto agli atomi i cui orbitali esternisono scarsamente popolati.
3

Gruppo
Periodo
3
2
1
4
5
6
7
*
**
*
**
* Lantanidi
** Attinidi
3Li
4Be
5B
6C
7N
8O
9F
10Ne
11Na
12Mg
13Al
14Si
15P
16S
17Cl
18Ar
19K
20Ca
21Sc
22Ti
23V
24Cr
25Mn
26Fe
27Co
28Ni
29Cu
30Zn
31Ga
32Ge
33As
34Se
35Br
36Kr
37Rb
38Sr
39Y
40Zr
41Nb
42Mo
43Tc
44Ru
45Rh
46Pd
47Ag
48Cd
49In
50Sn
51Sb
52Te
53I
54Xe
55Cs
56Ba
57La
72Hf
73Ta
74W
75Re
76Os
77Ir
78Pt
79Au
80Hg
81Tl
82Pb
83Bi
84Po
85At
86Rn
87Fr
88Ra
89Ac
104Rf
105Db
106Sg
107Bh
108Hs
109Mt
110Ds
111Rg
112Cn
113Uut
114Uuq
115Uup
116Uuh
117Uus
118Uud
1H
2He
71Lu
58Ce
59Pr
60Nd
61Pm
62Sm
63Eu
64Gd
65Tb
66Dy
67Ho
68Er
69Tm
70Yb
103Lr
90Th
91Pa
92U
93Np
94Pu
95Am
96Cm
97Bk
98Cf
99Es
100Fm
101Md
102No
Elementi di transizione
1s
2s
3s
4s
5s
6s
7s
3d
4d
5d
6d
2p
3p
4p
5p
6p
7p
4f
5f
I II III IV V VI VII VIII
ELETTRONEGATIVITÀ
ELET
TRO
NEG
ATIV
ITÀ
4

Elettronegatività (EN) di alcuni elementi secondoPauling
H(2.1)
He–
Li(1.0)
Be(1.5)
B(2.0)
C(2.5)
N(3.0)
O(3.5)
F(4.0)
Ne–
Na(0.9)
Mg(1.2)
Al(1.5)
Si(1.8)
P(2.1)
S(2.5)
Cl(3.0)
Ar–
K(0.8)
Ca(1.0)
Ga(1.6)
Ge(1.8)
As(2.0)
Se(2.4)
Br(2.8)
Kr–
Rb(0.8)
Sr(1.0)
In(1.7)
Sn(1.8)
Sb(1.9)
Te(2.1)
I(2.5)
X–
Cs(0.7)
Ba(0.9)
Tl(1.8)
Pb(1.8)
Bi(1.9)
Po(2.0)
At(2.2)
R–
Fr(0.7)
Ra(0.9) EN ≤ 1.8 Elementi metallici
EN ≥ 2.5 Elementi non metallici1.8 < EN < 2.5 Elementi semimetallici
Scala quantitativa dell’elettronegatività dedotta dalle energie di legame e dai potenziali di ionizzazione
potenziale di ionizzazione: energianecessaria per staccare un e- da unatomo isolato allo stato gassoso eportarlo a distanza infinita, quindiesprime la tendenza dell’atomo atrattenere i propri e-
5

IL LEGAME IONICO
Na . Cl... ....
Na+ Cl..
.. ....
-
EN = 2.1 EN = 2.8 EN = 0.9 EN = 3.0∆EN = ∆EN =
Insufficiente per la formazione di un
legame ionico
Sufficiente per la formazione di un
legame ionico
gruppo I:un
elettrone di valenza
gruppo VII:sette
elettroni di valenza
BrH Na Cl
2.8-2.1 = 0.7 3.0-0.9 = 2.1
Il legame ionico consiste in un'attrazione elettrostatica tra ioni disegno opposto.
6
N.B. Il Na+ acquista la configurazione elettronica del Ne mentre il Cl- quella dell’Ar

FORMAZIONE LEGAME IONICO
1) Na Na+ + e-E1
Cl-2) Cl + e- + E2
3) Na+ + Cl- NaCl + E3
E1 Potenziale ionizzazione di Na
E2 Affinità elettronica del Cl
E3 Attrazione elettrostatica tra gli ioni
E2 + E3 > E17
Si instaura tra 2 atomi di cui uno ha un basso potenziale di ionizzazione e l’altroun’elevata affinità elettronica. Giuseppe La Regina, Corso di Analisi
Affinità elettronica: energiache si libera quando un atomoacquista un e- formando ilcorrispondente ione negativo

IL LEGAME IONICOGli ioni Na+ e Cl-, essendo di carica opposta si attrarranno.
8
Le forze elettrostatiche seguono la legge di Coulomb, che esprime la forza di interazionetra due corpi carichi:
k = costante (che dipende anche dalle unità di misura usate)Za, Zb = cariche dei due ioni che interagisconorab = distanza tra i due nuclei
Occorre notare che la legge riguarda cariche puntiformi, e gli ioni non lo sono, ma puòessere considerata valida in prima approssimazione.
Reticolo bidimensionale di un cristallo ionico di NaCl.
Il campo di forze elettrostatiche di ogni ione si estende in tutte le direzioni, quindi le coppiedi ioni formatesi possono ancora interagire fra loro formando un aggregato che si estendeordinatamente nello spazio, il reticolo cristallino
Nella formazione deli legami ionici quindi, oltre all’attrazione tra 2 ioni, si manifestano altreforze attrattive che riducono ulteriormente l’energia del sistema, quindi un aggregato ionicoè più stabile di una singola coppia di ioni. La sua stabilità aumenta all’aumentare delnumero di coppie fino ad un minimo di energia che si raggiunge quando il cristallo haraggiunto dimensioni relativamente grandi

IL LEGAME IONICO
Ogni catione è circondato da anioni e viceversa (in questomodo le repulsioni tra ioni dello stesso segno vengonominimizzate).
9
NaCl
Cationi e anioni sono in ugualnumero perchè il composto nelsuo complesso deve essereelettricamente neutro.
Nel NaCl ogni Cl- è legato a 6 Na+
e viceversa in una strutturacristallina la cui unità elementareè un cubo a facce centrate che siripete per tutta l’estensione delcristallo.

IL LEGAME IONICO
gruppo II: due elettroni di valenza
gruppo VII: sette elettroni di valenza
FCaÈ un metallo: cede
i suoi elettroni
Ca++
È un non metallo: tende ad acquistare
l’elettrone che gli manca
F-
CaF2
10
N.B. Il n° di e- perduti da una specie atomica è uguale al n° di e- acquistati dall’altra
Poiché la difficoltà di aggiungere e togliere elettroni agli atomi aumenta all’aumentare delnumero di tali elettroni tolti o aggiunti, i legami tra ioni positivi o negativi con carichemaggiori di 2 non possono essere nettamente ionici.

Le proprietà dei composti ionici
danno origine a solidi cristallini
I vari ioni tendono ad assumere una disposizione geometrica regolare, il reticolocristallino, la cui unità strutturale è il singolo ione, mentre la disposizionegeometrica dipende dalla forma del composto, cioè dalla sua stechiometria edalle dimensioni relative degli ioni costituenti.
hanno alte temperature di fusione e di ebollizione
Per fondere il solido è necessario vincere le forze di attrazione tra le unità delreticolo, ossia le forze di attrazione elettrostatica, relativamente forti. Per fondereuna sostanza ionica è necessaria un’elevata quantità di energia termica che siraggiunge solo con elevate temperature
sono generalmente bianchi
Non assorbono radiazioni della porzione visibile dello spettro
11

sono ben solubili in acqua
Il tipo di solvente adatto per solubilizzare una sostanza dipende dal tipo dilegame presente nella sostanza stessa. Solitamente le forze di attrazioneelettrostatica sono inversamente proporzionali alla costante dielettrica del mezzoin cui si trovano. Quanto maggiore è la costante dielettrica del solvente, tantominori saranno le forze di attrazione tra le particelle di soluto.L’acqua con la sua elevata costante dielettrica (80) un ottimo solvente per lesostanze ioniche.
Le proprietà dei composti ionici
sono insolubili in solventi apolariLe sostanze ioniche non si sciolgono in solventi apolari come il benzene cheha una bassa costante dielettrica (2.5).
sono isolanti allo stato solido
sono conduttori allo stato fuso12

IL LEGAME COVALENTE
Il legame covalente consiste nella condivisione di una o più (massimo tre)coppie di elettroni.
gruppo VII: sette elettroni di valenza
Un legame di questo tipo, ovvero in cui la differenza di elettronegatività tra gli atomi è nulla, è detto covalente puro.
13

IL LEGAME COVALENTE (polare)Se tra due atomi la differenza di elettronegatività non è nulla, ma neanche così elevata da consentire la formazione un legame ionico, si instaurerà un legame covalente polare.
∆EN = 3.0-2.1 = 0.9EN = 3.0 EN = 2.1
H---Clδ+ δ-Il baricentro delle cariche positive
non coincide con quello delle cariche negative
14

IL LEGAME COVALENTE (polare)
Una molecola in cui vi sono 2 centri di cariche (es., HCl) costituisce un dipolo.
Un dipolo è formato da una certa carica positiva e da una uguale caricanegativa situate ad una determinata distanza.
Il prodotto del valore della carica per la distanza tra i centri delle 2 carichesi chiama momento dipolare.
Il momento dipolare dà un’indicazione della tendenza di un dipolo adorientarsi sotto l’azione di un campo elettrico, permettendo di distinguerefra molecole polari e molecole non polari.
15

IL LEGAME COVALENTE (polare)
Il momento dipolare si può determinare misurando la costante dielettricadella sostanza in esame.
Le sostanze polari hanno un’elevata costante dielettrica. La costante dielettrica di una
sostanza è definita come il rapportotra la capacità elettrica di uncondensatore che contiene lasostanza in esame e la capacità delmedesimo condensatorequando è vuoto.
Solvente Costantedielettrica a 20 °C
Acqua 80
Metanolo 30
Acetone 20
Acido acetico 10
Cloroformio 5
Etere etilico 4.5
Benzene 2.5
Esano 2
La polarità di un legame risulta tanto maggiore quanto maggiore è la differenzadi elettronegatività fra i 2 atomi.
16

IL LEGAME COVALENTE: legami polari e apolari
Nel caso di sostanze costituite da più atomi, non è sempre facileprevederne il carattere polare.
Anche se nella molecola ciascun legame è polare, il composto nel suoinsieme può risultare non polare.
Nel caso di CO2 l’ossigeno è più elettronegativo delcarbonio e quindi ciascun legame C─O è polare. Tuttavia,poiché la molecola è lineare, l’effetto di un dipolo vieneannullato dalla presenza dell’altro.
Il CHCl3 risulta polare per la diversa polaritàdei legami C-H e C-Cl. Nella strutturatetraedrica del CCl4 invece i dipoli siannullano.
17

∆EN = 3.5-2.1 = 1.4
EN = 3.5
EN = 2.1
gruppo I:un
elettrone di valenza
gruppo VI:sei elettroni di valenza
18
IL LEGAME COVALENTE POLARE (H2O)

IL LEGAME COVALENTE POLARE (H2O)
La struttura con gli atomi in linea retta, infatti, darebbe origine ad unamolecola apolare, poiché il momento risulterebbe nullo.
L’acqua ha un’elevata costante dielettrica.
Ciò dimostra che nella molecola H─O─H i tre atomi non sono allineati, masono disposti ad un angolo di circa 105 gradi.
19

LEGAMI POLARI E APOLARI
I legami tra 2 atomi, secondo la natura di questi, possono essere:
nettamente ionici;
nettamente covalenti;
possono avere tutte le infinite gradazioni di polarità comprese fra i 2 gradi estremi.
Tra sostanze ioniche e sostanze covalenti non esiste una netta distinzione.
20
Differenza di elettronegatività
Nel caso di atomi aventi elettronegatività diverse, nel legame risulta presente unacerta percentuale di carattere ionico, che è tanto maggiore quanto maggiore è ladifferenza di elettronegatività.

E’ possibile determinare la percentuale di carattere ionico in un legamecovalente, conoscendo la differenza di elettronegatività (XA – XB) tra 2 atomiA e B partecipanti al legame.
LEGAMI POLARI E APOLARI
21

- la struttura cubica a corpo centrato (es., Li, Na, K);
- la struttura cubica a facce centrate (es., Ca, Sr, Al, ecc.);
- la struttura esagonale compatta (es., Be, Mg, ecc.).
IL LEGAME METALLICO
I metalli presentano strutture cristalline in cui gli atomisono disposti in reticoli molto compatti.
Nella struttura cubica a corpo centrato ogni atomo èlegato a 8 atomi.Nelle strutture cubica a facce centrate ed esagonalecompatta ogni atomo è circondato da 12 atomi.
Le strutture fondamentali dei metalli sono:
22

Le strutture dei metalli non si accordano con i tipi di legame presenti nellealtre sostanze, in quanto la natura dei legami non può essere consideratané ionica né covalente.
IL LEGAME METALLICO
Per spiegare le proprietà dei metalli si può immaginare che un metallo siacostituito da un reticolo di ioni metallici positivi, circondati e legati tra loroda un “fluido elettronico” costituito dagli elettroni di valenza.
Gli atomi dei metalli hanno numerosi orbitali vacanti nei loro strati esterni, iquali possono interagire e fondersi con gli analoghi orbitali degli atomivicini.
Gli orbitali di valenza, fondendosi tra loro, danno luogo a nuovi orbitali(livelli elettronici) estesi a tutto il cristallo e che risultano parzialmenteoccupati.
Si può dire che gli elettroni di valenza non appartengono ai singoli atomi,ma a tutto il cristallo nel suo complesso.
Gli elettroni presenti in questi livelli formano i legami che trattengonoinsieme gli atomi nel cristallo.
23

Tali legami potrebbero essere assimilabili a legami di tipo covalente apolare,(elettroni messi in comune da atomi uguali).
IL LEGAME METALLICO
Tuttavia, diversamente dai legami covalenti veri e propri, essi non sonodirezionali.
Proprietà dei metalli conduttori di elettricità e calore
duttili e malleabili
elevata densità
24

IL LEGAME A IDROGENO
H è legato a X da un legame covalente polare e
contemporaneamente è attirato da un secondo atomo fortemente
elettronegativo Y appartenente ad una seconda molecola.
X-Hδ- δ+
Y
L'atomo di idrogeno fa da ponte fra i due atomi X e Y.
δ-
X H Y
Il legame a idrogeno è un tipo di attrazione intermolecolare che si instaura tramolecole che presentano atomi di idrogeno legati ad atomi piccoli e con elevataelettronegatività (F, O, N). L’elevata differenza di elettronegatività rende il legamemolto polarizzato e quindi genera una parziale carica positiva sull’idrogeno. Siverifica pertanto un’attrazione elettrostatica tra l’H di una molecola e l’atomo moltoelettronegativo di una seconda molecola.
25
δ- δ-δ+

Il legame a idrogeno non è forte come un legame covalente o come un legame ionico, ma è il più forte dei legami intermolecolari (forze di Van der Waals).
L’ordine di grandezza dell’energia di legame è:- per i legami ionici e covalenti: 100 kcal/mole;- per i legami a idrogeno: 10 kcal/mole;- per le forze di Van der Waals: 1 kcal/mole.
IL LEGAME A IDROGENO
Gli effetti del legame a idrogeno risultano notevoli in molte proprietà fisichee chimiche delle sostanze:•Bassa volatilità dell’ H2O• H2O, HF, ecc. presentano temperature di ebollizione relativamenteelevate.• a temperatura ambiente, l’acqua è liquida, mentre il suo congenere H2S è gassoso.•Il ghiaccio ha minore densità rispetto all’acqua liquida e occupa un volume maggiore.
26

IL LEGAME IDROGENO
Questa disposizione ordinata aumenta lo spazio esistente tra unamolecola e l'altra col risultato che la densità del ghiaccio diminuiscerispetto all'acqua allo stato liquido. Questo spiega perché l'acqua quandosolidifica aumenta di volume e perché il ghiaccio galleggia sull'acqua.
Perché questo tipo di legame possa formarsi è necessario che le molecolenon abbiano un eccessivo movimento. Nell'acqua allo stato liquido esisteuna certa percentuale di legame a idrogeno e questa aumenta di circa il15% quando l'acqua passa dallo stato liquido a quello solido, stato in cui lavelocità delle molecole diminuisce notevolmente.
27

ATTRAZIONI DIPOLO-DIPOLO
28
Le molecole dipolari creano attorno a sé deboli campi elettrici che fanno sentire lapropria attrazione su altre molecole polari vicine. In questo modo si verificaun'attrazione elettrostatica tra i poli opposti di due molecole: tale interazione è dettainterazione dipolo-dipolo
Sono più efficienti quando le sostanze si trovano negli stati condensati (solido,liquido). Sono tanto più intense quanto maggiore è la differenza di elettronegatività fragli atomi coinvolti (es. CHCl3, H2O, HBr).
Le molecole dipolari tendono a disporre i loro poli di carica opposta l'uno di fronteall'altro. In tale modo si raggiunge una configurazione di elevata stabilità che rendeminima l'energia potenziale del sistema. Le interazioni dipolo-dipolo non sono moltoefficienti nello stato gassoso poiché le distanze intermolecolari sono troppo elevate.

ATTRAZIONI IONE-DIPOLO
Sono interazioni elettrostatiche tra le molecole di solvente di natura polare e gli ioniin esso disciolti: anioni e cationi sono sempre circondati da molecole di solvente(ioni solvatati).
Ad esempio, gli ioni positivi possono attrarre il polo negativo di molecole polaricome H2O, NH3, ecc.
29

DISSOLUZIONE DI UN COMPOSTO IONICO
Grazie alla sua polarità l’acqua può solvatare anioni e cationi, cioè può circondarli. Per solvatare i cationi l’acqua utilizza gli elettroni non condivisi presenti sull’atomo di ossigeno, mentre per solvatare gli anioni utilizza gli atomi di idrogeno sui quali si concentra una parziale carica positiva.
30
Quando si pone un cristallo ionico in acqua inizialmente le molecole di acqua si dispongono intorno agli ioni che si trovano in superficie con la parte positiva in corrispondenza degli anioni e la parte negativa in corrispondenza dei cationi. In questo modo indeboliscono l’attrazione elettrostatica tra cationi e anioni.
Inizialmente il fenomeno riguarda la superficie del cristallo, successivamente agiscono sempre più in profondità nel reticolo cristallino, circondando i singoli ioni (solvatazione) e consentendo loro di disperdersi nel solvente e quindi di sciogliersi.

FORZE DI VAN DER WAALS
Le molecole non polari, trovandosi in presenza di dipoli, possono acquistare, anchesolo temporaneamente, una certa polarità. I dipoli, infatti, generando un campoelettrico, possono dare origine ad una polarizzazione indotta, cioè possono dareorigine a cariche indotte, di segno contrario anche in molecole di natura non polare,generando dei dipoli indotti.
La molecola dipolare dell’H2O deforma la nuvola elettronica della molecola di O2trasformandola in un dipolo
31

L’origine di tali forze è da attribuirsi all’effetto di spostamenti temporanei di caricaelettrica che si verificano in tutti gli atomi e le molecole. Infatti la situazione elettronica diun atomo o molecola è considerata simmetrica solo i senso statistico. Ci possonoessere fluttuazioni nella distribuzione degli elettroni intorno al nucleo che producono unarrangiamento dipolare di cariche temporaneo. Questo dipolo istantaneo può indurre unsimile dipolo in una molecola vicina.
FORZE DI VAN DER WAALSAnche tra molecole non polari possono instaurarsi delle deboli forze dovute al fatto che glielettroni possono assumere distribuzioni non simmetriche rispetto ai nuclei generando unatemporanea separazione di cariche e quindi una polarizzazione (dipoli transienti).
Più le molecole sono polarizzabili, più intense sono le forze di attrazione tra i dipoliistantanei. Le molecole diventano sempre più polarizzabili all'aumentare delle dimensioni;ecco perché Br2 è un liquido e I2, costituito da molecole di maggiori dimensioni, è unsolido.
32

Tipo di legame Modo di formazione Esempi Caratteristiche delle sostanzeInteratomicoIonico
Covalente
Metallico
IntermolecolareIdrogeno
Dipolo
Forze di van der Waals
Trasferimento di elettroni daatomi elettropositivi ad atomielettronegativi ed interazioneelettrostatica tra gli ionirisultanti.Messa in comune di coppie dielettroni da parte di elementi dielettronegatività confrontabile.
Elettroni liberi migranoattraverso un reticolo di ionimetallici.
Ponte di idrogeno tra due atomipiccoli e molto elettronegatividi una stessa molecola o di duemolecole vicine.Attrazione elettrostatica tradipoli permanenti di molecolecovalenti polari.
Attrazione elettrostatica tradipoli indotti in molecoleapolari.
NaCl, LiH, K2S, CaO
H2, Cl2, CH4, B4C, diamante
K, Zn, Cu5Sn
HF, H2O, NH3, DNA, C2H5OH,
CH3Cl, SO2
Ne, Cl2, CH4, CCl4
Esistono come ioni in tutte le fasi;sono conduttori di elettricità alloliquido
Molecole molto stabili, non ionizzatee non conduttrici
Conduttori di elettricità in tutte lefasi.
Punti di fusione e di ebollizionemolto più alti di quelli di sostanzesimili che non hanno ponti diidrogenoPunti di fusione ed ebollizioneleggermente superiori a quelli dimolecole non polari di massaconfrontabile.
Punti di fusione ed ebollizione bassi.Cristalli teneri
RIASSUNTO DEI TIPI DI LEGAME INTERATOMICI E INTERMOLECOLARI
33