PROTEINAS - s7eda9bc1e5199500.jimcontent.com · PROTEINAS DEFINICIÓN AMINOÁCIDOS ESTRUCTURA...
Transcript of PROTEINAS - s7eda9bc1e5199500.jimcontent.com · PROTEINAS DEFINICIÓN AMINOÁCIDOS ESTRUCTURA...


PROTEINAS DEFINICIÓN
AMINOÁCIDOS
ESTRUCTURA
CLASIFICACIÓN
Apolares
Polares sin carga
Polares con carga ácidos
Polares con carga básica
PROPIEDADES
ENLACE
PEPTÍDICO
PROTEÍNAS
ESTRUCTURA
PRIMARIA
SECUNDARIA
TERCIARIA
CUATERNARIA
PROPIEDADES
CLASIFICACIÓN
FUNCIONES
Formadas por
Que se unen
mediante
Para formar

PROTEINAS
C O H N y P S

• ¿CUANTO OCUPAN LAS PROTEINAS EN EL CUERPO HUMANO?
• Las proteínas son muy abundantes, pues constituyen casi la mitad del peso en seco de la célula. En el organismo de una persona adulta, del 18 al 19% de su peso está formado por proteínas, lo que en una persona de unos 70 kg. de peso supone unos 13 kg. aproximadamente.




Los aminoácidos se unen entre sí originando péptidos. Según su tamaño
molecular, pueden ser oligopéptidos, formados por no más de 10 Aa y
polipéptidos, constituidos por más de 10 Aa.
Cuando el número de Aa supera los 50 y el polipeptido tiene una estructura
tridimensional específica se habla propiamente de proteínas.
Los aminoácidos que un organismo no puede sintetizar y, por tanto, tienen
que ser suministrados con la dieta se denominan aminoácidos esenciales; y
aquellos que el organismo puede sintetizar se llaman aminoácidos no
esenciales.
Para la especie humana son esenciales ocho aminoácidos: treonina,
metionina, lisina, valina, triptófano, leucina, isoleucina y fenilalanina
(además puede añadirse la histidina como esencial durante el crecimiento,
pero no para el adulto)

ALGUNOS PÉPTIDOS NATURALES
a) Oxitocina.- es un péptido con función hormonal que produce la hipófisis para
provocar las contracciones uterinas durante el parto.
b) Encefalina.- es un péptido de 5 aminoácidos producido por las células nerviosas
(neuronas) para inhibir el dolor; es decir, actúa como la morfina.
c) Veneno de escorpiones y algunas serpientes. Son péptidos con acción neurotóxica. y
por tanto producen irritaciones, paralizaciones e incluso la muerte de las presas.


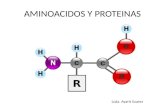
Aminoácidos I Moléculas orgánicas que presentan un radical amino y un radical carboxilo.
Existen más de cien en la naturaleza.
Sólo 20 forman parte de casi todas las proteínas, se denominan proteínicos. Son
todos α-aminoácidos.
C COOH R
NH2
H
Otros aminoácidos pueden presentar interés biológico, porque forman parte de
proteínas de microorganismos, porque dan lugar a moléculas fundamentales
(tiroxina) o porque sufren modificaciones como metilaciones, fosforilaciones, ... (
β-alanina; forma parte de coenzimas, ácido γ- aminobutírico; neurotransmisor de
las sinapsis inhibidoras).

Aminoácidos III. Clasificación
Grupo carboxilo ionizado
Grupo amino ionizado







AMINOÁCIDOS RAMIFICADOS
Se les llama ramificados por la disposición de sus cadenas laterales que van unidas a la base del
carbono del
aminoácido, o también se les llama esenciales puesto que es necesario consumirlos en las dietas
ya que
nuestro cuerpo no los produce por sí solo. Estos aminoácidos a los que nos referimos son la leucina
(Leu), la
isoleucina (Iso) y a la valina (Val).
Estos aminoácidos no son usados por el hígado si no que son usados por el músculo para la
formación de
energía cuando el nivel de glucógeno se está ajustando. Son, pues una fuente de energía directa
para el
organismo.
El aporte de dichos aminoácidos consigue un descenso de hasta un 15% de fatiga mental y un 7%
de menor
agotamiento físico ya que la concentración de glucógeno muscular sólo desciende un 10% frente a
un 35% en
el de placebo (J. Bilbao e Iñaki Iñigo, 1999).
Tiene otras propiedades, estimulan la síntesis proteica por lo que aumentan el desarrollo muscular,
importante
en situaciones de entrenamiento intenso de cara a la preparación de una competición, se favorece
un aumento
de la fuerza al disminuir el pH del músculo (S. Ribas, 1998

PROPIEDADES DE LOS AMINOACIDOS
Los aminoácidos son compuestos sólidos; incoloros; cristalizables; de
elevado punto de fusión (habitualmente por encima de los 200 ºC); solubles
en agua; con actividad óptica y con un comportamiento anfótero.
•1. ACTIVIDAD OPTICA
Tienen C asimétrico (menos la glicina) y desvían el plano de la luz
polarizada. No tiene por qué coincidir con las formas D o L.
•2. COMPORTAMIENTO ANFÓTERO
Disueltos en agua pueden ionizarse como ácido (liberando protones) o
como una base (captando protones) dependiendo del pH.
•3. PUNTO ISOELÉCTRICO:
pH en el que el aminoácido adopta forma neutra, con tantas cargas
positivas como negativas.

PROPIEDADES DE LOS AMINOACIDOS
•1. ACTIVIDAD OPTICA
Tienen C asimétrico y desvían el plano de la luz polarizada. No tiene por
qué coincidir con las formas D o L.
Tridimensionalmente el carbono presenta una configuración tetraédrica en la que el carbono se dispone en el centro y los cuatro elementos que se unen a él ocupan los vértices. Cuando en el vértice superior se dispone el -COOH y se mira por la cara opuesta al grupo R, según la disposición del grupo amino (-NH2) a la izquierda o a la derecha del carbono se habla de " -L-aminoácidos o de " -D-aminoácidos respectivamente. En las proteínas sólo se encuentran aminoácidos de configuración L.
Imágenes especulares no
superponibles entre si
ENANTIOMEROS

PROPIEDADES DE LOS AMINOACIDOS
2. COMPORTAMIENTO ANFÓTERO
El comportamiento anfótero se refiere a que, en disolución acuosa, los aminoácidos son capaces de ionizarse, dependiendo del pH, como un ácido (cuando el pH es básico), como una base (cuando el pH es ácido) o como un ácido y una base a la vez (cuando el pH es neutro).
pH neutro
pH ácido Comportamiento
básico. (Capta
protones)
Queda cargado
positivamente
pH básico Comportamiento
ácido. (Libera
protones)
Queda cargado
negativamente
- +
+ -
+ -
N

Si disminuye el pH, el medio se hace ácido, aumenta la concentración de H+. El aminoácido tiende a neutralizar la acidez captando H+ y se carga positivamente, se comporta como base. Si aumenta el pH el medio se hace básico, disminuye la concentración H+. El aminoácido tiende a neutralizar la basicidad, libera protones y se carga negativamente, se comporta como un ácido.
2. COMPORTAMIENTO ANFÓTERO (II)
http://www.lourdes-
luengo.org/unidadesbio/proteinas/proteinas
.htm

El pH en el cual un aminoácido tiende a adoptar una forma dipolar neutra
(igual número de cargas positivas que negativas) se denomina Punto
Isoeléctrico. La solubilidad en agua de un aminoácido es mínima en su
punto isoeléctrico.
3. PUNTO ISOELÉCTRICO:

ENLACE PEPTÍDICO Se enlazan el grupo carboxilo de un aminoácido y el grupo amino del siguiente aminoácido liberándose una molécula de agua. Estos dos grupos se sitúan en el mismo plano y las distancias y ángulos que se crean entre ellos es algo fijo, siempre son iguales.
Estos enlaces por hidrólisis se rompen, y como consecuencia los péptidos y proteínas se desdoblan en los aminoácidos que los forman. Este proceso se puede realizar por métodos químicos (ácidos, álcalis, etc) o mediante enzimas proteolíticas
Los dos extremos de un peptido no son equivalentes, existe el extremo N
terminal y el C terminal. Por convenio, el extremo amino se considera
como el comienzo de la cadena peptídica.


CARACTERÍSTICAS DEL ENLACE PEPTÍDICO
1. Enlace covalente tipo amida
2. Carácter parcial de doble enlace (rígido y sin rotaciones, átomos en
el mismo plano)
3. Los enlaces del Cα con el ácido carboxílico y con la amina si
pueden girar.
4. EL O del carbonilo y el H del amino se situan en lados opuestos del
enlace (configuración trans)

La disposición en el espacio de los cuatro átomos de la unidad peptídica y los dos átomos de carbono alfa es tal que se sitúan en un mismo plano (plano peptídico) con distancias y ángulos fijos; esta ordenación planar es rígida. Sólo hay libertad de rotación alrededor de los carbonos alfa.




ESTRUCTURA DE LAS PROTEINAS
Las proteínas podemos definirlas como largas cadenas polipeptídicas
(a veces una sola) que presentan una determinada configuración
espacial denominada conformación nativa. La función que
desempeñan depende de esta forma que adoptan en el espacio. La
configuración espacial de las proteínas viene determinada por 4 niveles
estructurales o estructuras
PRIMARIA secuencia de aminoácidos
SECUNDARIA hélice α y lámina plegada β, hélice de colágeno
TERCIARIA globular y filamentosa
CUATERNARIA unión de varias cadenas
Cada uno de estos niveles se construye a partir del anterior.


La ESTRUCTURA PRIMARIA esta representada por la sucesión lineal de aminoácidos que forman la cadena peptídica y por lo tanto indica qué aminoácidos componen la cadena y el orden en que se encuentran. El ordenamiento de los aminoácidos en cada cadena peptídica, no es arbitrario sino que obedece a un plan predeterminado en el ADN. Esta estructura define la especificidad de cada proteína.
Las cadenas R se disponen
alternativamente a uno y otro
lado del eje.



ESTRUCTURA SECUNDARIA
• Disposición que adopta la cadena de aminoácidos en el espacio, debida
a la capacidad de rotación que tiene el Cα de cada aminoácido.
• Una misma cadena puede adoptar diferentes estructuras secundarias en
diferentes segmentos de la misma según sean los ángulos que forman
entre sí los enlaces peptídicos consecutivos y eso depende de la sucesión
de Aa (de la estructura primaria).
Las estructuras más importantes son:
-Hélice alfa
- Lamina plegada beta

HÉLICE ALFA
Los planos de los sucesivos enlaces peptídicos se disponen formando una hélice dextrógira. Hay 3.6 aminoácidos por cada vuelta, y cada vuelta tiene 5.4 angstroms. Todas las cadenas laterales de los Aa se proyectan hacia fuera de la hélice y los grupos C=O y N-H de los enlaces peptídicos quedan hacia arriba o hacia abajo, en dirección más o menos paralela al eje de la hélice. Esta disposición de los planos peptídicos permite que se formen enlaces por puente de hidrógeno entre un C=O y un N-H cada cuatro aminoácidos. Estos enlaces son paralelos al eje de la hélice

3,6 Aa /vuelta
Esta estructura se mantiene gracias a enlaces por puentes de hidrógeno que se
establecen entre grupos NH y grupos CO de enlaces peptídicos diferentes que debido al
enrollamiento se encuentran enfrentados.
Puede presentarse tanto en proteínas globulares como fibrosas
5.4 A



HOJA PLEGADA O ESTRUCTURA BETA
En esta estructura los planos de los enlaces peptídicos sucesivos se disponen en zig.zag, La estructura se estabiliza también mediante enlaces por puentes de hidrógeno entre los grupos C=O y N-H de planos peptídicos pertenecientes a diferentes segmentos de la cadena polipeptídica. Las cadenas laterales se colocan por encima y por debajo alternativamente porque la configuración del enlace es trans.
Como la alfa hélice la estructura en beta
hoja también es muy estable ya que todos
los grupos carbonilo de los planos
peptídicos forman puentes de hidrógeno
con los amino.



45
ANTIPARALELA
PARALELA
Conformación-β

La estabilidad de esta disposición se mantiene gracias a la asociación de varias
moléculas o varios segmentos de la misma cadena polipeptídca
La lámina aparece en muchas regiones de proteínas globulares y
también en proteínas estructurales como la fibroína de la seda

Se une de 3 en 3; superhélice

48
Secuencias de la cadena polipeptídica con
estructura α o β a menudo están conectadas
entre sí por medio de los llamados giros β.
Son secuencias cortas, con una conformación
característica que impone un brusco giro de
180o a la cadena principal de un polipéptido.
Giros β
AA como Asn, Gly y Pro (que se acomodan mal
en estructuras de tipo α o β) aparecen con
frecuencia en este tipo de estructura.
La conformación de los giros b está estabilizada
generalmente por medio de un puente de
hidrógeno entre los residuos 1 y 4 del giro β
Sirven para que la proteína adopte estructuras
más compactas

La ESTRUCTURA TERCIARIA esta representada por los superplegamientos y
enrrollamientos de la estructura secundaria, constituyendo formas tridimensionales
geométricas muy complicadas que se mantienen por enlaces fuertes (puentes
disulfuro entre dos cisteinas) y otros débiles (puentes de hidrógeno; fuerzas de Van
der Waals; interacciones iónicas e interacciones hidrofóbicas).
Desde el punto de vista funcional, esta estructura es la más importante pues, al
alcanzarla es cuando la mayoría de las proteinas adquieren su actividad biológica o
función.

50
• La conformación terciaria de una proteína globular es la conformación tridimensional del polipéptido plegado.
• Las interacciones que intervienen en el plegamiento de la estructura secundaria son:
• Interacciones hidrofóbicas entre restos laterales no polares.
• Uniones de Van der Waals.
• Puentes de Hidrógeno.
• Interacciones salinas.
• Puentes Disulfuro.
• Las funciones de las proteínas dependen del plegamiento particular que adopten.
• Esta estructura está altamente influenciada por la estructura primaria.
Estructura terciaria







1. La estructura cuaternaria es la unión mediante
enlaces débiles (no covalentes) de varias cadenas
polipeptídicas con estructura terciana, idénticas o
no, para formar un complejo proteico.
2. Cada una de estas cadenas polipeptídicas recibe
el nombre de protómero (subunidad o monómero)
3. Según el número de protómeros que se asocian.
las proteínas que tienen estructura cuaternaria se
denominan:
• Dímeros, como la hexoquinasa.
• tetrámero como la hemoglobina.
• Pentámeros, como la ARN-polimerasa.
• Polímeros, cuando en su composición
intervienen gran número de protómeros.
(cápsida del virus de la poliomielitis, que
consta de 60 subunidades proteicas, los
filamentos de actina y miosina de las células
musculares, etc).
58
Estructura cuaternaria

59
• Las interacciones que estabilizan esta estructura son en general uniones débiles:
• Interacciones hidrofóbicas.
• Puentes de hidrógeno.
• Interacciones salinas.
• Fuerza de Van der Waals.
• En algunas ocasiones puede haber enlaces fuertes tipo puentes disulfuro, en el caso de las inmunoglobulinas.
Estructura cuaternaria

60




65
En resumen, la estructura de una proteína.
Primaria Secundaria Terciaria Cuaternaria
Secuencia Conformación Asociación
Hélice
Hoja Plegada
Globular
Fibrosa
Subunidades iguales
Subunidades distintas
Combinación
ilimitada de
aminoácidos.
Unión
Peptídica
Puente de
Hidrógeno
Puente de Hidrógeno,
Interacciones hidrofóbicas,
salinas, electrostáticas.
Fuerzas diversas no
covalentes.

PROPIEDADES DE LAS PROTEINAS
Las propiedades de las proteínas dependen sobre todo de los radicales R
libres y de que éstos sobresalgan de la molécula y, por tanto, tengan la
posibilidad de reaccionar con otras moléculas.
El conjunto de aminoácidos de una proteína cuyos radicales poseen la
capacidad de unirse a otras moléculas y de reaccionar con éstas se
denomina centro activo de la proteína.
66

Propiedades de las proteínas
Solubilidad Desnaturalización y renaturalización
Especificidad
De función De especie
Capacidad amortiguadora

Las proteínas globulares poseen un elevado tamaño molecular, por lo
que al disolverse, dan lugar a disoluciones coloidales.
La solubilidad de estas moléculas se debe a los radicales R que, al
ionizarse, establecen puentes de hidrógeno con las moléculas de
agua. Así, la proteína queda recubierta de una capa de moléculas de
agua que impide que se pueda unir a otras proteínas, lo que
provocaría su precipitación.
Solubilidad
La solubilidad depende del pH,
temperatura, concentración
iónica... A pesar de ser solubles, la
mayoría de las membranas
biológicas son impermeables al
paso de proteínas.
Capa de moléculas de agua

Pérdida de la conformación espacial característica de la proteína
cuando se somete a condiciones ambientales desfavorables.
Consiste en la pérdida de todas las estructuras de orden superior
(secundaria, terciaria y cuaternaria) quedando la proteína reducida
a un polímero con estructura primaria.
Consecuencias inmediatas son:
- Disminución drástica de la solubilidad de la
proteína, acompañada frecuentemente de
precipitación
- Pérdida de todas sus funciones biológicas
- Transformación en filamentos lineales y delgados que se
entrelazan unos con otros para formar compuestos
fibrosos e insolubles en agua.
Desnaturalización y renaturalización

Desnaturalización reversible e irreversible
REVERSIBLE:
Ocurre cuando las condiciones ambientales que la provocan
duran poco tiempo o son poco intensas. Cuando cesan las
proteinas adoptan la conformación original
(RENATURALIZACION)
IRREVERSIBLE:
Cambios ambientales intensos y persistentes, y los filamentos
permanecen en estado fibroso, insolubles en agua y sin
actividad biológica.

Agentes desnaturalizantes
I. Físicos
1. Calor. La mayor parte de las proteínas experimentan
desnaturalizaciones cuando se calientan entre 50 y 60 ºC; otras se
desnaturalizan también cuando se enfrían por debajo de los 10 a 15 ºC.
2. Radiaciones
II. Químicos: todos los agentes que rompen interacciones
o enlaces presentes en la estructura nativa de la proteína:
1. Detergentes
2. Urea y guanidina a altas concentraciones
3. Altas concentraciones de sal y extremos de pH
4. Reactivos de grupos -SH

HOCH2 CH2 SH
CH2 SH
HOCH
HCOH
CH2 SH
C O
NH2
NH2
C NH
NH2
NH2
O S
O
O
O-
2-mercaptoetanol
Ditiotreitol (DTT)
Dodecilsulfato sódico (SDS, laurilsulfato)
Urea
Guanidina
Agentes desnaturalizantes

73

La especificidad es doble:
• de especie
• de función.
Especificidad de especie:
En su secuencia de aminoácidos, las proteínas presentan dos tipos de
sectores:
• Sectores estables
• Sectores variables: Algunos aminoácidos pueden ser sustituidos por
otros distintos sin que se altere la funcionalidad de la molécula.
Ello ha dado lugar, durante la evolución, a una gran variabilidad de proteínas,
lo que permite que cada especie tenga sus proteínas específicas y que,
incluso, aparezcan diferencias entre individuos de la misma especie (rechazo
en trasplantes de tejidos).
Las diferencias entre proteínas homologas, es decir, con la misma función,
son grandes entre especies alejadas evolutivamente y escasas entre especies
emparentadas.
74
Especificidad

Especificidad de función.
La especificidad también se refiere a la función.
• Cada proteína realiza una determinada función exclusivamente, por ejemplo,
catalizar cierta reacción química sobre cierto substrato y no sobre otro.
• La especificidad se debe a que su actuación se realiza mediante
interacciones selectivas con otras moléculas, para lo que necesitan una
determinada secuencia de aa y una conformación concreta.
• Un cambio en la secuencia o conformación puede impedir la unión y por lo
tanto dificultar la función.
75

Las proteínas, al estar constituidas por aminoácidos, tienen un
comportamiento anfótero. Tienden a neutralizar las variaciones de pH
del medio, ya que pueden comportarse como un ácido o una base y,
por tanto, liberar o retirar protones (H+) del medio
76
Capacidad amortiguadora

CLASIFICACIÓN DE PROTEÍNAS
Se clasifican en:
• Holoproteínas: Formadas solamente por aminoácidos.
• Heteroproteínas: Formadas por una fracción proteínica y por
un grupo no proteínico, que se denomina "grupo prostético.
Se clasifican según la naturaleza del grupo prostético.
77
PROTEÍNAS
Holoproteínas
Proteínas filamentosas
Proteínas globulares
Heteroproteínas
Cromoproteínas
Glucoproteínas
Lipoproteínas
Nucleoproteínas
Fosfoproteínas

Globulares:
1. Prolaminas: Zeína (maíz),gliadina (trigo), hordeína (cebada)
2. Gluteninas: Glutenina (trigo), orizanina (arroz).
3. Albúminas: Seroalbúmina (sangre), ovoalbúmina (huevo),
lactoalbúmina (leche)
4. Hormonas: Insulina, hormona del crecimiento, prolactina,
tirotropina
5. Enzimas: Hidrolasas, Oxidasas, Ligasas, Liasas, Transferasas .
78
HOLOPROTEÍNAS
Más complejas que las fibrosas. Forman estructuras compactas, casi esféricas,
solubles en agua o disolventes polares. Son responsables de la actividad celular

Fibrosas:
1. Colágenos: en tejidos conjuntivos, cartilaginosos
2. Queratinas: En formaciones epidérmicas: pelos, uñas, plumas,
cuernos.
3. Elastinas: En tendones y vasos sanguíneos
4. Fibroínas: En hilos de seda, (arañas, insectos)
79
HOLOPROTEÍNAS
Más simples que las globulares. Forman estructuras alargadas, ordenadas en una
sola dimensión, formando haces paralelos. Son responsables de funciones
estructurales y protectoras

1. Glucoproteínas:GP: glúcido. Ej. ribonucleasa, anticuerpos, hormona
luteinizante
2. Lipoproteínas: GP lípido. De alta, baja y muy baja densidad, que
transportan lípidos en la sangre.
LDL
Transporte de colesterol y fosfolípidos.
Entrada en células: mediada por receptores.
Dirección: hígado – tejidos (colesterol malo)
HDL
Tejidos al hígado (colesterol bueno)
3. Nucleoproteínas: Histonas + ácidos nucleicos.
Estabiliza el ADN. Ejemplos; Nucleosomas de la cromatina, ribosomas,
histonas y protaminas de eucariotas.
4. Cromoproteínas: GP: pigmentos. Pueden ser de dos tipos:
a) Porfirínicas. (hemo) Hemoglobina, mioglobina que transportan
oxígeno, citocromos, que transportan electrones
b) No porfirínicas como la hemocianina (pigmento respiratorio de
crustáceos y moluscos, de color azul y que contiene cobre)
5. Fosfoproteínas: Tienen PO4H3 en el grupo prostético. La caseína de la
leche.
HETEROPROTEÍNAS Contienen parte no proteica: GRUPO PROSTÉTICO

81
1. Estructural
2. Enzimática
3. Hormonal
4. Defensiva
5. Transporte
6. Reserva
7. Función
homeostática
8. Anticongelante
9. Actividad contráctil
FUNCIONES Y EJEMPLOS DE PROTEÍNAS:

Es una de las funciones más características:
• Algunas glucoproteínas forman parte de las membranas celulares. Intervienen en el transporte selectivo de iones (bomba de Na-K)
• Otras proteínas forman el citoesqueleto de las células, las fibras del huso, de los cilios y flagelos.
• Otras, como las histonas forman parte de los cromosomas eucariotas. • El colágeno, que mantiene unidos los tejidos animales y forma los
tendones y la matriz de los huesos y cartílagos. • La elastina, en el tejido conjuntivo elástico (ligamentos paredes de vasos
sanguíneos). • La queratina, que se sintetiza en la epidermis y forma parte de pelos, uñas,
escamas de reptiles, plumas, etc. • La fibroína, que forma la seda y las telas de arañas. Es una disolución
viscosa que solidifica rápidamente al contacto con el aire.
82
Estructural

• Es la función más importante.
• Las enzimas son las proteínas más numerosas y especializadas y actúan como biocatalizadores de las reacciones que constituyen el metabolismo celular.
• Se diferencian de los catalizadores no biológicos porque las enzimas son específicas de la reacción que catalizan y de los sustratos que intervienen en ellas.
83
Insulina y glucagón ; regulan el metabolismo de los glúcidos Hormona del crecimiento segregada por la hipófisis Calcitonina
Enzimática
Hormonal
Inmunoglobulina,; anticuerpos frente a antígenos Trombina y fibrinógeno; protección (coágulos) Proteoglucanos (mucinas) germicidas y protectores
Defensiva

• Además de las proteínas transportadoras de las membranas, existen otras
extracelulares que transportan sustancias a lugares diferentes del organismo. • Hemoglobina, la hemocianina (invertebrados) y la mioglobina del
músculo estriado. • Los citocromos transportan electrones en la cadena respiratoria
(mitocondrias) y en la fase luminosa de la fotosíntesis (cloroplastos). • La seroalbúmina transporta ácidos grasos, fármacos y productos
tóxicos por la sangre. • Las lipoproteínas transportan el colesterol y los triacilglicéridos por la
sangre. (Recordad que los lípidos son insolubles en agua
84
Transporte

85
En general, las proteínas no se utilizan para la obtención de energía. No
obstante, algunas como la ovoalbúmina de la clara de huevo, la caseína de la leche o la gliadina de la semilla de trigo, son utilizadas por el embrión en desarrollo como nutrientes.
Las proteínas intracelulares y del medio interno intervienen en el
mantenimiento del equilibrio osmótico en coordinación con los tampones.
Reserva
Función homeostática

Presentes en el citoplasma de ciertos peces antárticos.
El movimiento y la locomoción en los organismos unicelulares y pluricelulares
dependen de las proteínas contráctiles: • la dineína, en cilios y flagelos, • la actina y miosina, responsables de la contracción muscular.
86
Anticongelante
Función contráctil



En la figura se observan tres fragmentos de la estructura de una
proteína. Haz un comentario. (C=gris; H=blanco; O=rojo; N=azul;
R=amarillo).






Basándote en lo que se haz un comentario.


http://www.educa.madrid.org/web/cc.nsdel
asabiduria.madrid/Ejercicios/2b/Biologia/pr
oteinas/estruc_prot2.htm
http://milksci.unizar.es/bioquimica/temas/a
minoacids/estructurprot.html

Estructura de las proteínas
Estructura primaria
Una cadena polipeptídica consiste en una cadena lineal de aminoácidos unidos por enlaces peptídicos. El primer puesto de la
cadena corresponde al grupo amino terminal, y la estructura primaria es la secuencia en la que están situados todos los
constituyentes hasta llegar al carboxilo terminal. Esta secuencia está codificada genéticamente
Existen cadenas polipeptídicas de cualquier número de aminoácidos, sin que exista una solución de continuidad entre péptidos y
proteínas. Por convención, se suele considerar proteína a quellos polipéptidos con un peso molecular del orden de 10.000 o más.
Estructura secundaria
La estructura secundaria es la forma en la que la cadena polipeptidica se pliega en el espacio. En una proteína, cada tramo de
cadena polipeptídica tiene distinta estructura secundaria. Existen varias formas definidas de estructura secundaria, las más
importantes de las cuales son las llamadas hélice a y hoja plegada .
Las estructuras secundarias definidas están mantenidas por puentes de hidrógeno formados exclusivamente entre los grupos amino
y carboxilo que constituyen el esqueleto de la cadena polipeptídica. Consecuentemente, los parámetros estructurales (distancias,
ángulos) serán iguales, independientemente de la proteína y de los aminoácidos que formen la estructura.




PROPIEDADES DE LOS PROTEINAS
1. Capacidad amortiguadora
2. Especificidad
3. Desnaturalización
4. Solubilidad
5. Punto isoeléctrico
La propiedades físicas y químicas de una proteína dependen casi por
completo de los grupos funcionales contenidos en las cadenas laterales R
de los aminoácidos que quedan expuestos en su superficie, es decir, del
plegamiento de la cadena o cadenas peptídicas y de la conformación
geométrica que adopten

PROPIEDADES
1. Capacidad amortiguadora debido a su comportamiento anfótero.
2. Especificidad.
• Los grupos funcionales de las cadenas laterales R definen una superficie activa e
interaccionan con otras moléculas. Sólo una pequeña fracción de aminoácidos se
distribuyen por al superficie, el resto es necesario para mantener la forma de la
proteína.
• Generalmente la actividad biológica se basa en la unión selectiva con otra
molécula de geometría complementaria.
ESPECIFICIDAD=“Unión de la superficie activa (sitio activo) de las proteínas con
otras moléculas se basa en el plegamiento particular de cada proteína (estructura
terciaria o cuaternaria si la hay) que, en último término depende de la secuencia de
aminoácidos”.
• Son específicas de cada especie e incluso de cada organismo.
• La semejanza entre proteínas es mayor cuanto mayor sea el grado de parentesco
evolutivo.
. Por tanto, cualquier cambio en la secuencia de aminoácidos de una proteína puede ocasionar una modificación de las estructuras secundaria, terciaria y cuaternaria(si la tiene) que provoca la alteración de la geometría de la superficie activa y en consecuencia la pérdida de la función biológica.

ANEMIA FALCIFORME
La anemia falciforme es una enfermedad hereditaria de los glóbulos rojos. Se
caracteriza por episodios de dolor, anemia (falta de glóbulos rojos), infecciones serias
y daño en órganos vitales. Cadena B 6glu-val
Los síntomas de la anemia falciforme son causados por una hemoglobina anormal. La
hemoglobina, la principal proteína contenida en los glóbulos rojos, transporta el
oxígeno desde los pulmones hacia todo el organismo. Normalmente, los glóbulos
rojos son redondos y flexibles y se desplazan fácilmente por los vasos sanguíneos.
Pero en la anemia falciforme, la hemoglobina anormal hace que los glóbulos rojos se
endurezcan y, vistos bajo el microscopio, adoptan la forma de una letra C, como una
hoz.. Esto causa dolor (llamado episodio o crisis de dolor de anemia falciforme) y, a
veces, daños en los órganos. Los glóbulos rojos falciformes también mueren y se
descomponen más rápidamente que los glóbulos normales, lo cual produce anemia


3. Desnaturalización. Pérdida de su conformación espacial característica
cuando se somete a condiciones ambientales desfavorables ( cambios de
temperatura, pH, salinidad, composición, radiaciones, ...) y como consecuencia
de ello se anula su función biológica. Se alteran los puentes de hidrógeno y el
resto de interacciones débiles que mantienen la estructura secundaria y
terciaria, pero no el covalente.
Al romperse los enlaces débiles las proteínas se transforman en filamentos
lineales y delgados que se entrelazan unos con otros hasta formar compuestos
fibrosos e insolubles en agua.
Si el cambio no ha sido muy drástico
se puede producir la renaturalización.



D. Solubilidad.
Las proteínas fibrosas son insolubles, pero las globulares suelen ser
solubles ya que las cargas positivas y negativas en la superficie de la
proteina interaccionan con las moléculas de agua de su entorno, dando
lugar a una capa de solvatación.
E. Punto isoeléctrico. Cada proteína tiene un pH para el cual la carga
neta de la molécula es nula. Esta propiedad se aprovecha para separar
proteínas de una mezcla por un procedimiento denominado electroforesis


CLASIFICACIÓN DE LAS PROTEÍNAS
HOLOPROTEINAS
P. GLOBULARES
P. FILAMENTOSAS
• ALBÚMINAS: (ovo, lacto y seroalbúminas)Función de reserva
y transportadora
• GLOBULINAS: asociadas a la hemoglobina y a los
anticuerpos
• HISTONAS Y PROTAMINAS. Interaccionan con el ADN
eucariota
Insolubles en agua y desempeñan funciones
estructurales como el colágeno, la elastina, la
queratina y la fibroína
HETEROPROTEINAS • GLUCOPROTEINAS. GP=cadena glucídica
(proteoglucanos, proteínas de membrana, hormonas…)
• LIPOPROTEINAS GP=sust. lipídica. Transporte de
colesterol y otros lípidos por el torrente sanguíneo)
• CROMOPROTEINAS GP=sust. Coloreada que puede ser
– Naturaleza porfirínica (grupo hemo)
-- N. no porfirínica (sin anillos tetrapirrólicos)
hemocianina
• OTROS: fosfoproteinas (GP= ac. Fosfórico) caseina
nucleoproteínas (GP el ADN)
Formadas por cadenas
peptídicas (grupo
proteico) y sustancias
no proteínas (grupo
prostético)(GP)

El grupo hemo es un grupo prostético que
forma parte de la hemoglobina que se
encuentra en los eritrocitos de la sangre.
El grupo hemo contiene hierro y un anillo
de porfirina, es un tetrapirrol cíclico, el
tetrapirrol está compuesto por 4 cadenas
de pirrol enlazadas a un anillo, en el centro
de este anillo se encuentra el átomo de
hierro.
Se encuentra principalmente unido a
cadenas polipeptídicas de la hemoglobina
en los eritrocitos. Su función principal es la
de almacenar y transportar oxígeno
molecular de los pulmones hacia los
tejidos y dióxido de carbono desde los
tejidos periféricos hacia los pulmones.
Los grupos hemo son los responsables del
color rojo de la sangre.

ENZIMAS

ENZIMAS o BIOCATALIZADORES

Enzimas. Naturaleza y acción La mayoría son proteínas globulares y conjugadas o
heteroproteínas.
Enzima
Apoenzima (parte proteica)
Cofactor (parte prostética) Cofactor (inorgánico)
Coenzima (orgánico)
Mecanismo de acción: E + S ES E + P
Centro activo: región del enzima donde se une el sustrato. Diferentes aá. realizan
distintas funciones: unen el sustrato, orientan el sustrato, mantienen la estructura
del centro activo y modifican el sustrato y lo transforman en producto.
Es fundamental mantener la secuencia y estructura.
Efectores: lugares donde pueden unirse otras sustancias y modificar la actividad
enzimática

Especificidad enzimática Teoría de la “llave-cerradura” de Fisher
Teoría del “ajuste inducido”
Especificidad de sustrato:
•Absoluta: sólo reconoce un sustrato. Ej. Glucoxidasa (glucosa)
•Relativa: varios sustratos con estructuras semejantes. Ej. Hexoquinasa (fosforila
hexosas)
•Estereoquímica: reconoce a un estereoisómero. Ej. Forma D, pero no a la forma L
Enzimas bisustrato: reconocen a dos sustratos
Especificidad de acción: sólo cataliza una de las posibles reacciones que puede
sufrir un sustrato y dan lugar a rutas metabólicas diferentes.

Cinética enzimática I

Cinética enzimática II

Cinética enzimática III Efectores: modifican la actividad del enzima, pueden ser activadores e
inhibidores.
Reversibles:
•Competitivos
•No competitivos.
e i no
e s si
e
i
s
i
e
s s e si
i e no
Irreversibles: se altera definitivamente la estructura del enzima. Ej. algunos
antibióticos, venenos,...

Cinética enzimática IV
Otras formas de regulación de la actividad enzimática:
•Enzimas alostéricos: adquieren nueva conformación al unirse al sustrato de
modo que aumenta su actividad.
•Complejos multienzimáticos: conjunto de enzimas que aumentan la eficacia de la
reacción.
•Proenzimas o zimógenos: son inactivas hasta que sufren la transformación a
enzimas.

Enzimas. Clasificación
denominación función
1. Oxidorreductasas Reacciones de oxidación-reducción
2. Transferasas Transferencia de un grupo funcional.
3. Hidrolasas Ruptura de una molécula mediante adicción de H2O
4. Liasas Ruptura no hidrolítica de enlaces
5. Isomerasas Transformación en su isómero
6. Ligasas Formación de enlaces. Requiere energía (ATP)

Coenzimas I Naturaleza nucleotídica:
•AMPc (AMP cíclico). Interviene en la transducción de señales. 2º mensajero.
•ATP (moneda energética). También GTP, UTP, ...
•NAD (nicotín-adenín dinucleótido): vitamina PP y adenosina. Interviene en
reacciones de oxido-reducción.
•FAD (flavín-adenín dinucleótido): vitamina B2 y adenosina. Interviene en
reacciones de oxido-reducción.
•Coenzima A o CoA (adenosín difosfato y vitamina B5. Interviene en reacciones de
descarboxilación y en transferencias de grupos acilo.

Coenzimas II Naturaleza vitamínica: solubles en agua e insolubles en agua
nombre función hipovitaminosis
B2 Oxido-reducción Dermatosis y estomatitis.
PP Oxido-reducción Pelagra, diarrea y demencia.
B5 Transferencia de carboxilo Fatiga y náuseas.
B1 Transferencia de aldehído Beriberi: neuritis y cardiopatía.
C Hidroxilación, inmunidad y
antioxidante
Escorbuto (hemorragia de
encías) e infecciones.
A Síntesis de pigmentos de retina Xeroftalmia, ceguera nocturna.
D Metabolismo de Ca y P Raquitismo.
K Coagulación sanguínea Hemorragias.
E Antioxidante y esterilidad Esterilidad y anemia.


1.- Comente las propiedades de los aminoácidos. ¿Qué son y cómo se
forman los péptidos?.
2.- Describa las características de los niveles de organización estructural de
las proteinas. ¿Qué diferencias hay entre las alfa-hélice y las láminas
plegadas de la estructura secundaria de las proteínas?
3.- Explique la desnaturalización de las proteínas, contestando
razonadamente a las siguientes cuestiones: concepto; factores que pueden
desnaturalizar a las proteínas; tipos de enlaces que se rompen durante el
proceso; posibilidades de ser reversible.
4.- Explique a qué se refiere la especificidad de las proteínas y por qué
puede plantear problemas en los transplantes de órganos.
5.- Funciones de las proteínas. Cite ejemplos de proteínas y funciones
concretas que desempeñen en el organismo.


B. Niveles estructurales
1. Estructura primaria
- Cada proteína se caracteriza por el número, tipo y orden de los aa que la componen.
- La secuencia de aa condiciona los niveles estructurales siguientes.
2. Estructura secundaria
- Todos los enlaces de la cadena polipeptídica, excepto los enlaces peptídicos, permiten la rotación de la molécula.
De todas las conformaciones posibles solo algunas son estables. La mayoría de las proteínas presentan una estructura
conjunta.
- Hélice alfa
Hélice dextrógira con 3,6 aa por vuelta. Puentes de H entre el grupo -NH de un aa y el -C=O del cuarto aa que sigue
en la secuencia. Los R quedan hacia afuera.
PROTEÍNAS 2
Algunos aminoácidos como la Prolina desestabilizan esta estructura. También la presencia de cadenas laterales
voluminosas o grupos con la misma carga próximos.
- Lámina plegada b
Cadena plegada sobre sí misma y en zig-zag. Se estabiliza también mediante puentes de H entre distintas zonas
de la cadena polipeptídica. Los grupos R se alternan hacia arriba y abajo.
- Hélice de colágeno
Predominan la Prolina y la hidroxiprolina. Hélice más abierta. Tres hélices se unen para formar una superhélice de
colágeno.
3. Estructura terciaria (Globular)
- Replegamiento tridimensional. Determina la actividad de la proteína. Las proteínas con estructura terciaria son más
activas, las fibrosas suelen ser estructurales. Se producen interacciones entre radicales de aa que se encuentran
separados en la cadena polipeptídica.
4. Estructura cuaternaria (Proteínas oligoméricas)
Proteínas oligoméricas. Asociación de varias subunidades proteicas iguales o diferentes mediante enlaces débiles.
Un ejemplo de proteína oligomérica es la hemoglobina, formada por cuatro subunidades iguales dos a dos.
C. Conformación de las proteínas
- Es la forma tridimensional característica de una proteína en sus estado nativo. Corresponde a la estructura combinada
secundaria, terciaria y cuaternaria. Las proteínas pueden ser de dos clases principales:
Proteínas fibrosas : constituidas por cadenas polipeptídicas ordenadas de modo paralelo a un eje, formando fibras o
láminas largas. Son físicamente resistentes e insolubles en agua o en disoluciones salinas diluidas. Estructurales.
Proteínas globulares : formadas por cadenas polipeptídicas plegadas estrechamente adoptando formas esféricas o
globulares compactas. La mayoría son solubles en sistemas acuosos y son biológicamente más activas.
- La conformación tridimensional es la que confiere a cada proteína su actividad biológica exclusiva. Esta conformación,
por su parte, depende de la secuencia específica de aminoácidos de sus cadenas polipeptídicas.
VI. PROPIEDADES
A. Capacidad amortiguadora debido a su comportamiento anfótero.
B. Especificidad. Son específicas de cada especie e incluso de cada organismo. La semejanza entre proteínas es mayor
cuanto mayor sea el grado de parentesco evolutivo.
C. Desnaturalización. Pierden su actividad al perder su estructura terciaria por algún cambio en el medio (temperatura, pH,
salinidad, composición, radiaciones, ...). Si el cambio no ha sido muy drástico se puede producir la renaturalización.
D. Solubilidad. Las proteínas fibrosas son insolubles, pero las globulares suelen ser solubles.
E. Punto isoeléctrico. Cada proteína tiene un pH para el cual la carga neta de la molécula es nula. Esta propiedad se aprovecha
para separar proteínas de una mezcla por un procedimiento denominado electroforesis .

VII. CLASIFICACIÓN
- Las proteínas de se pueden clasificar atendiendo a diversos criterios:
Según su conformación podemos distinguir proteínas fibrosas , como el colágeno o la a-
queratina, y proteínas globulares ,
como la.
A. Según su conformación
1. Proteínas fibrosas (colágeno, a-queratina)
2. Proteínas globulares (hemoglobina, enzimas)
B. Según su composición
1. Holoproteínas (proteínas simples)
- Por hidrólisis sólo producen aminoácidos .
2. Heteroproteínas (proteínas conjugadas)
- Por hidrólisis producen aminoácidos y otro componente orgánico o inorgánico.
- La parte no aminoácida de las heteroproteínas se denomina grupo prostético.
- En función del grupo prostético estas proteínas se pueden clasificar en:
a. Cromoproteínas : el grupo prostético es un pigmento.
En la hemoglobina, la mioglobina y el citocromo c, el pigmento es una metalporfirina (anillo
tetrapirrólico).
En la rodopsina el pigmento es un derivado de la vitamina A
b. Glucoproteínas : tienen un glúcido como grupo prostético. Si el porcentaje de glúcidos
es muy elevado reciben el
nombre de proteoglucanos , como las mucoproteínas (80% de glúcidos).
Ejemplos: fibrinógeno, inm unoglobulinas, FSH, TSH, pepsina, ovoalbúmina y glucoproteínas de
la membrana..
c. Lipoproteínas : con un lípido como grupo prostético.
Las lipoproteínas del plasma sanguíneo (VLDL, LDL y HDL) son ejemplos de este grupo.
d. Nucleoproteínas : proteínas unidas a ácidos nucleicos.
Como las que constituyen los ribosomas o las partículas virales.
e. Fosfoproteínas : presentan grupos fosfato.
La caseína de la leche o la vitelina del huevo son fosfoproteínas.
f. Metaloproteínas : poseen átomos metálicos .
La ferritina que se encuentra en el bazo tiene Fe(OH)3 como grupo prostético.

C. Según sus funciones
1. Enzimas (biocatalizadores)
- Aceleran las reacciones del metabolismo. Se conocen más de dos mil, entre ellos la ADN-polimerasa (interviene en
la síntesis del ADN), la pepsina (enzima que digiere las proteínas en el estómago) o el citocromo c (transfiere electrones
en la cadena respiratoria).
2. Proteínas de reserva
- Almacenan aminoácidos como elementos nutritivos o como sillares para el embrión en crecimiento. La caseína de la
leche o la ovoalbúmina de la clara del huevo son proteínas de reserva.
3. Proteínas transportadoras
- Son proteínas capaces de unirse a diversos tipos de moléculas para transportarlas. La hemoglobina y la hemocianina
son responsables del transporte de oxígeno en los vertebrados y en algunos invertebrados respectivamente. La
mioglobina transporta oxígeno en los músculos. La seroalbúmina de la sangre transporta ácidos grasos desde el tejido
adiposo a otros órganos. Las lipoproteínas del plasma sanguíneo (VLDL, LDL y HDL) transportan lípidos entre
el intestino, el hígado y los tejidos adiposos.
4. Proteínas contráctiles
- La actina y la miosina son las principales responsables de contracción muscular.
5. Proteínas protectoras o defensivas
- La trombina y el fibrinógeno son proteínas plasmáticas que participan en la coagulación de la sangre. Los anticuerpos
o inmunoglobulinas (g-globulinas) son proteínas específicas que se combinan con las moléculas extrañas que
penetran en el organismo y las neutralizan.
6. Toxinas
- Algunas proteínas son sustancias extremadamente tóxicas para los animales en cantidades muy pequeñas. Una
cienmilésima de gramo de la toxina A producida por el Clostridium botulinum , responsable de algunas intoxicaciones
alimentarias, es suficiente para matar a una persona. La toxina diftérica y los venenos de serpiente son también
proteínas.
7. Hormonas
- Las hormonas insulina (regula el metabolismo de la glucosa), STH (hormona del crecimiento), ACTH (hormona
adrenocorticotrópica), FSH (hormona estimulante del folículo) y TSH (hormona estimulante del tiroides) son de naturaleza
proteica.
8. Proteínas estructurales
- El colágeno es la principal proteína estructural en los tejidos conectivos y en el hueso. La a-queratina es el principal
componente de la capa superficial de la piel, de los pelos, las plumas y las uñas. También podemos citar aquí las
glucoproteínas de las membranas celulares y las mucoproteínas o mucinas (proteínas asociadas a mucopolisacáridos)
de las secreciones mucosas.

![AMINOÁCIDOS PÉPTIDOS Y PROTEINAS - [DePa] Departamento de …depa.fquim.unam.mx/amyd/archivero/Unidad_2_Aminoacidos,_peptido… · Mecanismo general de una reacción de transaminación.](https://static.fdocuments.net/doc/165x107/5ba22f6b09d3f2d14d8b657a/aminoacidos-peptidos-y-proteinas-depa-departamento-de-depafquimunammxamydarchiverounidad2aminoacidospeptido.jpg)










![carbono - [DePa] Departamento de Programas …depa.fquim.unam.mx/amyd/archivero/AMINO-ACIDOS-Y-PROTEINAS-P… · CLASIFICACIÓN DE LOS AMINOÁCIDOS ... sistema nervioso simpático,](https://static.fdocuments.net/doc/165x107/5ba3905009d3f21e368bb51b/carbono-depa-departamento-de-programas-depafquimunammxamydarchiveroamino-acidos-y-proteinas-p.jpg)






