Vorkurs Chemie · Wasserstoff + Stickstoff → Ammoniak + Wasserstoff + Sauerstoff → Wasserdampf...
Transcript of Vorkurs Chemie · Wasserstoff + Stickstoff → Ammoniak + Wasserstoff + Sauerstoff → Wasserdampf...
Titelfoto wurde entfernt, dafür wurden Links eingefügt:Materialien zur Vorlesung: https://www.chemie.uni-kl.de/sitzmann/lehre/allgemeine-chemie-fuer-maschinenbauer-und-bauingenieure-ch-v1/
Bzw. www.chemie.uni-kl.de; dort anklicken: AC(Anorganische Chemie); AG Sitzmann; Lehre; Allgemeine Chemie ….
Youtube-Video zum Thema „Atome“ (Wiederholung vom Montag, 19. 10. 2015) https://www.youtube.com/watch?v=3nge3LrK1S0
Youtube-Video zum Thema „Kovalente Bindung“ (Vorbereitung für Dienstag, 20. 10. 2015) https://www.youtube.com/watch?v=Mo4Vfqt5v2A
Mit wenig Zeitaufwand finden Sie auch entsprechende Beiträge in deutscher Sprache. Wenn Ihnen besonders hilfreiche Links begegnen, bin ich für eine Nennung dankbar: [email protected]
Vorkurs Chemie19. Oktober 2015
Dr. Helmut Sitzmann, Apl.-Professor für Anorganische Chemie
Vorkurs Chemie19. Oktober 2015
Fünf Tage – Fünf Themen
Atombau und PeriodensystemChemische Bindung
Formelschreibweise und chemische ReaktionenChemisches Gleichgewicht
Elektrochemie
Abbildungen gemeinfrei: wikimedia, Ben Mills;
Kupfer auf Eisenblech mit Genehmigung (WILEY-VCH)
atomos - unteilbar
Demokrit
460 – 371 v. Chr.
Schüler des Leukipp von Milet
Griechischer Philosoph
Atomistisches Prinzip:
Alles ist aus kleinsten Einheiten zusammengesetzt,
die nicht weiter unterteilt werden können.
Abbildung: Wikimedia, Public Domain
Atomhypothese John Dalton
1766 – 1844
Bestimmung von Massenverhältnissen
chemischer Elemente in chemischen Verbindungen
Konstante und multiple Proportionen einfach erklärt:
Elemente können sich in unterschiedlichen Verhältnis-
sen miteinander verbinden. Zwischen diesen Verhält-
nissen besteht ein einfacher Zusammenhang.
Beispiel: N2O, NO, N2O3, NO2, N2O5
1803 Atomhypothese
Abbildung: Ausschnitt aus einem Gemälde von B. R. Faulkner, Public Domain
John Dalton: Rechenbeispiel zu den multiplen Proportionen
Verbindung Prozent-anteil
Ammoniak N 82.245 H 17.755
Wasser O 88.810H 11.190
Stickoxid I, Lachgas N 63.648 O 36.352
Stickoxid II O 53.320N 46.680
Stickoxid III O 63.146N 36.854
Stickoxid IV O 69.554N 30.446
Stickoxid V O 74.064N 25.936
John Dalton: Rechenbeispiel zu den multiplen Proportionen
L
Verbindung Prozent-anteil
Massen-verhältnis
Zahlen-wert
Bemerkung
Ammoniak N 82.245 H 17.755
N/H 4.632 4.632 g Stickstoffatome binden 1 g Wasserstoffatome
Wasser O 88.810H 11.190
O/H 7.936 7.936 g Sauerstoffatome binden 1 g Wasserstoffatome
Stickoxid I, Lachgas N 63.648 O 36.352
O/N 0.571 Das stickstoffreichste Stickoxid
Stickoxid II O 53.320N 46.680
O/N 1.142 2 x 0.571 = 1.142
Stickoxid III O 63.146N 36.854
O/N 1.713 7.936g / 4.632 g =3 x 0.571 = 1.713
Stickoxid IV O 69.554N 30.446
O/N 2.284 4 x 0.571 = 2.284
Stickoxid V O 74.064N 25.936
O/N 2.855 5 x 0.571 = 2.855
John Dalton: Rechenbeispiel zu den multiplen Proportionen
Joseph Louis Gay-Lussac (1778 – 1850)
Verbindung Prozent-anteil
Massen-verhältnis
Zahlen-wert
Bemerkung
Ammoniak NH3 N 82.245 H 17.755
N/H 4.632 4.632 g Stickstoffatome binden 1 g Wasserstoffatome
Wasser H2O O 88.810H 11.190
O/H 7.936 7.936 g Sauerstoffatome binden 1 g Wasserstoffatome
Lachgas N2O N 63.648 O 36.352
O/N 0.571 Das stickstoffreichste Stickoxid
Stickstoffmonoxid NO O 53.320N 46.680
O/N 1.142 2 x 0.571 = 1.142
Distickstofftrioxid N2O3 O 63.146N 36.854
O/N 1.713 7.936g / 4.632 g =3 x 0.571 = 1.713
Stickstoffdioxid NO2 O 69.554N 30.446
O/N 2.284 4 x 0.571 = 2.284
DistickstoffpentoxidN2O5
O 74.064N 25.936
O/N 2.855 5 x 0.571 = 2.855
+
Wasserstoff + Stickstoff → Ammoniak
+
Wasserstoff + Sauerstoff → Wasserdampf
+
Wasserstoff + Chlor → Chlorwasserstoff
Abbildung: Wikimedia, Public Domain
John Dalton: Rechenbeispiel zu den multiplen Proportionen
Lorenzo Romano Amadeo Carlo Avogadro (1776 – 1856): Molekül – Hypothese 1811 Abbildung zu L. R. A. C. Avogadro: Wikimedia, Public Domain
Joseph Louis Gay-Lussac (1778 – 1850)
Verbindung Prozent-anteil
Massen-verhältnis
Zahlen-wert
Bemerkung
Ammoniak NH3 N 82.245 H 17.755
N/H 4.632 4.632 g Stickstoffatome binden 1 g Wasserstoffatome
Wasser H2O O 88.810H 11.190
O/H 7.936 7.936 g Sauerstoffatome binden 1 g Wasserstoffatome
Lachgas N2O N 63.648 O 36.352
O/N 0.571 Das stickstoffreichste Stickoxid
Stickstoffmonoxid NO O 53.320N 46.680
O/N 1.142 2 x 0.571 = 1.142
Distickstofftrioxid N2O3 O 63.146N 36.854
O/N 1.713 7.936g / 4.632 g =3 x 0.571 = 1.713
Stickstoffdioxid NO2 O 69.554N 30.446
O/N 2.284 4 x 0.571 = 2.284
DistickstoffpentoxidN2O5
O 74.064N 25.936
O/N 2.855 5 x 0.571 = 2.855
Entdeckung des Elektrons
J. J. Thomson
1856 – 1940
entdeckte 1897 in der Kathodenstrahlröhre das Elektron
und erhielt 1906 den Nobelpreis
Abbildungen: J. J. Thomson: Wikimedia, Public Domain; Kathodenstrahlröhre: Science Museum London, Creative Commons License
Entdeckung des Neutrons
James Chadwick
1891 – 1974
entdeckte 1932 das Neutron
Nobelpreis 1935
Foto: Public domain; Grafik: NASA, gemeinfrei (Neutronenstern mit rotem Riesen, fiktiv)
Bestandteile des Atoms
Smileys: Pixabay (freie Nutzung ohne Bildnachweis)
Proton Elektron Neutron
Ich bin positiv Ich bin negativ Mir ist das egal
Elementarteilchen als Bestandteile der Atome
Name Symbol Ruhemasse Atommassen-einheiten
elektrische Ladung
Elementar-ladungen
Proton p+ 1.67261x10-24 g 1.0072 1.6x10-19 C 1
Neutron N 1.67492x10-24 g 1.0086 0 0
Elektron e- 0.91096x10-27 g 0.0005 -1.6x10-19 C -1
Der Atomkern besteht aus Protonen und Neutronen.
Er enthält fast die gesamte Atommasse, (ca. 99.8%)
Der Kernradius ist 10-5 bis 10-4 Atomradius
Daraus resultiert eine Kerndichte von ca. 1.41 x 1014 g/cm3 (Fe)
Zeichnung: www.chemistry.about.com; Public Domain; Foto Dumas: Public Domain, Grafik zum Atomdurchmesser: Cweiske; GNU license, darf frei verwendet werden
Zahl der Protonen im Kern: OrdnungszahlZahl der Kernteilchen (Nucleonen): Massenzahl
Zwei Protonen im Kern, Ordnungszahl 2: HeliumVier Kernteilchen, Massenzahl 4, Symbol: 4He
Das Atom
Jean Baptiste Dumas (1800 – 1884)bestimmte sehr genau die Atom-masse von 22 Elementen
Das Atom
Geldscheinfoto: Bank of New Zealand, Public Domain, Grafik: www.chemistry.about.com; Public Domain; Zeichnung: darf nur ohne Nennung des Urhebers weiterverwendet werden
Nucleonen
Zahl der Kernteilchen (Nucleonen): MassenzahlZahl der Protonen im Kern: Ordnungszahl
Beispiel oben: Zwei Protonen im Kern, Ordnungszahl 2: HeliumVier Kernteilchen, Massenzahl 4, Symbol 4HeMan kennt auch Heliumkerne, die nur ein Neutron enthalten: 3He4He und 3He sind Isotope3He und 3H sind Isobare
H11 H21 H31
Isotope
Ar4018 K40
19 Ca4020
Isobare
Ernest Rutherford (1871 – 1937) erkannte,dass Atome einen unerhört dichten Kernenthalten und ansonsten aus leerem Raum bestehen.
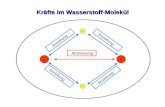
Elektronenverteilung in einem Chlorwasserstoff-Molekül
Grafik: http://www.uni-koeln.de/math-nat-fak/didaktiken/chemie/uvm_projekt/modul_3/bigpic_hcl_4.htm; urheberrechtlich geschütztFoto von Erwin Schrödinger aus dem Jahr der Verleihung des Nobelpreises 1933: Public Domain
Weil sich chemische Phänomene in der Elektronenhülleder Atome abspielen, müssen wir uns näher mit derStruktur der Elektronenschalen befassen.
Erwin Schrödinger (1887 – 1961)beschrieb Elektronen als Welle.
Das Spektrum des Wasserstoffatoms
Diskrete Energieniveaus
Scharfe Spektrallinien
Energieaufnahme: Lichtabsorption
Energieabgabe: Lichtemission
Abbildung eines Spektrums bitte selbst aufrufen, z. B. hier:http://voer.edu.vn/m/bohrs-theory-of-the-hydrogen-atom/62b1becc
ElektronegativitätFähigkeit eines Atoms
- Eigene Elektronen festzuhalten … und …
- Elektronen anderer Atome anzuziehen
Erste Ionisierungsenergie der Elemente der Ordnungszahlen 1 - 103
Auf der senkrechten Achse ist die Energie in Elektronenvolt aufgetragen, die zur Entfernung eines Elektrons aus einem neutralen Atom benötigt wird.
Die Balken im Diagramm entsprechen den Elementen mit den Ordnungszahlen1 (Wasserstoff) bis 103 (Lawrencium).
Ein hoher Energiebetrag wird dann benötigt, wenn das betreffende Element über eine sehr stabile Elektronenschale verfügt.
Schalenstruktur der Atome
Die innerste Elektronenschalebietet Platz für zwei Elektronen.Weiter außen gelegene Schalenkönnen mehr Elektronenaufnehmen.Die Kapazität der n. Schale für Elektronen beträgt 2n2.
Die Schalen sind in Unterschalengegliedert, welche mit den Buchstaben s, p, d und f bezeich-net werden. Diese Bezeichnun-gen stammen aus der Spektro-skopie, wo die entsprechendenAbsorptionsbanden als sharp, principal, diffuse oder funda-mental bezeichnet wurden.