Uniwersytet w Białymstoku Wydział Biologiczno-Chemiczny...4.5 Organogeneza pędowa i korzeniowa...
Transcript of Uniwersytet w Białymstoku Wydział Biologiczno-Chemiczny...4.5 Organogeneza pędowa i korzeniowa...

Uniwersytet w Białymstoku
Wydział Biologiczno-Chemiczny
Aneta Adamczuk
Modyfikacje morfogenezy lnu zwyczajnego
(Linum usitatissimum L.) typu oleistego i włóknistego
w kulturach in vitro
Rozprawa doktorska
Promotor: dr hab. Iwona Ciereszko, prof. UwB
Promotor pomocniczy: dr Irena Siegień
Białystok, 2017

2
Serdecznie dziękuję:
Pani Promotor,
dr hab. Iwonie Ciereszko, prof. UwB
oraz dr Irenie Siegień,
za niewyczerpane pokłady cierpliwości,
bezcenne rady w trakcie wykonywania
i redagowania tej pracy.
Pani dr Urszuli Kotowskiej i mgr Justynie
Kapelewksiej z Zakładu Chemii
Środowiska, dr Ewie Olchowik-Grabarek
z Zakładu Biofizyki oraz dr Joannie
Leśniewskiej za nieocenioną pomoc
w trakcie prowadzenia badań
oraz cenne wskazówki.
Koleżankom z Zakładu Fizjologii Roślin:
Bożenie, Ewie, Edycie, Irenie i Oli
za pomoc i wsparcie.
Rodzicom, Mężowi i Dzieciom
za ogromne wsparcie i wyrozumiałość.

3
Autorka rozprawy doktorskiej, Aneta Adamczuk, była stypendystką w ramach projektu
pt.: „Stypendia dla doktorantów województwa podlaskiego”, realizowanego na podstawie
Umowy o dofinansowanie projektu Instytucji Pośredniczącej w ramach Programu Operacyjnego
Kapitał ludzki 2007-2013,nr POKL.08.02.02-20-002/12. Działanie 8.2.Transfer wiedzy,
Poddziałanie 8.2.2. Regionalne Strategie Innowacji.

4
Spis treści
Wykaz stosowanych skrótów .......................................................................................... 10
1. Wstęp ................................................................................................................ 13
1.1 Morfogeneza w warunkach in vitro .................................................................. 13
1.2 Czynniki wpływające na morfogenezę ............................................................. 17
1.2.1 Rola światła w regulacji morfogenezy roślin ................................................... 17
1.2.2 Rola węglowodanów w kulturach in vitro ........................................................ 21
1.2.3 Rola hormonów i regulatorów wzrostu w procesie morfogenezy w
warunkach in vitro ............................................................................................ 24
1.3 Działanie abiotycznych czynników środowiskowych na proces morfogenezy 31
1.4 Reaktywne formy tlenu (ROS) w procesie organogenezy w warunkach in
vitro ................................................................................................................... 33
1.4.1 Rola ROS w morfogenezie w warunkach in vitro ............................................ 36
1.4.2 Sygnalna rola ROS w morfogenezie w warunkach in vitro ............................. 37
1.5 Regulacja procesów wzrostowych i morfogenetycznych przez tlenek azotu
(NO) .................................................................................................................. 38
2 Założenia i cel pracy ......................................................................................... 43
3 Materiał i metody .............................................................................................. 46
3.1 Materiał doświadczalny .................................................................................... 46
3.1.1 Charakterystyka gatunku badawczego ............................................................. 46
3.2 Sterylizacja i kiełkowanie nasion lnu ............................................................... 48
3.2.1 Sterylizacja nasion ............................................................................................ 48
3.2.2 Warunki kiełkowania nasion ............................................................................ 48
3.3 Skład podłoży hodowlanych oraz warunki wzrostu kultur in vitro .................. 49
3.3.1 Skład i przygotowanie podłoży do wzrostu kultur in vitro .............................. 49
3.3.2 Badanie oddziaływania wybranych cytokinin i auksyn na proces
organogenezy .................................................................................................... 51
3.3.3 Badanie wzajemnych stężeń cytokininy i auksyny na efektywność procesu
organogenezy .................................................................................................... 51
3.3.4 Warunki wzrostu eksplantatów ........................................................................ 52
3.4 Badanie wpływu stresu osmotycznego na proces organogenezy ..................... 52
3.5 Badanie wpływu nitroprusydku sodu (SNP) na proces organogenezy ............. 54
3.5.1 Badanie wpływu SNP dodanego bezpośrednio do pożywki na organogenezę 54
3.5.2 Badanie wpływu par wydzielających się z wodnego roztworu SNP na
organogenezę .................................................................................................... 54
3.6 Badanie wpływu c-PTIO (ang. 2-(4-carboxyphenyl)-4,4,5,5-
tetramethylimidazoline-1-oxyl-3-oxide) na proces organogenezy w

5
kulturach in vitro poddanych działaniu par wydzielających się z wodnego
roztworu SNP ................................................................................................... 56
3.7 Analiza wzrostu materiału doświadczalnego ................................................... 57
3.8 Analiza mikroskopowa początkowych etapów organogenezy pędowej i
korzeniowej w hipokotylach lnu zwyczajnego ................................................. 58
3.9 Oznaczanie zawartości barwników fotosyntetycznych .................................... 59
3.10 Oznaczanie natężenia fotosyntezy netto i oddychania ciemniowego ............... 60
3.11 Izolacja i identyfikacja związków chemicznych przy użyciu chromatografii
gazowej ze spektrometrią mas (GC-MS) .......................................................... 60
3.11.1 Izolacja lotnych związków organicznych (LZO) w kulturach pędowych lnu
zwyczajnego z wykorzystaniem mikroekstrakcji do fazy stacjonarnej
(SPME) ............................................................................................................. 60
3.11.2 Izolacja związków organicznych w ekstraktach metanolowych kultur
pędowych lnu zwyczajnego .............................................................................. 61
3.11.3 Identyfikacja otrzymanych związków .............................................................. 62
3.12 Oznaczanie zawartości białka w ekstrakcie enzymatycznym .......................... 62
3.13 Oznaczanie zawartości metabolitów wtórnych ................................................ 63
3.13.1 Oznaczanie zawartości antocyjanów i związków fenolowych ......................... 63
3.13.2 Oznaczanie zawartości związków polifenolowych i tanin ............................... 63
3.14 Oznaczenia parametrów stresu oksydacyjnego ................................................ 64
3.14.1 Oznaczanie zawartości H2O2 ............................................................................ 64
3.14.2 Oznaczanie zawartości produktów peroksydacji lipidów reagujących z
kwasem tiobarbiturowym (TBARS) ................................................................. 65
3.15 Oznaczanie zdolności przeciwwolnorodnikowej oraz aktywności enzymów
antyoksydacyjnych ........................................................................................... 66
3.15.1 Przygotowanie ekstraktu enzymatycznego do oznaczania zdolności
przeciwwolnorodnikowej na zasadzie redukcji stabilnego wolnego rodnika
1,1-difenylo-2-pikrylohydrazylowego (DPPH.) ............................................... 66
3.15.1.1 Oznaczanie zdolności przeciwwolnorodnikowej na zasadzie redukcji
stabilnego wolnego rodnika 1,1-difenylo-2-pikrylohydrazylowego (DPPH.) . 66
3.15.2 Przygotowanie ekstraktu enzymatycznego do oznaczania aktywności
dysmutazy ponadtlenkowej (SOD) i katalazy (CAT) ....................................... 67
3.15.2.1 Oznaczanie aktywności dysmutazy ponadtlenkowej (SOD) ............................ 67
3.15.2.2 Oznaczanie aktywności katalazy (CAT) .......................................................... 67
3.16 Analiza statystyczna wyników ......................................................................... 68
4 Wyniki .............................................................................................................. 69
4.1 Wzrost kultur oraz organogeneza pędowa w kulturach in vitro lnu
zwyczajnego (Linum usitatissimum L.) w zależności od rodzaju pożywki ...... 69

6
4.2 Wzrost kultur oraz organogeneza korzeniowa w kulturach in vitro lnu
zwyczajnego w zależności od rodzaju pożywki ............................................... 72
4.3 Wpływ wybranych auksyn i cytokinin na proces organogenezy ..................... 75
4.3.1 Oddziaływanie wybranych cytokinin na organogenezę pędową lnu
zwyczajnego (Linum usitatissimum L.) ............................................................ 75
4.3.2 Oddziaływanie wybranych auksyn na organogenezę korzeniową lnu
zwyczajnego (Linum usitatissimum L.) ............................................................ 81
4.4 Wpływ wzajemnych stężeń cytokininy i auksyny na efektywność procesu
organogenezy .................................................................................................... 87
4.4.1 Oddziaływanie wzajemnych stężeń cytokininy i auksyny na efektywność
organogenezy pędowej ..................................................................................... 87
4.4.2 Oddziaływanie wzajemnych stężeń cytokininy i auksyny na efektywność
organogenezy korzeniowej ............................................................................... 90
4.5 Organogeneza pędowa i korzeniowa lnu zwyczajnego (Linum usitatissimum
L.) w pierwszym tygodniu wzrostu kultur in vitro (analiza anatomiczna) ....... 94
4.5.1 Przebieg procesu organogenezy pędowej w kulturach in vitro lnu
zwyczajnego odm. Szafir .................................................................................. 94
4.5.2 Przebieg procesu organogenezy pędowej w kulturach in vitro lnu
zwyczajnego odm. Selena ................................................................................. 96
4.5.3 Przebieg procesu organogenezy korzeniowej w kulturach in vitro lnu
zwyczajnego odm. Szafir .................................................................................. 97
4.5.4 Przebieg procesu organogenezy korzeniowej w kulturach in vitro lnu
zwyczajnego odm. Selena ................................................................................. 99
4.6 Zawartość barwników fotosyntetycznych w kulturach pędowych in vitro lnu
zwyczajnego ................................................................................................... 101
4.7 Intensywność fotosyntezy netto (PN) i oddychania ciemniowego (DR) kultur
pędowych in vitro lnu zwyczajnego ............................................................... 103
4.8 Analiza związków chemicznych przy użyciu chromatografii gazowej ze
spektrometrią mas (GC-MS) .......................................................................... 104
4.8.1 Analiza LZO w kulturach pędowych lnu zwyczajnego z wykorzystaniem
mikroekstrakcji do fazy stacjonarnej (SPME) ................................................ 104
4.8.2 Analiza związków organicznych w ekstraktach metanolowych kultur
pędowych lnu zwyczajnego ............................................................................ 109
4.9 Zawartość metabolitów wtórnych w kulturach in vitro lnu zwyczajnego
(Linum usitatissimum L.) odm. Szafir i odm. Selena ..................................... 113
4.9.1 Zawartość związków fenolowych i antocyjanów w kulturach pędowych in
vitro lnu zwyczajnego ..................................................................................... 113
4.9.2 Zawartość związków fenolowych i antocyjanów w kulturach korzeniowych
in vitro lnu zwyczajnego ................................................................................. 114

7
4.9.3 Zawartość białka w ekstraktach wykorzystywanych do określenia
zawartości związków fenolowych i antocyjanów w kulturach pędowych i
korzeniowych in vitro lnu zwyczajnego ......................................................... 116
4.9.4 Zawartość związków polifenolowych i tanin w kulturach pędowych in vitro
lnu zwyczajnego ............................................................................................. 117
4.9.5 Zawartość związków polifenolowych i tanin w kulturach korzeniowych in
vitro lnu zwyczajnego ..................................................................................... 118
4.10 Aktywność enzymów antyoksydacyjnych w kulturach in vitro lnu
zwyczajnego (Linum usitatissimum L.) odm. Szafir i odm. Selena................ 119
4.10.1 Aktywność dysmutazy ponadtlenkowej i katalazy w kulturach pędowych in
vitro lnu zwyczajnego ..................................................................................... 120
4.10.2 Aktywność dysmutazy ponadtlenkowej i katalazy w kulturach
korzeniowych in vitro lnu zwyczajnego ......................................................... 121
4.10.3 Zawartość białka w ekstraktach wykorzystywanych do określenia
aktywności enzymów antyoksydacyjnych w kulturach pędowych i
korzeniowych in vitro lnu zwyczajnego ......................................................... 123
4.11 Wpływ stresu osmotycznego na proces organogenezy w kulturach in vitro
lnu zwyczajnego (Linum usitatissimum L.) odm. Szafir i odm. Selena ......... 125
4.11.1 Wpływ stresu osmotycznego na organogenezę pędową w kulturach in vitro
lnu zwyczajnego odm. Szafir, rosnących na podłożu z dodatkiem różnych
rodzajów cukru ............................................................................................... 125
4.11.2 Zawartość produktów peroksydacji lipidów reagujących z kwasem
tiobarbiturowym (TBARS) w kulturach pędowych lnu odm. Szafir,
rosnących na podłożu z dodatkiem różnych rodzajów cukru ......................... 126
4.11.3 Wpływ stresu osmotycznego (podwyższona zawartość sacharozy) na
organogenezę pędową w kulturach in vitro lnu zwyczajnego odm. Szafir
oraz odm. Selena ............................................................................................. 127
4.11.4 Wpływ stresu osmotycznego (podwyższona zawartość sacharozy) na
organogenezę korzeniową w kulturach in vitro lnu zwyczajnego odm. Szafir
oraz odm. Selena ............................................................................................. 129
4.11.5 Zawartość produktów peroksydacji lipidów reagujących z kwasem
tiobarbiturowym (TBARS) w kulturach pędowych lnu zwyczajnego odm.
Szafir i odm. Selena, poddanych działaniu stresu osmotycznego .................. 132
4.11.6 Zawartość produktów peroksydacji lipidów reagujących z kwasem
tiobarbiturowym (TBARS) w kulturach korzeniowych lnu zwyczajnego
odm. Szafir i odm. Selena, poddanych działaniu stresu osmotycznego ......... 132
4.11.7 Zawartość nadtlenku wodoru (H2O2) w kulturach pędowych lnu
zwyczajnego odm. Szafir i odm. Selena, poddanych działaniu stresu
osmotycznego ................................................................................................. 133
4.11.8 Zawartość nadtlenku wodoru (H2O2) w kulturach korzeniowych lnu
zwyczajnego odm. Szafir i odm. Selena, poddanych działaniu stresu
osmotycznego ................................................................................................. 134

8
4.12 Wpływ SNP, bezpośrednio dodanego do pożywki, na przebieg
organogenezy w kulturach in vitro lnu zwyczajnego (Linum usitatissimum
L.) odm. Szafir ................................................................................................ 135
4.12.1 Wpływ SNP, bezpośrednio dodanego do pożywki ,na przebieg
organogenezy pędowej w kulturach in vitro lnu zwyczajnego odm. Szafir ... 135
4.12.2 Wpływ SNP, bezpośrednio dodanego do pożywki, na przebieg
organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego odm.
Szafir ............................................................................................................... 137
4.13 Wpływ par wydzielających się z wodnego roztworu SNP na przebieg
organogenezy w kulturach in vitro lnu zwyczajnego (Linum usitatissimum
L.) odm. Szafir i odm. Selena ......................................................................... 139
4.13.1 Wpływ par wydzielających się z wodnego roztworu SNP na przebieg
organogenezy pędowej w kulturach in vitro lnu zwyczajnego odm. Szafir ... 139
4.13.2 Wpływ par wydzielających się z wodnego roztworu SNP na przebieg
organogenezy pędowej w kulturach in vitro lnu zwyczajnego ....................... 143
4.13.3 Wpływ par wydzielających się z wodnego roztworu SNP na przebieg
organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego, rosnących
na pożywkach bez dodatku hormonów .......................................................... 146
4.13.4 Wpływ par wydzielających się z wodnego roztworu SNP na przebieg
procesu organogenezy w kulturach in vitro lnu zwyczajnego, rosnących na
pożywkach bez dodatku hormonów ............................................................... 150
4.14 Wpływ c-PTIO (ang. 2-(4-carboxyphenyl)-4,4,5,5-tetramethylimidazoline-
1-oxyl-3-oxide) na proces organogenezy w kulturach in vitro lnu
zwyczajnego (Linum usitatissimum L.), poddanych działaniu par
wydzielających się z wodnego roztworu SNP ................................................ 157
4.14.1 Intensywność procesu organogenezy korzeniowej w kulturach
korzeniowych in vitro lnu zwyczajnego, poddanych działaniu par
wydzielających się z wodnego roztworu SNP w obecności c-PTIO .............. 157
4.14.2 Intensywność procesu organogenezy w kulturach in vitro lnu zwyczajnego
odm. Selena, rosnących na pożywce bez dodatku hormonów, poddanych
działaniu par wydzielających się z wodnego roztworu SNP w obecności c-
PTIO ............................................................................................................... 160
4.15 Natężenie stresu oksydacyjnego w kulturach in vitro lnu zwyczajnego
(Linum usitatissimum L.) odm. Selena, poddanych działaniu par
wydzielających się z wodnego roztworu SNP ................................................ 164
4.15.1 Zawartość nadtlenku wodoru (H2O2) w kulturach in vitro lnu zwyczajnego
odm. Selena, poddanych działaniu par wydzielających się z wodnego
roztworu SNP ................................................................................................. 164
4.15.2 Zawartość produktów peroksydacji lipidów, reagujących z kwasem
tiobarbiturowym (TBARS) w kulturach in vitro lnu odm. Selena, poddanych
działaniu par wydzielających się z wodnego roztworu SNP .......................... 166
4.16 Zdolność przeciwwolnorodnikowa oraz aktywność enzymów
antyoksydacyjnych w kulturach in vitro lnu zwyczajnego (Linum

9
usitatissimum L.) odm. Selena, poddanych działaniu par wydzielających się
z wodnego roztworu SNP ............................................................................... 168
4.16.1 Zdolność przeciwwolnorodnikowa określona na zasadzie redukcji
stabilnego wolnego rodnika 1,1-difenylo-2-pikrylohydrazylowego (DPPH.)
w kulturach in vitro lnu odm. Selena, poddanych działaniu par
wydzielających się z wodnego roztworu SNP ................................................ 168
4.16.2 Oznaczanie aktywności dysmutazy ponadtlenkowej (SOD) w kulturach in
vitro lnu odm. Selena, poddanych działaniu par wydzielających się z
wodnego roztworu SNP .................................................................................. 171
4.16.3 Oznaczanie aktywności katalazy (CAT) w kulturach in vitro lnu odm.
Selena, poddanych działaniu par wydzielających się z wodnego roztworu
SNP ................................................................................................................. 175
4.16.4 Zawartość białka w ekstraktach wykorzystanych do określenia aktywności
enzymów antyoksydacyjnych w kulturach in vitro lnu zwyczajnego (Linum
usitatissimum L.) odm. Selena, poddanych działaniu par wydzielających się
z wodnego roztworu SNP ............................................................................... 176
5 Dyskusja ......................................................................................................... 178
5.1 Optymalne warunki wzrostu oraz przebieg wybranych procesów w
kulturach in vitro lnu zwyczajnego (Linum usitatissimum L.) odm. Szafir
(typ oleisty) i odm. Selena (typ włóknisty) ................................................... 178
5.2 Oddziaływanie stresu osmotycznego oraz SNP na modyfikację
organogenezy lnu zwyczajnego (Linum usitatissimum L.) typu oleistego
(odm. Szafir) i typu włóknistego (odm. Selena) ............................................. 186
6 Podsumowanie i wnioski ................................................................................ 194
Streszczenie .................................................................................................................. 196
Summary ....................................................................................................................... 198
Bibliografia ................................................................................................................... 200
Spis rycin ...................................................................................................................... 227
Spis tabel ....................................................................................................................... 238
Spis fotografii ............................................................................................................... 242
Aneks ........................................................................................................................ 244

10
Wykaz stosowanych skrótów
2,4-D - kwas 2,4-dichlorofenoksyoctowy
2iP - (dimetyloalliloamino)-puryna
ABA - kwas abscysynowy
APX - peroksydaza askorbinianiu
ATP – adenozyno-5’-trifosforan
BA – benzyloaminopuryna
BBM - geny związane z powstawaniem zarodów z komórek somatycznych, ang. baby
boom
BR - brasinosteroidy
B5 - pożywka wg Gamborga
cADPR – cykliczna adenozynodifosforyboza
CAT - katalaza
cGMP – cykliczny guanozyno-3’,5’-monofosforan
CN- - anion cyjankowy
CDPK – kinazy białkowe regulowane przez jony wapnia
c-PTIO – ang. 2-(4-Carboxyphenyl)-4,4,5,5-tetramethylimidazoline-1-oxyl-3-oxide
CPVPP – taniny nie związane z PVPP
Cry1 i Cry 2 – kryptochrom 1 i kryptochrom 2
CT - zawartość tanin
Cu/Zn SOD – rodzina izoform miedziowo-cynkowych SOD
DHAR - reduktaza dehydrosakorbinianu
DNA – kwas deosyrybonukleinowy
DPPH. – stabilny wolny rodnik 1,1-difenylo-2-pikrylohydrazylowy
DR – oddychanie ciemniowe
EPR – elektronowy rezonans paramagnetyczny
FAA - formalino–aceto-alkohol
Fe SOD – rodzina izoform żelazowych SOD
GA3 – kwas giberelowy
GC-MS – chromatografia gazowa ze spektrometrem masowym

11
GR - reduktaza glutationowa
GSH - glutation
GSNO - S-nitrozoglutation
HCN - cyjanowodór
H2O2 – nadtlenek wodoru
IAA - kwas indolilo-3-octowy
IBA - kwas indolilo-3-masłowy
JA - kwas jasmonowy
K- kontrola, kultury rosnące w optymalnych warunkach
KCN – cyjanek potasu
KIN – kinetyna
LEC – geny związane z powstawaniem zarodów z komórek somatycznych, ang. leafy
cotyledon
LOV – domeny wchodzące w skład fototropin, ang. light, oxygen, voltage
LZO – lotne związki organiczne
MAPK – kinaza białkowa aktywowana mitogenem
MDA – aldehyd malonowy
MDHAR - reduktaza monodehydroaskorbinaniu
Me-JA - jasmonian metylu
Mn SOD – rodzina izoform manganowych SOD
MS - pożywka wg Murashige i Skoog
MS+B5 - pożywka wg Murashige i Skoog (makroelementy) + pożywka wg Gamborga
(mikroelementy i składniki organiczne)
NAA - kwas naftylo-1-octowy
NADPH – fosforan dinukleotydu nikotynoamido- adeninowego
Ni-NOR - reduktaza azotyn-tlenek azotu
NiR - reduktaza azotynowa
NO – tlenek azotu
NOS-like - enzym o aktywności zbliżonej do syntazy tlenku azotu
NR - reduktaza azotanowa
nsHb - niesymbiotyczne hemoglobiny

12
PAR – promieniowanie fotosyntetycznie czynne
Pfr – forma fitochromu absorbująca światło dalekiej czerwieni (z maksimum λ=730 nm)
PHYA – PHYE - geny kodujące fitochrom u Arabidopsis thaliana
PN – fotosynteza netto
Pr - forma fitochromu absorbująca światło czerwone (z maksimum λ=600 nm)
PSI – fotosystem I
PSII – fotosystem II
PVP - poliwinylopirolidon
PVPP - poliwinylopolipirolidon
RNS – reaktywne formy azotu
ROS - reaktywne formy tlenu
S I – pierwszy wariant stresu osmotycznego (dwukrotne zwiększenie zawartości cukru
w pożywce)
S II – drugi wariant stresu osmotycznego (trzykrotne zwiększenie zawartości cukru w
pożywce)
SD - odchylenie standardowe
SERK - gen związany z powstawaniem zarodów z komórek somatycznych, ang.
somatic embryogenesis receptor kinase
s.m. - sucha masa
SNAP - S-nitrozoacetylo-penicyloamina
SNP – nitroprusydek sodu
SOD – dysmutaza ponadtlenkowa
SPME – mikroekstrakcja do fazy stacjonarnej
św.m. - świeża masa
TBARS – produkty peroksydacji lipidów reagujące z kwasem tiobarbiturowym
TDZ - tidiazuron
XOR - oksydoreduktaza ksantynowa

13
1. Wstęp
Rozwój roślin jest procesem, na który składają się wzrost, różnicowanie się w
tkanki, organy lub całe organizmy. Zależności pomiędzy rozwojem a wzrostem,
różnicowaniem, ekspresją genów w określonej kolejności i czasie oraz morfogenezą,
prowadzą do wytworzenia całych organizmów roślinnych o skomplikowanej budowie.
Termin morfogeneza (gr. morphe – kształt, genesis – pochodzenie) oznacza szereg
przemian rozwojowych, w wyniku których następuje formowanie komórek, tkanek i
organów w pełni rozwinięty, dojrzały organizm roślinny. Regulacja procesu
morfogenezy odbywa się endogennie i dotyczy mechanizmów warunkujących
aktywację genów oraz sposób ich działania, co skutkuje syntezą specyficznych białek,
determinujących czynności życiowe rośliny (Taiz i Zeiger 2006). Wyizolowana
komórka, pochodząca z pełni ukształtowanej rośliny, może dać początek nowemu
organizmowi, ponieważ każda z nich zawiera kompletną informację, niezbędną do jej
rozwoju. Informacja zawarta w DNA ulega ekspresji w określonej kolejności. Białka
enzymatyczne dają sygnały do wytwarzania innych białek. Regulacja na poziomie
komórkowym obejmuje również procesy indukcji i represji syntezy enzymów
metabolicznych przez specyficzne metabolity komórkowe. Morfogeneza regulowana
jest także poprzez regulację wzajemnego oddziaływania i współzależności komórek,
odbywającej się przy udziale fitohormonów, oraz egzogennie poprzez działanie
czynników środowiska takich jak: światło, temperatura, wilgotność, zapotrzebowanie na
substancje odżywcze, determinujących charakter reakcji morfogenetycznych (Burza
1995, Taiz i Zeiger 2006, Tretyn 2012).
1.1 Morfogeneza w warunkach in vitro
Materiałem wyjściowym do założenia kultury in vitro może być każda część
rośliny, nazywana eksplantatem (organy, tkanki, ich fragmenty, pojedyncze komórki
czy protoplasty), zawierająca żywe komórki z nieuszkodzonym materiałem
genetycznym. Istnieje podział na eksplantaty pierwotne, od których kultura została
zainicjowana, oraz pozostałe, zwane wtórnymi (Bach i Pawłowska 2009).
Regeneracja roślin z komórek somatycznych jest możliwa dzięki ich
totipotencji. Komórki takie charakteryzują się zdolnością wznowienia podziałów
mitotycznych, co prowadzi do różnicowania się w inne typy komórek, a w
konsekwencji do odtworzenia organów czy całego organizmu (Bach i Pawłowska

14
2009). Pobudzenie komórek somatycznych do podziałów następuje przez uszkodzenie
rośliny w warunkach naturalnych, odizolowanie jej fragmentu i przeniesienie do
sterylnych kultur. Inicjacja i przebieg procesów rozwojowych w kulturach in vitro
zależą od rodzaju i wzajemnych proporcji regulatorów wzrostu obecnych w pożywce.
Istnieje pewna ogólna prawidłowość w oddziaływaniu auksyn i cytokinin na
organogenezę (Skoog i Miller 1957, Czerpak i Piotrowska 2003). Zgodnie z przyjętą
regułą, wysoki poziom auksyn stymuluje powstawanie korzeni, podczas gdy wysokie
stężenie cytokinin warunkuje powstawanie pędów. Równe poziomy obu hormonów
wpływają na formowanie samego kalusa, czyli niezróżnicowanej lub słabo
zróżnicowanej tkanki złożonej z komórek parenchymatycznych, której różnicowanie
może nastąpić w wyniku obecności regulatorów wzrostu w pożywce (Ryc. 2) (Su i wsp.
2011).
Rozwój eksplantatów w warunkach in vitro może być ukierunkowany na
bezpośrednie wytworzenie pędów, korzeni, jak też zarodków, z których może powstać
nowa roślina, lub na organogenezę pośrednią poprzedzoną wytworzeniem kalusa, z
którego następnie mogą powstawać organy (Burza 1995, Taiz i Zeiger 2006).
Zasadnicze procesy morfogenetyczne, dotyczące rozwoju roślin w warunkach in vitro,
można podzielić na: organogenezę pędową – kaulogenezę, korzeniową – ryzogenezę i
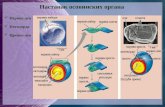
embriogenezę somatyczną (Ryc. 1).
Ryc. 1. Drogi organogenezy i embriogenezy somatycznej w roślinnych kulturach
in vitro. Zmodyfikowane wg (Adamczuk i wsp. 2012b).

15
Ważnym sposobem regeneracji stała się embriogeneza somatyczna, polegająca
na formowaniu zarodków z komórek somatycznych. Takie podejście skutecznie
zmniejsza ryzyko zaburzeń genetycznych (Attree i Fowke 1993). Embriogeneza
somatyczna może przebiegać w sposób bezpośredni, kiedy zarodki somatyczne
kształtują się na młodych tkankach, podobnie jak niedojrzałe zarodki zygotyczne.
Natomiast embriogeneza na starszych eksplantatach, np. fragmencie liścia, zachodzi
pośrednio, przez stadium kalusa. Sposób regeneracji roślin ze względu na wysoki
współczynnik rozmnażania, znajduje szerokie zastosowanie w nasiennictwie oraz
szkółkarstwie (Park i wsp. 1998).
Właściwy wzrost i rozwój organizmów roślinnych, również w warunkach
in vitro, uzależniony jest od sprawnej komunikacji międzykomórkowej. W
doniesieniach ostatnich lat sugeruje się, że komunikacja symplastowa, zachodząca
dzięki obecności plasmodesm, odgrywa znaczącą rolę w przemieszczaniu się cząsteczek
sygnałowych pomiędzy komórkami roślinnymi, a jednocześnie istotnie wpływa na
różnicowanie komórek i morfogenezę (Sokołowska 2005, Wróbel-Marek i wsp. 2015).
Zmiany w komunikacji symplastowej, z którymi skorelowane są zmiany ekspresji
genów zaobserwowano także w warunkach in vitro. W kulturach tytoniu szlachetnego
(Nicotiana tabacum L.), regenerujące tkanki stanowiły pojedynczą domenę
symplastową, aż do momentu wytworzenia wierzchołka pędu na eksplantacie, a
następnie powstały organ izolowany był symplastowo (Cantrill i wsp. 2001). Na
podstawie analiz wzrostu zarodków somatycznych w kulturach cykorii (Cichorium
intybus L.) oraz embriogennej kultury orzecha kokosowego (Cocos nucifera L.),
stwierdzono, że czasowa izolacja komórek embriogennych jest niezbędna w
zainicjowaniu nowych dróg rozwojowych (Verdeil i wsp. 2001, Marzec i Kurczyńska
2014).
Prace mające na celu wyjaśnienie podłoża genetycznego zdolności roślin do
regeneracji warunkach in vitro, prowadzone są od wielu lat. Poznanie mechanizmów
kontrolujących morfogenezę, pozwoli poprawić efektywność regeneracji roślin w
kulturach in vitro (Burza 1995, Taiz i Zeiger 2006). Udało się zidentyfikować loci cech
ilościowych, związanych z reakcją komórek roślinnych w kulturach in vitro na mapach
sprzężeń markerów molekularnych, a także wyizolować i scharakteryzować geny
zaangażowane w proces somatycznej embriogenezy. Dotychczas zidentyfikowano kilka
genów, związanych z procesem powstawania zarodków z komórek somatycznych,
takich jak m.in.: geny SERK (ang. somatic embryogenesis receptor kinase), LEC (ang.

16
leafy cotyledon), a także BBM (ang. baby boom) (Gruszczyńska i Rakoczy-Trojanowska
2007, Kulus 2013). Gen SERK ulega ekspresji już w komórkach proembriogennych,
bierze udział w przekazywaniu sygnałów i uruchamianiu szeregu procesów
umożliwiających zapoczątkowanie embriogenezy. Geny LEC (LEC1, LEC2 i FUS3)
kodują białka zaangażowane w prawidłowy rozwój zarodka na wszystkich etapach
rozwoju i wzrostu. Zidentyfikowane u rzodkiewnika (Arabidopsis thaliana (L.) Heynh.)
i rzepaku (Brassica napus L.) białka BBM, zaszeregowano do czynników
transkrypcyjnych o kluczowej roli w regulacji szlaków, związanych z embriogenezą
somatyczną. U mutantów z nadekspresją genu BBM, zaobserwowano spontaniczne
formowanie zarodków somatycznych (o podobnej organizacji co zarodki zygotyczne)
oraz struktur podobnych do liścieni (Gruszczyńska i Rakoczy-Trojanowska 2007, Kulus
2013).
Wykorzystanie hodowli in vitro do mikrorozmnażania roślin, jest jednym
z najważniejszych praktycznych zastosowań roślinnych kultur in vitro (Szopa i Kostyń
2006). Zaletą rozmnażania klonalnego, oprócz niewielkiej ilości materiału wyjściowego
wykorzystanego do pozyskiwania dużej ilości roślin potomnych, jest też wyrównanie
genotypowe oraz fenotypowe produkowanych roślin. Głównymi sposobami
mikrorozmnażania, jest otrzymywanie pąków/pędów na drodze organogenezy
bezpośredniej i organogenezy pośredniej oraz somatycznej embriogenezy (Szczygieł
2005, Mikuła i wsp. 1996, 2002, 2015).
Efekt końcowy (wysoka liczba uzyskanych organów) prowadzenia kultur
in vitro zależy od właściwości biochemiczno-fizjologicznych i genetycznych użytego
materiału roślinnego, właściwości fizycznych podłoża oraz substancji odżywczych i
stymulatorów wzrostu w nim zawartych, a także od warunków zewnętrznych, w których
prowadzi się kulturę. Czynnikiem morfogenetycznym podczas wzrostu i rozwoju
eksplantatów w prowadzonych kulturach jest m.in. światło, odpowiedni dobór składu
pożywki i regulatorów wzrostu (Ramage i Williams 2002, Siegień i wsp. 2013).

17
1.2 Czynniki wpływające na morfogenezę
1.2.1 Rola światła w regulacji morfogenezy roślin
Światło słoneczne stanowi istotny czynnik środowiskowy w życiu roślin.
Odgrywa ono ważną funkcję w regulowaniu metabolizmu i morfogenezy. Rola światła
w rozwoju roślin jest naturalnie związana z procesem fotosyntezy, w którym pełni
funkcje czynnika troficznego, oraz z procesami fotomorfogenezy. Światło inicjuje
proces fotosyntezy, wpływa na aktywność niektórych enzymów metabolizmu
fotosyntetycznego, pośrednio reguluje również intensywność transpiracji np. poprzez
wpływ na stopień otwarcia aparatów szparkowych. Promieniowanie fotosyntetycznie
aktywne jest źródłem energii podczas reakcji fotosyntezy, niezbędnym w przemianach
prostych związków nieorganicznych do cukrów, które są prekursorami wszystkich
związków organicznych w roślinie (Taiz i Zeiger 2006, Strzałka 2012), także w
kulturach in vitro (Borkowska 2003).
Absorbowanie promieniowania zależne jest od długości fali, ale też od
właściwości samego organizmu, np. od fizycznych okryw ciała rośliny i ich zdolności
odbijania światła. Tylko część promieniowania docierającego do organizmów
roślinnych jest przez nie absorbowana i wykorzystywana w fazie świetlnej fotosyntezy.
Reszta swobodnie przenika przez liście i przechodzi na zewnątrz, lub jest przez nie
odbijane (Aphalo 2006, Garstka 2007, Strzałka 2012). Liście roślin do przeprowadzenia
reakcji fotosyntezy, w optymalnych warunkach wzrostu, wykorzystują około 5%
całkowitej energii słonecznej, która dociera do powierzchni Ziemi. Promieniowanie
fotosyntetycznie czynne (PAR, ang. photosynthetically active radiation), z którego
rośliny korzystają w procesie fotosyntezy, mieści się w zakresie pomiędzy 400 a 700
nm (Strzałka 2012, Gieczewska 2015). Światło pochłaniane jest przez grupę barwników
fotosyntetycznych, do których zaliczamy m.in. chlorofile a i b absorbujące światło
fioletowoniebieskie (400-480 nm) oraz czerwone (620-680 nm), jak również
karotenoidy (Sulkiewicz i Ciereszko 2016). Barwniki te pełnią rolę fotoreceptorów i są
składnikami anten energetycznych, gdzie współdziałają funkcjonalnie z białkami i
lipidami oraz przekazują energię do fotosystemów (PSI, PSII). Niektóre barwniki
(karotenoidy) chronią ponadto aparat fotosyntetyczny (a zwłaszcza PSII) przed
szkodliwym wpływem nadmiaru promieniowania (Demmig-Adams i Adams 1996,
Szabó i wsp. 2005). Wyróżnia się dwie główne fazy fotosyntezy: 1) fazę reakcji

18
fotochemicznych, zależnych od światła, co w efekcie prowadzi do redukcji NADP oraz
syntezy ATP; 2) fazę reakcji enzymatycznych (niezależnych od światła), zużywających
produkty reakcji fotochemicznych (NADPH, ATP), niezbędnych do związania i
redukcji CO2. Pierwszym trwałym produktem tych reakcji są triozy, przekształcane
następnie do skrobi i/lub sacharozy (Strzałka 2012). Asymilaty, będące produktem
fotosyntezy w liściach, są w większości transportowane do organów (akceptorów),
które nie są w stanie przeprowadzić tego procesu lub poziom, na którym go
przeprowadzają nie pokrywa ich zapotrzebowania na asymilaty. Związki te mogą być
substratami oddechowymi i donorami szkieletów węglowych do syntezy metabolitów
podstawowych i wtórnych, a magazynowane w roślinie - wpływać na wielkość
wytworzonej biomasy (Starck 2008, Ostaszewska-Bugajska i wsp. 2015).
Światło działa na roślinę bezpośrednio, jako czynnik morfogenetyczny, będący
bodźcem inicjującym określone zmiany rozwojowe. Wszystkie etapy cyklu życiowego i
rozwoju roślin, od kiełkowania do indukcji kwitnienia, a także starzenie, regulowane są
m.in. przez światło (Taiz i Zeiger 2006). Reakcją na promieniowanie czerwone jest
wzmożony proces kiełkowania, natomiast światło dalekiej czerwieni daje efekt
przeciwny, co zaobserwowano podczas kiełkowania nasion cebuli (Allium cepa L.)
oraz sałaty (Lactuca sativa L.) (Warening i Philips 1985). Do reakcji fizjologicznych
wywołanych działaniem światła czerwonego i dalekiej czerwieni, zalicza się również
odginanie się haczykowato zgiętego epikotylu, powiększanie się liści, czy inicjację
korzeni. Antagonistyczne efekty działania światła czerwonego i dalekiej czerwieni
wykazano na poziomie subkomórkowym i molekularnym w reakcjach takich jak ruchy
chloroplastów, synteza enzymów, czy zmiany przepuszczalności membran
cytoplazmatycznych (Hopkins i Hüner 2004). Wymienione reakcje zachodzące pod
wpływem światła, możliwe są dzięki występowaniu w roślinach barwników, będących
receptorami światła czerwonego, niebieskiego i ultrafioletu (Ahmad i wsp. 1998, Casal
2000, Lin 2000, Keller i wsp. 2011). Kryptochrom, fototropina lub zeaksantyna
odbierają bodźce świetlne z zakresu krótkofalowego promieniowania słonecznego (320
- 500 nm), natomiast fitochromy z zakresu długofalowego (580 - 730 nm) (Cashmore i
wsp. 1999, Casal 2000). Zaabsorbowanie fali świetlnej o odpowiedniej długości
zapoczątkowuje szereg przemian zakończonych odpowiedzią fizjologiczną, oddziałując
na sposób funkcjonowania genów związanych ze wzrostem, różnicowaniem się
komórek lub na zmianę równowagi hormonalnej (Hopkins i Hüner 2004, Taiz i Zeiger
2006, Igamberdiev i wsp. 2014).

19
Fitochromy są najdokładniej i najwcześniej poznanymi receptorami światła
czynnego morfogenetycznie. Biorą udział w wielu różnych procesach rozwojowych,
takich jak np. indukcja i regulacja wzrostu, kiełkowaniu nasion, deetiolacji czy
kwitnieniu (Mohr i Schopfer 1994, Casal 2000, Gabryś 2012). Maksimum absorpcji
barwnika przypada na długości fal, które odpowiadają światłu czerwonemu (660 nm) i
dalekiej czerwieni (730 nm). Fitochrom występuje w roślinach w dwóch formach, które
różnią się między sobą pod względem własności spektralnych i aktywności
fizjologicznej. Forma nieaktywna biologicznie Pr, pochłania promieniowanie z pasma o
długości 600 nm i pod jego wpływem przekształca się w aktywną biologicznie formę Pfr
reagującą na światło o długości 730 nm. Pfr może ulegać degradacji, bądź ponownemu
przekształceniu do Pr. Fitochromy kodowane są przez niewielką rodzinę genów. U
rzodkiewnika pospolitego białkowe składniki tych fotoreceptorów kodowane są przez
pięć genów (PHYA, B, C, D, E), z czego stosunkowo silniejszej ekspresji ulegają geny
PHYA i PHYB (Baba‐Kasai i wsp. 2014).
Ogromna rozpiętość energetyczna procesów sterowanych przez fitochromy,
doprowadziła do wyszczególnienia trzech kategorii reakcji fitochromowych: bardzo
nisko energetycznych (VLFR), niskoenergetycznych (LFR), wysokoenergetycznych
(HIR) (Franklin i Quail 2010). Charakterystyczną cechą reakcji fitochromowych LFR,
do których zalicza się m.in. kiełkowanie nasion niektórych odmian sałaty czy ruchy
senne liści, jest możliwość odwrócenia działania światła czerwonego przez daleką
czerwień. Reakcje VLFR np. indukcja ekspresji genu LHCB kodującego białko wiążące
chlorofile a i b w kompleksie antenowym, wywoływane przez światło czerwone, daleką
czerwień lub niebieskie, nie są odwracalne. Warunkiem wywoływania
wysokoenergetycznych reakcji HIR, takich jak: deetiolocja siewek, jest naświetlanie
rośliny przez dłuższy czas światłem o dużym natężeniu (Gabryś 2012).
Fitochromy mają zdolność także „odczytywania” długości dnia i nocy oraz
regulowania przez to procesu kwitnienia u gatunków roślin fotoperiodycznie
wrażliwych. Zmiany w zawartości poszczególnych form fitochromu pozwalają
regulować reakcje związane z cyklem dobowym (Kopcewicz 2012).
Kryptochromy są fotoreceptorami światła niebieskiego obecnymi u wszystkich
gatunków roślin. Odkryto je także u koralowców, jak również u owadów, ptaków i
ssaków. Stanowią podklasę receptorów światła niebieskiego – flawoprotein,
regulujących kiełkowanie, elongację, fotoperiodyzm i inne reakcje wzrostowe roślin
(Cashmore i wsp. 1999, Casal 2000, Keller i wsp. 2011). Kryptochromy absorbują

20
promieniowanie w zakresie 370 - 500 nm. Reakcje, które są inicjowane światłem
niebieskim, nie są odwracalne (Mohr i Schopfer 1995). U większości roślin występują
dwa homologiczne kryptochromy: cry1 i cry2. W efekcie naświetlenia światłem
niebieskim, ultrafioletowym i zielonym, obserwuje się szybki spadek poziomu cry2. W
momencie niskiego natężenia oświetlenia, deetiolacja jest kontrolowana przez obydwa
kryptochromy, tymczasem przy dużym natężeniu, dominującą rolę pełni cry1 (Ahmad i
wsp. 1998, Cashmore i wsp. 1999, Casal 2000).
Fototropiny są białkami receptorowymi, należącymi do kinaz, które ulegają
fosforylacji w odpowiedzi na światło niebieskie. Występują w błonie komórkowej
roślin wyższych (Casal 2000). Fototropiny w N-końcowym, fragmencie posiadają dwie
domeny LOV1 oraz LOV2 połączone z grupą chromoforową mononukleotydu
flawinowego (FMN), natomiast fragment C-końcowy, posiada domenę katalityczną
(kinaza serynowo- treoninowa). Fototropiny funkcjonują w dwóch odmianach aktywnej
(na świetle) lub nieaktywnej (w ciemności). Za odbieranie bodźców środowiskowych,
które zmieniają stan oksydoredukcyjny komórki, odpowiada domena LOV (Casal 2000,
Demarsy i Fankhauser 2009). Współdziałając z kryptochromem i fitochromem,
odpowiadają za regulację fototropizmu. Odgrywają również ważną rolę w ruchach
aparatów szparkowych, chloroplastów wewnątrz komórki, rozwoju liści czy w
pierwszych zmianach (przed uaktywnieniem kryptochromu), związanych z
wydłużaniem łodygi (Lin 2000, Luesse i wsp. 2010).
Zeaksantyna jest barwnikiem absorbującym światło niebieskie, zaliczanym do
karotenoidów. Występuje ona w błonach tylakoidów chloroplastów. Jest wytwarzana w
skutek odwracalnego przeobrażenia wiolaksantyny w cyklu ksantofilowym (Demmig-
Adams i Adams 1996, Szabó i wsp. 2005). Wykazano, że widmo czynnościowe ruchu
aparatów szparkowych pokrywa się z widmem absorpcyjnym zeaksantyny (Hopkins i
Hüner 2004).
W ostatnich latach wykryto, i częściowo scharakteryzowano, także inne
fotoreceptory, m.in. UVR8 (Kong i Okajima 2016 i literatura tam cytowana).
Światło wpływa również na procesy morfogenetyczne w kulturach in vitro.
Prawidłowy przebieg rozwoju eksplantatów, zależy od wyznaczenia takich właściwości
światła, jak jego natężenie, czas ekspozycji oraz długość fali świetlnej. Jakość oraz
natężenie światła uczestniczy np. w wytwarzaniu i namnażaniu pędów, kształtowaniu
anatomii, wielkości liścia czy w wytwarzaniu korzeni w kulturach in vitro (Reuveni i
Evenor 2007). Światło niebieskie i ultrafioletowe przeważnie wpływa negatywnie na

21
komórki hamując ich podziały i wzrost, uniemożliwiając indukcję i proliferację kalusa,
czy hamując powstawanie pąków przybyszowych. Wykazano, że światło zielone i żółte
może stymulować wytwarzanie pąków przybyszowych z części hipokotyli. W
warunkach in vitro, analogicznie do warunków naturalnych, najbardziej efektywnym
jest światło fotosyntetycznie aktywne (400-700 nm). U woskownicy europejskiej
(Myrica gale L.) wysoka intensywność światła indukuje wytwarzanie oraz wydłużanie
korzeni, jak również ma stymulujący wpływ na masę i długość pędów (Tavares i wsp.
1998). Natomiast w przypadku eksplantatów korzeni czosnku pospolitego (Allinum
sativum L.), indukcję i proliferację kalusa warunkuje zupełny brak światła, zaś światło
ma stymulujący wpływ na organogenezę pędową (Martín-Urdíroz i wsp. 2004). Światło
białe, czerwień i daleka czerwień, wpływają stymulująco na kaulogenezę dzikiej
odmiany pomidora (Lycopersicon esculentum Mill.) natomiast światło niebieskie
powoduje spadek zdolności regeneracyjnej (Bertram i Lercari 2000).
W badaniach nad wpływem cukrów oraz intensywnością światła na wzrost
rzodkiewnika pospolitego w warunkach in vitro zaobserwowano, iż wyższe stężenie
sacharozy w pożywce niweluje negatywne działanie światła o silnym natężeniu na
proces fotosyntezy oraz cykl ksantofilowy (Eckstein i wsp. 2012). Niską zdolność
fotosyntetyczną roślin hodowanych in vitro przypisuje się słabemu rozwojowi aparatu
fotosyntetycznego, niskiej aktywności enzymów uczestniczących w wiązaniu CO2,
niewystarczającej wymianie gazowej oraz uszkodzeniu aparatów szparkowych (Rival i
wsp. 1997, Zenkteler i Borkowska 2002). W przypadku kontrolowanych warunków
temperaturowych i świetlnych w trakcie wzrostu roślin w warunkach in vitro, to skład
chemiczny podłoża odgrywa znaczącą rolę w rozwoju i aktywności aparatu
fotosyntetycznego (Rybczyński i wsp. 2007).
1.2.2 Rola węglowodanów w kulturach in vitro
Cukry pełnią istotne funkcje we wzroście i rozwoju roślin: budulcowe,
zapasowe, są substratami reakcji oddechowych, czy metabolitami pośrednimi szeregu
procesów biochemicznych; mogą także chronić przed czynnikami stresowymi, np. jako
osmoprotektanty (Ciereszko 2006). Glukoza i sacharoza regulują ponadto procesy
wzrostowe i metaboliczne oraz funkcjonują jako cząsteczki sygnałowe (Ciereszko 2007,
van den Ende 2014). Zmiany stężenia i składu sacharydów następują w tkankach roślin
w ciągu doby oraz w czasie kolejnych etapów wzrostu i rozwoju. Dlatego u roślin

22
funkcjonują sprawne systemy percepcji i transdukcji sygnałów wywołanych zmianami
dostępności cukrów. Cukry wpływają na podziały komórkowe, proces kiełkowania,
wzrost wegetatywny, zakwitanie oraz starzenie roślin, często w sposób niezależny od
funkcji metabolicznych (Ciereszko 2007, Ciereszko 2016). Cukry wpływają na wzrost,
wytwarzanie i metabolizm liści, pędów oraz korzeni. Zmiany poziomu glukozy lub
sacharozy, wpływają na intensywność fotosyntezy i eksport asymilatów z liści oraz na
metabolizm oddechowy (Ciereszko 2006). Starzenie się roślin może być natomiast
indukowane deficytem cukrów (Morkunas i wsp. 2012). Cukry wpływają również na
strukturę lub ruchy organelli komórkowych (van Dingenen i wsp. 2016). Sacharoza
oddziałuje np. na morfologię, wielkość i liczbę chloroplastów w komórkach liści
rozetowych rzodkiewnika, obserwuje się wówczas mniejsze i nieregularne plastydy w
komórkach mezofilu (van Dingenen i wsp. 2016). Badania ostatnich lat wskazały także
na trehalozo-6-P, jako czynnik sygnalny, regulujący wiele procesów wzrostowych
roślin (Figueroa i Lunn 2016).
Deficyt sacharozy prowadzi do indukcji głównych punktów kontrolnych (PCP1 i
PCP2, ang. principal control points), które blokują cykl komórkowy odpowiednio w
fazie G1 i G2 (Polit i Ciereszko 2009 i literatura tam cytowana). Wzbogacenie pożywki
w cukier uruchamia aktywność replikacyjną i mitotyczną, jednak z opóźnieniem
kilkunastogodzinnnym. Czas może być modulowany przy pomocy fitohormonów:
cytokinina podana z sacharozą przyspieszała, natomiast auksyna - opóźniała
wznowienie replikacji (Polit i Ciereszko 2009 i literatura tam cytowana). Ostatnie
badania wskazały, że cukry (wraz z auksyną) regulują ekspresję cyklin typu D podczas
interfazy (Wang i Ruan 2013).
Drogi transdukcji sygnałów wywołanych przez cukry, współdziałają ze szlakami
hormonalnymi, a także odpowiedzią na zmiany czynników środowiska tworząc w
komórkach sieć komunikacyjno-sygnalizacyjną, kontrolującą procesy wzrostowe i
rozwojowe roślin. Charakterystyka mutantów cukrowych i hormonalnych (głównie z
zaburzoną syntezą ABA i etylenu), dostarczyła dowodów współdziałania hormonalnych
dróg sygnalnych i wywołanych przez cukry (Ciereszko 2007 i literatura tam cytowana).
Kolejne badania wskazały na współdziałanie cytokinin, giberelin oraz kwasu
jasmonowego, salicylowego czy brasinosteroidów ze szlakami cukrowymi (Ljung i
wsp. 2015, Ciereszko 2016 i literatura tam cytowana).
W warunkach kultury in vitro, węglowodany, jako składniki pożywek, są
niezbędnym czynnikiem dla rosnących i różnicujących się tkanek. Działają również

23
jako induktory lub rep resory, genów regulując wzrost i rozwój tkanek oraz zachodzące
w nich procesy metaboliczne (Koch 1996). Odgrywają znaczącą rolę w przekazywaniu
sygnałów indukujących morfogenezę, wzrost komórek czy odpowiedź na stres (Ho i
wsp. 2001). Stanowią źródło węgla organicznego, wykorzystywane są jako materiał
energetyczny i substrat do syntez w różnych szlakach metabolicznych. Węglowodany, a
zwłaszcza alkohole cukrowe, takie jak sorbitol, mannitol, oddziałują na procesy
morfogenetyczne tkanek poprzez wpływ na potencjał osmotyczny pożywki (Neto i
Otoni 2003, Staikidou i wsp. 2005). W hodowlach in vitro ciągłe dostarczanie
cukrowców z podłoża jest niezbędne z powodu zredukowanej aktywności
fotosyntetycznej kultur, w wyniku niskiej intensywności światła, ograniczonej wymiany
gazowej oraz wysokiej wilgotności (Bogunia i Przywara 1999). Jednak wysokie
egzogenne stężenie sacharozy w pożywce, zmniejsza zdolności fotosyntetyczne
hodowanych roślin oraz pędów w warunkach in vitro (Fuentes i wsp. 2005). Najczęściej
używanym źródłem węgla dla podtrzymania wzrostu in vitro i różnicowania się tkanek,
a także dobrze poznanym pod tym względem węglowodanem, jest sacharoza. Cukier
ten pod wpływem wydzielanej przez eksplantaty inwertazy, rozkładany jest do glukozy
i fruktozy (Tremblay i Tremblay 1995).
W badaniach nad wpływem różnych cukrów na morfogenezę w kulturach in
vitro lnu zwyczajnego (Linum usitatissimum L.), najefektywniejszą kaulogenezę
zaobserwowano na podłożu z dodatkiem maltozy, natomiast obecność sacharozy
stymulowała namnażanie kalusa i ryzogenezę (Millam i wsp. 1992). W kulturach
rzepaku, najwyższą ilość tkanki kalusowej uzyskano na pożywkach z 1% i 3% glukozą,
natomiast najsłabsze namnażanie kalusa zanotowano na podłożu z rybozą. W kulturach
rosnących na pożywce zawierającej sacharozę, stwierdzono czterokrotny przyrost
biomasy, podczas gdy w obecności fruktozy, masa kalusa zwiększyła się półtorakrotnie.
Użycie cukru w stężeniu 10%, w każdym z testowanych wariantów doświadczenia,
indukowało najsłabszy przyrost kalusa (Bogunia i Przywara 1999). Z badań nad
embriogenezą somatyczną w kulturach zawiesinowych kukurydzy, wynika, że mannitol,
jak i sacharoza, stymulowały embriogenezę. Sacharoza w stężeniu 6% wpływała
ponadto na akumulację skrobi i dojrzewanie zarodków somatycznych. Natomiast w
obecność 2% sacharozy obserwowano formowanie pędów i korzeni na drodze
organogenezy pośredniej (Emons i wsp. 1993). W kulturach fasoli wielokwiatowej
(Phaseolus coccineus L.) oraz róży (Rosa sp. L.), glukoza była bardziej efektywna niż

24
sacharoza w indukowaniu kaulogenezy (Genga i Allavena 1991, Hsia i Korban 1996).
Rzodkiewnik pospolity, hodowany w warunkach in vitro, wymagał obecności cukru w
podłożu, jako dodatkowego źródła węgla. Wykazano ponadto, że bardzo niskie stężenia
sacharozy oraz glukozy, były odpowiednie do prawidłowego wzrostu i rozwoju roślin w
warunkach in vitro (Eckstein i wsp. 2012). W kulturach goryczki (Gentiana kurroo
Royle), prawidłowy rozwój i funkcjonowanie aparatu fotosynetycznego
zaobserwowano przy zawartości 0,2-0,4% sacharozy w pożywce. Natomiast brak
sacharozy w podłożu oraz sacharoza o stężeniu 3% nie wpływała korzystnie na
aktywność aparatu fotosyntetycznego (Rybczyński i wsp. 2007).
1.2.3 Rola hormonów i regulatorów wzrostu w procesie morfogenezy w
warunkach in vitro
Procesy wzrostu i rozwoju roślin regulowane są przez niskocząsteczkowe endo-
i egzogenne substancje zwane fitohormonami lub hormonami roślinnymi. Występują
one powszechnie w roślinach, są aktywne biologicznie w bardzo małych ilościach, a
niektóre z nich, podobnie jak hormony zwierzęce, działają daleko od miejsc swojej
biosyntezy. Regulatory wzrostu, hormony roślinne i ich syntetyczne analogi: auksyny i
cytokininy (stosowane najczęściej w kulturach), gibereliny, kwas abscysynowy i etylen,
jasmoniany czy brassinosteroidy, są charakterystycznymi składnikami używanymi do
pożywek w kulturach in vitro, silnie wpływającymi na efekt prowadzonej kultury
(Bishop i wsp. 2015). Kierunek morfogenezy w kulturach in vitr,o uzależniony jest w
dużym stopniu od rodzaju zastosowanych hormonów, jak też współdziałania między
nimi. Koordynując wiele procesów fitohormony mogą oddziaływać niezależnie od
siebie, lub wzajemnie wzmacniać, bądź eliminować swoje efekty (Taiz i Zeiger 2006,
Bajguz i Hayat 2009, Frankowski i wsp. 2009, Adamczuk i wsp. 2012b, Bishop i wsp.
2015).
Cytokininy są pochodnymi adeniny syntetyzowanymi głównie w korzeniach.
Stymulują one podziały komórek, uczestniczą w ich różnicowaniu, regulują wzrost,
spoczynek, transport i akumulację asymilatów, syntezę kwasów nukleinowych,
aktywność enzymów. Dobrze znaną właściwością cytokinin jest opóźnianie procesu
starzenia liści. Stymulują one rozwój liści, otwieranie aparatów szparkowych, syntezę
chlorofilu i karotenoidów. Zwiększają ilość białek fotosyntetycznych, na poziomie
transkrypcyjnym, jak i potranskrypcyjnym (Pilarska i wsp. 2015 i literatura tam

25
cytowana). Hormony te wpływają na morfogenezę, znosząc dominację wierzchołkową,
indukują powstawanie pędów przybyszowych i hamowanie formowania korzeni
przybyszowych. Cytokininy są regulatorami wzrostu niezbędnymi do zainicjowania
merystemów pędowych w kulturach in vitro. Hormonami należącymi do tej grupy,
stosowanymi w kulturach in vitro są naturalne – zeatyna, 6(ɣ,ɣ-dimetyloalliloamino)-
puryna (2iP) oraz syntetyczne – benzyloaminopuryna (BA), kinetyna (Ružić i Vujović
2008). Naturalne cytokininy zeatyna, 2iP, to pochodne zasady purynowej adeniny, w
której do grupy aminowej przyłączony jest najczęściej pięciowęglowy izoprenowy
łańcuch alifatyczny, a rzadziej aromatyczny podstawnik benzylowy, w różnych
modyfikacjach chemicznych. Aktywność cytokininową wykazują również niektóre
związki syntetyczne, pochodne mocznika, jak, np., tidiazuron (TDZ) (Czerpak i
Piotrowska 2003).
Najczęściej obserwowane działanie cytokinin na kultury roślinne in vitro to
inicjacja merystemów pędowych, stymulacja kaulogenezy, zahamowanie tworzenia
korzeni, redukcja długości pędów i opóźnianie procesu starzenia. Fitohormony te są
substancjami, które powodują odmłodzenie eksplantatów co ma ogromne znaczenie w
przypadku rozmnażania starych, wartościowych drzew leśnych lub starych klonów
roślin sadowniczych. Pierwszą reakcją na dodatek cytokininy do pożywki jest
zwiększenie świeżej masy eksplantatów (Orlikowska 1997). Najwyższy procent
reagujących eksplantatów oraz najwyższą liczbę pędów obserwowano na pożywce z
dodatkiem BA, m.in. w kulturach rumiana szlachetnego (Anthemis nobilis L.) czy
różnych odmian lnu (Linum usitatissimum L.) (Echeverrigaray i wsp. 2000, Belongova i
Raldugina 2006, Janowicz i Wojciechowski 2009). Organogeneza pędowa, niezależnie
od gatunku żywopłonu (Aeschynomene spp.) z jakiego pochodziły eksplantaty, była
najwyższa, gdy pożywka zawierała stosunkowo niską koncentrację NAA, w
porównaniu do użytej cytokininy (Rey i Mroginski 1996).
Obecnie znanych i stosowanych jest kilka cytokinin mocznikowych. Szczególne
znaczenie ma tidiazuron (TDZ): N-fenylo-N’-1,2,3-tiodiazylo-5-yl-mocznik, który
wykazuje bardzo silną aktywność cytokininową. Stwierdzono, że TDZ jest potężnym
regulatorem odpowiedzi morfogenetycznych u wielu gatunków roślin. Odpowiedzi te
obejmują somatyczną embriogenezę, mikropropagację, regenerację, formowanie pędów
i pobudzanie uśpionych pąków (Jasiwal i Sawhney 2006). Stosowany jest w kulturach
in vitro, m.in. tych roślin, które słabo reagują na BA (Borkowska 1997). Indukcję
embriogenezy somatycznej przez TDZ obserwowano w kulturach bambusa (Bambusa

26
sp. Shreb.), wiśni (Cerasus sp. Mill.) czy pieprzowca rocznego (Capsicum annum L.)
(Khan i wsp. 2006). TDZ okazał się także bardzo skuteczny w indukowaniu
organogenezy pędowej in vitro takich roślin jak: kiwi (Actinidia sp. Lindl.), jabłoń
(Malus sp. Mill.), groch (Pisum sp. L.) czy sezam indyjski (Sesamum indicum L.)
(Magioli i wsp. 1998, Were i wsp. 2006). W kulturach żyworódki (Kalanchoë
blossfeldiana Poelln.), TDZ okazał się efektywniejszym stymulatorem kaulogenezy niż
BA (Sanikhani i wsp. 2006). Siewki lnu hodowane na pożywce z dodatkiem TDZ
wykazywały wyraźną wieloraką odpowiedź na ten związek: zahamowanie wydłużania
korzeni, skrócenie hipokotyla, zgrubienie nasady hipokotyla oraz przyleganie liścieni do
wierzchołka. Konsekwencją działania TDZ na fragmenty hipokotyli lnu, obok
wymienionych efektów było indukowanie kaulogenezy (Gairi i Rashid 2002, Mundhara
i Rashid 2006).
Auksyny odpowiedzialne są głównie za wydłużanie komórek, indukcję
tworzenia korzeni przybyszowych, formowanie kalusa oraz hamowanie wzrostu pąków
kątowych. Syntetyzowane są w młodych częściach roślin, takich jak wierzchołki
pędów, rozwijające się liście, młode owoce. Szczególną właściwością tych
fitohormonów jest ich polarny transport, kontrolowany przez białka PIN odpowiadające
za wypływ auksyn z komórki. Białka te odgrywają znaczącą rolę w asymetrycznym
rozmieszczeniu stężenia auksyn w roślinie, co wpływa znacząco na wzrost i rozwój
rośliny (Tanaka i wsp. 2006, Wiśniewska i wsp. 2006). Prawidłowy przebieg rozwoju
zarodkowego, tworzenie korzeni bocznych uwarunkowany jest dynamiczną zamianą
lokalizacji białek PIN (Wiśniewska i wsp. 2009 i literatura tam cytowana). Wszystkie
obserwowane dotychczas reakcje morfogenetyczne roślin na auksyny, stwierdzono
również w kulturach in vitro. Auksyny wraz z cytokininami indukują bezpośrednią
organogenezę (Tilkat i Onay 2009). Efektem działania auksyn na eksplantaty w
warunkach in vitro jest stymulacja podziałów komórkowych, prowadząca do
wytworzenia kalusa, a przy współdziałaniu z cytokininami organogenezy korzeniowej i
pędowej oraz somatycznej embriogenezy (Korach i wsp. 2002). Rozwój kalusa
obserwuje się na pożywkach z dodatkiem auksyny jako jedynego regulatora, ale
dodatek cytokininy przyspiesza jego wzrost. Podwyższenie poziomu auksyny w
podłożu pobudza tworzenie korzeni (Ryc. 2). Auksyna stymuluje biosyntezę etylenu w
tkankach, który wpływać może na szybsze starzenie kultur. Najczęściej stosowany w
kulturach in vitro jest kwas indolilo-3-octowy (IAA) – auksyna naturalna, jak też kilka
syntetycznych: kwas indolilo-3-masłowy (IBA), kwas naftalenooctowy (NAA), kwas

27
2,4- dichlorofenoksyoctowy (2,4-D), pikloram czy dikamba (Gaspar i wsp. 1996). W
kulturach in vitro auksyny są wykorzystywane do pobudzania regeneracji brakujących
organów, inicjowania wegetatywnych pąków, namnażania kalusa w obecności
cytokinin.
Ryc. 2. Współdziałanie auksyn i cytokinin w indukcji organogenezy w kulturach
in vitro.
Wzajemna proporcja auksyn w stosunku do cytokinin decyduje zwykle o
kierunku przemian morfogenetycznych. Hormony, działając antagonistycznie,
wpływają na różnicowanie korzeni. Podwyższenie poziomu auksyny, przy braku
cytokininy, może prowadzić do stymulacji rozwoju korzeni bocznych, natomiast
obecność cytokininy hamuje ten proces (Werner i Schmulling 2009). Przewaga
cytokinin nad auksynami w kulturach szparaga (Asparagus densiflorus (Kunth) Jessop),
indukowała powstawanie pędów oraz zwiększała ich liczbę (Benmoussa i wsp. 1996).
W otrzymywaniu pędów dzwonka karpackiego (Campanula carpatica Jacq.) z kalusa,
niezbędna jest obecność zarówno auksyny jak i cytokininy w optymalnych dla tego
gatunku stężeniach w pożywce (Frello i wsp. 2002). Zniesienie dominacji pąka
wierzchołkowego to również wynik współdziałania cytokinin z endo- i egzogennymi
auksynami. Rośliny pomidora otrzymane in vitro na pożywce z hormonami (IAA, BA),
wyróżniały się większą intensywnością wzrostu na początku okresu wegetacji, lepiej
zawiązywały owoce w górnych gronach. Plon tych roślin był wyższy w porównaniu do
roślin z siewu tradycyjnego (Górecka i wsp. 1997). Roślinne regulatory wzrostu
odgrywają także ważną rolę w inicjacji somatycznej embriogenezy oraz w stymulacji
dojrzewania zarodków somatycznych. Powszechnie używane cytokininy w pożywkach

28
indukcyjnych są dodawane również do pożywek regeneracyjnych, w których odgrywają
ważną rolę w procesie dojrzewania zarodków, stymulując tworzenie liścieni (Mikuła i
wsp. 1997).
Gibereliny należą do licznej grupy ponad stu związków. Za główne aktywne
gibereliny w roślinach wyższych uważane są: A1, A3, A4, A7 i A9. Wytwarzane są w
dojrzewających nasionach, owocach, zielonych częściach rośliny, wierzchołkach
wzrostu pędu, korzeniach, pręcikach. Hormony te biorą udział w takich procesach jak:
wydłużanie łodygi roślin karłowatych, indukcja kwitnienia, pobudzanie zawiązywania
owoców, przyspieszanie wychodzenia nasion ze stanu spoczynku, indukują
wytwarzanie α-amylazy, stymulują powstawanie owoców partenokarpicznych. W
kulturach in vitro najczęściej stosowaną gibereliną jest kwas giberelowy (GA3), który
często wywołuje efekt zbliżony do auksyn. Gibereliny w dużych stężeniach indukują
formowanie kalusa, a współdziałając z auksynami, stymulują jego proliferację. Dodatek
gibereliny do kultur, gdzie zapoczątkowany został proces organogenezy stymuluje
liczbę tworzonych struktur. Gibereliny działają jak inhibitory w formowaniu zarodków
somatycznych, jednocześnie ułatwiając dalsze etapy ich rozwoju (Stefaniak 2004, Taiz i
Zeiger 2006).
Kwas abscysynowy (ABA), należący do seskwiterpenów, jest jedynym
przedstawicielem tej grupy hormonów. Najczęstszym efektem działania ABA jest
hamowanie wzrostu czy kiełkowania. Reguluje również szereg procesów takich jak:
dojrzewanie i spoczynek nasion, wzrost korzeni, starzenie się liści, a także
przechodzenie z fazy wzrostu wegetatywnego do generatywnego. Uważany jest za
jeden z głównych, obok, JA i etylenu hormon stresu, umożliwiający roślinie
przystosowanie się do niekorzystnych warunków środowiska. Pośredniczy w regulacji
otwierania aparatów szparkowych oraz wpływa na ekspresję genów związanych ze
stresem (Wasąg i Kowlczyk 2009). W kulturach in vitro ABA zwykle hamuje
formowanie i namnażanie kalusa, jednak w obecności cytokininy stymuluje namnażanie
komórek. W kulturach in vitro roślin cytrusowych może stymulować tworzenie kalusa
oraz współdziałać w dojrzewaniu zarodków somatycznych. W procesie morfogenezy
przyspiesza rozwój organów przybyszowych, indukuje wytwarzanie kwiatów.
Niewielka dawka ABA indukuje embriogenezę somatyczną w komórkach kalusa i
zapewnia prawidłowy rozwój zarodków somatycznych. Działa również jako inhibitor
przedwczesnego kiełkowania zarodków somatycznych (Kępczyńska 2006, Kulus 2013).
Obecność ABA w pożywce inicjującej embriogenezę somatyczną marchwi (Daucus

29
carota L.) i kminku (Carum carvi L.), uniemożliwiało przemiany, mające na celu
nadanie komórkom charakteru embriogennego, natomiast w fazie dojrzewania
zarodków somatycznych sprzyjało prawidłowemu wykształceniu liścieni (Orlikowska
1997).
Kolejnym hormonem wykorzystywanym w kulturach in vitro jest etylen - gaz o
prostej budowie chemicznej, cechujący się dużą lotnością i łatwością przemieszczania
się w roślinie. Hormon ten wytwarzany jest przez wszystkie żywe komórki, stymuluje
kiełkowanie, starzenie się kwiatów i liści, przyspiesza dojrzewanie owoców, zrzucanie
liści, a także tworzenie korzeni przybyszowych oraz hamuje wydłużanie łodyg
(Frankowski i wsp. 2007). Etylen uczestniczy w reakcji roślin na czynniki stresowe.
Syntetyzowany, m.in. w odpowiedzi na zranienie, gromadzi się w naczyniach, w
których prowadzone są kultury in vitro, wywołując efekty zbliżone do auksyn. Zbyt
szczelne zamknięcie naczyń powoduje duże nagromadzenie tego gazu, co może
skutkować szybszym starzeniem kultur. Prowadzi to do zahamowania podziałów
komórkowych, wzrostu komórek oraz przyspiesza ich starzenie. Hamuje proliferację
kalusa i wytworzenie pędów przybyszowych, obniża efektywność somatycznej
embriogenezy (Stefaniak 2004, Frankowski i wsp. 2007).
Jasmoniany (JAs) są grupą roślinnych regulatorów wzrostu, reprezentowaną
przez kwas jasmonowy (JA) oraz jego ester metylowy, nazywany jasmonianem metylu
(Me-JA). Związki te odgrywają ważną regulacyjną rolę we wzroście i rozwoju roślin
oraz w wielu procesach komórkowych. Doniesienia na temat działania kwasu
jasmonowego dotyczyły przyspieszania procesu starzenia (Chung i wsp. 2008). U wielu
badanych roślin m.in. tytoniu szlachetnego (Nicotiana tabacum L.), komosy czerwonej
(Chenopodium rubrum L.) i wolfii bezkorzeniowej (Wolffia arrhiza (L.) Horkel ex
Wimm.), zaobserwowano zahamowanie kwitnienia pod wpływem tego fitohormonu,
natomiast w przypadku rzepaku jasmoniany wpływały na tworzenie się kwiatów (Pak i
wsp. 2009, Wilmowicz i wsp. 2012). Hormony tej grupy mają istotny wpływ na
prawidłowe formowanie płonnych i płodnych części kwiatów oraz otwieranie się pąków
kwiatowych. Dodatkowo kwas jasmonowy powstający w nitkach pręcików, uczestniczy
w dojrzewaniu ziaren pyłku, a koniugat kwasu jasmonowego z izoleucyną uczestniczy
pośrednio w regulowanej przez światło sekrecji nektaru (Wilmowicz i wsp. 2012).
Jasmoniany uczestniczą również w reakcjach roślin na stresy biotyczne i abiotyczne.
Odpowiedź abiotyczna wymaga natychmiastowej mobilizacji sygnałów obronnych
rośliny. Może to być realizowane poprzez wyzwolenie impulsu uwalniającego

30
fitohormon lub powodującego jego syntezę de novo. Ponadto uważa się, że kwas
jasmonowy i jego ester metylowy biorą udział w uruchamianiu mechanizmów
indukowanej odporności systemicznej (Andrys 2014 i literatura tam cytowana). W
zranionych tkankach roślin dochodzi do gromadzenia kwasu jasmonowego, który jest
sygnałem aktywującym ekspresję genów, takich jak inhibitory proteinaz, taniny czy
enzymów w metabolizmie fitoaleksyn (Creelman i Mullet 1997). α-tokoferol
wpływając na sygnalizację wewnątrzkomórkową bezpośrednio, przez interakcję
elementów kaskady sygnałowej bądź pośrednio, poprzez zapobieganie peroksydacji
lipidów reguluje pozim JA w roślinie (Munne-Bosch i Alegre 2002).
JA i Me-JA mogą być dodawane na każdym etapie prowadzenia kultur in vitro
oraz stosowane w kulturach zawiesinowych, gdzie wpływają na zwiększoną produkcję
metabolitów wtórnych (Kim i wsp. 2004, Wiktorowska i wsp. 2010, Zhao i wsp. 2013).
Stymulują proces tworzenia bulw, mikrobulw i cebul. W badaniach dotyczących kultur
in vitro stosowano JA i Me-JA m.in. w namnażaniu roślin – pistacji właściwej (Pistacia
vera L.), ziemniaka (Solanum tuberosum L.), gloriozy wspaniałej (Glorisa
rothschildiana ‘O’Brien’) (Dolcet-Sanujan i Claveria 1995, Weryszko-Chmielewska i
Kozak 2002) oraz ich ukorzenianiu (Maciejewska i Kopcewicz 2002, Luo i wsp. 2009).
U gatunków Cymbidium zaobserwowano, iż mieszanina Me-JA i chitozanu stymuluje
wzrost pędów (w przeciwieństwie do JA) i formowanie korzeni (Shimasaki i wsp.
2010). W kulturach in vitro ryżu (Oryza sativa L.) kwas jasmonowy zmniejszył wzrost
pędów, wielkość i liczbę liści oraz korzeni (Cho i wsp. 2007). Kwas jasmonowy
stymulował tworzenie się pędów oraz cebul w kulturach in vitro czosnku, a także
tworzenie bulw u narcyza trójpręcikowego (Narcissus triandrus L.) (Ravnikar i wsp.
1993, Santos i Salema 2000).
Brasinosteroidy (BR) to związki o charakterze regulatorów wzrostu należące do
grupy steroidów. Do naturalnych BR należą 24-epibrasinolid (BR27) oraz 28-
homobrasinolid (BR17). Syntetyczne BR oraz ich analogi o aktywności biologicznej
zbliżonej do naturalnych, to m.in. TS303, 5f-HCTS, MH5 (Janeczko 2005 i literatura
tam cytowana). Brasinosteroidy występują u roślin w łodygach, korzeniach, pyłku
kwiatowym, nasionach, pąkach kwiatowych, zidentyfikowano je również w glonach
(Bajguz i Hayat 2009). Związki te są aktywne fizjologicznie w około 1000 razy
mniejszych stężeniach niż znane hormony roślinne. Brasinosteroidy stymulują wzrost i
rozwój roślin, podnoszą efektywność fotosyntezy, odgrywają istotną rolę m.in. w

31
zahamowaniu wzrostu korzeni, biosyntezie etylenu, aktywacji pompy protonowej,
różnicowaniu naczyń, a także działają ochronnie na roślinę w warunkach stresu
(zwiększają aktywność enzymów antyoksydacyjnych, sprzyjają produkcji ochronnych
białek szoku cieplnego) (Yu i wsp. 2004, Krishna 2003, Mazzorra i wsp. 2002).
Brasinosteroidy znalazły również zastosowanie w roślinnych kulturach in vitro.
Stwierdzono, iż sprzyjają wzrostowi kalusa, stymulują embriogenezę oraz
organogenezę. W kulturach kalusa rzodkiewnika pospolitego, (Arabidopsis thaliana L.)
brasionosteroidy regulowały podziały komórkowe tak, jak w przypadku cytokinin
poprzez aktywację genów dla cyklin typu D (CycD3) (Hu i wsp. 2000).
Zaobserwowano również poprawę syntezy metabolitów wtórnych np. paclitakselu
stosowanego w chemioterapii nowotworów, pod wpływem brasinolidu dodanego do
kultur zawiesinowych cisu (Taxus chinesis (Pilger) Rehder) (Zang i wsp. 2001). W
kulturach hipokotylowych kalafiora (Brassica oleracea L. var.botrytis L.) pod
wpływem brasinolidu stwierdzono stymulację organogenezy pędowej (Sasaki 2002).
Brassinosteroidy wraz z cytokininami indukowały formowanie kalusa oraz kaulogenezę
w kulturach in vitro sałaty (Lactuca sativa L.) (Nunez i wsp. 2004). BR pobudzają
również proces embriogenezy somatycznej w kulturach takich roślin jak: sosna (Pinus
sp. L.), świerk (Picea sp. A. Dietr.) czy ryż (Pullman i wsp. 2003).
Oprócz omówionych powyżej hormonów na procesy wzrostu i morfogenezy
roślin mogą wpływać różne regulatory wzrostu (nie zaliczane do hormonów), np.
poliaminy (Sińska 1986), tlenek azotu, a także nowo poznane, jak karrikiny czy
strigolaktony (Janas i wsp. 2010, Marzec i Muszyńska 2012, Starck 2014).
1.3 Działanie abiotycznych czynników środowiskowych na proces
morfogenezy
Rośliny w warunkach naturalnych narażone są na działanie wielu
niekorzystnych czynników środowiska takich jak: zbyt niska lub wysoka temperatura,
deficyt wybranych składników pożywki, czy stres spowodowany niedoborem wody.
Mogą one być przyczyną zaburzeń metabolicznych, zahamowania wzrostu,
zmniejszonego owocowania czy uszkodzeń tkanek, organów, a długotrwałe i
intensywne ich oddziaływanie, w skrajnych przypadkach, doprowadza do fazy
wyczerpania organizmu i jego śmierci (Kacperska 2012).

32
Wspólną odpowiedzią tkanek roślinnych na działanie niekorzystnych czynników
biotycznych i abiotycznych jest stres oksydacyjny i nitrozacyjny, wywołany
nadprodukcją reaktywnych form tlenu (ROS), reaktywnych form azotu (RNS) i
rodników, powstający na skutek zachwiania równowagi między wytwarzaniem
ROS/RNS a ich usuwaniem przez systemy antyoksydacyjne (Jaspers i Kangasjarvi
2010). Przejawem działania tych stresów jest m.in. peroksydacja lipidów, uszkodzenia
DNA i białek oraz innych ważnych składników w komórce. Dane literaturowe wskazują
także, że ROS/RNS w niewielkich stężeniach, działając jako cząsteczki sygnalne
wpływają stymulująco na przebieg wielu procesów, zapoczątkowują ciąg zdarzeń
prowadzących do zmiany metabolizmu, naprawy uszkodzeń czy efektywniejszej
regeneracji (Mitrović i Bogdanović 2008, Kreslavski 2012).
ROS/RNS uczestniczą w procesach związanych ze wzrostem, różnicowaniem i
rozwojem komórek roślinnych, również podczas morfogenezy w kulturach in vitro
(Tian i wsp. 2003).
Ryc. 3. Podwójna rola reaktywnych form tlenu (ROS) oraz reaktywnych form azotu (RNS)
w regulacji morfogenezy roślin w kulturach in vitro. Zmodyfikowane wg Adamczuk i wsp.
(2012a)
Stres oksydacyjny/nitrozacyjny generowany w wyniku zaburzenia równowagi
pomiędzy wytwarzaniem ROS/RNS a ich usuwaniem, ma również wpływ na kultury in

33
vitro. Widoczne objawy tych stresów to zmniejszenie zawartości wody w tkankach,
zahamowanie wzrostu kultur czy obniżenie zdolności regeneracyjnych, a nawet ich
obumieranie (Abbasi 2011, Benson 2000). Zaobserwowano także, że działanie
niektórych niekorzystnych czynników stresowych może zwiększać zdolności
regeneracyjne roślin (Puijalon i wsp. 2008). Krótkotrwałe działanie stresu wodnego
wpływało stymulująco na regenerację ryżu oraz pszenicy zwyczajnej (Triticum
aestivum L.) (Jain i wsp. 1996, Khanna i Daggard 2001). Stres cieplny, solny oraz
niedobór składników mineralnych miały pozytywny wpływ na powstawanie pąków
pędowych na hipokotylach siewek lnu hodowanych in vitro (Mundhara i Rashid 2001).
Wprowadzanie i namnażanie roślin (bądź ich części) in vitro może wpływać na
metabolizm oksydacyjny i narażać tkanki na szkodliwe działanie ROS. Jednocześnie,
procesy utleniania oraz ROS mogą pozytywnie wpływać na procesy morfogenetyczne
w kulturach in vitro (Haq i wsp. 2009). Wybrane warunki stresowe generujące
powstawanie ROS, zastosowano w badaniach nad sposobem poprawy regeneracji w
kulturach in vitro.
1.4 Reaktywne formy tlenu (ROS) w procesie organogenezy w warunkach
in vitro
W komórkach roślinnych ROS powstają bezustannie jako produkty uboczne
wielu szlaków metabolicznych zlokalizowanych w różnych przedziałach komórkowych.
Poziom ROS w roślinach w optymalnych warunkach ich wzrostu jest niski.
Organellami o wysokiej aktywności metabolizmu tlenowego są chloroplasty,
mitochondria i peroksysomy (Małecka i Tomaszewska 2005). ROS są grupą wolnych
rodników, reaktywnych molekuł i jonów pochodzących z O2. Tlen ze stanu
podstawowego może przechodzić do dużo bardziej reaktywnych form zarówno przez
transfer energii, jak i reakcje przenoszenia elektronu. Wśród ROS wyróżnia się
wzbudzone cząsteczki tlenu: tlen singletowy, nadtlenek wodoru, rodniki tlenowe (O2.-,
rodnik hydroksylowy), ponadto rodniki organiczne np.: alkoksylowe (RO.),
nadtlenkowe (ROO.), acyloksylowe (RCOO
.). Najbardziej znanymi ROS są: tlen
singletowy (1O2), anionorodnik ponadtlenkowy (
.O2
-), nadtlenek wodoru (H2O2) oraz
rodnik hydroksylowy (.OH). Zarówno
.O2
-, jak i H2O2 są uważane za umiarkowanie
reaktywne. H2O2, najstabilniejsza cząsteczka wśród ROS odznacza się dość długim
okresem półtrwania (1 ms). Swobodnie, dyfunduje przez błony komórkowe, co
umożliwia oddziaływanie na komórki oddalone od miejsca jego powstawania, a zatem

34
może funkcjonować jako cząsteczka sygnałowa. Najbardziej aktywny spośród ROS,
rodnik hydroksylowy odznacza się bardzo krótkim okresem półtrwania, nie
przemieszcza się przez błony komórkowe i zdolny jest do utleniania praktycznie
wszystkich ważnych biologicznie związków (Sharma i wsp. 2012, Nowicka i Kruk
2013). Produkcja i usuwanie wolnych rodników musi podlegać ścisłej kontroli, gdyż ich
gwałtowne i niespecyficzne reakcje prowadzą do uszkodzeń, włączając w to
peroksydację lipidów, inaktywację enzymów, innych funkcjonalnych białek, zamiany w
strukturze zasad organicznych i uszkodzeń DNA (Apel i Hirt 2004). Minimalizacja
skutków reakcji ROS z ważnymi molekułami komórkowymi jest możliwa dzięki
obecności niskocząsteczkowych przeciwutleniaczy, służących jako akceptory
elektronów i wyspecjalizowanych enzymów rozkładających ROS (Foyer i Shigeoka
2011). Do antyoksydantów nieenzymatycznych zalicza się antyoksydanty hydrofobowe,
chroniące wnętrze błon komórkowych i antyoksydanty hydrofilowe, chroniące
środowisko wodne komórki. Główne antyoksydanty hydrofobowe to: α-tokoferol
(witamina E), karotenoidy (β-karoten) i ksantofile. α-tokoferol odgrywa ważną rolę w
ochronie błon komórkowych przed uszkodzeniami wywołanymi przez ROS. Działa
jako „wygaszacz” tlenu singletowego oraz wymiatacz ROS powstających podczas
peroksydacji lipidów (Bartosz 2013). Karotenoidy w chloroplastach chronią aparat
fotosyntetyczny, odpowiadają za detoksykację ROS i tlenu singletowego powstającego
w wyniku wzbudzenia kompleksu fotosyntetycznego prze światło (Apel i Hirt 2004). W
skład grupy antyoksydantów hydrofilowych zalicza się kwas askorbinowy (witamina
C), glutation, kofeinę, kwas nikotynowy. Askorbinian i glutation – główne elementy
cyklu Halliwella-Asady, reagują bezpośrednio z anionorodnikiem ponadtlenkowym,
tlenem singletowym i nadtlenkiem wodoru (Foyer i Noctor 2005). Askorbinian
uczestniczy w reakcji Mehlera, polegającej na przeniesieniu elektronu z kompleksu PSI
bezpośrednio na cząsteczkę tlenu z wytworzeniem anionorodnika ponadtlenkowego,
który ulega przekształceniu w H2O2 w reakcji katalizowanej w chloroplastach przez
miedziowo-cynkową dysmutazę ponadtlenkową (Asada 2000, Kozłowska-Szerenos i
Ciereszko 2013).
Funkcje antyoksydacyjne mogą pełnić także związki fenolowe, nieazotowe
metabolity wtórne, które w zależności od budowy mogą wykazywać aktywność w fazie
hydrofilowej lub hydrofobowej. Związki fenolowe dzieli się na proste fenole i ich
pochodne: taniny, flawonoidy i izoflawonoidy. Większość tych związków wywodzi się

35
z aminokwasów: tyrozyny i fenyloalaniny, a syntetyzowane są na drodze szlaku kwasu
szikimowego i/lub kwasu malonowego (Amalesh i wsp. 2011). Cząsteczki należące do
powyższych grup spełniają wiele funkcji w rozwoju roślin np., taniny chronią przed
roślinożercami, flawonole, flawony i antocyjany nadają barwy kwiatom i owocom,
adsorbują promieniowanie nadfioletowe, chroniąc przed uszkodzeniami
fotooksydacyjnymi, izoflawonoidy są silnymi fitoaleksynami, powstającymi na skutek
kontaktu z patogenem (Dixon i Paiva 1995, Ryan i wsp. 2002, Hernandez i wsp. 2008,
Jasiński i wsp. 2009, Barbehenn i Constabel 2011).
Dzięki obecności grup hydroksylowych flawonoidy posiadają zdolności
przeciwutleniające prowadzące do usuwania stresu oksydacyjnego oraz jego skutków i
uważane są za jedne z kluczowych związków obronnych odpowiedzialnych za
usuwanie ROS (Bartwal i wsp. 2013). Zaangażowane są m.in. w chelatację jonów
metali przejściowych, głównie miedzi i żelaza, które katalizują reakcję Fentona i
Habera-Weissa, gdzie produktem jest rodnik hydroksylowy, przerywanie kaskady
reakcji peroksydacji lipidów, oddziałują na wzrost aktywności enzymów
antyoksydacyjnych (m.in. dysmutazy ponadtlenkowej i katalazy) bądź pełnią funkcję
substratów dla enzymów, w przypadku wyczerpania zasobów innych mechanizmów
(Kowalewska i Litwinienko 2010, Agati i wsp. 2012, Czaplińska i wsp. 2012).
Stężenie związków fenolowych zależy od etapu rozwoju rośliny, a synteza tych
metabolitów zachodzi nawet po jej zranieniu (Dubravina i wsp. 2005). Jednak w
początkowych etapach rozwoju kultur tkankowych zaobserwowano niższą zawartość
fenoli niż w roślinach macierzystych, znaczący wzrost ich produkcji nastąpił podczas
organogenezy pędowej), jak i korzeniowej (Wu i wsp. 2007, Soler-Cantero i wsp.
2012). Związki fenolowe chronią auksyny przed dekarboksylacją, co skutkuje
prawidłowym rozwojem korzeni, za których wzrost hormony te są odpowiedzialne (De
Klerk i wsp. 2011).
Do antyoksydantów enzymatycznych zaliczamy enzymy zaangażowane
bezpośrednio w usuwanie ROS (dysmutazy ponadtlenkowe, katalazy, peroksydazy), jak
również enzymy biorące udział w reakcjach utleniania i redukcji askorbinianu lub
redukcji glutationu: peroksydaza askorbinianowa (APX, EC 1.11.1.11), reduktaza
monodehydroaskorbinianu (MDHAR, EC 1.6.5.4), reduktaza dehydrosakorbinianu
(DHAR, EC 1.8.5.1), reduktaza gultationowa (GR, EC 1.6.4.2) (Batková i wsp. 2008).
Dysmutaza ponadtlenkowa (SOD, EC 1.15.1.1) jest enzymem działającym w „pierwszej
linii obrony” przed wolnymi rodnikami, która katalizuje dwuetapową reakcję

36
dysmutacji anionorodnika ponadtlenkowego do H2O2. Wyróżnia się trzy rodzaje
dysmutaz ponadtlenkowych: i) cynkowo-miedziowe (CuZn SOD), obecne w
cytoplazmie, chloroplastach, peroksysomach; ii) manganowe (MnSOD), zlokalizowane
w mitochondriach i peroksysomach; iii) żelazowe (FeSOD), występujące głównie w
chloroplastach (Małecka i Tomaszewska 2005). H2O2 powstający w wyniku dysmutacji
anionorodnika ponadtlenkowego przy udziale: katalazy (CAT, EC 1.11.1.6), APX i GR
ulega następnie reakcji dysproporcjacji. Znane są trzy formy katalazy o różnej
lokalizacji w komórce: CAT-1, CAT-2 zlokalizowane w peroksysomach,
glioksysomach, cytozolu oraz CAT-3 obecna w mitochondriach, cytozolu (Bartosz
2013). Peroksydaza askorbinianowa jest enzymem biorącym udział w cyklu
sprzężonych reakcji – cyklu Halliwella-Asady, którego głównym celem jest usuwanie
H2O2 (Foyer i Noctor 2005). APX i jej izoformy występują w cytozolu, chloroplastach,
mitochondriach i peroksysomach (Blokhina i wsp. 2003). Reduktaza glutationowa i
DHAR, obecne w chloroplastach i cytoplazmie, to enzymy pośrednio uczestniczące w
dysmutacji H2O2 podczas cyklu Halliwella-Asady. Reduktaza dehydroaskorbinianowa
katalizuje reakcję regeneracji askorbinianu, podczas gdy GR regeneruje glutation
(Batková i wsp. 2008).
1.4.1 Rola ROS w morfogenezie w warunkach in vitro
ROS uczestniczą w procesach związanych ze wzrostem, różnicowaniem i
rozwojem komórek roślinnych, również podczas morfogenezy w kulturach in vitro
(Tian i wsp. 2003, Skrzypek 2012). Efekt działania warunków stresowych na procesy
morfogenetyczne roślin wiąże się z wytwarzaniem ROS, zwłaszcza H2O2 (Kreslavski i
wsp. 2012). Produkcja H2O2 związana jest nie tylko z działaniem stresu, ale związek ten
znany jest również jako cząsteczka sygnalna w procesach wzrostu i rozwoju roślin
(Ślesak i wsp. 2007).
Zaobserwowano iż, H2O2 wpływał na procesy rozwojowe kilku gatunków roślin
w warunkach in vitro (Papadakis i wsp. 2001, Mitović i wsp. 2012). W wyniku
działania H2O2 stwierdzono, iż niewielkie stężenia tej reaktywnej formy tlenu mogą być
zaangażowane w organogenezę pędową mieczyka (Gladiolus sp. L.) (Gupta i Datta
2003). H2O2 działał pozytywnie na namnażanie komórek kalusa i formowanie
primordiów pędowych w kulturach truskawki (Fragaria ×ananassa Duchesne) (Tian i
wsp. 2003). Wysokie stężenie H2O2 stwierdzono w kalusie przypołudnika

37
kryształowego (Masembryanthemum crystallinum L.), wykazującym wysoki potencjał
regeneracyjny (Libik i wsp. 2005). Podwójną rolę H2O2 zaobserwowano w kulturach
winorośli, gdzie obniżał on potencjał regeneracyjny, ale jednocześnie okazał się
niezbędny przy podziałach protoplastów (Papadakis i wsp. 2001).
Badania prowadzone w warunkach in vitro wskazują, że efektem działania ROS
może być zmiana potencjału antyoksydacyjnego tkanek i zaangażowanie systemu
antyoksydacyjnego w regulację morfogenezy roślin (Chen i Ziv 2001). W przypadku
pieprzu czarnego (Piper nigrum L.) potencjał ten ulegał znacznemu podwyższeniu
podczas regeneracji pędów, w porównaniu do tkanek niezróżnicowanych (Nisar i wsp.
2010). Zregenerowane tkanki biedrzeńca anyżu (Pimpinella anisum L.) również
wykazywały wysoki potencjał antyoksydacyjny. W materiale tym stwierdzano
równocześnie podwyższone stężenie fenoli, metabolitów pełniących ochronne funkcje
przed negatywnym działaniem ROS (Andarwulan i Shetty 1999, Mitrović i wsp. 2012).
Aktywność przeciwutleniaczy może ulegać zmianie na różnych etapach regeneracji. W
kulturach in vitro mieczyka, somatyczna embriogeneza była efektywniejsza, gdy
aktywność SOD była wysoka, natomiast CAT i peroksydazy (POD, EC 1.11.1.7) niska
(Gupta i Datta 2003). Wzrost aktywności CAT i POD obserwowano natomiast podczas
organogenezy pędowej w kulturach mieczyka. Wysoki poziom SOD i brak aktywności
CAT oraz POD w eksplantatch na początku prowadzenia kultur Tacitus bellus L. oraz
niska aktywność SOD, a podwyższona CAT i POD podczas organogenezy pędowej,
może świadczyć o tym, iż utrzymanie niskiego poziomu H2O2 jest niezbędne w procesie
kaulogenezy (Mitrović i wsp. 2012).
W pracy dotyczącej kultur pszenicy namnażanie kalusa związane było z
produkcją ROS, wywoływaną przez hormony roślinne dodane do pożywki. Autorzy
sugerują, iż ROS mogą pośredniczyć w drogach sygnalnych pomiędzy egzogennymi
hormonami a indukcją morfogenezy w kulturach in vitro (Sztechyńska-Hebda i wsp.
2007).
1.4.2 Sygnalna rola ROS w morfogenezie w warunkach in vitro
ROS mogą funkcjonować w komórce jako „podwójni agenci”. Inicjując silny
stres oksydacyjny, mogą prowadzić do uszkodzeń, a nawet śmierci organizmów, a
jednocześnie funkcjonują jako cząsteczki sygnalne w molekularnych, biochemicznych i
fizjologicznych odpowiedziach, które mogą przyczynić się do stworzenia

38
mechanizmów adaptacyjnych i poprawić tolerancję organizmu na czynniki stresowe
(Kreslavski i wsp. 2012). ROS (w tym H2O2) są wtórnymi przekaźnikami w kilku
odpowiedziach na działanie hormonów roślinnych: grawitropizmie korzenia,
kiełkowaniu nasion, biosyntezie ligniny, programowanej śmierci komórki, a także w
reakcjach nadwrażliwości i nabywania odporności na stresy abiotyczne i biotyczne
(Sharma i wsp. 2012). Informacje na temat elementów komórkowych szlaków
sygnałowych prowadzących do tolerancji na działanie czynników stresowych u roślin
można odnaleźć m.in. w pracach Ślesak i wsp. 2007, Kreslavski i wsp. 2012, Sharma i
wsp. 2012. Odbierany przez roślinny receptor sygnał związany z produkcją ROS, ulega
transdukcji poprzez wtórne przekaźniki sygnału, nagromadzeniu wapnia, białka G,
fosforylację białek (Batková i wsp. 2008). ROS mogą również modulować działanie
wielu elementów szlaków sygnalnych, jak fosfatazy, kinazy białkowe czy czynniki
transkrypcyjne (Xiong i wsp. 2002).
Percepcja i transdukcja sygnałów wywołanych przez ROS, a także mechanizmy
molekularne związane z ROS, które wpływają na procesy morfogenetyczne w kulturach
in vitro, nie są zbyt dobrze poznane (Verdus i wsp. 1997, Abbasi i wsp. 2011). Verdus i
współpracownicy (1997) sugerowali, że pozytywny efekt bodźców mechanicznych na
proces organogenezy w kulturach lnu może być związany z szybką aktywacją kinazy
MAPK, będącej elementem kaskady kinaz oraz kinazy zależnej od wapnia CDPK.
Obert i współpracownicy (2005) wykazali, że rozwój i różnicowanie komórek związane
jest ze zróżnicowaną ekspresją genów, dlatego metabolizm ROS może odgrywać
decydującą rolę w tych procesach.
1.5 Regulacja procesów wzrostowych i morfogenetycznych przez tlenek
azotu (NO)
Tlenek azotu (NO) jako niewielka, silnie reaktywna cząsteczka, jest
wielofunkcyjnym wtórnym przekaźnikiem w komórkach różnych organizmów
należącym do reaktywnych form azotu (RNS). Do RNS zalicza się także ditlenki azotu
(NO2) i tritlenki azotu (N2O3). W komórkach roślinnych NO odpowiada za regulację
podstawowych mechanizmów związanych z utrzymaniem homeostazy redoks. Reaguje
zarówno z akceptorami, jak i donorami elektronów, i może występować jako rodnik
(NO.), kation (NO
+) oraz anion (NO
-) (Wandehenne i wsp. 2001). Podwójny charakter
tej cząsteczki zależny jest od jej poziomu w komórce. W niskich stężeniach pozytywnie

39
wpływa na wzrost i rozwój, natomiast w wysokich przyczynia się do zaburzeń w
metabolizmie roślin. NO obok ROS i hormonów, odgrywa ważną rolę w regulacji
procesów morfogenetycznych w roślinach. NO może z łatwością migrować do
cytoplazmy, dyfundować przez warstwy lipidowe błon oraz reagować z donorami i
akceptorami elektronów, z jonami metali przejściowych (żelazo, cynk, miedź), a
pośrednio jako RNS z białkami i lipidami (Corpas i wsp. 2011, Gniazdowska i wsp.
2009, Grzegorzewska i wsp. 2009). Mechanizm działania NO związany jest między
innymi z potranslacyjną modyfikacją białek - nitracją i S-nitrozylacją. Nitracja jest
znacznikiem generowanego przez RNS stresu nitrozacyjnego i dotyczy aminokwasów
aromatycznych, a zwłaszcza tyrozyny. S-nitrozylacja natomiast dotyczy głównie
cysteiny. Modyfikacji tej podlegają przede wszystkim elementy szlaków transdukcji
sygnałów np. receptory, czynniki transkrypcyjne (Ciąćka i wsp. 2014 i literatura tam
cytowana). Dane literaturowe wskazują, że NO, jako cząsteczka sygnalna, poza
kinazami MAP, może uruchamiać inne elementy szlaku transdukcji sygnału, tj. cGMP,
cADPR, Ca2+
, doprowadzając do zmiany ekspresji genów i podwyższenia tolerancji na
działanie czynników stresowych (Gill i wsp. 2013, Mur i wsp. 2013).
Do egzogennych źródeł tlenku azotu należą związki stosowane w praktyce
laboratoryjnej m.in. S-nitrozoacetylopenicyloaminy (SNAP), nitroprusydek sodu (SNP),
S-nitrozoglutationu (GSNO) (Gniazdowska i Bogatek 2007). Światło wpływa na
uwalnianie z tych związków m.in. tlenku azotu. Donory różnią się między sobą
zarówno ilością emitowanego NO, ale także szybkością oraz czasem emisji tego gazu.
Wykazano, że największą emisją NO charakteryzuje się SNAP, następnie GSNO, a
najmniejszą SNP. W przypadku SNAP maksymalne wydzielanie NO przypadało na
pierwszą godzinę od naświetlania, dla GSNO – na piątą godzinę, w przypadku SNP na
drugą godzinę od naświetlania. Wykazano również, że czasowy brak światła
zahamował emisję NO z SNP, co dowodzi, że jest to najbardziej światłoczuły spośród
badanych donorów (Floryszak-Wieczorek i wsp. 2006).
SNP (donor NO) w medycynie wykorzystywany jest w nagłych przypadkach
wymagających obniżenia ciśnienia tętniczego krwi (Wang i wsp. 2002). Związek ten
znalazł również zastosowanie w badaniach dotyczących wpływu NO na procesy
wzrostu i rozwoju roślin. Pierwszym produktem rozkładu SNP, poza uwalnianym NO,
jest m.in. anion cyjankowy (CN-) (Meeussen i wsp. 1992, Wnag i wsp. 2002).
Organizmy roślinne posiadają zdolność do uwalniania cyjanowodoru (HCN), związku
chemicznego zbudowanego z wodoru, węgla i azotu, tworzącego z wodą kwas

40
cyjanowodorowy, którego sole zawierające anion CN- określa się mianem cyjanków.
Cyjanowodór odgrywa regulacyjną rolę w kiełkowaniu nasion (usuwa spoczynek i
stymuluje kiełkowanie m.in. zarodków jabłoni), asymilacji azotanów, metabolizmie
cukrów i lipidów oraz w różnych reakcjach roślin na czynniki środowiskowe
(Gniazdowska i wsp. 2010). Hamuje aktywność CAT, SOD, POD – enzymów systemu
antyoksydacyjnego, reduktazy azotanowej (NR, EC 1.7.1), reduktazy azotynowej (NiR,
EC 1.7.7.1) – enzymów uczestniczących w asymilacji azotu (Oracz i wsp. 2009). Pełni
ochronną rolę przed roślinożercami oraz patogenami. Działanie tego związku związane
jest przede wszystkim z hamowaniem aktywności oksydazy cytochromowej w
mitochondrialnym łańcuchu transportu elektonów, a także aktywności wielu enzymów
posiadających jony metali w centrum aktywnym. Posiada zdolność do swobodnego
przemieszczania się z miejsc syntezy do innych części komórki, dzięki temu z łatwością
dyfunduje przez błony. HCN, powstający razem z etylenem, uczestniczy w
aklimatyzacji roślin do abiotycznych i biotycznych warunków stresowych (Siegień i
Bogatek 2006). Źródłem cyjanowodoru w roślinach są głównie glikozydy cyjanogenne
(np., amigdalina, prunazyna, linamaryna, lotaustralina), a w przypadku nasion roślin z
rodziny mydleńcowatych i kasztanowcowatych – cyjanogenne lipidy (Zagrobelny i
wsp. 2004). Cyjanowodór powstawać może również z glioksalanu i hydroksyloaminy,
produktów pośrednich fotooddychania i szlaku redukcji azotanów.
W roślinie synteza NO zachodzi w mitochondriach, peroksysomach,
chloroplastach oraz w cytoplazmie i apoplaście. Szlaki biosyntezy tego gazu obejmują:
drogi redukcyjne – związane z redukcją NO2-, jak i zależne od argininy - oksydacyjne,
enzymatyczne oraz nieenzymatyczne (Frohlich i Durner 2011, Gupta i Igamberdiev
2015). Biosynteza NO na drodze nieenzymatycznej, charakterystyczna dla apoplastu,
zachodzi w kwaśnym pH, gdzie anion NO2- przy udziale reduktantów ulega
przekształceniu do NO. Enzymy odpowiadające za syntezę NO to m.in. reduktaza
azotanowa, katalizująca redukcję NO2- do NO w obecności NADPH, reduktazy azotyn-
tlenek azotu (Ni-NOR), oksydoreduktazy ksantynowej (XOR) (Stohr i wsp. 2001, Yu i
wsp. 2014). W fazie anabolicznej kiełkowania, a także w momencie przebicia okryw
nasiennych przez korzeń zarodkowy oraz w trakcie wzrostu siewki istotną drogą
biosyntezy NO wydaje się być zachodząca przy udziale enzymu o aktywności zbliżonej
do syntazy tlenku azotu (NOS-like). Enzym ten w obecności tlenu i przy udziale
NADPH katalizuje przekształcanie L-argininy do NO i L-cytruliny (Grupta i wsp. 2011,
Mur i wsp. 2013, Krasuska i wsp. 2016). Sugeruje się u organizmów roślinnych

41
występowanie innych, zależnych od argininy, oksydacyjnych dróg syntezy NO
związanych z udziałem poliamid i hydroksyloaminy (Gupta i wsp. 2011). Utrzymanie
równowagi stężenia NO w miejscu, działania zależy od syntezy oraz usuwania tej
cząsteczki. W regulację zawartości NO zaangażowane są m.in. anionorodnik
ponadtlenkowy, jony metali przejściowych oraz podstawowe zmiatacze NO, jak
niesymbiotyczne hemoglobiny (nsHb) i glutation (GSH) (Grzegorzewska i wsp. 2009,
Gniazdowska i wsp. 2009, Hebelstrup i wsp. 2013).
Tlenek azotu uczestniczy w regulacji procesów wzrostowych i rozwojowych
roślin np. wpływając stymulująco na kiełkowanie nasion m.in. szarłatu szorstkiego
(Amaranthus retroflexus L.) (Liu i wsp. 2011), sałaty siewnej (Beligni i Lamattina
2000) czy jabłoni domowej (Malus domestica Borkh.) (Gniazdowska i wsp. 2010),
przyrost świeżej masy kukurydzy (Zea mays L.), rozwój blaszki liściowej grochu
(Pisum sativum L.) czy regulację fotomorfogenezy u rzodkiewnika (Leshem i Haramaty
1996, Hebelstrup i wsp. 2013, Simontacchi i wsp. 2013). NO jako przeciwutleniacz,
regulując zawartość ROS utrzymuje homeostazę redoks, doprowadzając do
podwyższenia odporności roślin na stresy (Grzegorzewska i wsp. 2009). W badaniach
Fan i Liu (2012), rośliny poncyrii (Poncirus trifoliata L.) poddane działaniu
nitroprusydku sodu (SNP) i stresowi suszy, charakteryzowały się niższym stężeniem
ROS, przy podwyższonej aktywności enzymów antyoksydacyjnych, a także lepszą
odpornością na utratę wody. Sposób działania NO w roślinach w warunkach
stresowych, wiąże się ze współdziałaniem tej cząsteczki z hormonami (m.in. ABA,
etylenem, kwasem jasmonowym) i innymi cząsteczkami sygnalnymi (np. H2O2)
(Simontacchi i wsp. 2013, Qiao i wsp. 2014). W warunkach suszy NO, razem z ABA i
H2O2, poprzez kinazy MAP współdziała w zamykaniu aparatów szparkowych, a także
w reakcji na zranienie z JA, czy w regulacji starzenia z kwasem salicylowym (Neill i
wsp. 2003).
Regulacja morfogenezy poprzez NO, skorelowana jest również z hormonami
roślinnymi. Zaobserwowano, że cytokinina prowadzi do szybkiego wydzielania NO w
kulturach komórkowych, co może świadczyć o udziale tego gazu w szlaku transdukcji
sygnałów zależnym od cytokininy (Tun i wsp. 2001). NO wraz z cytokininami,
współdziałając w aktywacji ekspresji genów związanych z regulacją cyklu
komórkowego, doprowadził do proliferacji komórek w kulturach rzodkiewnika (Shen i
wsp. 2013). Wykazano, że NO, podobnie jak auksyny, stymulował wzrost i tworzenie
korzeni siewek ogórka (Cucumis sativus L.) oraz uczestniczył w modulacji wygięcia

42
geotropicznego korzeni siewek soi warzywnej (Glycine max (L.) Merr.) (Pagnussat i
wsp. 2003, Hu i wsp. 2005). Doniesienia związane z interakcją NO i auksyn w
kulturach in vitro dotyczyły głównie ukorzeniania zregenerowanych pędów (Han i wsp.
2009, Kalra i Babbar 2012).
W badaniach nad wpływem NO na organizmy roślinne technikę kultur in vitro
wykorzystuje się w niewielkim stopniu. Doświadczenia te dotyczą głównie efektu
morfogenetycznego obserwowanego w wyniku działania dodanych do pożywki
donorów NO (np. SNP, SNAP). Pozytywny efekt dodanych do pożywki donorów NO
(SNP, SNAP) na organogenezę pędów oraz korzeni, uzyskano w kulturach lnu
zwyczajnego (Kalra i Babbar 2010). W przypadku kultur pochrzynu chińskiego
(Dioscorea opposita Thunb.) wykazano, że zastosowanie SNP, poprzez obniżenie
stężenia H2O2, przyczyniło się do ograniczenia brązowienia eksplantatów pochodzących
z bulw, i równocześnie do zwiększenia proliferacji kalusa oraz regeneracji pędów (Xu i
wsp. 2009). Znane są także nieliczne przykłady pozytywnego wpływu egzogennego NO
na morfogenezę niektórych gatunków roślin w kulturach in vitro w warunkach
stresowych. SNP, będący donorem NO, korzystnie wpływał na regenerację pędów w
kulturach in vitro Cymbidium w warunkach deficytu magnezu (Guha i Rao 2012).

43
2 Założenia i cel pracy
Proces morfogenezy regulowany jest endogennie (na poziomie komórkowym)
oraz egzogennie poprzez czynniki środowiskowe. W kulturach in vitro formowanie
komórek, tkanek czy organów oraz tworzenie dojrzałych organizmów roślinnych,
uzależnione jest nie tylko od predyspozycji danej rośliny do namnażania w warunkach
in vitro, ale również od warunków prowadzenia kultury. Wprowadzenie do kultur
in vitro nowych gatunków roślin, wymaga szczegółowego doboru warunków kultury.
Do kluczowych elementów, które wymagają opracowania należą m.in.: wybór
odpowiedniego eksplantatu, metody dezynfekcji, dobór składu podłoża i warunków
wzrostu w celu efektywnego mnożenia materiału roślinnego. Pomimo szerokiej wiedzy
na temat mikrorozmnażania roślin w warunkach in vitro, istniejąca zmienność
międzyrodzajowa i międzygatunkowa wymusza dobór warunków panujących
w kulturach in vitro indywidualnie dla każdego gatunku i odmiany, a nawet typu
użytkowego, jak w przypadku lnu zwyczajnego (Linum usitatissimum L.), co umożliwia
uzyskanie jednorodnego materiału badawczego. Len już w latach 70-tych XX wieku
wykorzystywany był jako roślina modelowa w badaniach kultur tkankowych (Millam
i wsp. 1992, 2005 i literatura tam cytowana), jednak nadal niewiele wiadomo o
mechanizmach kontrolujących organogenezę tego gatunku.
Warunki klimatyczne w Polsce w okresie wegetacyjnym są bardzo zmienne
i często niekorzystnie wpływające na wzrost, rozwój i plonowanie roślin uprawnych.
Len należy do grupy roślin, która charakteryzuje się szczególną wrażliwością na deficyt
wody. Wysoka temperatura oraz silne nasłonecznienie, w trakcie okresu wegetacyjnego,
nie wpływają korzystnie na wzrost i plonowanie lnu włóknistego. Dlatego też, jednym
z głównych celów hodowli twórczych lnu, jest poprawienie zdolności plonowania
tej rośliny w niesprzyjających warunkach środowiskowych, jak np. susza.
Zainicjowanie organogenezy oraz stymulacja tego procesu w kulturach in vitro,
mają kluczowe znaczenie w mikrorozmnażaniu roślin. Na zwiększenie ilości organów
ma wpływ nie tylko optymalizacja warunków wzrostu w kulturach in vitro, ale również
działanie niekorzystnych czynników środowiskowych, m.in. takich jak: zasolenie,
deficyt wody, wysoka temperatura. Syntetyzowane w takich przypadkach reaktywne
formy tlenu oraz reaktywne formy azotu, poza negatywnym oddziaływaniem, mogą
pozytywnie (funkcja sygnalna) wpływać na rośliny. Kultury in vitro stwarzają dogodne

44
warunki do badań udziału ROS i RNS w regulacji morfogenezy zarówno w warunkach
optymalnych, jak i stresowych.
Głównym celem badań prowadzonych w ramach realizacji rozprawy doktorskiej
było porównanie zdolności morfogenetycznych lnu zwyczajnego (Linum usitatissimum
L.) typu oleistego (L. var brevimulticaulis Vav., odm. Szafir) i typu włóknistego
(L. var. elongatum Vav., odm. Selena), oraz określenie mechanizmów regulacji
organogenezy przez wybrane czynniki w kulturach in vitro obu badanych odmian.
W ramach postawionego problemu badawczego poszukiwano odpowiedzi
na następujące pytania:
1. Jakie są optymalne warunki wzrostu i organogenezy pędowej i korzeniowej lnu
zwyczajnego typu oleistego (odm. Szafir) i włóknistego (odm. Selena)
w kulturach in vitro. Czy istnieją różnice w warunkach wzrostu kultur badanych
odmian?
2. Jak przebiega proces organogenezy (analiza zmian anatomicznych na podstawie
preparatów mikroskopowych) obu badanych odmian lnu zwyczajnego?
3. Czy istnieją różnice w procesie fotosyntezy, oddychania i zawartości barwników
fotosyntetycznych w kulturach in vitro obu badanych odmian lnu zwyczajnego,
rosnących w optymalnych warunkach?
4. Czy kultury in vitro lnu zwyczajnego typu oleistego i włóknistego, rosnące
w optymalnych warunkach, różnią się składem chemicznym i zawartością
metabolitów wtórnych?
5. Czy kultury lnu zwyczajnego typu oleistego i włóknistego, w optymalnych
warunkach wzrostu i organogenezy, różnią się aktywnością/wykorzystaniem
elementów systemu antyoksydacyjnego?
6. Czy istnieją różnice we wzroście i organogenezie w kulturach badanych odmian
w reakcji na stres osmotyczny?
7. Czy stres osmotyczny indukuje w kulturach lnu zwyczajnego odm. Szafir i odm.
Selena stres oksydacyjny?
8. Czy nitroprusydek sodu (SNP) wpływa na wzrost i organogenezę pędową
i korzeniową lnu zwyczajnego w warunkach in vitro? Czy istnieją różnice
we wzroście i organogenezie w kulturach obu typów lnu w reakcji na SNP?
9. Czy egzogenne działanie SNP indukuje w kulturach badanych odmian lnu stres
oksydacyjny?

45
10. Czy egzogenne działanie SNP wpływa na zmiany aktywności systemu
antyoksydacyjnego w kulturach lnu zwyczajnego typu oleistego i włóknistego?

46
3 Materiał i metody
3.1 Materiał doświadczalny
3.1.1 Charakterystyka gatunku badawczego
Badania prowadzono na kulturach in vitro lnu zwyczajnego
(Linum usitatissimum L.) typu oleistego odm. Szafir oraz typu włóknistego odm. Selena
rosnących w warunkach optymalnych i poddanych działaniu czynników, mających
na celu poprawę procesu organogenezy.
Rodzaj Linum L. należący do rodziny Linaceae liczy ponad 200 gatunków,
spośród których jedynie len zwyczajny (Linum usitatissimum L.) ma zastosowanie
praktyczne. Len zwyczajny jest rośliną jednoroczną, kwitnącą od czerwca do lipca.
Roślinę cechują proste, rozgałęzione u góry łodygi o jasnoniebieskich lub białawych
kwiatach. Owocem lnu jest niepękająca, pięciokomorowa torebka nasienna, mieszcząca
około 10 nasion zwanych potocznie siemieniem lnianym. Oleiste formy lnu (Fot. 1)
są krótkopędowe i wielkonasienne, włókniste natomiast długopędowe, drobnonasienne
(Zając i wsp. 2012, Silska i wsp. 2014).
Fot. 1. Pokrój ogólny form lnu zwyczajnego (Linum usitatissimum L.) odmiany Selena
(typ włóknisty lnu - A) oraz Szafir (typ oleisty lnu - B), (Fot. A. Adamczuk).

47
Pochodzący z obszarów śródziemnomorskich len zwyczajny to jedna
z pierwszych roślin udomowionych przez człowieka. Znane są dwie formy lnu: len
włóknisty, z którego pozyskiwany jest surowiec w postaci włókien łykowych
do wyrobu materiału o szerokim zastosowaniu, oraz len oleisty, uprawiany przede
wszystkim dla nasion bogatych w olej. Odmiany włókniste lnu uprawiane są głównie
w klimacie wilgotnym i umiarkowanym w Europie (zwłaszcza we Francji, Hiszpanii)
oraz w Azji (Chiny) i Afryce (Egipt). Len oleisty uprawiany przede wszystkim
w Indiach, Argentynie, południowej Rosji, USA, a szczególnie w Kanadzie (największy
producent i eksporter nasion lnu na świecie), krajach o suchym i umiarkowanym
klimacie (Burbulis i wsp. 2007, Popis i wsp. 2015).
Uprawa lnu w Polsce miała duże znaczenie w okresie po II wojnie światowej
do lat dziewięćdziesiątych XX wieku (Heller 2012). Jeszcze w latach siedemdziesiątych
XX wieku uprawa tej rośliny zajmowała powierzchnię ok. 130 000 ha. Obecnie uprawa
lnu w Polsce nabiera tempa, zwłaszcza ze względu na nowe możliwości wykorzystania
tej rośliny. Z roku na rok następuje zwiększanie powierzchni plantacji lnu, która w roku
2009 wynosiła dla lnu włóknistego 19 000 ha, natomiast w roku 2013 dla lnu oleistego
14 000 ha (Zając i wsp. 2012, Popis i wsp. 2015). W Polsce uprawiane są 4 odmiany lnu
oleistego: Bukoz (najnowsza), Jantarol, Oliwin oraz Szafir. Walory użytkowe siemienia
lnianego powodują coraz większe zapotrzebowanie na nasiona lnu oleistego.
Odpowiedni dobór warunków siedliskowych, wprowadzanie nowych, lepiej
plonujących odmian, pozwoliło w ostatnim dwudziestoleciu na wzrost plonowania tego
typu lnu pomimo zmniejszenia areału upraw (Heller i Wielgusz 2011). Na terenie Polski
polecanych jest osiem odmian lnu włóknistego: Milenium, Fortuna, Minerwa, Ariadna,
Artemida, Selena, Luna, Atena, Temida (Heller 2007). Ten typ użytkowy lnu -
włóknisty najlepiej plonuje w regionach gdzie dominuje wilgotna i chłodna pogoda
czyli w rejonach nadmorskich i podgórskich (Dolny Śląsk).
Len zwyczajny to roślina o wysokim potencjale cyjanogennym. Związki
cyjanogenne poza rolą ochronną przed roślinożercami i atakiem patogenów, pełnią
również ważne funkcje w metabolizmie roślin, m. in. jako źródło azotu w syntezie
aminokwasów i białek, pełnią rolę regulacyjną HCN (Siegień 2007). Potencjał
cyjanogenny lnu zmienia się podczas kiełkowania nasion, rozwoju siewek i wzrostu
roślin (Niedźwiedź-Siegień 1998). Zawartość cyjanoglikozydów wzrasta u tych roślin
na wczesnym etapie rozwoju siewek oraz przed kwitnieniem. Len zawiera dwa
cyjanoglikozydy, należące do monoglikozydów – linamarynę i lotaustralinę. Nasiona

48
większości przebadanych odmian zawierają diglikozydy cyjanogenne – linustatynę
i neolinustatynę, natomiast w niewielkiej ilości monoglikozyd – linamarynę (Oomah
i wsp. 1992, Niedźwiedź-Siegień 1998).
Len zwyczajny stanowi źródło włókien i oleju, mających zastosowanie w wielu
gałęziach przemysłu m.in. w przemyśle włókienniczym, farmaceutycznym,
spożywczym, olejarskim, jako dodatek do pasz, a także w budownictwie, czy przemyśle
meblarskim (Adamczuk i wsp. 2015).
Badania prowadzono z wykorzystaniem 7-dniowych sterylnych siewek,
fragmentów hipokotyli oraz kultur in vitro wyprowadzonych z fragmentów (4-5 mm)
hipokotyli 7-dniowych sterylnych siewek lnu zwyczajnego (Linum usitatissimum L.),
typu włóknistego (odm. Selena) i oleistego (odm. Szafir). Nasiona odmiany Selena
pochodziły z Instytutu Włókien Naturalnych i Roślin Zielarskich w Poznaniu, Zakład
Doświadczalny Sielc Stary (rok zbioru 2010) natomiast odmiany Szafir z Hodowli
Roślin Strzelce Sp. z o.o. (rok zbioru 2009, 2012).
3.2 Sterylizacja i kiełkowanie nasion lnu
3.2.1 Sterylizacja nasion
Sterylizację nasion lnu (4-5 g) przeprowadzano w komorze z laminarnym przepływem
powietrza (typ „ Biohazard” ESCO NC2-4LB) w następujących etapach:
a) Płukanie nasion w 50 ml 70% alkoholu etylowym przez 1 minutę w sterylnej
zlewce na mieszadle magnetycznym,
b) Płukanie nasion w sterylnej wodzie destylowanej przez 1 minutę,
c) Zasadnicza sterylizacja nasion:
- odmiana Szafir – płukanie nasion w 100 ml 0,1% (w/v) roztworu chlorku
rtęciowego (HgCl2) przez 15 minut,
- odmiana Selena - płukanie nasion w 100 ml 0,06% (w/v) roztworu HgCl2
przez 5 minut w sterylnych zlewkach na mieszadle magnetycznym,
d) Czterokrotne płukanie nasion sterylną wodą destylowaną przez: 1 min., 5 min.,
10 min. i 15 min.
3.2.2 Warunki kiełkowania nasion
Wysterylizowane nasiona lnu wykładano równomiernie (około 20-25
sztuk/szalkę) na sterylne podłoże agarowe (0,75% w/v) przy użyciu sterylnej pęsety.

49
Szalki owijano parafilmem i ustawiano do kiełkowania w pomieszczeniu fitotronowym,
gdzie panowały następujące warunki: długość dnia 16h, temperatura dzień/noc-
23oC/18
oC, wilgotność powietrza 60%, natężenie promieniowania
PAR – 50 µmol m-2
s-1
.
3.3 Skład podłoży hodowlanych oraz warunki wzrostu kultur in vitro
3.3.1 Skład i przygotowanie podłoży do wzrostu kultur in vitro
Pożywki do wzrostu kultur przygotowywano z wcześniej sporządzonych
roztworów wyjściowych przechowywanych w temperaturze 4oC (mikro-
i makroelementy) oraz -10oC (witaminy i składniki organiczne) lub gotowych podłoży
wg Murashige i Skoog (MS) oraz wg Gamborga (B5) zawierających makroelementy,
mikroelementy oraz witaminy opisane przez Murashige i Skoog (1962) i Gamborga
i wsp. (1968). Odpowiednie ilości sacharozy i kazeiny (pożywka MS) lub sacharozy
(pożywka B5) dodawano bezpośrednio do pożywki. Do podłoży dodawano hormony
roślinne (auksyny i cytokininy) w odpowiednich stężeniach sprzyjających
organogenezie pędowej lub korzeniowej. Pożywki zestalano agarem (0,75% w/v)
i doprowadzono ich pH do wartości 5,7-5,9 przy pomocy 0,1N HCl i 0,1N NaOH.
Podłoża sterylizowano w autoklawie (ASL 80B) przez 30 minut w temperaturze 121oC
pod ciśnieniem 1 atm.
Przetestowano trzy warianty pożywki, których skład podano w tabeli 1:
a) wg Murashige i Skoog (MS)
b) wg Gamborga (B5)
c) MS (makroelementy) + B5 (mikroelementy i składniki organiczne) (MS+B5)
Do pożywek dodawano: cytokininę (benzyloaminopurynę - BA), auksyny (kwas
naftylo-1-octowy – NAA; kwas 2,4-dichlorofenoksyoctowy - 2,4-D) w proporcjach:
a) BA (1 mg l-¹) + 2,4-D (0,025 mg l
-¹) - w celu umożliwienia organogenezy
pędowej;
b) NAA (1mg l-¹) + BA (0,025 mg l
-¹) – w celu umożliwienia organogenezy
korzeniowej.

50
Tab. 1. Skład pożywek hodowlanych
Pożywki
Składniki
Murashige i Skoog –
stężenie w pożywce
(mg l-¹)
MS
Gamborga
– stężenie w pożywce
(mg l-¹)
B5
Murashige i Skoog +
Gamborga – stężenie w
pożywce (mg l-¹)
MS + B5
Makroelementy
NH4NO3 1650 - 1650
KNO3 1900 2500 1900
CaCl2x2H2O 440 113 440
MgSO4x7H2O 370 250 370
KH2PO4 170 - 170
(NH4)2SO4 - 134 -
NaH2PO4xH2O - 130,4 -
Mikroelementy
KJ 0,83 0,75 0,75
H3BO3 6,2 3,0 3,0
MnSO4x4H2O 22,3 - -
MnSO4xH2O - 10 10
ZnSO4x7H2O 8,6 2,0 2,0
Na2MoO4x2H2O 0,25 0,25 0,25
CuSO4x5H2O 0,025 0,025 0,025
CoCl2x6H2O 0,025 0,025 0,025
Na2xEDTA 37,3 37,3 37,3
FeSO4x7H2O 27,8 27,8 27,8
Składniki organiczne
M-inozytol 100 100 100
Kwas nikotynowy 0,5 1,0 1,0
Pirydoksyna 0,5 1,0 1,0
Tiamina 0,1 10 10
Glicyna 2,0 - -
Cukier
Sacharoza 30000 20000 20000
Białko
Kazeina 1000 - -

51
3.3.2 Badanie oddziaływania wybranych cytokinin i auksyn na proces
organogenezy
Warianty pożywek opisane w podrozdziale 3.3.1. wzbogacono o wybrane
cytokininy i auksyny. Do każdej dodawano hormony sprzyjające:
a) Organogenezie pędowej – dodawano kolejno wybrane cytokininy oraz auksynę
2,4-D w stężeniach:
BA (1mg l-¹) + 2,4-D (0,025 mg l
-¹)
Kinetynę (KIN) (1mg l-¹) + 2,4-D (0,025 mg l
-¹)
Tidiazuron (TDZ) (1mg l-¹) + 2,4-D (0,025 mg l
-¹)
b) Organogenezie korzeniowej – dodawano kolejno wybrane auksyny
oraz cytokininę BA w stężeniach:
2,4-D (1mg l-1
) + BA (0,025mg l-1
)
NAA (1mg l-1
) + BA (0,025 mg l-1
)
Kwas indolilo-3-masłowy (IBA) (1mg l-1
+ BA (0,025 mg l-1
)
3.3.3 Badanie wzajemnych stężeń cytokininy i auksyny na efektywność procesu
organogenezy
Wybrane na podstawie doświadczenia opisanego w podrozdziale 3.3.1. pożywki
odpowiednie do wzrostu i rozwoju kultur odm. Szafir oraz odm. Selena wzbogacono
o różne warianty stężeń wybranych hormonów (podrozdział 3.3.2.) w celu:
a) Obserwacji najefektywniejszej organogenezy pędowej – dodawano cytokininę
BA i auksynę 2,4-D w takiej ilości, aby stosunek stężeń każdego z tych
hormonów w pożywce odpowiadał wartościom przedstawionym w tabeli 2,
b) Obserwacji najefektywniejszej organogenezy korzeniowej – dodawano auksynę
NAA i cytokininę BA w takiej ilości, aby stosunek stężeń każdego z tych
hormonów w pożywce odpowiadał wartościom przedstawionym w tabeli 3.

52
Tab. 2. Wzajemne stężenia cytokininy BA i auksyny 2,4-D w poszczególnych
wariantach pożywki
Wariant pożywki BA [mg l-1
] 2,4-D [mg l-1
] 2,4-D : BA
1 1,0 0,0 0 : 1
2 1,0 0,025 1 : 40
3 1,0 0,05 1 : 20
4 1,0 0,1 1 : 10
5 1,0 0,2 1 : 5
6 1,0 0,5 1: 2
7 1,0 0,75 1 : 1,33
8 1,0 1,0 1 : 1
Tab. 3. Wzajemne stężenia auksyny NAA i cytokininy BA w poszczególnych
wariantach pożywki
Wariant pożywki NAA [mg l-1
] BA [mg l-1
] BA : NAA
1 1,0 0,0 0 : 1
2 1,0 0,025 1 : 40
3 1,0 0,05 1 : 20
4 1,0 0,1 1 : 10
5 1,0 0,2 1 : 5
6 1,0 0,5 1 : 2
7 1,0 0,75 1 : 1,33
8 1,0 1,0 1 : 1
3.3.4 Warunki wzrostu eksplantatów
Eksplantaty hipokotylowe (4-5 mm fragmenty), pochodzące ze sterylnych 7-
dniowych siewek lnu wykładano w komorze z laminarnym przepływem powietrza na
określone pożywki zestalone agarem (0,75% (w/v); 10 sztuk/szalka). Szalki z
eksplantatami zabezpieczano parafilmem i ustawiano do wzrostu na 28 dni w
pomieszczeniu fitotronowym, gdzie panowały warunki opisane w podrozdziale 3.2.2.
3.4 Badanie wpływu stresu osmotycznego na proces organogenezy
Pożywki z dodatkiem hormonów sprzyjających organogenezie pędowej
i korzeniowej lnu odm. Szafir i Selena (opis w p. 3.3.1.-3.3.3.) modyfikowano dodając
cukier w ilości (zmodyfikowana metoda wg Haq i wsp. 2009):
a) Pożywka MS:
MS + sacharoza 30000 mg l-1
pożywki – kontrola (K)

53
MS + sacharoza 2x 30000 mg l-1
pożywki – pierwszy wariant stresu (S I)
MS + sacharoza 3x 30000 mg l-1
pożywki– drugi wariant stresu (S II)
b) Pożywka MS:
MS + sorbitol 15000 mg l-1
+ maltoza 15000 mg l-1
pożywki – kontrola
(K)
MS+ sorbitol 2x 15000 mg l-1
+ maltoza 2x 15000 mg l-1
pożywki –
pierwszy wariant stresu (S I)
c) Pożywka B5:
B5 + sacharoza 20000 mg l-1
pożywki – kontrola (K)
B5 + sacharoza 2x 20000 mg l-1
pożywki – pierwszy wariant stresu (S I)
B5 + sacharoza 3x 20000 mg l-1
pożywki – drugi wariant stresu (S II)
Zastosowano różne warianty wzrostu kultur na pożywkach zawierających
zwiększoną zawartość cukrów. Warianty te podano w tabeli 4.
Tab. 4. Warunki wzrostu kultur in vitro lnu zwyczajnego na pożywkach ze zwiększoną
zawartością cukrów
Odmiana Organogeneza Warianty pożywki Warianty wzrostu kultury
Szafir
pędowa
SI
K (7 dni)+ S (7 dni) + K (14 dni)
K (5 dni) + S (5dni) + K (18 dni)
SII
K (7 dni)+ S (7 dni) + K (14 dni)
K (5 dni) + S (5dni) + K (18 dni)
korzeniowa SII
K (7 dni)+ S (7 dni) + K (14 dni)
K (5 dni) + S (5dni) + K (18 dni)
Selena
pędowa
SI K (7 dni)+ S (7 dni) + K (14 dni)
SII K (7 dni)+ S (7 dni) + K (14 dni)
korzeniowa
SI K (7 dni)+ S (7 dni) + K (14 dni)
SII K (7 dni)+ S (7 dni) + K (14 dni)
Po przeprowadzonych badaniach wstępnych do dalszych analiz wybrano
pogrubione w tabeli 5 warianty wzrostu kultur na pożywkach zawierających dwukrotne
(S I) i trzykrotne (S II) zwiększenie sacharozy w pożywce.
Warunki wzrostu eksplantatów opisano w podrozdziale 3.3.4.

54
3.5 Badanie wpływu nitroprusydku sodu (SNP) na proces organogenezy
3.5.1 Badanie wpływu SNP dodanego bezpośrednio do pożywki na organogenezę
Pożywkę z dodatkiem hormonów sprzyjających organogenezie pędowej lnu
odm. Szafir (opis w p. 3.3.1. - 3.3.3) sterylizowano, a następnie przy pomocy filtrów
strzykawkowych (Ahlstrom, średnica: 33 mm, wielkość porów: 0,2 µm) dodawano SNP
w stężeniach podanych w tabeli 5 (metoda wg Karla i Babbar 2010).
Tab. 5. Stężenia SNP dodanego bezpośrednio do pożywki
Len zwyczajny
(L. usitatissimum) Warianty kultur
Stężenie SNP
[mg l-1
]
odm. Szafir kultury pędowe
2µM
4µM
6µM
25µM
50µM
Warunki wzrostu eksplantatów na określonych wariantach pożywki opisano w
podrozdziale 3.3.4.
3.5.2 Badanie wpływu par wydzielających się z wodnego roztworu SNP na
organogenezę
Eksplantaty hipokotylowe badanych odmian lnu wykładano na pożywkę z
dodatkiem hormonów sprzyjających organogenezie pędowej lub korzeniowej. Rodzaj
pożywki i hormonów, a także ich stężenia odpowiednie dla danej odmiany lnu wybrano
na podstawie wcześniejszych doświadczeń, opisanych w p. 3. 3.1. - 3.3.3.

55
Ryc. 4. Schemat przedstawiający eksplantaty hipokotylowe lnu zwyczajnego
(Linum usitatissimum L.) odmiany Szafir i Selena poddane działaniu par
wydzielających się z wodnego roztworu SNP.
Otwarte szalki z eksplantatami umieszczano w szklanej przeźroczystej komorze,
do której wstawiano również szalkę z odpowiednią pojemnością (Tab. 6) roztworu SNP
(Ryc. 4). Komorę zamykano wieczkiem i szczelnie okręcano parafilmem. Komorę
ustawiano w pomieszczeniu fitotronowym i poddawano naświetleniu (czas ekspozycji
podano w tabeli 6) światłem białym o natężeniu napromienienia 150µmol m-2
s-1
(metoda zmodyfikowana wg Floryszak-Wieczorek i wsp. 2006, Gniazdowska i wsp.
2007). W tych warunkach eksplantaty traktowane były oparami gazów wydzielających
się pod wpływem silnego promieniowania z wodnego roztworu SNP. Kultury kontrolne
poddawano naświetleniu światłem o jednakowym natężeniu i czasie ekspozycji jak
eksplantaty poddane działaniu SNP. Po upływie określonego czasu ekspozycji szalki z
eksplantatami wyjmowano w komorze z laminarnym przepływem powietrza, gdzie
przekładano eksplantaty na sterylną pożywkę (10 sztuk/szalka), a następnie
przenoszono do wzrostu w warunkach opisanych w p. 3.2.2.

56
Tab. 6. Czas i warunki ekspozycji kultur in vitro lnu zwyczajnego na opary gazów
wydzielających się z wodnego roztworu SNP
Len zwyczajny
(L. usitatissimum)
Warianty kultur
Czas ekspozycji
[h]
Stężenie SNP
odm. Szafir
pędowe
korzeniowe
bez hormonów
3
5 ml 5mM
10 ml
20 ml
30 ml
40 ml 5mM; 10mM
24 40 ml
250µM;
500µM; 5mM;
10mM
odm. Selena
pędowe
korzeniowe
bez hormonów
3
5 ml
5mM
10 ml
20 ml
30 ml
3.6 Badanie wpływu c-PTIO (ang. 2-(4-carboxyphenyl)-4,4,5,5-
tetramethylimidazoline-1-oxyl-3-oxide) na proces organogenezy w
kulturach in vitro poddanych działaniu par wydzielających się z
wodnego roztworu SNP
Eksplantaty hipokotylowe badanych odmian lnu wykładano na sterylną bibułę
nasączoną pożywką (odpowiednią dla danej odmiany lnu wybraną na podstawie
wcześniejszych doświadczeń, opisanych w p. 3.3.1. - 3.3.3.) z dodatkiem hormonów
sprzyjających organogenezie pędowej lub korzeniowej oraz 15 ml 0,3 mM c-PTIO
(„wymiatacz” tlenku azotu).

57
Ryc. 5. Schemat przedstawiający eksplantaty hipokotylowe lnu zwyczajnego
(Linum usitatissimum L.) odmiany Szafir i Selena poddane działaniu par
wydzielających się z wodnego roztworu SNP w obecności c-PTIO.
Otwarte szalki z eksplantatami umieszczano w szklanej przeźroczystej komorze,
do której wstawiano szalkę z wybraną na podstawie wcześniejszego doświadczenia
opisanego w p. 3.5.2 pojemnością roztworu 5mM SNP (Ryc. 5). Komorę zamykano
wieczkiem i szczelnie okręcano parafilmem. Komorę ustawiano w pomieszczeniu
fitotronowym i poddawano naświetleniu przez 3h światłem białym o natężeniu
napromienienia 150 µmol m-2
s-1
(metoda zmodyfikowana wg Floryszak-Wieczorek i
wsp. 2006, Gniazdowska i wsp. 2007). W tych warunkach eksplantaty traktowane były
oparami gazów wydzielających się pod wpływem silnego promieniowania z wodnego
roztworu SNP. Po upływie określonego czasu ekspozycji szalki z eksplantatami
wyjmowano w komorze z laminarnym przepływem powietrza, gdzie przekładano
eksplantaty na sterylną pożywkę (10 sztuk/szalka), a następnie przenoszono do wzrostu
w warunkach opisanych w p. 3.2.2.
3.7 Analiza wzrostu materiału doświadczalnego
Obserwacje kultur prowadzono cotygodniowo przez 28 dni dokonując oceny
procesu organogenezy (% reagujących eksplantatów oraz liczby organów
przypadających na eksplantat) licząc reagujące eksplantaty i formujące się organy:

58
% reagujących ekspl. =
x 100%
liczba organów/ekspl. =
gdzie:
ekspl. - eksplantat
Wykonano również pomiary świeżej masy (g) (waga RADWAG E42S)
oraz suchej masy (g). Pojedyncze eksplantaty po zważeniu świeżej masy były suszone
przez 24 h w 105oC (suszarka Memmert UN110) i ponownie ważone w celu oznaczenia
suchej masy. Średnie wartości świeżej i suchej masy stanowiły podstawę do obliczenia
zawartości wody w kulturach:
gH2O g-1
św.m.=
gH2O g-1
s.m. =
gdzie:
św.m. – średnia świeża masa eksplantatów
s.m. – średnia sucha masa eksplantatów
3.8 Analiza mikroskopowa początkowych etapów organogenezy pędowej
i korzeniowej w hipokotylach lnu zwyczajnego
Do zbadania przebiegu najwcześniejszych zmian anatomicznych podczas
organogenezy pędowej i korzeniowej lnu odm. Szafir (typ oleisty) i odm. Selena (typ
włóknisty), przez 7 kolejnych dni wzrostu kultur pędowych i korzeniowych (warunki
wzrostu kultur p. 3.3.1. - 3.3.3.) pobierano po kilka eksplantatów, których źródłem były
7-dniowe sterylne siewki badanych odmian. Materiał roślinny utrwalano przez 24
godziny, początkowo pod zmniejszonym ciśnieniem, w FAA (formalino–aceto-alkohol,
zawierający 37% formaldehyd, 100% kwas octowy lodowaty i 70% alkohol etylowy w
stosunku objętościowym 5:5:90, wg Gerlacha 1972). Po utrwaleniu materiał płukano
trzykrotnie w 70% alkoholu etylowym i w nim przechowywano materiał do czasu
wykonywania skrawków.
Wykonywano preparaty mikroskopowe z przekrojów poprzecznych hipokotyli
według następujących procedur:
1) Preparaty półtrwałe: materiał utrwalony w FAA i przechowywany w 70%
alkoholu etylowym przepłukiwano w H2O destylowanej, następnie zatopiono

59
w 3% agarze i cięto na skrawki o grubości 30 µm z wykorzystaniem mikrotomu
wibracyjnego (Leica VT 1200S). Skrawki barwiono przez kilka minut 0,02%
błękitem metylenowym, przepłukiwano wodą i zamykano w 50% glicerynie.
2) Preparaty trwałe przygotowywano techniką parafinową. Utrwalony materiał
odwodniono dodatkowo w szeregu alkoholowym o rosnących stężeniach
w dwóch zmianach czystego ksylenu, następnie w cieplarce w dwóch zmianach
parafiny o temperaturze topnienia 56-58oC. Po odwodnieniu materiał zatapiano
w parafinie z 5% domieszką wosku pszczelego. Bloczki parafinowe cięto na
mikrotomie rotacyjnym Leica RM 2245 na skrawki o grubości 15 µm. Preparaty
barwiono 1% safraniną w 50% alkoholu etylowym oraz zielenią trwałą w 92%
alkoholu etylowym, następnie odwadniano w izopropanolu i zamykano
w Euparolu (metoda wg Garlacha 1972).
Mikrofotografie z preparatów anatomicznych wykonano w mikroskopie
Olympus BX53 przy użyciu programu cellSens Standard. Dodatkowo wykonano
fotografie pojedynczych eksplantatów (obraz morfologiczny) pochodzących z 10-12-
dniowej kultury pędowej i korzeniowej w mikroskopie stereoskopowym Leica M205
FA z użyciem programu LAS MultiFocus, który umożliwia automatyczną akwizycję
obrazów w osi Z.
3.9 Oznaczanie zawartości barwników fotosyntetycznych
Zawartość barwników fotosyntetycznych (chlorofilu a i b oraz sumy
karotenoidów) oznaczano metodą wg Wellburn (1994). Do badań wykorzystano 7-
dniowe sterylne siewki, fragmenty hipokotyli, kultury pędowe po 5, 14 i 28 dniu
wzrostu (opis warunków wzrostu p. 3.3.1. - 3.3.4.) badanych odmian. 300 mg materiału
roślinnego ucierano z 5 ml 95% alkoholu etylowego i odrobiną piasku morskiego.
Próby wirowano (wirówka MPW 351R) przy 10 000 g przez 10 minut. Absorbancję
ekstraktów odczytywano w spektrofotometrze (CE 2501, Cecil) przy długościach fal:
470 nm, 664,2 nm i 648,6 nm wobec próby ślepej (95% alkohol etylowy). Wszystkie
czynności wykonywano przy słabym oświetleniu, aby zapobiec fotooksydacji
chlorofilu.
Stężenie chlorofilu a i b oraz karotenoidów obliczono wg następujących wzorów:
Chlorofil a (Chla) = 13,36 A 664,2 – 5,19 A 648,6
Chlorofil b (Chlb) = 27,43 A 648,6 – 8,12 A 664,2
Chl a+b = 5,24 A 664,2 + 22,24 A 648,6

60
Karotenoidy = (1000 A470 – 2,13 Chla – 97,64 Chlb) / 209
gdzie
A470, A648,6, A664,2 – absorbancja przy długości fali 470 nm, 648,6 nm, 664,2 nm
Stężenie chlorofilu a i b oraz sumy karotenoidów wyrażano w [µg g-1
św. m.].
3.10 Oznaczanie natężenia fotosyntezy netto i oddychania ciemniowego
Natężenie fotosyntezy netto i oddychania ciemniowego oznaczono
w 7-dniowych sterylnych siewkach, kulturach pędowych po 5, 14 i 28 dniu wzrostu
(opis warunków wzrostu p. 3.3.1. - 3.3.4.) badanych odmian. Do pomiarów natężenia
fotosyntezy i oddychania ciemniowego stosowano analizator CO2
w podczerwieni (LI 6262, Li-COR). Pomiary wykonywano w gazowym układzie
otwartym, umieszczając badany materiał roślinny w kamerze fotosyntetycznej
o pojemności około 200 ml (Busch i wsp. 2013). Szybkość przepływu powietrza
w układzie otwartym wynosiła 0,5 l/min. Pomiarów dokonywano przy natężeniu
napromienienia wynoszącym 150 µmol m-2
s-1
. Temperatura wewnątrz kamery nie
przekraczała 25oC. W układzie wykorzystywano atmosferyczne stężenie CO2 (ok. 400
ppm). Otrzymane wyniki natężenia fotosyntezy netto (PN) oraz oddychania
ciemniowego (DR) wyrażano w [µmol CO2 g-1
św.m. min-1
].
3.11 Izolacja i identyfikacja związków chemicznych przy użyciu
chromatografii gazowej ze spektrometrią mas (GC-MS)
3.11.1 Izolacja lotnych związków organicznych (LZO) w kulturach pędowych lnu
zwyczajnego z wykorzystaniem mikroekstrakcji do fazy stacjonarnej
(SPME)
Do oznaczeń wykorzystano 7-dniowe sterylne siewki i kultury pędowe
po 5-tym, 14-tym i 28-mym dniu wzrostu (opis warunków wzrostu p. 3.3.1. - 3.3.4.)
badanych odmian. Ekstrakcję lotnych związków organicznych (LZO) prowadzono
poprzez umieszczenie włókna ekstrakcyjnego w fazie nadpowierzchniowej (wariant
ang. Headspace-Solid Phase Microextraction, HS-SPME) nad materiałem roślinnym.
Izolację związków prowadzono przy użyciu włókna z fazą stacjonarną CAR/PDMS
Carboxen/Polidimetylosiloksan (CAR/PDMS) o grubości 75 µm. W celu dokonania
izolacji LZO próbkę materiału roślinnego o masie 2g umieszczano w szklanej fiolce
o pojemności 15 ml. Próbkę inkubowano w łaźni wodnej w 40oC przez 10 minut.
Następnie do fazy nadpowierzchniowej nad próbką wprowadzano włókno do SPME.

61
Proces izolacji lotnych związków prowadzono w czasie 30 minut. Przez cały czas
kontaktu włókna z fazą gazową, roztwór utrzymywano w temperaturze 40oC. Po
zakończeniu ekstrakcji włókno przenoszono do dozownika aparatu GC-MS. Włókno
wysuwano w głąb dozownika na głębokość 2 cm. Etap termodesorpcji trwał 30 minut.
Do oznaczeń wykorzystano chromatograf gazowy HP 6890 N (Agilent Technologies)
z elektroniczną kontrolą ciśnienia (EPC) 59864B, wyposażony w detektor MS 5973,
a także kolumnę kapilarną HP-5MS (30m 0,25mm 0,25 m) oraz dozownik typu
split/splitless. Warunki pracy układu chromatograficznego przedstawiono w tabeli 7.
Tab. 7. Warunki pracy układu chromatograficznego (GC/MS)
Parametr Wartość
Temperatura początkowa pieca 38 oC
Izoterma początkowa 2 min
Szybkość wzrostu temperatury 5
oC/min do 100
oC
10 oC/min do 270
oC
Temperatura dozownika 250 oC
Gaz nośny Hel
Objętościowe natężenie przepływu gazu nośnego 1 mL/min
Tryb pracy dozownika splitless
Odcinanie rozpuszczalnika brak
Warunki pracy
detektora
Tryb pracy detektora SCAN
Temperatura źródła jonów 230 oC
Temperatura kwadrupola 150 oC
Temperatura linii transferowej 280 oC
Zakres mas m/z 15 - 300
Czas analizy 80 min
3.11.2 Izolacja związków organicznych w ekstraktach metanolowych kultur
pędowych lnu zwyczajnego
Analizę związków organicznych w ekstraktach metanolowych kultur pędowych
lnu zwyczajnego wykonano wg zmodyfikowanej metody opisanej przez Zhou i wsp.
(2012). Oznaczenia wykonano w 7-dniowych sterylnych siewkach i kulturach
pędowych po 5-tym, 14-tym i 28-mym dniu wzrostu (opis warunków wzrostu p. 3.3.1. -
3.3.4.) badanych odmian. Materiał roślinny suszono w suszarce przez 24 godziny
w temperaturze 50oC. 500 mg wysuszonego materiału homogenizowano w moździerzu,
a następnie dodawano 3 ml mieszaniny metanolu z wodą w stosunku 4:1 (v/v) oraz
60 µl ksylitolu (0,1 mg ml-1
) jako wzorca wewnętrznego. Próby mieszano i inkubowano

62
w łaźni z ultradźwiękami (Elmasonic S80H) w przez 40 minut. Następnie próby
przesączano przez bibułę filtracyjną. Otrzymany supernatant odparowywano do sucha
w przy użyciu wyparki próżniowej (350, Unipan) w temperaturze 40oC. Tak
przygotowany materiał roślinny poddano procesowi derywatyzacji. W tym celu
wysuszony materiał rozpuszczono w 80 µl bezwodnej pirydyny oraz 200 µl N,O -
Bis(trimetylosililo)trifluoroacetamidu (BSTFA) i ogrzewano w temperaturze 70oC przez
30 min. Analizę otrzymanych ekstraktów prowadzono w układzie GC-MS.
3.11.3 Identyfikacja otrzymanych związków
Podczas analizy chromatograficznej uzyskano dwa rodzaje niezależnych
od siebie informacji identyfikacyjnych: dane retencyjne oraz widma mas. Widma mas
zarejestrowane dla poszczególnych związków organicznych porównywano z widmami
mas zgromadzonymi w bazie danych NIST MS. W drugim etapie identyfikacji
obliczono indeksy retencji (IRx) związków z wykorzystaniem wzoru na arytmetyczny
indeks retencji Van den Doola i Kratza (1963), stosowanego w przypadku analiz
prowadzonych z programowanym wzrostem temperatury:
)()1(
)()(100100IR x
ztzt
ztxtz
RR
RR
gdzie:
tR(x) – czas retencji badanego związku, tR(z) i tR(z+1) – czas retencji n-alkanów
zawierających odpowiednio z i z+1 atomów węgla w cząsteczce, pomiędzy którymi
znajduje się związek x.
Wyznaczone wartości IR poszczególnych związków porównywano
z wartościami literaturowymi IR dostępnymi w komputerowych bazach danych (m.in.
baza danych Zakładu Chemii Środowiska UwB). Związek uznano za poprawnie
zidentyfikowany, jeśli otrzymane widmo mas wykazywało zgodność z widmem w bazie
danych, a różnica między wyliczonym a literaturowym indeksem retencji była
nie większa niż 10 jednostek. W przypadkach, gdy nie był dostępny literaturowy
indeks retencji, a widmo mas było jednoznaczne, identyfikację prowadzono tylko
w oparciu o widmo mas.
3.12 Oznaczanie zawartości białka w ekstrakcie enzymatycznym
Zawartość białka oznaczano metodą wg Bradforda (1976) w ekstrakcie
enzymatycznym przygotowanym w sposób opisany w podrozdziale 3.13.1. i 3.15.2.

63
Z każdej próby pobierano 0,1 ml ekstraktu i dodawano 1 ml odczynnika Bradforda.
Próby mieszano i inkubowano przez 15 minut w temperaturze pokojowej. Następnie
mierzono absorbancję przy użyciu spektrofotometru (BECKMAN, DU730) przy
długości fali 595 nm, wobec próby ślepej (0,1 ml buforu ekstrakcyjnego i 1 ml
odczynnika Bradforda).
Stężenie białek oznaczano na podstawie krzywej wzorcowej sporządzonej
dla roztworów albuminy (25-250 g ml-1
) i wyrażono w [mg g-1
św.m.].
3.13 Oznaczanie zawartości metabolitów wtórnych
3.13.1 Oznaczanie zawartości antocyjanów i związków fenolowych
Zawartość wybranych związków fenolowych: fenylopropanoidy, flawonoidy
oraz antocyjany oznaczano metodą wg Kubo i wsp. (1999). 500 mg tkanki
homogenizowano z 2 ml 100mM buforu fosforanowego o pH 7,8 zawierającego 1mM
askorbinian. Homogenat przenoszono do probówek wirówkowych i wirowano
w temperaturze 4oC przy 22 000 g przez 30 minut. Następnie oznaczano absorbancję
w nierozcieńczonym ekstrakcie za pomocą spektrofotometru (BECKMAN) przy fali
o długości 600 nm (antocyjany). Po dziesięciokrotnym rozcieńczeniu mierzono
absorbancję przy długości fali 320 nm (związki fenolowe: fenylopropanoidy
+ flawonoidy).
Oznaczenia wykonano w 7-dniowych sterylnych siewkach, kulturach pędowych
i korzeniowych po 5, 14 i 28 dniu wzrostu (opis warunków wzrostu p. 3.3.1. - 3.3.4.)
badanych odmian.
Wyniki przedstawiono jako ilość jednostek absorbancji (U) na 1 mg białka.
1 U – ilość białka w ekstrakcie, wykazująca absorbancję (A)= 1, przy długości fali λ=
320 nm/ 600 nm w szklanej kuwecie o przekroju 1 cm.
3.13.2 Oznaczanie zawartości związków polifenolowych i tanin
Zawartość całkowita polifenoli i tanin oznaczono spektrofotometrycznie
wg metody opisanej przez Makkar i wsp. (1995) oraz Żebrowskiego (2009) przy użyciu
odczynnika Folin-Ciocalteau. Materiał roślinny suszono w suszarce przez 24 godziny
w temperaturze 50oC. 150-200 mg wysuszonego materiału homogenizowano
w moździerzu, następnie dodawano 3 ml 70% acetonu. Próby przenoszono
do probówek wirówkowych i inkubowano w ciemności przez 1 godzinę w temperaturze

64
pokojowej. Następnie próby wirowano w temperaturze 4oC przez 15 minut przy 20 000
g. Zebrany supernatat przetrzymywano w łaźni lodowej i wykorzystano do oznaczenia
zawartości polifenoli i tanin.
W celu oznaczenia całkowitej zawartości polifenoli (Ctot) do 0,1 ml
odwirowanego ekstraktu dodawano 2 ml 2% węglanu sodu (Na2CO3). Po upływie
2 minut dodawano 0,1 ml odczynnika Folin-Ciocalteu, rozcieńczonego uprzednio
H2O destylowaną w stosunku 1:1. Próby pozostawiono w ciemności, w temperaturze
pokojowej na 30 minut. Próba zerowa zamiast ekstraktu zawierała 0,1 ml 70% acetonu.
Następnie mierzono absorbancję przy długości fali 750 nm. Zawartość polifenoli
odczytano wg krzywej wzorcowej sporządzonej dla roztworu kwasu taninowego w
zakresie stężeń 0 – 16 µg/ml. Zawartość polifenoli przedstawiono w [mg g-1
s. m.].
W celu określenia zawartości tanin wykonano oznaczenie stężenia fenoli
niezwiązanych z poliwinylopolipirolidonem (PVPP). Do probówki dodano 0,1 g PVPP,
1 ml H2O destylowanej oraz 1 ml ekstraktu. Próby mieszano i inkubowano 15 minut
w temperaturze 4oC. Następnie wirowano w temperaturze 4
oC przez 15 minut przy
20 000 g. W zebranym ekstrakcie oznaczono zawartość niezwiązanych z PVPP
polifenoli (CPVPP) według procedury opisanej dla oznaczenia całkowitej zawartości
polifenoli (Ctot). Absorbancję zmierzono przydługości fali 725 nm.
Oznaczenia wykonano dla wariantów doświadczalnych wymienionych w p. 3.13.1.
Zawartość tanin (CT) obliczono ze wzoru:
Ct= Ctot - CPVPP
Ct – stężenie tanin
Ctot – całkowite stężenie polifenoli
CPVPP – taniny nie związane z PVPP
Zawartość tanin wyrażono w [mg g-1
s. m.].
3.14 Oznaczenia parametrów stresu oksydacyjnego
3.14.1 Oznaczanie zawartości H2O2
Pomiar zawartości H2O2 w kulturach dokonano w wariantach badawczych
wybranych na podstawie wcześniejszych doświadczeń (p. 3.4. i 3.5.2.) metodą
wg Velikova i wsp. (2000).
1 g materiału roślinnego rozcierano w zimnym moździerzu (0-4oC) z piaskiem
morskim oraz 1,5 ml 0,1% kwasu trichlorooctowego (TCA). Następnie ekstrakty

65
wirowano przy 15 000 g przez 15 minut w 4oC w wirówce MPW 351R. Do 0,25 ml
supernatantu dodawano 0,25 ml buforu K-fosforanowego (10 mM, pH=7,0) oraz 0,5 ml
1M jodku potasu (KJ). Próba zerowa zawierała 0,5 ml 10 mM buforu K-fosforanowego
o pH=7,0 oraz 0,5 ml 1M KJ. Absorbancję roztworu odczytano przy długości fali 390
nm na spektrofotometrze (BECKMAN). Zawartość H2O2 w próbie odczytywano
z krzywej sporządzonej z użyciem roztworów wzorcowych H2O2 w zakresie
5– 200 nmol ml-1
.
Zawartość H2O2 wyrażono w [nmol g-1
św. m.].
3.14.2 Oznaczanie zawartości produktów peroksydacji lipidów reagujących
z kwasem tiobarbiturowym (TBARS)
Zawartość produktów reakcji z kwasem tiobarbiturowym (TBARS) oznaczano
w wariantach badawczych wybranych na podstawie wcześniejszych doświadczeń
(p. 3.4. i 3.5.2.) wykorzystując zmodyfikowaną metodę wg Singh i Verma (1995).
Do rozdrobnionego materiału roślinnego dodawano: 1 ml 0,5% kwasu tiobarbiturowego
(TBA) w 20% TCA, 1 ml H2O oraz 30µl 2% butylohydroksytoluenu (BHT). Próby
inkubowano w łaźni wodnej (MILL 147) w temperaturze 95oC przez 30 minut, po czym
umieszczano w łaźni lodowej na 10 minut. Następnie próby odwirowywano w wirówce
(MPW 351R) przy 10 000 g przez 10 minut. Absorbancję oznaczano za pomocą
spektrofotometru (BECKMAN) przy długości fal: 532 i 600 nm. Zawartość TBARS
wyrażano jako stężenie aldehydu malonowego (MDA), które obliczano używając
współczynnika ekstynkcji dla kompleksu MDA-TBA (155 mM-1
x cm-1
) według wzoru:
TBARS = (A532 – A600) x V / x L x d x św.m.
A532, A600 – współczynnik ekstynkcji dla długości fal odpowiednio 532 i 600 nm
L – molowy współczynnik ekstynkcji dla TBARS [155 mM-1
x cm-1
]
V- objętość próby [L]
d – grubość warstwy naczynia [1 cm]
św.m. – równowartość materiału roślinnego w 1 ml próby [g]
Zawartość TBARS wyrażono w [nmol g-1
św.m.]

66
3.15 Oznaczanie zdolności przeciwwolnorodnikowej oraz aktywności
enzymów antyoksydacyjnych
3.15.1 Przygotowanie ekstraktu enzymatycznego do oznaczania zdolności
przeciwwolnorodnikowej na zasadzie redukcji stabilnego wolnego rodnika
1,1-difenylo-2-pikrylohydrazylowego (DPPH.)
Ekstrakt enzymatyczny wykorzystany do oznaczenia zdolności
przeciwwolnorodnikowej na zasadzie redukcji stabilnego wolnego rodnika
1,1-difenylo-2-pikrylohydrazylowego (DPPH.) przygotowano z wariantów badawczych
wybranych na podstawie doświadczenia opisanego w p. 3.5.2. wg metody opisanej
przez Amarowicz i wsp. (2004).
Materiał roślinny rozcierano w moździerzu z 95% (w/v) alkoholem etylowym
w stosunku 15:100 (m/v). Próby inkubowano w łaźni z ultradźwiękami (Elmasonic
S80H) w temp. 50oC przez 30 minut. Następnie zawiesinę przesączano przez bibułę
filtracyjną, a pozostałość ekstrahowano jeszcze dwa razy. Połączone supernatanty
odparowywano do sucha przy użyciu wyparki próżniowej (350, Unipan)
w temperaturze 40oC. W celu dalszej analizy, próby przechowywane były w
temperaturze 4oC.
3.15.1.1 Oznaczanie zdolności przeciwwolnorodnikowej na zasadzie redukcji
stabilnego wolnego rodnika 1,1-difenylo-2-pikrylohydrazylowego (DPPH.)
Redukcję rodnika DPPH. pod wpływem ekstraktu enzymatycznego
(przygotowany wg podrozdziału 3.15.1) oznaczano poprzez pomiar intensywności jego
widma metodą elektronowego rezonansu paramagnetycznego (EPR)
wg zmodyfikowanej metody Olchowik-Grabarek i wsp. (2016).
Do 100 µl 500µM metanolowego roztworu DPPH.
dodawano
10 lub 20 µl ekstraktu roślinnego. Po upływie 3 minut rejestrowano pierwszą pochodną
widma DPPH.. Pomiary wykonano na spektrometrze EPR (Adani CMS 8400) przy
parametrach: moc tłumienia: 7dB; pole magnetyczne: 336 mT; zakres przemiatania:
10 mT; czas przemiatania: 50 s; amplituda modulacji: 0,02 mT; wzmocnienie: 6.10
-2;
częstotliwość: 9,41 GHz.
Próbę kontrolną stanowił metanolowy roztwór DPPH. bez dodatku ekstraktu.
Wyniki przedstawiono jako procent redukcji wolnego stabilnego rodnika DPPH..

67
3.15.2 Przygotowanie ekstraktu enzymatycznego do oznaczania aktywności
dysmutazy ponadtlenkowej (SOD) i katalazy (CAT)
Materiał roślinny (warianty badawcze wybrane na podstawie doświadczenia
opisanego w p. 3.5.2.) w ilości 1g homogenizowano w 5 ml 0,2M buforu ekstrakcyjnego
(bufor fosforanowy 0,1 M pH 7,8; 2 mM DTT; 0,1 mM EDTA; 1,25 mM PEG), 0,1 g
PVP i z piaskiem morskim. Następnie odwirowywano w 4˚C przy 11 500g przez
30 minut. Supernatant oczyszczano na wcześniej przygotowanych kolumnach żelowych
(PD 10 Sephadex G-25M, Amorsham Pharmacie Biotech). Otrzymany eluat
przetrzymywano w łaźni lodowej.
3.15.2.1 Oznaczanie aktywności dysmutazy ponadtlenkowej (SOD)
Aktywność SOD (EC 1.15.1.1) oznaczano zmodyfikowaną metodą wg
Giannapolitis i Reis (1977). Mieszanina reakcyjna o objętości 3 ml zawierała: 0,1 M
bufor fosforanowy pH 7,8; 1,3 µM ryboflawinę; 13 mM metioninę; 63 µM błękitu
nitrotetrazoliowego (NBT) oraz ekstrakt enzymatyczny (uzyskany w sposób opisany w
p. 3.15.1.) lub H2O (próby kontrolne). Próby inkubowano przez 15 minut przy
napromieniowaniu 500 µmol m-1
s-1
w temperaturze 25˚C.
W celu oznaczenia aktywności poszczególnych izoform SOD ekstrakt
enzymatyczny inkubowano przez 30 min. w temperaturze 25o
C z 5 mM KCN
i/lub 5 mM H2O2 według metody opisanej przez Corpas i wsp. (1998).
Za jednostkę aktywności SOD przyjmowano ilość enzymu wymaganą
do 50% hamowania redukcji NBT, oznaczonej przy długości fali 560 nm.
3.15.2.2 Oznaczanie aktywności katalazy (CAT)
Aktywność CAT (EC 1.11.1.6) określano jako szybkość zużywania nadtlenku
wodoru (H2O2) w mieszaninie reakcyjnej przy długości fali 240 nm w czasie
100 sekund oznaczano metodą wg Aebi (1984). Mieszanina reakcyjna zawierała: 0,05
M bufor fosforanowy pH= 7,0; 37,5 mM H2O2 oraz ekstrakt enzymatyczny (uzyskany
w sposób opisany w p. 3.15.1.). Aktywność enzymu obliczano wg wzoru:
Aktywność CAT = [(∆DO/∆t) × Vm] / [E × P × Ve]
gdzie:
∆DO/∆t- przyrost gęstości optycznej w czasie (min-1
cm-1
)

68
Vm- objętość mieszaniny reakcyjnej (ml)
E- molekularny współczynnik absorbancji dla H2O2 przy długości fali 240 nm
(40,0 mM-1
cm-1
)
P- zawartość białka (µg ml-1
)
Ve- objętość ekstraktu (ml)
Aktywność CAT wyrażono w [mmol H2O2 min-1
mg-1
białka].
3.16 Analiza statystyczna wyników
Doświadczenia wykonano w minimum 5 powtórzeniach, w co najmniej 3
seriach doświadczalnych. Otrzymane wyniki przedstawiono w postaci średnich i ich
odchyleń standardowych (SD), obliczone z poszczególnych grup danych przy użyciu
pakietu Excel (Office 2007, Microsoft). Wyniki poddano analizie statystycznej,
wykorzystując analizę wariancji ANOVA dla układów czynnikowych. Wnioskowanie
statystyczne przeprowadzono na poziomie istotności p ≤ 0,05. Analizę statystyczną
wykonano przy użyciu programu SPSS Statistics 24.

69
4 Wyniki
4.1 Wzrost kultur oraz organogeneza pędowa w kulturach in vitro lnu
zwyczajnego (Linum usitatissimum L.) w zależności od rodzaju pożywki
Wszystkie spośród przetestowanych pożywek okazały się odpowiednie do powstawania
pędów na eksplantatach hipokotylowych lnu odm. Szafir (typ oleisty) – 100%
reagujących eksplnatatów (Fot. 2). Pędy formowały się już w pierwszym tygodniu
wzrostu kultur (Ryc. 6 A).
W przypadku kultur odm. Selena (typ włóknisty) pędy pojawiły się w drugim tygodniu
wzrostu na pożywce B5 i MS+B5. Efektywniejszą o około 40% organogenezę pędową
obserwowano w 2 i 3 tygodniu wzrostu na podłożu B5, w porównaniu do MS+B5 (Fot.
2, Ryc. 6 B). Najsłabsza kaulogeneza była na pożywce MS (około 15%) - pędy pojawiły
się dopiero w 4 tygodniu wzrostu (Ryc. 6 B).
Fot. 2. Kultury pędowe lnu zwyczajnego odm. Szafir i odm. Selena po 4 tygodniach wzrostu na
pożywkach: MS, B5 oraz MS+B5 z dodatkiem BA (1 mg l-1
) oraz 2,4-D
(0,025 mg l-1
).

70
A)
B)
Ryc. 6. Efektywność organogenezy pędowej w kulturach in vitro lnu zwyczajnego odm. Szafir
(A) i odm. Selena (B) rosnących na pożywkach MS, B5, MS+B5 z dodatkiem BA (1 mg l-1
)
oraz 2,4-D (0,025 mg l-1
). Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Najwyższą liczbą pędów odznaczały się kultury odm. Szafir, rosnące na pożywce MS
(Ryc. 7 A). W 1 i 2 tygodniu wzrostu liczba pędów w kulturach rosnących na podłożu
MS+B5 była niższa w porównaniu z pożywką MS, wynosiła średnio 3 i 5
pędów/eksplantat. W 3 i 4 tygodniu najniższą (średnio 13 pędów/eksplantat) liczbą
pędów odznaczały się kultury rosnące na podłożu B5, w porównaniu do MS (Ryc. 7 A).
Liczba pędów inicjowanych na pojedynczym eksplantacie w kulturach odm. Selena
była podobna na wszystkich testowanych pożywkach. W 4 tygodniu wynosiła średnio 3
pędy/ eksplantat (Ryc. 7 B).
0
20
40
60
80
100
120
1 2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir MS B5 MS+B5
0
20
40
60
80
100
120
2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Selena MS B5 MS+B5
* * *

71
A)
B)
Ryc. 7. Liczba pędów formujących się na eksplantatch hipokotylowych lnu zwyczajnego odm.
Szafir (A) oraz Selena (B) rosnących na pożywkach MS, B5, MS+B5 z dodatkiem BA (1 mg l-1
)
oraz 2,4-D (0,025 mg l-1
). Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Najniższą świeżą i suchą masą, charakteryzowały się eksplantaty pochodzące
z kultur lnu oleistego, rosnące na pożywce B5 (Tab. 8). W przypadku lnu włóknistego
najniższą świeżą i sucha masa odznaczały się eksplantaty z kultur rosnących na podłożu
MS. Zawartość wody przypadająca na miligram świeżej i suchej masy w kulturach obu
badanych odmian była porównywalna we wszystkich wariantach doświadczenia
(Tab. 8).
0
4
8
12
16
20
24
1 2 3 4
Lic
zba
pęd
ów
/ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Szafir MS B5 MS+B5
*
*
* *
0
4
8
12
16
2 3 4
Lic
zba
pęd
ów
/ek
spl.
[sz
t.]
Czas wzrostu [tydzień]
Selena MS B5 MS+B5

72
Tab. 8. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir oraz Selena rosnących na pożywce MS, B5
oraz MS+B5 z dodatkiem BA (1 mg l-1
) oraz 2,4-D (0,025 mg l-1
). Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05
Odmiana Pożywka Świeża masa Sucha masa Zawartość H2O Zawartość H2O
[mg ekspl.-1
] [mg ekspl.-1
] [mg H2O mg-1
św.m.] [mg H2O mg-1
s.m.]
Sza
fir
MS 1035,05±187,02 61,23±10,12 0,94±0,013 16,11±3,22
B5 423,16±63,33* 31,34±3,34* 0,92± 0,015 12,59±2,51
MS + B5 746,54±61,52 43,51±5,09 0,94±0,007 16,51±2,26
Sel
ena
MS 100,34±30,73* 10,09±2,66* 0,89±0,032 9,35±3,99
B5 289,12±42,23 22,31±1,32 0,92±0,011 12,03±1,87
MS + B5 246,42±55,63 17,84±3,23 0,93±0,025 13,94±5,09
4.2 Wzrost kultur oraz organogeneza korzeniowa w kulturach in vitro lnu
zwyczajnego w zależności od rodzaju pożywki
Organogeneza korzeniowa w kulturach lnu odm. Szafir w 2 tygodniu wzrostu
była najwyższa na pożywce B5 i wynosiła ok. 80%. W 3 i 4 tygodniu wzrostu kultur
najefektywniejszą (około 100%) ryzogenezę zaobserwowano na pożywce MS oraz B5
(Ryc. 8 A).
Fot. 3. Kultury korzeniowe lnu zwyczajnego odm. Szafir i odm. Selena po 4 tygodniach
wzrostu na pożywkach: MS, B5 oraz MS+B5 z dodatkiem NAA (1 mg l-1
) oraz BA
(0,025 mg l-1
).

73
Najefektywniejszą organogenezę korzeniową w kulturach odm. Selena zaobserwowano
na podłożu B5 po 4 tygodniach wzrostu wynosiła około 60% (Ryc. 8 B). W tym
przypadku korzenie pojawiły się już w drugim tygodniu wzrostu. Na pożywce MS
korzenie pojawiły się w 3 tygodniu wzrostu. Procent reagujących eksplantatów był o
około 90% niższy w 3 tygodniu, natomiast w 4 tygodniu wzrostu o 30% niż na podłożu
B5. W przypadku pożywki MS + B5 oraz MS nie zaobserwowano formowania korzeni
na eksplantatach (Ryc. 8 B). Kultury takie brązowiały (Fot. 3).
A)
B)
Ryc. 8. Efektywność organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego odm.
Szafir (A) i odm. Selena (B) rosnących na pożywkach MS, B5, MS+B5 z dodatkiem NAA
(1 mg l-1
) oraz BA (0,025 mg l-1
). Wyniki średnie ± SD. *Różnice istotne statystycznie, przy
p≤0,05.
0
20
40
60
80
100
120
2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir MS B5 MS+B5
* *
*
0
20
40
60
80
100
120
2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Selena MS B5 MS+B5
* *

74
Liczba formujących się korzeni na eksplantacie w kulturach odm. Szafir oraz odm.
Selena była najwyższa na pożywce B5 (Ryc. 9). W przypadku kultur odm. Szafir,
rosnących na pożywce B5 zaobserwowano, iż korzenie były bardzo liczne, lecz krótkie,
a eksplantaty ulegały szybszemu starzeniu (Fot. 3), natomiast na eksplantatach
rosnących na pożywce MS i MS + B5 korzenie były liczne i długie (Fot. 3).
A)
B)
Ryc. 9. Liczba korzeni formujących się na eksplantatch hipokotylowych lnu zwyczajnego odm.
Szafir (A) oraz Selena (B) rosnących na pożywkach MS, B5, MS+B5 z dodatkiem NAA
(1 mg l-1
) oraz BA (0,025 mg l-1
). Wyniki średnie ± SD. *Różnice istotne statystycznie, przy
p≤0,05.
Świeża oraz sucha masa, a także zawartość wody przypadająca na miligram
świeżej i suchej masy kultur korzeniowych odm. Szafir, rosnących na wszystkich
testowanych pożywkach, była podobna (Tab. 9). Świeża i sucha masa kultur odm.
Selena rosnących na pożywce MS oraz MS+B5 była istotnie niższa niż kultur
rozwijających się na podłożu B5. Zawartość wody, przypadająca na miligram suchej
0
4
8
12
16
20
24
2 3 4 Lic
zba
ko
rzen
i /
ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Szafir MS B5 MS+B5
* *
* *
* *
0
4
8
12
16
20
24
2 3 4
Lic
zba
ko
rzen
i/ek
spl.
[sz
t.]
Czas wzrostu [tydzień]
Selena MS B5 MS+B5
* *

75
masy w eksplantatach pochodzących z kultur odm. Selena rosnących na pożywce MS,
była najniższa (Tab. 9).
Tab. 9. Świeża i sucha masa eksplantatów z korzeniami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir oraz Selena rosnących na pożywce MS, B5
oraz MS+B5 z dodatkiem NAA (1 mg l-1
) oraz BA (0,025 mg l-1
). Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05
Odmiana Pożywka Świeża masa Sucha masa Zawartość H2O Zawartość H2O
[mg ekspl.-1
] [mg ekspl.-1
] [mg H2O mg-1
św.m.] [mg H2O mg-1
s.m.]
Sza
fir MS 863,36±201,13 59,23±14,25 0,93±0,027 14,41± 3,76
B5 833,12±257,36 49,19±18,02 0,94±0,022 17,76± 4,48
MS + B5 732,06±200,89 41,56±8,32 0,94±0,008 16,64±2,17
Sel
ena
MS 141,48±20,65* 15,36±1,66* 0,89±0,018 8,52±1,58*
B5 544,36±123,34 33,24±6,30 0,94±0,024 15,99±4,71
MS + B5 103,34±23,98* 9,38±2,51* 0,91±0,031 10,50±2,99
4.3 Wpływ wybranych auksyn i cytokinin na proces organogenezy
4.3.1 Oddziaływanie wybranych cytokinin na organogenezę pędową lnu
zwyczajnego (Linum usitatissimum L.)
Organogenezę pędową w kulturach in vitro lnu odm. Szafir (typ oleisty)
obserwowano już w pierwszym tygodniu wzrostu na wszystkich badanych podłożach,
natomiast w czwartym tygodniu w większości wariantów wynosiła 100% (Ryc. 10). W
obecności kinetyny (KIN) w pożywce MS, procent reagujących eksplantatów w 3 i 4
tygodniu wzrostu kultur był niższy niż w przypadku BA i TDZ (Ryc. 10 A). Na podłożu
B5 w obecności tidiazuronu (TDZ) efektywność kaulogenezy była niższa w 1 i 2
tygodniu wzrostu, w porównaniu do BA oraz TDZ (Ryc. 10 B). Organogeneza pędowa
w kulturach rosnących na pożywce MS+B5 była podobna niezależnie od zastosowanej
cytokininy (Ryc. 10 C). Najwyższą liczbą pędów (około 17 sztuk na eksplantat)
odznaczały się kultury lnu oleistego, rosnące w obecności BA na wszystkich
testowanych pożywkach w stosunku do KIN i TDZ (Ryc. 11).

76
A)
B)
C)
Ryc. 10. Efektywność organogenezy pędowej w kulturach in vitro lnu zwyczajnego odm. Szafir
rosnących na pożywkach MS (A), B5 (B), MS+B5 (C) z dodatkiem wybranej cytokininy: BA,
KIN, TDZ (1 mg l-1
) + 2,4-D (0,025 mg l-1
). Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05.
0
20
40
60
80
100
120
1 2 3 4 % r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir BA KIN TDZ MS
* *
0
20
40
60
80
100
120
1 2 3 4 % r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir BA KIN TDZ B5
*
*
0
20
40
60
80
100
120
1 2 3 4 % r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir BA KIN TDZ MS+B5

77
A)
B)
C)
Ryc. 11. Liczba pędów formujących się na eksplantatch hipokotylowych lnu zwyczajnego odm.
Szafir rosnących na pożywkach MS (A), B5 (B), MS+B5 (C) z dodatkiem wybranej cytokininy:
BA, KIN, TDZ (1 mg l-1
) + 2,4-D (0,025 mg l-1
). Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05.
0
4
8
12
16
20
24
1 2 3 4
Lic
zba
pęd
ów
/ ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Szafir BA KIN TDZ MS
* *
*
* *
*
0
4
8
12
16
1 2 3 4
Lic
zba
pęd
ów
/ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Szafir BA KIN TDZ B5
* * * *
* * *
*
0
4
8
12
16
20
1 2 3 4
Lic
zba
pęd
ów
/ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Szafir BA KIN TDZ MS+B5
* * * *
*

78
Najwyższą świeżą masą odznaczały się eksplantaty z pędami pochodzące z
kultur lnu oleistego rosnących w na pożywkach MS i MS+B5 z dodatkiem BA, a
najniższą na podłożach z KIN. Sucha masa eksplantatów rozwijających się na podłożu
MS+B5 z KIN była niższa niż w pozostałych wariantach (Tab. 10). Zawartość wody,
przypadająca na miligram świeżej masy eksplantatów, była podobna niezależnie od
zastosowanej pożywki oraz zawartej cytokininy. Zawartość wody przypadająca na
miligram suchej masy eksplantatów była najniższa na podłożu MS w obecności KIN
oraz na podłożu B5 z dodatkiem TDZ (Tab. 10).
Tab. 10. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody w kulturach in vitro
lnu zwyczajnego odm. Szafir rosnących na pożywce MS, B5 oraz MS+B5 z dodatkiem
wybranej cytokininy: BA, KIN, TDZ (1 mg l-1
) + 2,4-D (0,025 mg l-1
). Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05
Rodzaj hormonu Świeża masa Sucha masa H2O H2O
[mg x ekspl.-1
] [mg x ekspl.-1
] [mg x mg-1
św.m.] [mg x mg-1
s.m.]
MS
BA 754,15±168, 23 46,45±10,12 0,94±0,02 16,33±4,21
KIN 134,23± 21,02* 18,13±8,11 0,80±0,13 7,90±0,91*
TDZ 580,41±136,16 41,56±9,12 0,92±0,02 12,21±3,34
B5
BA 172,20± 27,42 17,17±9,13 0,87±0,09 14,63±4,41
KIN 191,32±35,54 20,23±6,71 0,87±0,07 10,74±1,85
TDZ 149,19±35,41 17,32±6,14 0,88±0,02 7,61±1,32*
MS + B5
BA 644,00±77,11 37,72±3,32 0,94±0,01 16,69±2,99
KIN 146,05±68,24* 12,12±5,77* 0,91±0,04 11,33±5,02
TDZ 580,21±45,18 35,52±6,62 0,94±0,01 16,18±3,65
Kultury pędowe odm. Selena (typ włóknisty lnu) rosnące na podłożu B5 i
MS+B5 w obecności BA oraz KIN, odznaczały się najefektywniejszą organogenezą
(Ryc. 12). W kulturach rosnących na pożywce z dodatkiem TDZ kaulogeneza nie
wystąpiła. Liczba pędów formujących się na eksplantacie była podobna we wszystkich
wariantach doświadczenia, gdzie obserwowano proces organogenezy pędowej
(Ryc. 13).

79
A)
B)
C)
Ryc. 12. Efektywność organogenezy pędowej w kulturach in vitro lnu zwyczajnego odm.
Selena rosnących na pożywkach MS (A), B5 (B), MS+B5 (C) z dodatkiem wybranej
cytokininy: BA, KIN, TDZ (1 mg l-1
) + 2,4-D (0,025 mg l-1
). Wyniki średnie ± SD. *Różnice
istotne statystycznie, przy p≤0,05.
0
20
40
60
80
2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Selena BA KIN TDZ MS
0
20
40
60
80
2 3 4 % r
ea
gu
jący
hc
eksp
lan
tató
w
Czas wzrostu [tydzień]
Selena BA KIN TDZ B5
*
0
20
40
60
80
2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Selena BA KIN TDZ MS+B5

80
A)
B)
C)
Ryc. 13. Liczba pędów formujących się na eksplantatch hipokotylowych lnu zwyczajnego odm.
Selena rosnących na pożywkach MS (A), B5 (B), MS+B5 (C) z dodatkiem wybranej
cytokininy: BA, KIN, TDZ (1 mg l-1
) + 2,4-D (0,025 mg l-1
). Wyniki średnie ± SD. *Różnice
istotne statystycznie, przy p≤0,05.
0
2
4
6
8
2 3 4
Lic
zba
pęd
ów
/ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Selena BA KIN TDZ MS
0
2
4
6
8
2 3 4
Lic
zba
pęd
ów
/ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Selena BA KIN TDZ B5
*
0
2
4
6
8
2 3 4
Lic
zba
pęd
ów
/ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Selena BA KIN TDZ MS+B5
*

81
Najwyższą świeżą masą na pożywce MS odznaczały się eksplantaty rosnące
w obecności TDZ. Świeża masa eksplantatów rozwijających się na podłożu B5 była
podobna niezależnie od zawartej w niej cytokininy (Tab. 11). W przypadku pożywki
MS+B5 najniższą świeżą i suchą masą charakteryzowały się eksplantaty rosnące
w obecności KIN. Zawartość wody, przypadająca na miligram suchej masy
eksplantatów z pędami na pożywce MS+B5 z dodatkiem TDZ, była istotnie najwyższa
w porównaniu do pozostałych wariantów hormonalnych (Tab. 11).
Tab. 11. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody w kulturach in vitro
lnu zwyczajnego odm. Selena rosnących na pożywce MS, B5 oraz MS+B5 w zależności od
wybranej cytokininy BA, KIN, TDZ (1 mg l-1
) + 2,4-D (0,025 mg l-1
). Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05.
Rodzaj hormonu Świeża masa Sucha masa H2O H2O
[mg x ekspl.-1
] [mg x ekspl.-1
] [mg x mg-1
św.m.] [mg x mg-1
s.m.]
MS
BA 100,21±29,82* 10,02±2,11 0,89±0,03 9,34±3,99
KIN 124,13±12,02* 16,23±2,11 0,84±0,12 8,90±2,91
TDZ 280,41±26,16 21,46±9,12 0,92±0,02 12,51±3,12
B5
BA 693,32±231,51 39,17±8,13 0,92±0,03 17,39±7,41
KIN 318,23±115,45 28,23±9,71 0,86±0,11 14,17±4,65
TDZ 747,19±91,41 34,32±3,14 0,94±0,01 21,02±3,59
MS + B5
BA 519,00±129,11 51,72±11,32 0,84±0,16 9,69±1,08*
KIN 257,05±33,24* 22,12±2,77* 0,90±0,01 10,56±1,71*
TDZ 733,21±133,18 41,52±13,62 0,92±0,06 22,56±5,46
4.3.2 Oddziaływanie wybranych auksyn na organogenezę korzeniową lnu
zwyczajnego (Linum usitatissimum L.)
Spośród przetestowanych auksyn najwyższą efektywnością formowania korzeni w
kulturach odm. Szafir charakteryzowała się auksyna NAA (82-97% reagujących
eksplantatów) niezależnie od zastosowanego rodzaju pożywki (Ryc. 14). Na wszystkich
podłożach z dodatkiem 2,4-D organogeneza korzeni była najniższa i wynosiła około
10%. Najwyższą liczbę korzeni na eksplantacie odnotowano na pożywce B5
z dodatkiem auksyny NAA i wynosiła około 16 korzeni/eksplantat w 4 tygodniu
wzrostu (Ryc. 15 B). Najniższą liczbę korzeni inicjowanym na pojedynczym
eksplantatcie zaobserwowano na pożywkach z dodatkiem auksyny 2,4-D (Ryc. 15).

82
A)
B)
C)
Ryc. 14. Efektywność organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego odm.
Szafir rosnących na pożywkach MS (A), B5 (B), MS+B5 (C) z dodatkiem wybranej cytokininy:
2,4-D, NAA, IBA (1 mg l-1
) + BA (0,025 mg l-1
). Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05.
0
20
40
60
80
100
120
2 3 4 % r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir 2,4-D NAA IBA MS
* * * *
* *
0
20
40
60
80
100
120
2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir 2,4-D NAA IBA B5
*
*
*
0
20
40
60
80
100
120
2 3 4 % r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir 2,4-D NAA IBA MS+B5
*
*
*

83
A)
B)
C)
Ryc. 15. Liczba korzeni formujących się na eksplantatch hipokotylowych lnu zwyczajnego
odm. Szafir rosnących na pożywkach MS (A), B5 (B), MS+B5 (C) z dodatkiem wybranej
cytokininy: 2,4-D, NAA, IBA (1 mg l-1
) + BA (0,025 mg l-1
). Wyniki średnie ± SD. *Różnice
istotne statystycznie, przy p≤0,05.
0
4
8
12
16
20
2 3 4
Lic
zba
ko
rzen
i/ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Szafir 2,4-D NAA IBA MS
* * * * * *
0
4
8
12
16
20
2 3 4
Lic
zba
ko
rzen
i/ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Szafir 2,4-D NAA IBA B5
* *
*
*
0
4
8
12
16
20
2 3 4 Lic
zba
ko
rzen
i /
ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Szafir 2,4-D NAA IBA MS+B5
* * * *

84
Świeża masa oraz zawartość wody przypadająca na miligram świeżej i suchej
masy eksplantatów z korzeniami pochodzących z kultur odm. Szafir była podoba we
wszystkich wariantach doświadczenia (Tab. 12). Sucha masa eksplantatów rosnących
na pożywce MS oraz MS+B5 z dodatkiem 2,4-D była istotnie niższa w porównaniu do
eksplantatów rozwijających w obecności NAA (Tab. 12).
Tab. 12. Świeża i sucha masa eksplantatów z korzeniami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir rosnących na pożywce MS, B5 oraz MS+B5
w zależności od wybranej auksyny 2,4-D, NAA, IBA (1 mgl-1
) + BA (0,025 mgl-1
). Wyniki
średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05
Hormony Świeża masa Sucha masa H2O H2O
[mg x ekspl.-1
] [mg x ekspl.-1
] [mg x mg-1
św.m.] [mg x mg-1
s.m.]
MS
2,4-D 126,36±30,23 13,56±2,21* 0,89±0,03 8,71±2,99
NAA 263,31±115,51 25,23±5,56 0,88±0,08 10,50±3,08
IBA 94,20±50,23 12,89±6,62 0,85±0,07 8,13±3,57
B5
2,4-D 115,54±57,45 13,32±5,88 0,87±0,07 10,23±0,77
NAA 179,47±42,42 17,47±3,62 0,90±0,02 9,88±2,93
IBA 110,68±41,11 12,55±5,12 0,86±0,12 12,35±1,39
MS + B5
2,4-D 172,23±37,74 15,57±3,17* 0,91±0,02 10,51±3,08
NAA 264,49± 89,23 25,45±1,71 0,89±0,04 9,73±2,95
IBA 189,12±64,42 16,64±5,35 0,90±0,05 11,23±3,70
Organogenezę korzeniową w kulturach lnu włóknistego zaobserwowano jedynie
na pożywce MS oraz B5 (Ryc. 16). Efektywniejszą ryzogenezą (około 60% reagujących
eksplantatów) oraz wcześniejszym pojawieniem się organów (w 2 tygodniu wzrostu),
charakteryzowały się kultury rosnące na pożywce B5 z dodatkiem NAA (Ryc. 16 B).
Najwyższą liczbą korzeni (około 18 korzeni/eksplantat) odznaczały się kultury, rosnące
na podłożu B5 w obecności auksyny NAA (Ryc. 17).

85
A)
B)
Ryc. 16. Efektywność organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego odm.
Selena rosnących na pożywkach MS (A), B5 (B) z dodatkiem wybranej cytokininy: 2,4-D,
NAA, IBA (1 mg l-1
) + BA (0,025 mg l-1
). Wyniki średnie ± SD. *Różnice istotne statystycznie,
przy p≤0,05.
0
20
40
60
80
100
3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Selena 2,4-D NAA IBA MS
0
20
40
60
80
100
2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Selena 2,4-D NAA IBA B5
*
*

86
A)
B)
Ryc. 17. Liczba korzeni formujących się na eksplantatch hipokotylowych lnu zwyczajnego
odm. Selena rosnących na pożywkach MS (A), B5 (B) z dodatkiem wybranej cytokininy: 2,4-D,
NAA, IBA (1 mg l-1
) + BA (0,025 mg l-1
). Wyniki średnie ± SD. *Różnice istotne statystycznie,
przy p≤0,05.
Najwyższą świeżą masą na pożywce MS odznaczały się eksplantaty rosnące w
obecności NAA oraz 2,4-D. Świeża masa eksplantatów, rozwijających się na podłożu
B5 z dodatkiem IBA, była najniższa (Tab. 13). W przypadku pożywki MS najniższą
świeżą masą charakteryzowały się eksplantaty, rosnące w obecności 2,4-D. Zawartość
wody przypadająca na miligram świeżej i suchej masy eksplantatów z korzeniami była
podobna we wszystkich wariantach doświadczenia (Tab. 13).
0
4
8
12
16
3 4
Lic
zba
ko
rzen
i/ e
ksp
l. [
szt]
Czas wzrostu [tydzień]
Selena 2,4-D NAA IBA MS
0
4
8
12
16
20
24
2 3 4
Lic
zba
ko
rzen
i/ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Selena 2,4-D NAA IBA B5
* *

87
Tab. 13. Świeża i sucha masa eksplantatów z korzeniami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Selena rosnących na pożywce MS, B5 oraz MS+B5
w zależności od wybranej auksyny 2,4-D, NAA, IBA (1 mgl-1
) + BA (0,025 mgl-1
). Wyniki
średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Hormony Świeża masa Sucha masa H2O H2O
[mg x ekspl.-1
] [mg x ekspl.-1
] [mg x mg-1
św.m.] [mg x mg-1
s.m.]
MS
2,4-D 103,46±23,32 9,45±2,11* 0,91±0,03 10,50±2,99
NAA 141,19±20,09 15,53±1,36 0,89±0,02 8,52±1,58
IBA 69,89±20,23* 11,79±2,32 0,88±0,03 8,77±2,97
B5
2,4-D 398,88±40,45 32,17±5,77 0,91±0,03 11,89±4,02
NAA 473,27±13,42 30,45±7,32 0,93±0,03 15,5±6,52
IBA 163,51±15,42* 19,14±5,35 0,87±0,02 7,55±1,25
Na podstawie przeprowadzonych doświadczeń związanych z testowaniem
pożywek (p. 4.1-4.2) oraz wybranych hormonów (p. 4.3.1-4.3.2) na efektywność
organogenezy pędowej i korzeniowej w celu wyboru optymalnego składu podłoża oraz
najodpowiedniejszej cytokininy i auksyny do dalszych analiz, wybrano pożywkę MS
dla odm. Szafir (typ oleisty) i pożywkę B5 dla odm. Selena (typ włóknisty) oraz
cytokininę BA oraz auksynę NAA.
4.4 Wpływ wzajemnych stężeń cytokininy i auksyny na efektywność
procesu organogenezy
4.4.1 Oddziaływanie wzajemnych stężeń cytokininy i auksyny na efektywność
organogenezy pędowej
Organogenezę pędową w kulturach lnu odm. Szafir zaobserwowano już w
pierwszym tygodniu wzrostu. Najwyższa efektywność kaulogenezy była w zakresie
stężeń auksyny 2,4-D (0 - 0,2 mg l-1
) i wynosiła 100% w 4 tygodniu wzrostu (Ryc. 18
A, Fot. 4.) W stężeniu 2,4-D (0,5 mg l-1
) była istotnie niższa i wynosiła ok. 80%. W
wyższych stężeniach auksyny (0,75 oraz 1 mg l-1
) w pożywce procent reagujących
eksplantatów był niższy i wynosił odpowiednio ok. 50% - 25% (Ryc. 18 A).
Organogenezę pędową w kulturach odm. Selena zaobserwowano od 2 tygodnia
wzrostu. Najwyższym procentem reagujących eksplantatów (około 90%) w 3 tygodniu
wzrostu, odznaczały się kultury rosnące przy stężeniu auksyny 2,4-D (0,025 mg l-1
)
(Ryc. 18 B, Fot. 5). Przy stężeniu 2,4-D (0,05 mg l-1
) kaulogeneza wynosiła ponad 60%.

88
Przy stężeniach auksyny (0,75; 0,5; 1 mg l-1
) w pożywce organogeneza pędów nie
wystąpiła (Ryc. 18).
Liczba pędów przypadająca na eksplantat w kulturach odm. Szafir była
najwyższa, przy stężeniu auksyny 2,4-D w pożywce od 0 do 0,2 mg l
-1 (Ryc. 19 A).
Najwyższą liczbę pędów przypadającą na eksplantat w kulturach odm. Selena
obserwowano przy stężeniach 2,4-D od 0,05 mg l-1
do 0 mg l -1
w 3 tygodniu wzrostu.
W 4 tygodniu liczba pędów na pojedynczym eksplantacie była podobna we wszystkich
wariantach doświadczenia, gdzie stwierdzono ryzogenezę (Rys.19 B).
Fot. 4. Eksplantaty hipokotylowe lnu odm. Szafir oraz odm. Selena ze zregenerowanymi
pędami w zależności od zmieniających się stężeń auksyny 2,4-D (0-1 mg l-1
) przy stałym
stężeniu cytokininy BA (1mg l-1
) w pożywce (2,4-D:BA).

89
A)
B)
Ryc. 18. Efektywność organogenezy pędowej w kulturach in vitro lnu zwyczajnego odm. Szafir
(A) i odm. Selena (B) w zależności od zmieniających się stężeń auksyny 2,4-D (0-1 mg l-1
) przy
stałym stężeniu cytokininy BA (1 mg l-1
) – (2,4-D : BA). Wyniki średnie ± SD. *Różnice
istotne statystycznie, przy p≤0,05.
0
20
40
60
80
100
120
1 2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir 0:1 1:40 1:20 1:10 1:5 1:2 1:1.33 1:1
0
20
40
60
80
100
120
2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Selena 0:1 1:40 1:20 1:10 1:5 1:2 1:1.33 1:1

90
A)
B)
Ryc. 19. Liczba pędów formujących się na eksplantatach hipokotylowych lnu zwyczajnego
odm. Szafir (A) i odm. Selena (B) w zależności od zmieniających się stężeń auksyny 2,4-D (0-1
mg l-1
) przy stałym stężeniu cytokininy BA (1mg l-1
) – (2,4-D:BA). Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05.
4.4.2 Oddziaływanie wzajemnych stężeń cytokininy i auksyny na efektywność
organogenezy korzeniowej
Organogenezę korzeniową w kulturach lnu oleistego oraz lnu włóknistego
zaobserwowano od drugiego tygodnia wzrostu (Ryc. 20). Najwyższą ryzogenezę w
kulturach odm. Szafir w 4 tygodniu wzrostu, sięgającą około 100%, obserwowano w
stężeniu cytokininy BA w zakresie stężeń (0 – 0,05 mg lˉ1). W zakresie stężeń od 0,5
mg l-1
do 1,0 mg l-1
BA w pożywce, nie stwierdzono pojawienia się korzeni na
eksplantatch (Ryc. 20 A, Fot. 6). W kulturach odm. Selena procent reagujących
eksplantatów był najwyższy (100%) przy braku cytokininy BA w pożywce (Ryc. 20 B).
0
4
8
12
16
20
24
1 2 3 4
Lic
zba
pęd
ów
/ ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Szafir 0:1 1:40 1:20 1:10 1:5 1:2 1:1.33 1:1
0
4
8
12
16
2 3 4
Lic
zba
pęd
ów
/ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Selena 0:1 1:40 1:20 1:10 1:5 1:2 1:1.33 1:1

91
Istotnie niższą organogenezę korzeniową, w porównaniu do kultur rosnących na
podłożu bez dodatku cytokininy, zaobserwowano przy stężeniach BA od 0,025 mg l-1
do 0,1 mg l-1
. W zakresie stężeń od 0,2 mg l-1
do 1,0 mg l-1
cytokininy BA w podłożu
nie stwierdzono ryzogenezy w kulturach odm. Selena (Ryc. 20 B). Najwyższą liczbę
korzeni na eksplantatach pochodzących z siewek lnu odm. Szafir w 4 tygodniu wzrostu,
zaobserwowano na pożywkach z dodatkiem BA w zakresie (0- 0,025 mg l-1
) 4-10
korzeni na eksplantacie (Ryc. 21 A). Liczba korzeni przypadająca na eksplantat w
kulturach odm. Selena po 4 tygodniach wzrostu, była najwyższa (około 17 sztuk na
eksplantat) na pożywce z dodatkiem 0,025 mg l-1
cytokininy BA (Ryc. 21 B).
Fot. 5. Eksplantaty hipokotylowe lnu odm. Szafir oraz odm. Selena ze zregenerowanymi
korzeniami w zależności od zmieniających się stężeń cytokininy BA (0-1mg l-1
) przy stałym
stężeniu auksyny NAA (1 mg l-1
) – (BA:NAA).

92
A)
B)
Ryc. 20. Efektywność organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego odm.
Szafir (A) i odm. Selena (B) w zależności od zmieniających się stężeń cytokininy wzajemnych
proporcji hormonów BA (0-1 mg l-1
) przy stałym stężeniu auksyny NAA (1 mg l-1
) – (BA :
NAA). Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
0
20
40
60
80
100
2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir 0:1 1:40 1:20 1:10 1:5 1:2 1:1.33 1:1
* *
0
20
40
60
80
100
120
2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Selena 0:1 1:40 1:20 1:10 1:5 1:2 1:1.33 1:1

93
A)
B)
Ryc. 21. Liczba korzeni formujących się na eksplantatach hipokotylowych lnu zwyczajnego
odm. Szafir (A) i odm. Selena (B) w zależności od zmieniających się stężeń cytokininy BA (0-
1 mg l-1
) przy stałym stężeniu auksyny NAA (1 mg l-1
) – (BA : NAA). Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05.
Kultury lnu oleistego rosnące na pożywce MS charakteryzowały się efektywną
organogenezą (wysokim % reagujących eksplantatów oraz liczbą organów przypadającą
na pojedynczy eksplantat). Powstające pędy nie wykazywały oznak starzenia, korzenie
były liczne i długie. Eksplantaty pochodzące z kultur odm. Szafir, rosnące na pożywce
MS z dodatkiem BA (1 mg l-1
) + 2,4-D (0,025 mg l-1
), odznaczały się również wysoką
świeżą i suchą masą. Efektywną kaulogenezę i ryzogenezę stwierdzono w kulturach lnu
włóknistego, rosnącego na podłożu B5 z dodatkiem BA (1 mg l-1
) + 2,4-D (0,025 mgl-1
)
– kultury pędowe oraz NAA (1 mg l-1
) + BA (0,025 mg l-1
) – kultury korzeniowe. Na
podstawie przeprowadzonych i opisanych w podrozdziale od 4.1 do 4.4.2 doświadczeń,
do kolejnych analiz wybrano podłoża: MS (dla odm. Szafir) i B5 (dla odm. Selena) z
dodatkiem BA (1 mg l-1
) + 2,4-D (0,025 mg l-1
) - nazywane w dalszej części pracy
0
4
8
12
16
20
24
2 3 4
Lic
zba
ko
rzen
i /e
ksp
l. [
szt]
Czas wzrostu [tydzień]
Szafir 0:1 1:40 1:20 1:10 1:5 1:2 1:1.33 1:1
0
4
8
12
16
20
24
2 3 4
Lic
zba
ko
rzen
i /e
ksp
l. [
szt]
Czas wzrostu [tydzień]
Selena 0:1 1:40 1:20 1:10 1:5 1:2 1:1.33 1:1

94
pożywką pędową oraz MS (dla odm. Szafir) i B5 (dla odm. Selena) z dodatkiem NAA
(1 mg l-1
) + BA (0,025 mg l-1
) – nazywane dalej pożywką korzeniową.
4.5 Organogeneza pędowa i korzeniowa lnu zwyczajnego (Linum
usitatissimum L.) w pierwszym tygodniu wzrostu kultur in vitro
(analiza anatomiczna)
Analiza przekrojów poprzecznych hipokotyli lnu odm. Szafir i Selena z 7
kolejnych dni po wyłożenia eksplanatów na pożywki pędowe i korzeniowe, pokazuje
zmiany anatomiczne zachodzące w początkowym okresie inicjowania organów.
4.5.1 Przebieg procesu organogenezy pędowej w kulturach in vitro lnu
zwyczajnego odm. Szafir
Przekrój poprzeczny przez eksplantat hipokotylowy pochodzący z 7-dniowej
siewki lnu odm Szafir (środkowy fragment hipokotyla o długości ok. 0,5 cm)
przedstawia Fot. 6.0. Hipokotyl okrywa 1-warstwowa epiderma z aparatami
szparkowymi i charakterystycznymi komórkami brodawkowatymi, biegnącymi
pasmami wzdłuż organu. Korę pierwotną wypełnia miękisz asymilacyjny z większą
ilością skrobi na obwodzie i bliżej walca osiowego. Posiada miękiszowy rdzeń i wiązki
łykodrzewne o różnych układach pasm przewodzących w liczbie od 2 do 6, zależnie od
miejsca przekroju hipokotyla. Na zewnątrz od łyka pierwotnego obecne są pojedyncze,
grubościenne komórki włókien.
Po upływie doby od wyłożenia eksplantatów na pożywkę pędową, zaobserwowano
powiększenie się jąderek w komórkach epidermy i miękiszu, wzrost ilości i wielkości
ziaren skrobi na obwodzie hipokotyla i przy walcu osiowym, oraz podziały nielicznych
komórek miękiszu i epidermy (Fot. 6.1). Po dwóch dniach wzrostu kultury lnu oleistego
w całym miękiszu zwiększyła się ilość skrobi, a wiele komórek tej tkanki oraz epidermy
podzieliło się. Podzielone komórki miękiszu utworzyły wyraźne pasma biegnące
promieniście od walca osiowego ku obwodowi organu (Fot. 6.2). Po trzecim dniu
wzrostu stwierdzono wiele komórek miękiszowych podzielonych na wąskie
spłaszczone komórki (Fot. 6.3). Grupy komórek pochodnych epidermy, tworzące
zaczątki centrów merystematycznych (zawiązków pąków przybyszowych), widoczne
były już po trzech, czterech (Fot. 6.4), i pięciu dniach wzrostu kultury pędowej (Fot.
6.5). Po pięciu dniach od wyłożenia eksplantatów na pożywkę, większe centra
merystematyczne zaczęły się uwypuklać na powierzchni eksplantatu (Fot. 6.5 a) Po

95
upływie szóstej doby, w zawiązkach pąków zaczęły się wydłużać zawiązki liści, a pod
nimi różnicować z miękiszu pasma wiązek przewodzących (Fot. 6.6). Po tygodniu
wzrostu kultury, widoczne były centra merystematyczne pędów w różnych fazach
rozwoju oraz wydłużone zawiązki liści osłaniające merystemy wierzchołkowe pędów
(Fot. 6.7).
Po 12 dniach wzrostu kultury pędowej odm. Szafir powierzchnię hipokotyla pokrywały
liczne zawiązki pędów przybyszowych w różnych stadiach rozwoju, a na jego końcach
wykształcił się kalus (Fot. 6.12).
Fot. 6. Organogeneza pędów na eksplantatach hipokotylowych lnu odm. Szafir rosnących na
pożywce pędowej.
(0) Eksplantat - hipokotyl 7-dniowej siewki lnu na przekroju poprzecznym.
(1-7) Przekroje poprzeczne przez hipokotyl po kolejnych dniach (1-7) kultury pędowej.
(12) Hipokotyl z zawiązkami pędów przybyszowych po 12 dniach wzrostu na pożywce pędowej
(obraz stereoskopowy).
Skala dla fotografii: 0, 4, 6, 7a =200 µm; 1, 2, 3, 5, 5a = 20 µm; 6a , 7=50 µm; 12 =1 mm.
3 4 5
6a
00 2
12
0 1 2
5a 6 6a
7 7a 12

96
4.5.2 Przebieg procesu organogenezy pędowej w kulturach in vitro lnu
zwyczajnego odm. Selena
Budowa anatomiczna hipokotyla lnu odm. Selena (Fot. 7.0) okazała się zbliżona
(z wyjątkiem braku zróżnicowanych pojedynczych włókien w sąsiedztwie łyka) do
budowy hipokotyla lnu odm. Szafir (Fot. 6.0). Po pierwszej i drugiej dobie wzrostu
kultur odm. Selena, zmiany zachodzące w eksplantacie były podobne jak u odm. Szafir
(Fot. 6.1; 6.2). Po trzech dniach wzrostu kultury pędowej, komórki na końcach
eksplantatu, podzielone wielokrotnie i w różnych płaszczyznach, utworzyły kalus (Fot.
7.3). Dalej od jego końców niewiele komórek epidermy uległo podziałowi, a w
miękiszu podzielone komórki tworzyły pasma biegnące nieregularnie ku obwodowi.
Podobny obraz był widoczny po 4 dniach wzrostu kultury (Fot. 7.4). Po 5 dniach
wzrostu eksplantatów lnu włóknistego, bliżej uciętego końca hipokotyla w sąsiedztwie
kalusa, obserwowano nieliczne, uwypuklone i silniej barwiące się safraniną grupy
komórek, które przypominały merystematyczne zawiązki pędów (Fot. 7.5), ale na
wierzchołku posiadały aparat szparkowy (Fot. 7.5 a). Podobne struktury, w różnym
stopniu rozwinięte, obserwowano również w eksplantatach pochodzących z kultur po 6-
tym dniu wzrostu (Fot. 7.6 i 7.6 a). Po sześciu dniach od wyłożenia eksplantatów na
pożywkę, na granicy z kalusem widoczne były uwypuklone wzgórki merystematyczne,
ciasno przylegające do siebie, o niejasnym przeznaczeniu. Po siedmiu dniach wzrostu
kultury obserwowano nieliczne, ale typowe, merystemy pąków przybyszowych z 3-4
zawiązkami liści (Fot.7.7 i 7.7 a), wyrastające z bocznej powierzchni eksplantatu, a pod
nimi pasma różnicujących się wiązek przewodzących, połączone z systemem
przewodzącym walca osiowego.
Morfologię 7-dniowego eksplantatu lnu przedstawia Fot. 7.7 b.

97
Fot. 7. Organogeneza pędów na eksplantatach hipokotylowych lnu odm. Selena rosnących na
pożywce pędowej.
(0) Eksplantat - hipokotyl 7-dniowej siewki lnu na przekroju poprzecznym.
(1-7a) Przekroje poprzeczne przez hipokotyl po kolejnych dniach (1-7) kultury pędowej.
(7b) Hipokotyl z zawiązkami pędów przybyszowych po 7 dniach wzrostu na pożywce pędowej
(obraz stereoskopowy).
Skala dla fotografii: 0, 5, 6, 7 =200 µm; 1, 3 = 20 µm; 4, 5a, 6a , 6b, 7a=50 µm; 7b =1 mm.
4.5.3 Przebieg procesu organogenezy korzeniowej w kulturach in vitro lnu
zwyczajnego odm. Szafir
Przebieg organogenezy korzeniowej w kulturach in vitro lnu odm. Szafir w
ciągu pierwszego tygodnia wzrostu na pożywce korzeniowej przedstawia Fot. 8.
Budowa anatomiczna eksplantatu bezpośrednio po pobraniu z hipokotyla 7-dniowej
siewki lnu oleistego (Fot. 8.0) została dokładnie opisana w podrozdziale 4.5.1.
0 1 3
7 7a 7b
6 6a
6b
4 5
5a
0 1 3
3
5a
6b

98
Po upływie pierwszej doby od wyłożenia eksplantatów na pożywkę, w tkance
miękiszowej wzrosła ilość skrobi i zanikły antocyjany w hipodermie (obserwacje
wykonano na świeżych skrawkach). Po dwóch dniach wzrostu kultur (Fot. 8.2) liczne
komórki miękiszowe eksplantatu po jego dolnej stronie (zwróconej do pożywki)
podzieliły się, a stykające się ściany podziałowe utworzyły promieniste pasma biegnące
ku epidermie. Po trzecim dniu wzrostu zaobserwowano podziały w kambium w walcu
osiowym (Fot. 8.3). Miękisz kory pierwotnej eksplantatu był od pierwszego dnia
kultury biegunowo zróżnicowany: komórki po stronie dolnej (stykającej się z
podłożem) zawierały więcej skrobi i podlegały podziałom, komórki po stronie górnej
(nie dotykającej podłoża) nie dzieliły się. Od czwartego dnia wzrostu kultury
korzeniowej odm. Szafir w eksplantacie formowały się zawiązki korzeni
przybyszowych okryte endodermą (Fot. 8.4, 8.5, 8.6, 8.7); często wyrastały one parami
i były skierowane w przeciwne strony (Fot. 8.7 i 8.7 a). Po tygodniu od wyłożenia
eksplantatów na pożywkę komórki epidermy i miękiszu, od strony nie stykającej się z
podłożem, pozostawały prawie niepodzielone, a po stronie przylegającej do pożywki,
wskutek licznych podziałów utworzyły się kompleksy komórkowe, a wśród nich
naczynia siatkowate. Korzenie przybyszowe pozostawały nadal wewnątrz eksplantatu, a
tkanka miękiszowa wokół nich była znacznie rozluźniona (Fot. 8.7). Po tygodniu
wzrostu eksplantatu na pożywce korzeniowej obserwowano miejscami zwarte, silniej
barwiące się, koncentryczne układy komórek z pasmem naczyń wewnątrz,
przypominające centra merystematyczne. Przypuszczalnie mogły to być zawiązki
korzeni formujących się z kalusa (Fot. 8.7 b i 8.7 c).
Fot. 8.11 przedstawia eksplantat z korzeniami na powierzchni i z dużą ilością kalusa na
końcach po jedenastu dniach wzrostu kultury lnu odm. Szafir na pożywce korzeniowej.

99
Fot. 8. Organogeneza korzeni na eksplantatach hipokotylowych lnu odm. Szafir rosnących na
pożywce korzeniowej.
(0) Eksplantat - hipokotyl 7-dniowej siewki lnu na przekroju poprzecznym.
(1-7c) Przekroje poprzeczne przez hipokotyl po kolejnych dniach (1-7) kultury korzeniowej.
(11) Hipokotyl z zawiązkami korzeni przybyszowych po 11 dniach wzrostu na pożywce
korzeniowej (obraz stereoskopowy).
Skala dla fotografii: 0, 7 =200 µm; 2-6, 7a-7c = 50 µm; 11 =1 mm.
Zawiązki korzeni powstające w kalusie, z naczyniami wewnątrz (strzałki).
4.5.4 Przebieg procesu organogenezy korzeniowej w kulturach in vitro lnu
zwyczajnego odm. Selena
Budowa anatomiczna eksplantatów pochodzących z hipokotyli 7- dniowych siewek lnu
włóknistego, została opisana w podrozdziale 4.5.2. Zmiany jakie zaszły w eksplantatch
od ich wyłożenia na pożywkę (Fot. 9.0) przez pierwszy tydzień wzrostu kultury
korzeniowej przedstawia Fot. 9.

100
Po pierwszej dobie wzrostu kultur na pożywce korzeniowej wzrosła w
komórkach eksplantatu ilość skrobi, głównie na obwodzie i wokół walca osiowego (Fot.
9.1). Po dwóch dniach wzrostu kultury obserwowano podzielone komórki miękiszu
przy walcu osiowym (Fot. 9.2), a także niektóre komórki epidermy i miękiszu kory
pierwotnej. Stykające się ściany podziałowe utworzyły ciągi rozchodzące się
promieniście w miękiszu. Po trzeciej dobie od wyłożenia eksplantatów na pożywkę,
przy walcu osiowym widoczne były miejscowo namnożone komórki, ale ich układ nie
przypominał typowego zawiązka korzenia (Fot. 9.3). Dolna (przylegająca do podłoża) i
górna (nie stykająca się z podłożem) część eksplantatu wyraźnie się różniły: komórki
miękiszu od strony podłoża były podzielone wielokrotnie, a te po stronie górnej dzieliły
się w niewielkim stopniu. Po czwartej dobie wzrostu zmiany zachodzące w
eksplantatach były kontynuacją poprzednich (postępowały podziały komórek). Od
piątego dnia wzrostu kultur obserwowano nieliczne, ale typowe, zawiązki korzeni
przybyszowych okryte endodermą (Fot. 9.5). Prawie cały eksplantat (z wyjątkiem jego
górnej części) był wypełniony kulistymi kompleksami komórkowymi, utworzonymi z
komórek, które się wielokrotnie podzieliły w obrębie ściany komórki macierzystej. Po
szóstym i siódmym dniu wzrostu kultur odm. Selena, obserwowano nieliczne zawiązki
korzeni przybyszowych wyrastające nad ksylemem (Fot. 9.7), które występując parami,
były skierowane w dwóch przeciwnych kierunkach i ustawione naprzeciwko siebie
(Fot. 9.7 a). Miękisz w górnej (nie stykającej się z podłożem) części eksplantatu był
rozluźniony, a jego komórki prawie niepodzielone, natomiast w części stykającej się z
pożywką cały miękisz był przekształcony w kompleksy komórek (Fot. 9.7 a). Wewnątrz
niektórych kompleksów widoczne były pasma zróżnicowanego ksylemu (Fot. 9.7 b), ale
znaczenie tych struktur jest niejasne.
Fot. 9.11 przedstawia 11-dniowy eksplantat z kultury korzeniowej lnu odm.
Selena, z silnie rozwiniętym kalusem i kilkoma niewielkim korzeniami na powierzchni.

101
Fot. 9. Organogeneza korzeni na eksplantatach hipokotylowych lnu odm. Selena rosnących na
pożywce korzeniowej.
(0) Eksplantat - hipokotyl 7-dniowej siewki lnu na przekroju poprzecznym.
(1-7b) Przekroje poprzeczne przez hipokotyl po kolejnych dniach (1-7) kultury korzeniowej.
(11) Hipokotyl z zawiązkami korzeni przybyszowych po 11 dniach wzrostu na pożywce
korzeniowej (obraz stereoskopowy).
Skala dla fotografii: 0, 7a =200 µm; 1, 7, 7b = 50 µm; 2,3,5 =20 µm ; 11 =1 mm.
Zawiązek korzenia przybyszowego i kompleksy komórkowe z pasmem ksylemu
(strzałki).
4.6 Zawartość barwników fotosyntetycznych w kulturach pędowych in
vitro lnu zwyczajnego
Nie zaobserwowano istotnych różnic w zawartości chlorofilu a, b sumy tych
barwników oraz karotenoidów w 7-dniowych sterylnych siewkach obu badanych
odmian lnu (Ryc. 22 A-C, 23). Natomiast fragmenty hipokotyli pochodzące z siewek
odmiany Selena odznaczały się wyższą o około 30% zawartością barwników
fotosyntetycznych w porównaniu do odmiany Szafir (czas wzrostu 0). Wraz ze
wzrostem kultur pędowych odmiany Selena zawartość barwników obniżała się w
porównaniu do kultur odmiany Szafir (Ryc. 22 A-C, 23). Wszystkie warianty
doświadczalne odznaczały się wyższą zawartością chlorofilu a spośród badanych
barwników fotosyntetycznych (Ryc. 22 A).

102
A)
B)
C)
Ryc. 22. Zawartość chlorofilu a (A), chlorofilu b (B), sumy chlorofilu a+b (C) w 7-dniowych
siewkach (Siewki), hipokotylach (czas wzrostu 0) oraz w kulturach in vitro lnu zwyczajnego,
rosnących na pożywce pędowej. Wartości średnie ±SD. * Różnice istotne statystycznie, przy
p≤0,05.
(Siewki – 7-dniowe sterylne siewki lnu stanowiące źródło eksplantatów, 5, 14, 28 – kultury in
vitro po 5, 14, 28 dniach wzrostu)
0
200
400
600
800
1000
Siewki 0 5 14 28
Za
wa
rto
ść c
hlo
rofi
lu a
[µ
g g
-1
św.m
.]
Czas wzrostu [dni]
Szafir Selena
* * * *
0
200
400
600
800
1000
Siewki 0 5 14 28
Za
wa
rto
ść c
hlo
rofi
lu b
[µ
g g
-1
św.m
.]
Czas wzrostu [dni]
Szafir Selena
* * *
0
200
400
600
800
1000
Siewki 0 5 14 28 Za
wa
rto
ść c
hlo
rofi
lu a
+b
[µ
g g
-1 ś
w.m
.]
Czas wzrostu [dni]
Szafir Selena
* * * *

103
Ryc. 23. Zawartość karotenoidów w 7-dniowych siewkach (Siewki), hipokotylach (czas
wzrostu 0) oraz w kulturach in vitro lnu zwyczajnego, rosnących na pożywce pędowej.
Wartości średnie ±SD. * Różnice istotne statystycznie, przy p≤0,05.
Szczegółowy opis wariantów doświadczalnych – w opisie Ryc. 22.
4.7 Intensywność fotosyntezy netto (PN) i oddychania ciemniowego (DR)
kultur pędowych in vitro lnu zwyczajnego
Najwyższą intensywnością fotosyntezy charakteryzowały się 7- dniowe siewki
lnu odm. Selena. Kultury odm. Szafir w 5-tym dniu wzrostu charakteryzowały się
wyższą o około 40% intensywnością fotosyntezy, w porównaniu do kultur odm. Selena
(Ryc. 24 A). W trakcie wzrostu kultur pędowych badanych odmian nastąpiło obniżenie
ich aktywności fotosyntetycznej (Ryc. 24 A).
We wszystkich badanych wariantach doświadczalnych nie odnotowano istotnej różnicy
w intensywności oddychania (Ryc. 24 B).
0
200
400
Siewki 0 5 14 28
Za
wa
rto
ść k
aro
ten
oid
ów
[µ
g g
-1 ś
w.m
.]
Czas wzrostu [dni]
Szafir Selena
* * * *

104
A)
B)
Ryc. 24. Intensywność fotosyntezy netto (A) oraz oddychania ciemniowego (B) w przeliczeniu
na g św.m. 7-dniowych siewek, eksplantatów z kultur in vitro lnu zwyczajnego, rosnących na
pożywce pędowej. Wartości średnie ±SD. * Różnice istotne statystycznie, przy p≤0,05.
Szczegółowy opis wariantów doświadczalnych – w opisie Ryc. 22.
4.8 Analiza związków chemicznych przy użyciu chromatografii gazowej ze
spektrometrią mas (GC-MS)
4.8.1 Analiza LZO w kulturach pędowych lnu zwyczajnego z wykorzystaniem
mikroekstrakcji do fazy stacjonarnej (SPME)
Odmiana Selena charakteryzowała się bardziej zróżnicowanym składem
chemicznym emitowanych związków (24 zidentyfikowane związki) w porównaniu do
odmiany Szafir (15 zidentyfikowanych związków). Butan-2-on wykazywał największy
procentowy udział w ogólnej ilości związków emitowanych przez 7-dniowe siewki oraz
0
200
400
600
800
1000
1200
1400
1600
Siewki 5 14 28 PN[µ
mo
l C
O2 m
in-1
g-1
św
.m.]
Czas wzrostu [dni]
Szafir Selena
*
*
0
20
40
60
80
100
120
140
160
Siewki 5 14 28 DR
[µ
mo
l C
O2 m
in-1
g-1
św
.m.]
Czas wzrostu [dni]
Szafir Selena

105
kultury pędowe in vitro odm. Szafir (Tab. 14), n-heksan w przypadku odm. Selena
(Tab. 15). Zawartość tych związków malała znacznie wraz ze wzrostem kultur.
W trakcie wzrostu kultur odm. Szafir zawartość etanolu wzrosła 20-krotnie,
natomiast 2-cyjanopropen, 2-cyjanopropan - 10-krotnie. W kulturach 5-dniowych odm.
Szafir zanotowano ponad 15% udział acetonu, którego zawartość obniżała się w trakcie
wzrostu kultur (Tab. 14). Najwyższą zawartość eteru dietylowego (3,07%) oraz 2-
cyjanobutanu (5,92%) odnotowano w 14 dniu wzrostu kultur odm. Szafir. W trakcie
wzrostu kultur ilość siarczku dimetylu, estru etylowego kwasu 3-hydroksymigdałowego
oraz tetradekanu zwiększała się (Tab. 14).
Wraz ze wzrostem kultur pędowych odm. Selena, procentowy udział etanolu
zwiększył się do 60% wraz ze wzrostem kultur. W siewkach i kulturach 5-dniowych
zawartość acetonu była wyższa niż w kulturach 14 i 28 - dniowych (Tab. 15). Spośród
związków emitowanych przez 7-dniowe siewki najwyższą zawartość odnotowano dla
siarczku dimetylu (1,49%), natomiast w kulturach w 5-tym dniu wzrostu dla n-
heksanolu (1,60%). W kulturach 14-dniowych najwyższą zawartością odznaczały się:
eter dietylowy (7,60%), kwas szczawiowy (2,80%) oraz n-pentadekan (2,07%).
Najwyższą zawartość spośród związków emitowanych przez 28 - dniowe kultury odm.
Selena wykazywały butan-2-on (7,20%) oraz octan etylu (4,70%; Tab. 15).

106
Tab. 14. Związki emitowane przez 7-dniowe siewki oraz kultury pędowe in vitro lnu zwyczajnego odm. Szafir
(Siewki – 7-dniowe sterylne siewki lnu stanowiące źródło eksplantatów, 5, 14, 28 – kultury in vitro po 5, 14, 28 dniach wzrostu)
Lp. Wynik identyfikacji Iexp Ilit Trzy największe
piki m/z
Zawartość [%]
Siewki 5 14 28
1. Etanol < 500 482 31, 45, 29 0,02 0,67 26,75 26,40
2. Aceton 500±1 500 43,58, 15 10,19 15,11 12,97 6,22
3. Eter dietylowy 506±1 504 31, 59, 45 0,58 2,25 3,07 1,57
4. Siarczek dimetylu 517±1 517 62, 47, 45 0,62 - 0,29 4,82
5. Octan metylu 525±1 523 43, 74, 42 - - - 1,78
6. Butan-2-on 599±1 598 43, 72, 29 87,50 70,90 20,27 21,66
7. 2-Cyjanopropen 603±1 611 41, 67, 66 - 3,74 9,87 12,14
8. 2-Cyjanopropan 622±1 626 42, 68, 54 0,17 1,92 10,89 9,85
9. 2-Metylobutanal 659±1 658 41, 57, 29 0,11 - - -
10. Pentan-3-on 699±1 688 57, 29, 86 0,13 - - -
11. 2-Cyjanobutan 723±1 726 55, 54, 27 0,13 0,29 5,92 3,92
12. 2-Metyl-1-butanol 737±1 740 56, 57, 41 0,13 - - -
13. Ester etylowy kwasu 3-
Hydroksymigdałowego 1162±1 - 267, 73, 268 0,07 0,85 1,82 2,43
14. Kwas 2-Metylobursztynowy 1330±1 1330 73, 147, 207 0,36 4,18 7,73 7,83
15. Tetradekan 1401±1 1400 57, 43, 71 - 0,08 0,41 1,36

107
Tab. 15. Związki emitowane przez 7-dniowe siewki oraz kultury pędowe in vitro lnu zwyczajnego odm. Selena
(Siewki – 7-dniowe sterylne siewki lnu stanowiące źródło eksplantatów, 5, 14, 28 – kultury in vitro po 5, 14, 28 dniach wzrostu)
Lp. Wynik identyfikacji Iexp Ilit Trzy największe
piki m/z
Zawartość [%]
Siewki 5 14 28
1. Aldehyd octowy <500 427 44, 29, 15 - - - 1,79
2. Etanol < 500 482 31, 45, 29 - 0,95 3,94 60,08
3. Aceton 500±1 500 43,58, 15 12,37 7,92 10,64 4,53
4. Eter dietylowy 502±1 504 31, 59, 45 1,10 0,73 7,60 1,26
5. Siarczek dimetylu 517±1 517 62, 47, 45 1,49 - - -
6. Butan-2-on 591±1 598 43, 72, 29 - - - 7,20
7. n-Heksan 601±1 600 57, 43, 41 82,46 85,80 65,86 17,75
8. Octan etylu 612±1 613 43, 61, 45 - - 4,70
9. 2-Cyjanopropan 622±1 626 42, 68, 54 0,25 0,16 1,53 -
10. Pentan-2-on 690±1 689 41, 43, 86 - - 0,33 -
11. Pentan-3-on 697±1 688 57, 29, 86 0,64 0,91 1,78 -
12. 3-Hydroxy-butan-2-on, izomer1 709±1 712 45, 43, 88 - - - 0,46
13. 3-Hydroxy-butan-2-on, izomer 2 712±1 712 45, 43, 88 - - - 0,59
14. 2-Cyjanobutan 722±1 726 55, 54, 27 0,08 0,34 1,87 -
15. n-Heksanal 803±1 800 41, 44, 56 - 0,73 - -
16. n-Heksanol 870±1 870 31, 43, 56 - 1,60 - -
17. Ester etylowy kwasu 3-
Hydroksymigdałowego 1161±1 - 267, 73, 268 0,14 - - -

108
18. n-Tridekan 1301±1 1300 57, 43, 71 - - 0,31 -
19. Kwas szczawiowy 1329±1 1333 73, 147, 45 0,93 - 2,80 -
20. n-Tetradekan 1400±1 1400 57, 43, 71 0,15 0,18 0,67 0,24
21. n-Pentadekan 1500±1 1500 57, 43, 71 0,31 0,45 2,07 0,87
22. n-Heksadekan 1600±1 1600 57, 43, 71 - 0,05 0,22 0,11
23. 1-(2-furylo)-3-buten-1,2-diol 1607±1 - - - - 0,24 0,11
24. n-Heptadekan 1700±1 1700 57, 43, 71 0,07 0,18 0,14 0,31

109
4.8.2 Analiza związków organicznych w ekstraktach metanolowych kultur
pędowych lnu zwyczajnego
Największy procentowy udział spośród związków zidentyfikowanych w
ekstraktach pozyskanych z 7-dniowych siewek oraz kultur pędowych lnu odm. Szafir,
stanowiły węglowodany i glukozydy od 43% (kultury 5 i 14 -dniowe) do 78% (siewki
oraz kultury 28 - dniowe) (Ryc. 25 A-D). W ekstraktach pozyskanych z 5 i 14 -
dniowych kultur, zaobserwowano zwiększenie udziału związków należących do grupy
kwasów alifatycznych i glicerydów, aminokwasów oraz heterocyklicznych związków
zawierających azot (Ryc. 25 B i C). Procentowy udział alkoholi polihydroksylowych
wzrastał (od 0,2% - kultury 5 - dniowe do 3% - kultury 28 - dniowe) w ekstraktach
pochodzących z kultur pędowych (Ryc. 25 B-D).
A
B

110
Kwasy alifatyczne i glicerydy Węglowodany i glukozydy
Aminokwasy Alkohole polihydroksylowe
Heterocykliczne związki zawierające azot Diterpeny
Związki aromatyczne Pozostałe
Ryc. 25. Średni procentowy udział związków organicznych zidentyfikowanych w ekstraktach
metanolowych pozyskanych z 7-dniowych siewek (A), 5 (B), 14 (C) i 28 (D) - dniowych kultur
pędowych in vitro lnu zwyczajnego odm. Szafir.
Ekstrakty pozyskane z 7 dniowych siewek oraz z kultur pędowych lnu odm.
Selena, odznaczały się największą ilością węglowodanów i glukozydów (18% - 78%)
(Ryc. 26 A-D). Procentowy udział aminokwasów oraz związków aromatycznych obniża
się w ekstraktach z kultur, w porównaniu do 7-dniowych siewek. Ilość alkoholi
C
D

111
polihydroksylowych oraz kwasów alifatyczny i glicerydów była wyższa (2% i 22%
odpowiednio) w ekstraktach z kultur 5 - dniowych w porównaniu do pozostałych
wariantów doświadczenia (Ryc. 26 A-D).
A
B

112
Kwasy alifatyczne i glicerydy Węglowodany i glukozydy
Aminokwasy Alkohole polihydroksylowe
Heterocykliczne związki zawierające azot Diterpeny
Związki aromatyczne Pozostałe
Ryc. 26. Średni procentowy udział związków organicznych zidentyfikowanych w ekstraktach
metanolowych pozyskanych z 7 - dniowych siewek (A), 5 (B), 14 (C) i 28 (D) - dniowych
kultur pędowych in vitro lnu zwyczajnego odm. Selena.
Szczegółowy wykaz związków organicznych zidentyfikowanych w ekstraktach
metanolowych, pochodzących z 7 - dniowych siewek oraz kultur pędowych lnu odm.
Szafir i odm. Selena, znajduje się w aneksie (Tab. I-II).
C
D

113
4.9 Zawartość metabolitów wtórnych w kulturach in vitro lnu zwyczajnego
(Linum usitatissimum L.) odm. Szafir i odm. Selena
Zakładaniu i wzrostowi roślinnych kultur in vitro towarzyszy szereg czynników
stresowych, które mogą wpływać pozytywnie, bądź negatywnie na organogenezę.
Czynniki te, generując stres oksydacyjny, powodują podwyższenie aktywności sytemu
antyoksydacyjnego, który może być zaangażowany w regulację procesów
morfogenetycznych w warunkach in vitro. Dlatego też zbadano zawartość związków
fenolowych, antocyjanów, związków polifenolowych oraz tanin, metabolitów,
mających zdolność antyoksydacyjną w 7- dniowych siewkach lnu oleistego i
włóknistego oraz w kulturach pędowych i korzeniowych w różnym czasie ich wzrostu.
4.9.1 Zawartość związków fenolowych i antocyjanów w kulturach pędowych
in vitro lnu zwyczajnego
Zawartość fenylopropanoidów i flawonoidów była wyższa w siewkach (o około
30%) oraz fragmentach hipokotyli (o około 10%) odm. Szafir, w porównaniu do odm.
Selena (Ryc. 27A). Zawartość powyższych związków fenolowych, wraz z upływem
czasu wzrostu kultur obu badanych typów lnu, obniżała się. Zawartość antocyjanów w
fragmentach hipokotyli lnu włóknistego była istotnie wyższa (o 30%) w porównaniu do
lnu oleistego (Ryc. 27 B). Wraz z upływem czasu wzrostu kultur obu odmian, ilość tego
antyoksydantu obniżała się.

114
A)
B)
Ryc. 27. Zawartość fenylopropanoidów i flawonoidów (A) oraz antocyjanów (B) w 7-dniowych
siewkach, hipokotylach, kulturach pędowych in vitro lnu zwyczajnego odm. Szafir oraz Selena.
Wyniki średnie ± SD. * Różnice istotne statystycznie, przy p≤0,05.
(Siewki – 7-dniowe sterylne siewki lnu stanowiące źródło eksplantatów; 0 – fragmenty
hipokotyli 7-dniowych siewek; 5, 14, 28 – kultury in vitro po 5- tym, 14-tym, 28-mym dniu
wzrostu).
4.9.2 Zawartość związków fenolowych i antocyjanów w kulturach korzeniowych
in vitro lnu zwyczajnego
Zawartość fenylopropanoidów i flawonoidów była wyższa w 7- dniowych
siewkach (o około 30%) i fragmentach hipokotyli (o około 10%) odm. Szafir, w
porównaniu do odm. Selena. W czasie wzrostu kultur korzeniowych obu odmian,
zawartość tych antyoksydantów obniżyła się, w porównaniu do siewek i fragmentów
hipokotyli średnio o 80% (Ryc. 28 A). W 5-tym (o 35%) i 28-mym dniu (o około 40%)
0
4
8
12
16
Siewki 0 5 14 28 Za
wa
rto
ść f
eny
lop
rop
an
oid
ów
i f
law
on
oid
ów
[U
mg
-1 b
iałk
a]
Czas wzrostu [dni]
Szafir Selena
*
*
0
0,4
0,8
1,2
Siewki 0 5 14 28
Za
wa
rto
ść a
nto
cyja
nó
w
[U
mg
-1 b
iałk
a]
Czas wzrostu [dni]
Szafir Selena
*

115
wzrostu kultur zawartość powyższych związków fenolowych była istotnie wyższa w
kulturach korzeniowych odm. Selena (typ włóknisty lnu), w porównaniu do odm. Szafir
(typ oleisty lnu). Zawartość antocyjanów w fragmentach hipokotyli odm. Selena była
wyższa w stosunku do odm. Szafir o 30%. W trakcie wzrostu kultur ilość antocyjanów
obniżyła się w porównaniu do siewek i pobranych z nich eksplantatów hipokotylowych
obu odmian o około 90% (Ryc. 28 B).
A)
B)
Ryc. 28. Zawartość fenylopropanoidów i flawonoidów (A) oraz antocyjanów (B) w 7-dniowych
siewkach, hipokotylach, kulturach korzeniowych in vitro lnu zwyczajnego odm Szafir oraz
odm. Selena. Wyniki średnie ± SD. * Różnice istotne statystycznie, przy p≤0,05.
(Siewki – 7-dniowe sterylne siewki lnu stanowiące źródło eksplantatów; 0 – fragmenty
hipokotyli 7-dniowych siewek; 5, 14, 28 – kultury in vitro po 5-tym, 14-tym, 28-mym dniu
wzrostu).
0
4
8
12
16
Siewki 0 5 14 28
Za
wa
rto
ść f
eny
lop
rop
an
oid
ów
i f
law
on
oid
ów
[U
mg
-1 b
iałk
a]
Czas wzrostu [dni]
Szafir Selena
*
*
*
*
0
0,4
0,8
1,2
Siewki 0 5 14 28
Za
wa
rto
ść a
nto
cyja
nó
w
[U m
g -
1 b
iałk
a]
Czas wzrostu [dni]
Szafir Selena
*
*

116
4.9.3 Zawartość białka w ekstraktach wykorzystywanych do określenia
zawartości związków fenolowych i antocyjanów w kulturach pędowych i
korzeniowych in vitro lnu zwyczajnego
Siewki oraz fragmenty hipokotyli odm. Selena charakteryzowały się wyższą (o
około 45%) zawartością białka w porównaniu do odm. Szafir (Ryc. 29 A, B). W
kulturach pędowych obu badanych odmian, zawartość białka występowała na
podobnym poziomie przez cały okres wzrostu (Ryc. 29 A). W kulturach korzeniowych
najwyższą zawartość białka odnotowano w kulturach odm. Szafir po 5-ciu dniach o
około 38% i po 14-tu dniach o około 30 % w stosunku do odm. Selena (Ryc. 29 B).
A)
B)
Ryc. 29. Zawartość białka w ekstraktach wykorzystanych do oznaczenia zawartości związków
fenolowych i antocyjanów w 7-dniowych siewkach (Siewki), hipokotylach (czas wzrostu 0)
oraz w kulturach pędowych (A) i korzeniowych (B) in vitro lnu zwyczajnego odm. Szafir oraz
odm. Selena. Wyniki średnie ± SD. * Różnice istotne statystycznie, przy p≤0,05.
(Siewki – 7-dniowe sterylne siewki lnu stanowiące źródło eksplantatów; 0 - fragmenty
hipokotyli 7-dniowych siewek; 5, 14, 28 – kultury in vitro po 5-tym, 14-tym, 28-mym dniu
wzrostu)
0
4
8
12
16
20
24
Siewki 0 5 14 28
Za
wa
rto
ść b
iałk
a [
mg
g-1
św
.m.]
Czas wzrostu [dni]
Szafir Selena
*
*
0
4
8
12
16
20
24
Siewki 0 5 14 28
Za
wa
rto
ść b
iałk
a [
mg
g-1
św
.m.]
Czas wzrostu [dni]
Szafir Selena
*
* *
*

117
4.9.4 Zawartość związków polifenolowych i tanin w kulturach pędowych in vitro
lnu zwyczajnego
Całkowita zawartość fenoli w siewkach odm. Szafir była o około 15% wyższa w
porównaniu do odm. Selena (Ryc. 30 A). W kulturach pędowych, rosnących w
warunkach in vitro, zawartość polifenoli obniżyła się o około 40% w stosunku do
fragmentów hipokotyli, będących eksplantatmi. Zawartość związków polifenolowych
wzrastała w kulturach pędowych odm. Selena i była wyższa w kulturach 5 (o około
30%) i 14-dniowych (o około 15%) w stosunku do kultur odm. Szafir. Zawartość tanin
była wyższa w 7-dniowych siewkach lnu odm. Szafir o około 45%, w porównaniu do
siewek odm. Selena (Ryc. 30 B). W 5-dniowych kulturach pędowych odm. Selena
zaobserwowano wzrost ilości tanin w stosunku do kultur odm. Szafir o około 30%.
A)
B)
Ryc. 30. Zawartość związków polifenolowych (A) oraz tanin (B) w 7-dniowych siewkach
(Siewki), hipokotylach (czas wzrostu 0), kulturach pędowych in vitro lnu zwyczajnego odm.
Szafir oraz odm. Selena. Wyniki średnie ± SD. * Różnice istotne statystycznie, przy p≤0,05.
(Siewki – 7-dniowe sterylne siewki lnu stanowiące źródło eksplantatów; 0 – fragmenty
hipokotyli 7-dniowych siewek; 5, 14, 28 – kultury in vitro po 5-tym, 14-tym, 28-mym dniu
wzrostu).
0
4
8
12
Siewki 0 5 14 28
Za
wa
rto
ść z
wią
zkó
w
po
life
no
low
ych
[m
g g
-1 s
.m.]
Czas wzrostu [dni]
Szafir Selena
*
*
*
0
4
8
12
Siewki 0 5 14 28
Za
wa
rto
ść t
an
in [
mg
g-1
s.m
.]
Czas wzrostu [dni]
Szafir Selena
* *

118
4.9.5 Zawartość związków polifenolowych i tanin w kulturach korzeniowych
in vitro lnu zwyczajnego
Zawartość związków polifenolowych była wyższa w 7-dniowych siewkach lnu
odm. Szafir niż odm. Selena o około 15% (Ryc. 31 A). Wzrastała natomiast w kulturach
korzeniowych lnu włóknistego i była istotnie wyższa w 14-tym i 28-mym dniu o około
35%, w porównaniu do kultur lnu oleistego. Polifenole występowały w znacznie
większej ilości w hipokotylach obu badanych odmian lnu, niż w siewkach oraz
kulturach korzeniowych (Ryc. 31 A). Zaobserwowano istotną różnicę w zawartości
tanin w 7-dniowych siewkach badanych odmian. Ilość tanin w siewkach odm. Szafir
była wyższa o 45% w porównaniu do odm. Selena (Ryc. 31 B). Poziom tego
antyoksydantu był najwyższy w fragmentach hipokotyli obu odmian. Istotny wzrost
zawartości tanin odnotowano w kulturach w 14-tym i 28-mym dniu wzrostu. Był
wyższy w kulturach lnu włóknistego o 15% (kultura 14-dniowa) i o 40% (kultura 28-
dniowa), niż u lnu oleistego (Ryc. 31 B).

119
A)
B)
Ryc. 31. Zawartość związków polifenolowych (A) oraz tanin (B) w 7-dniowych siewkach
(Siewki), hipokotylach (czas wzrostu 0), kulturach korzeniowych in vitro lnu zwyczajnego odm.
Szafir oraz odm. Selena. Wyniki średnie ± SD. * Różnice istotne statystycznie, przy p≤0,05.
(Siewki – 7-dniowe sterylne siewki lnu stanowiące źródło eksplantatów; 0 – fragmenty
hipokotyli 7-dniowych siewek; 5, 14, 28 – kultury in vitro po 5-tym, 14-tym, 28-mym dniu
wzrostu).
4.10 Aktywność enzymów antyoksydacyjnych w kulturach in vitro lnu
zwyczajnego (Linum usitatissimum L.) odm. Szafir i odm. Selena
Parametry stresu oksydacyjnego m.in. zawartość H2O2 (Ryc. 43, Ryc. 44), oznaczona w
czasie wzrostu kultur kontrolnych badanych odmian lnu, może świadczyć o
zachodzącym stresie oksydacyjnym. Zmiany w aktywności enzymów
antyoksydacyjnych, takich jak CAT czy SOD, na różnym etapie wzrostu kultur, może
mieć znaczenie w regulacji organogenezy lnu badanych odmian.
0
4
8
12
Siewki 0 5 14 28
Za
wa
rto
ść z
wią
zkó
w
po
life
no
low
ych
[m
g g
-1 s
.m.]
Czas wzrostu [dni]
Szafir Selena
* *
*
0
4
8
12
Siewki 0 5 14 28 Za
wa
rto
ść t
an
in [
mg
g-1
s.m
.]
Czas wzrostu [dni]
Szafir Selena
* * *

120
4.10.1 Aktywność dysmutazy ponadtlenkowej i katalazy w kulturach pędowych in
vitro lnu zwyczajnego
Najwyższą aktywność SOD stwierdzono w fragmentach hipokotyli (0 dni wzrostu).
Istotnie wyższą aktywność (o około 10%) odnotowano w przypadku hipokotyli odm.
Selena, w stosunku do odm. Szafir (Ryc. 32 A). W siewkach badanych odmian nie
stwierdzono istotnych różnic w aktywności SOD. Wraz ze wzrostem kultur odm. Szafir,
aktywność SOD spadała. W 14-tym i 28-mym dniu wzrostu kultur, aktywność SOD
była istotnie wyższa (o 40% - kultury 14 - dniowe oraz o 94% - kultury 28 - dniowe) w
kulturach lnu włóknistego, w porównaniu do lnu oleistego (Ryc. 32 A).
Najwyższą aktywność CAT zaobserwowano w 7-dniowych siewkach badanych
odmian lnu. W siewkach odm. Szafir, aktywność CAT była wyższa o około 30%, niż u
odm. Selena (Ryc. 32 B). W takcie wzrostu kultur obu odmian odnotowano spadek
aktywności CAT. W 5-tym (o 40%) i 14-tym dniu (o 45%) wzrostu wyższą
aktywnością CAT odznaczały się kultury odm. Szafir (typ oleisty lnu), w porównaniu
do kultur odm. Selena (typ włóknisty lnu). W 28-mym dniu wzrostu kultur odm. Selena
aktywność CAT była wyższa o około 40%, niż w kulturach odm. Szafir (Ryc. 32 B).

121
A)
B)
Ryc. 32. Aktywność dysmutazy ponadtlenkowej (A) oraz katalazy (B) w 7-dniowych siewkach
(Siewki), hipokotylach (0 dni wzrostu), kulturach pędowych in vitro lnu zwyczajnego odm.
Szafir oraz odm. Selena. Wyniki średnie ± SD. * Różnice istotne statystycznie, przy p≤0,05.
(Siewki – 7-dniowe sterylne siewki lnu stanowiące źródło eksplantatów; 0 – fragmenty
hipokotyli 7-dniowych siewek; 5, 14, 28 – kultury in vitro po 5-tym, 14-tym, 28-mym dniu
wzrostu).
4.10.2 Aktywność dysmutazy ponadtlenkowej i katalazy w kulturach
korzeniowych in vitro lnu zwyczajnego
Najwyższą aktywność SOD stwierdzono w fragmentach hipokotyli odm. Szafir
(Ryc. 33 A). W trakcie wzrostu kultur odm. Szafir odnotowano spadek aktywności tego
enzymu. W kulturach odm. Selena aktywność SOD utrzymywała się na wyższym
poziomie, niż w kulturach odm. Szafir. W 5-tym dniu wzrostu była wyższa o 33%, w
14-tym dniu wzrostu o 45%, 28-mym dniu wzrostu o 90% (Ryc. 33 A).
0
4
8
12
16
20
24
Siewki 0 5 14 28
SO
D [
U m
g-1
bia
łka
]
Czas wzrostu [dni]
Szafir Selena
*
* *
0
4
8
12
16
20
24
Siewki 0 5 14 28 CA
T [
mm
ol
H2O
2 m
g-1
bia
łka
min
-1]
Czas wzrostu [dni]
Szafir Selena
*
*
* *

122
Aktywność CAT w siewkach odm. Szafir była wyższa o 30% niż u odm. Selena
(Ryc. 33 B). W trakcie wzrostu kultur badanych odmian odnotowano spadek
aktywności CAT. W 5-tym dniu wzrostu aktywność tego enzymu była wyższa w
kulturach odm. Selena o około 80%, w porównaniu do kultur odm. Szafir (Ryc. 33 B).
A)
B)
Ryc. 33. Aktywność dysmutazy ponadtlenkowej (A) oraz katalazy (B) w 7-dniowych siewkach
(Siewki), hipokotylach (0 dni wzrostu), kulturach korzeniowych in vitro lnu zwyczajnego odm.
Szafir oraz odm. Selena. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
(Siewki – 7- dniowe sterylne siewki lnu stanowiące źródło eksplantatów; 0 – fragmenty
hipokotyli 7-dniowych siewek; 5, 14, 28 – kultury in vitro po 5-tym, 14-tym, 28-mym dniu
wzrostu).
0
4
8
12
16
20
24
Siewki 0 5 14 28
SO
D [
U m
g-1
bia
łka
]
Czas wzrostu [dni]
Szafir Selena
* *
*
*
0
4
8
12
16
20
24
Siewki 0 5 14 28 CA
T [
mm
ol
H2O
2 m
g-1
bia
łka
min
-1]
Czas wzrostu [dni]
Szafir Selena
* *

123
4.10.3 Zawartość białka w ekstraktach wykorzystywanych do określenia
aktywności enzymów antyoksydacyjnych w kulturach pędowych
i korzeniowych in vitro lnu zwyczajnego
Siewki (o około 20%) oraz fragmenty hipokotyli (o około 10%) odm. Selena
charakteryzowały się wyższą zawartością białka w porównaniu do odm. Szafir (Ryc. 34
A, B). W kulturach pędowych odm. Szafir obserwowano podobną zawartość białka na
wszystkich badanych etapach wzrostu kultur (Ryc. 34 A). W kulturach odm. Selena w
28-mym dniu wzrostu, zawartość białka była niższa o około 20%, w stosunku do kultur
odm. Szafir (Ryc. 34 A). W kulturach korzeniowych najwyższą zawartość białka
odnotowano w kulturach lnu oleistego po 5-ciu dniach wzrostu (Ryc. 34 B). W trakcie
wzrostu kultur badanych odmian, zawartość białka obniżała się. W kulturach
korzeniowych odm. Selena była niższa, niż kulturach odm. Szafir. W 5-tym dniu
wzrostu o około 14%, w 14-stym dniu o około 26%, i w 28-mym dniu wzrostu o około
30% (Ryc. 34 B).

124
A)
B)
Ryc. 34. Zawartość białka w ekstrakcie enzymatycznym wykorzystanym do oznaczenia
aktywności SOD i CAT w 7-dniowych siewkach (Siewki), hipokotylach (0 dni wzrostu) oraz w
kulturach pędowych (A) i korzeniowych (B) in vitro lnu zwyczajnego odm. Szafir oraz odm.
Selena. Wyniki średnie ± SD. * Różnice istotne statystycznie, przy p≤0,05.
(Siewki – 7-dniowe sterylne siewki lnu stanowiące źródło eksplantatów; 0 - fragmenty
hipokotyli 7-dniowych siewek; 5, 14, 28 – kultury in vitro po 5-tym, 14-tym, 28-mym dniu
wzrostu).
0
40
80
120
160
Siewki 0 5 14 28
Za
wa
rto
ść b
iałk
a [
µg
g-1
św
.m.]
Czas wzrostu [dni]
Szafir Selena
*
* *
0
40
80
120
160
Siewki 0 5 14 28 Za
wa
rto
ść b
iałk
a [
µg
g-1
św
.m.]
Czas wzrostu [dni]
Szafir Selena
*
*
* *
*

125
4.11 Wpływ stresu osmotycznego na proces organogenezy w kulturach in
vitro lnu zwyczajnego (Linum usitatissimum L.) odm. Szafir i odm.
Selena
4.11.1 Wpływ stresu osmotycznego na organogenezę pędową w kulturach in vitro
lnu zwyczajnego odm. Szafir, rosnących na podłożu z dodatkiem różnych
rodzajów cukru
Stres osmotyczny indukowano zwiększając zawartość cukrów: sacharozy oraz
sorbitolu+maltozy w pożywce pędowej, na którą wykładano eksplantaty hipokotylowe,
pochodzące z siewek lnu odm. Szafir (typ oleisty) według opisu w p. 3.4.
Zwiększenie zawartości cukru w pożywce nie wpłynęło na poprawę
organogenezy pędowej u odm. Szafir (Ryc. 35). W 28-mym dniu wzrostu kultur
rosnących w obecności zwiększonej ilości sacharozy, w podłożu zaobserwowano
istotne obniżenie procenta reagujących eksplantatów - około 15% w porównaniu do
kontroli (Ryc. 35 A).
Ryc. 35. Efektywność organogenezy pędowej w kulturach in vitro lnu zwyczajnego odm. Szafir
rosnących w warunkach stresu osmotycznego na pożywce MS ze zwiększoną zawartością
sacharozy (A) lub sorbitolu+maltozy (B). Wyniki średnie ± SD. *Różnice istotne statystycznie,
przy p≤0,05.
SI - dwukrotne zwiększenie zawartości sacharozy oraz sorbitolu+maltozy w podłożu w
stosunku do kontroli (K).
Eksplantaty rosnące w warunkach stresu osmotycznego na pożywce z dodatkiem
sacharozy, w 28-mym dniu wzrostu kultur charakteryzowały się podwyższoną świeżą i
suchą masą oraz zawartością wody przypadającą na miligram suchej masy w
0
20
40
60
80
100
7 14 21 28
% r
eag
ują
cych
ek
spla
nta
tów
Czas wzrostu [dni]
Szafir K SI
*
A
0
20
40
60
80
100
7 14 21 28
% r
eag
ują
cych
ek
spla
nta
tów
Czas wzrostu [dni]
Szafir K SI B

126
porównaniu do kontroli (Tab. 16 A). Świeża masa eksplantatów, rosnących w
warunkach stresu osmotycznego na pożywce z dodatkiem sorbitolu+maltozy,
bezpośrednio po stresie była niższa niż w kontroli, a w 28-mym dniu wzrostu była
wyższa w stosunku do kultur kontrolnych (Tab. 16 B).
Tab.16. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir rosnących w warunkach stresu osmotycznego
na pożywce MS z dodatkiem sacharozy (A) lub sorbitolu+maltozy (B) w 14-tym dniu
(bezpośrednio po działaniu stresu) oraz w 28-mym dniu wzrostu kultur. Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05
SI - dwukrotne zwiększenie zawartości sacharozy oraz sorbitolu+maltozy w podłożu w
stosunku do kontroli (K).
A)
B)
4.11.2 Zawartość produktów peroksydacji lipidów reagujących z kwasem
tiobarbiturowym (TBARS) w kulturach pędowych lnu odm. Szafir,
rosnących na podłożu z dodatkiem różnych rodzajów cukru
Zawartość TBARS w kulturach pędowych odm. Szafir (typ oleisty lnu),
rosnących w warunkach stresu osmotycznego (SI) na pożywce z dodatkiem sacharozy,
obniżyła się o około 10%, w stosunku do kontroli bezpośrednio po działaniu stresu
(Ryc. 36 A). W kulturach rosnących na podłożu z podwyższoną zawartością
Czas
wzrostu
[dni]
Warianty
doświad
czenia
Świeża masa Sucha masa Zawartość H2O Zawartość H2O
[mg ekspl.-1
] [mg ekspl.-1
] [mg H2O mg-1
św.m.] [mg H2O mg-1
s.m.]
14 K 99,17±11,5 7,63±0,32 0,92±0,006 11,96±0,95
S I 90,03±5,54 7,67±0,61 0,91± 0,002 10,76±0,34
28 K 142,98±4,17 11,52±0,75 0,92±0,004 11,45±0,74
S I 199,52±5,09* 14,20±0,29* 0,93±0,002 13,05±0,33*
Czas
wzrostu
[dni]
Warianty
doświad
czenia
Świeża masa Sucha masa Zawartość H2O Zawartość H2O
[mg ekspl.-1
] [mg ekspl.-1
] [mg H2O mg-1
św.m.] [mg H2O mg-1
s.m.]
14 K 54,03±9,15 3,47±0,60 0,93±0,005 14,63±1,22
S I 37,43±3,55* 2,70±0,43 0,93± 0,006 12,97±1,13
28 K 72,06±3,34 5,26±0,69 0,93±0,009 12,85±1,51
S I 87,77±5,18* 6,68±0,93 0,93±0,003 12,99±0,70

127
sorbitolu+maltozy, nie zaobserwowano różnic w zawartości TBARS, w porównaniu do
kontroli (Ryc. 36 B).
Ryc. 36. Zawartość produktów peroksydacji lipidów (TBARS) w kulturach pędowych lnu
zwyczajnego odm. Szafir rosnących w warunkach stresu osmotycznego na pożywce MS z
dodatkiem sacharozy (A) lub sorbitolu+maltozy (B) w 14-tym dniu (bezpośrednio po działaniu
stresu) oraz w 28-mym dniu wzrostu kultur. Wyniki średnie ± SD.
* Różnice istotne statystycznie, przy p≤0,05.
SI - dwukrotne zwiększenie zawartości sacharozy oraz sorbitolu+maltozy w podłożu w
stosunku do kontroli (K).
Na podstawie wcześniejszych doświadczeń (p. 4.11.1 - 4.11.2) i wyników,
przedstawionych na ryc. 35 B oraz 36 B, do kolejnych analiz wybrano warianty z
podwyższoną zawartością sacharozy w podłożu.
4.11.3 Wpływ stresu osmotycznego (podwyższona zawartość sacharozy) na
organogenezę pędową w kulturach in vitro lnu zwyczajnego odm. Szafir
oraz odm. Selena
Zastosowanie stresu osmotycznego nie wpłynęło na efektywność organogenezy
pędowej w kulturach in vitro obu badanych odmian lnu (Ryc. 37 A, B). Liczba pędów
na eksplantatch narażonych na działanie stresu, była zbliżona do kontroli przez cały
okres wzrostu kultur obu odmian (Ryc. 38 A, B). Porównując badane odmiany to
Selena (typ włóknisty lnu) odznaczała się niższą liczbą pędów formujących się na
eksplantatach, niż odm. Szafir (Ryc. 38).
0
4
8
12
16
20
14 28
TB
AR
S [
nm
ol
g-1
św
.m.]
Czas wzrostu [dni]
Szafir K SI
*
0
4
8
12
16
20
14 28
TB
AR
S [
nm
ol
g-1
św
.m.]
Czas wzrostu [dni]
Szafir K SI B A

128
Ryc. 37. Efektywność organogenezy pędowej w kulturach in vitro lnu zwyczajnego odm. Szafir
(A) i odm. Selena (B) rosnących w warunkach stresu osmotycznego (dwukrotne (SI) i
trzykrotne (SII) zwiększenie stężenia sacharozy w podłożu w stosunku do kontroli (K)) w 14-
tym dniu (bezpośrednio po działaniu stresu), 21-wszym dniu oraz w 28-mym dniu wzrostu
kultur. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 38. Liczba pędów formujących się na eksplantatch hipokotylowych lnu zwyczajnego odm.
Szafir (A) oraz odm. Selena (B) rosnących w warunkach stresu osmotycznego (dwukrotne (SI) i
trzykrotne (SII) zwiększenie stężenia sacharozy w podłożu w stosunku do kontroli (K) w 14-
tym dniu (bezpośrednio po działaniu stresu), 21-wszym dniu oraz w 28-mym dniu wzrostu
kultur. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Eksplantaty pochodzące z siewek odm. Szafir, rosnące w warunkach stresu
osmotycznego w 28-mym dniu wzrostu kultur, charakteryzowały się podwyższoną
świeżą masą (SI oraz SII) i suchą masą (SI), w porównaniu do kontroli (Tab. 17 A).
Zawartość wody przypadająca na miligram suchej masy eksplantatów odm. Szafir i
0
20
40
60
80
100
14 21 28
% r
eag
ują
cych
ek
spla
nta
tów
Czas wzrostu [dni]
Szafir K S I S II A
0
20
40
60
80
100
14 21 28
% r
eag
ują
cych
ek
spla
nta
tów
Czas wzrostu [dni]
Selena K S I S II B
0
4
8
12
16
20
24
14 21 28
Lic
zba p
ędów
/ek
spl
[szt
]
Czas wzrostu [dni]
Szafir K S I S II A
0
4
8
12
16
20
24
14 21 28
Lic
zba p
ędów
/ek
spl.
[sz
t]
Czas wzrostu [dni]
Selena K S I S II B

129
odm. Selena bezpośrednio po działaniu stresu (SII), a także w 28-mym dniu wzrostu
kultur lnu oleistego, była niższa, w stosunku do kontroli (Tab. 17 A, B).
Tab. 17. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir (A) oraz odm. Selena (B) rosnących w
warunkach stresu osmotycznego (dwukrotne (SI) i trzykrotne (SII) zwiększenie sacharozy w
podłożu w stosunku do kontroli (K)) w 14-tym dniu (bezpośrednio po działaniu stresu) oraz w
28-mym dniu wzrostu kultur. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05
A)
Czas
wzrostu
[dni]
Warianty
doświad
czenia
Świeża masa Sucha masa Zawartość H2O Zawartość H2O
[mg ekspl.-1
] [mg ekspl.-1
] [mg H2O mg-1
św.m.] [mg H2O mg-1
s.m.]
14
K 119,49±23,39 9,47±2,35 0,93±0,003 11,63±1,58
S I 106,42±11,19 9,67±1,14 0,92± 0,002 9,89±0,44
S II 102,52±9,83 9,93±0,45 0,91±0,003 8,46±0,46*
28
K 224,62±13,89 17,36±1,19 0,95±0,005 17,68±0,79
S I 347,70±31,99* 22,22±0,87* 0,94±0,007 16,15±0,99
S II 289,48±12,92* 18,76±0,86 0,93±0,005 14,25±0,67*
B) Czas
wzrostu
[tydzień]
Warianty
doświadcz
enia
Świeża masa Sucha masa Zawartość H2O Zawartość H2O
[mg ekspl.-1
] [mg ekspl.-1
] [mg H2O mg-1
św.m.] [mg H2O mg-1
s.m.]
14
K 95,68±13,45 9,07±1,65 0,90±0,005 9,17±0,51
S I 129,32±28,24 13,18±3,29 0,90± 0,005 8,87±0,44
S II 111,64±23,99 15,30±4,01 0,86±0,009* 6,13±0,49*
28
K 509,44±190,09 32,19±8,95 0,91±0,026 11,30±2,97
S I 502,72±191,05 34,20±8,59 0,94±0,014 15,74±2,76
S II 436,99±160,37 31,12±7,99 0,94±0,009 14,41±1,21
4.11.4 Wpływ stresu osmotycznego (podwyższona zawartość sacharozy) na
organogenezę korzeniową w kulturach in vitro lnu zwyczajnego odm. Szafir
oraz odm. Selena
Organogeneza korzeniowa w kulturach odm. Szafir była efektywniejsza w
kulturach narażonych na działanie stresu (SII) o około 30%, w porównaniu do kontroli
po 21-dniach wzrostu kultur (Ryc. 39 A). W kulturach odm. Selena bezpośrednio po
działaniu stresu osmotycznego (SI), ryzogeneza była o 40% wyższa, w stosunku do
kultur kontrolnych (Ryc. 39 B). W 28-mym dniu wzrostu procent eksplantatów z

130
korzeniami obniżył się o około 30% w kulturach lnu włóknistego, rosnących na podłożu
z trzykrotnie zwiększoną zawartością sacharozy, w porównaniu do kontroli (Ryc. 39 B).
Liczba korzeni na eksplantatch narażonych na działanie stresu, była podobna do
kontroli przez cały okres wzrostu kultur obu odmian (Ryc. 40 A, B).
Ryc. 39. Efektywność organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego odm.
Szafir (A) i odm. Selena (B) rosnących w warunkach stresu osmotycznego (dwukrotne (SI) i
trzykrotne (SII) zwiększenie stężenia sacharozy w podłożu w stosunku do kontroli (K)) w 14-
tym dniu (bezpośrednio po działaniu stresu), 21-wszym dniu oraz w 28-mym dniu wzrostu
kultur. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 40. Liczba korzeni formujących się na eksplantatch hipokotylowych lnu zwyczajnego
odm. Szafir (A) oraz odm. Selena (B) rosnących w warunkach stresu osmotycznego (dwukrotne
(SI) i trzykrotne (SII) zwiększenie stężenia sacharozy w podłożu w stosunku do kontroli (K)) w
14-tym dniu (bezpośrednio po działaniu stresu), 21-wszym dniu oraz w 28-mym dniu wzrostu
kultur. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
0
20
40
60
80
100
120
14 21 28
% r
eag
ują
cych
ek
spla
nta
tów
Czas wzrostu [dni]
Szafir K S II
*
A
0
20
40
60
80
100
120
14 21 28 %
rea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [dni]
Selena K S I S II
* *
B
0
4
8
12
16
20
24
14 21 28
Lic
zba k
orz
eni/
ek
spl.
[sz
t]
Czas wzrostu [dni]
Szafir K S II A
0
4
8
12
16
20
24
14 21 28
Lic
zba k
orz
eni/
ek
spl.
[sz
t]
Czas wzrostu [dni]
Selena K S I S II B

131
Zawartość wody przypadająca na miligram suchej masy eksplantatów odm.
Szafir poddanych stresowi osmotycznemu, była niższa bezpośrednio po działaniu
stresu, w porównaniu do eksplantatów kultur kontrolnych (Tab. 18 A).
Zawartość wody przypadająca na miligram suchej masy eksplantatów,
bezpośrednio po działaniu stresu, zwiększyła się w kulturach rosnących na podłożu z
dwukrotnie wyższą zawartością sacharozy (SI), w stosunku do kontroli. W kulturach
lnu odm. Selena (typ włóknisty), narażonych na działanie stresu osmotycznego (przy
trzykrotnym zwiększeniu stężenia sacharozy (SII) w pożywce), sucha masa była
wyższa, natomiast zawartość wody, przypadająca na miligram świeżej i suchej masy
eksplantatów, była niższa bezpośrednio po działaniu stresu, w porównaniu do kontroli
(Tab. 18 B).
Tab. 18. Świeża i sucha masa eksplantatów z korzeniami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir (A) oraz odm. Selena (B) rosnących w
warunkach stresu osmotycznego (dwukrotne (SI) i trzykrotne (SII) zwiększenie stężenia
sacharozy w podłożu w stosunku do kontroli (K)) w 14-tym dniu (bezpośrednio po działaniu
stresu) oraz w 28-mym dniu wzrostu kultur. Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05
A)
Czas
wzrostu
[dni]
Warianty
doświad
czenia
Świeża masa Sucha masa Zawartość H2O Zawartość H2O
[mg ekspl.-1
] [mg ekspl.-1
] [mg H2O mg-1
św.m.] [mg H2O mg-1
s.m.]
14 K 126,28±5,28 11,06±0,48 0,91±0,004 10,42±0,38
S II 132,50±18,69 13,70±4,06 0,90± 0,019 7,89±0,35*
28 K 489,92±81,58 29,95±5,36 0,94±0,004 15,39±0,55
S II 562,80±22,48 39,20±4,42 0,93±0,007 13,46±1,24
B) Czas
wzrostu
[tydzień]
Warianty
doświad
czenia
Świeża masa Sucha masa Zawartość H2O Zawartość H2O
[mg ekspl.-1
] [mg ekspl.-1
] [mg H2O mg-1
św.m.] [mg H2O mg-1
s.m.]
14
K 431,48±85,80 25,45±3,82 0,94±0,006 15,88±1,70
S I 400,83±53,02 31,62±2,74 0,92± 0,004 11,64±0,68*
S II 370,28±56,10 35,02±4,09* 0,90±0,004* 9,55±0,46*
28
K 520,37±91,36 23,42±2,95 0,95±0,007 21,74±6,04
S I 521,29±93,83 19,44±5,09 0,97±0,007 27,16±7,87
S II 489,35±78,71 22,90±4,56 0,95±0,008 21,22±8,23

132
4.11.5 Zawartość produktów peroksydacji lipidów reagujących z kwasem
tiobarbiturowym (TBARS) w kulturach pędowych lnu zwyczajnego odm.
Szafir i odm. Selena, poddanych działaniu stresu osmotycznego
W kulturach pędowych odm. Szafir (typ oleisty lnu) oraz odm. Selena (typ
włóknisty lnu), poddanych działaniu stresu osmotycznego, nie zaobserwowano
wzmożonej peroksydacji lipidów (Ryc. 41 A, B).
Ryc. 41. Zawartość produktów peroksydacji lipidów (TBARS) w kulturach pędowych lnu
zwyczajnego odm. Szafir (A) oraz odm. Selena (B) rosnących w warunkach stresu
osmotycznego (dwukrotne (SI) i trzykrotne (SII) zwiększenie stężenia sacharozy w podłożu w
stosunku do kontroli (K)) w 14-tym dniu (bezpośrednio po działaniu stresu) oraz w 28-mym
dniu wzrostu kultur. Wyniki średnie ± SD. * Różnice istotne statystycznie, przy p≤0,05.
4.11.6 Zawartość produktów peroksydacji lipidów reagujących z kwasem
tiobarbiturowym (TBARS) w kulturach korzeniowych lnu zwyczajnego
odm. Szafir i odm. Selena, poddanych działaniu stresu osmotycznego
Wykazano zwiększenie zawartości (o około 28%) produktów peroksydacji
lipidów, reagujących z kwasem tiobarbiturowym (TBARS) w kulturach korzeniowych
lnu oleistego, rosnących w warunkach stresu osmotycznego (SII) bezpośrednio po
działaniu stresu (14 dzień wzrostu), w porównaniu do kultur kontrolnych (Ryc. 42 A).
W kulturach korzeniowych odm. Selena poddanych działaniu stresu, nie
zaobserwowano wzmożonej peroksydacji lipidów (Ryc. 42 B).
0
4
8
12
16
20
24
14 28
TB
AR
S[n
mol
g-1
św
.m.]
Czas wzrostu [dni]
Szafir K SI SII A
0
4
8
12
16
20
24
14 28
TB
AR
S [
nm
ol
g-1
św
.m.]
Czas wzrostu [dni]
Selena K S I S II B

133
Ryc. 42. Zawartość produktów peroksydacji lipidów (TBARS) w kulturach korzeniowych lnu
zwyczajnego odm. Szafir (A) oraz odm. Selena (B) rosnących w warunkach stresu
osmotycznego (dwukrotne (SI) i trzykrotne (SII) zwiększenie stężenia sacharozy w podłożu w
stosunku do kontroli (K)) w 14-tym dniu (bezpośrednio po działaniu stresu) oraz w 28-mym
dniu wzrostu kultur. Wyniki średnie ± SD. * Różnice istotne statystycznie, przy p≤0,05.
4.11.7 Zawartość nadtlenku wodoru (H2O2) w kulturach pędowych lnu
zwyczajnego odm. Szafir i odm. Selena, poddanych działaniu stresu
osmotycznego
Obniżenie zawartości H2O2 o około 35% bezpośrednio po stresie,
zaobserwowano w kulturach lnu oleistego, rosnących na podłożu o dwukrotnie
zwiększonym stężeniu sacharozy (SI), w porównaniu do kontroli (Ryc. 43 A).
Zwiększenie zawartości H2O2 w kulturach pędowych lnu włóknistego, poddanych
działaniu stresu osmotycznego (SI oraz SII) o około 20% (SI) oraz 15% (SII), w
porównaniu do kultur kontrolnych, stwierdzono bezpośrednio po działaniu stresu (Ryc.
43 B).
0
4
8
12
16
20
24
14 28
TB
AR
S [
nm
ol
g-1
św
. m
.]
Czas wzrostu [dni]
Szafir K SII
*
A
0
4
8
12
16
20
24
14 28
TB
AR
S [
nm
ol
g-1
św
.m.]
Czas wzrostu [dni]
Selena K S I S II B

134
Ryc. 43. Zawartość nadtlenku wodoru (H2O2) w kulturach pędowych lnu zwyczajnego odm.
Szafir (A) oraz odm. Selena (B) rosnących w warunkach stresu osmotycznego (dwukrotne (SI)
i trzykrotne (SII) zwiększenie stężenia sacharozy w podłożu w stosunku do kontroli (K)) w 14-
tym dniu (bezpośrednio po działaniu stresu) oraz w 28-mym dniu wzrostu kultur. Wyniki
średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
4.11.8 Zawartość nadtlenku wodoru (H2O2) w kulturach korzeniowych lnu
zwyczajnego odm. Szafir i odm. Selena, poddanych działaniu stresu
osmotycznego
Niewielkie podwyższenie zawartości H2O2 (o około 20%), w porównaniu do
kontroli, zaobserwowano w kulturach korzeniowych lnu typu oleistego bezpośrednio po
działaniu stresu osmotycznego (SII). Tendencja ta utrzymywała się również w 28-mym
dniu wzrostu kultur (Ryc. 44 A). Zawartość H2O2 w kulturach lnu typu włóknistego
obniżyła się o około 50% bezpośrednio po działaniu warunków stresowych (SI, SII), w
porównaniu do kontroli. W 28-mym dniu wzrostu, kultury narażone na działanie stresu
osmotycznego (SI, SII), charakteryzowały się zwiększeniem zawartości H2O2 o około
30%, w stosunku do kultur kontrolnych (Ryc. 44 B).
W kulturach pędowych (Ryc. 43) oraz korzeniowych (Ryc. 44) zawartość H2O2
była trzykrotnie wyższa u lnu odm. Selena (typ włóknisty), niż u odm Szafir (typ
oleisty).
0
200
400
600
800
1000
14 28
H2O
2 [
nm
ol
g-1
św
.m.]
Czas wzrostu [dni]
Szafir K SI SII
*
A
0
200
400
600
800
1000
14 28
H2O
2 [
um
ol
g -1
św
.m.]
Czas wzrostu [dni]
Selena K S I S II
* *
B

135
Ryc. 44. Zawartość nadtlenku wodoru (H2O2) w kulturach korzeniowych lnu zwyczajnego odm.
Szafir (A) oraz odm. Selena (B) rosnących w warunkach stresu osmotycznego (dwukrotne (SI)
i trzykrotne (SII) zwiększenie stężenia sacharozy w podłożu w stosunku do kontroli (K)) w 14-
tym dniu (bezpośrednio po działaniu stresu) oraz w 28-mym dniu wzrostu kultur. Wyniki
średnie ± SD. * Różnice istotne statystycznie, przy p≤0,05.
4.12 Wpływ SNP, bezpośrednio dodanego do pożywki, na przebieg
organogenezy w kulturach in vitro lnu zwyczajnego (Linum
usitatissimum L.) odm. Szafir
Badano wpływ SNP, związku powszechnie stosowanego jako donor NO, na
efektywność organogenezy pędowej i korzeniowej wg metody opisanej w podrozdziale
3.5. Szczegółowe ustalenie wariantów doświadczalnych stosowanych na dalszym etapie
badań, przeprowadzono z wykorzystaniem lnu odm. Szafir (typ oleisty).
4.12.1 Wpływ SNP, bezpośrednio dodanego do pożywki ,na przebieg
organogenezy pędowej w kulturach in vitro lnu zwyczajnego odm. Szafir
Dodatek SNP do podłoża nie miał wpływu na efektywność formowania się
pędów. Zarówno procent eksplantatów (Ryc. 45 A), na których obserwowano
pojawianie się pędów, jak i liczba tych organów (Ryc. 45 B) w kulturach rosnących w
obecności SNP, była zbliżona do kontroli.
0
200
400
600
800
1000
14 28
H2O
2[n
mol
g-1
św
.m.]
Czas wzrostu [dni]
Szafir K SII
* *
A
0
200
400
600
800
1000
14 28
H2O
2 [
nm
ol
g-1
św
.m.]
Czas wzrostu [dni]
Selena K S I S II
* *
* *
B

136
A)
B)
Ryc. 45. Efektywność formowania pędów w kulturach in vitro lnu zwyczajnego odm. Szafir w
zależności od ilości SNP dodanego do pożywki pędowej. Wyniki średnie ± SD. *Różnice
istotne statystycznie, przy p≤0,05.
Świeża masa eksplantatów, pochodzących z kultur rosnących na pożywkach z
dodatkiem SNP, była niższa, niż kultur kontrolnych (Tab. 19). Istotnie mniejszą suchą
masą charakteryzowały się eksplantaty rosnące w obecności 50 µM roztworu SNP, w
porównaniu do kontroli. Zawartość wody w kulturach, przypadająca na gram świeżej i
suchej masy, była porównywalna we wszystkich wariantach doświadczenia (Tab. 19).
0
20
40
60
80
100
120
1 2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir K 2µM 4µM 6µM 25µM 50µM
0
4
8
12
16
20
24
28
1 2 3 4
Lic
zba
ped
ów
/ek
spl
[szt
]
Czas wzrostu [tydzień]
Szafir K 2µM 4µM 6µM 25µM 50µM

137
Tab. 19. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir rosnących na pożywce pędowej z dodatkiem
SNP. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05
Wariant
doświadczenia
Świeża masa
[mg ekspl.-1
]
Sucha masa
[mg ekspl.-1
]
Zawartość H2O
[mg H2O mg-1
św.m.]
Zawartość H2O
[mg H2O mg-1
s.m.]
K 846,70 ± 99,67 40,43 ± 5,67 0,94±0,005 15,36 ± 0,92
2 µM 602,00± 72,87* 39,47± 8,69 0,92 ± 0,009 15,68 ± 1,73
4 µM 606,95± 49,32* 36,17 ± 1,99 0,93 ± 0,003 15,71 ± 0,48
6 µM 554,63 ±77,52* 30,16 ± 4,37 0,93 ± 0,003 16,70 ± 0,61
25 µM 567,42 ± 62,32* 29,99± 3,65 0,94± 0,006 17,48± 2,11
50 µM 474,03± 41,84* 25,05± 3,11* 0,95± 0,009 18,71± 4,81
4.12.2 Wpływ SNP, bezpośrednio dodanego do pożywki, na przebieg
organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego odm.
Szafir
W drugim tygodniu wzrostu kultur korzeniowych, rosnących na pożywce z
dodatkiem 6 µM SNP, zaobserwowano obniżenie efektywności organogenezy
korzeniowej o około 40% w porównaniu do kultur kontrolnych. W kolejnych
tygodniach wzrostu kultur, nie odnotowano różnic w ryzogenezie pomiędzy kulturami
rosnącymi na pożywce z SNP a kontrolą (Ryc. 46 A, B).

138
A)
B)
Ryc. 46. Efektywność formowania korzeni w kulturach in vitro lnu zwyczajnego odm. Szafir w
zależności od ilości SNP dodanego do pożywki korzeniowej. Wyniki średnie ± SD. *Różnice
istotne statystycznie, przy p≤0,05.
Świeża masa kultur korzeniowych, rosnących w obecności SNP była
porównywalna do kultur kontrolnych (Tab. 20). Sucha masa kultur rosnących na
pożywce z dodatkiem 2 µM roztworu SNP, była istotnie wyższa w stosunku do
kontroli. Zawartość wody, przypadająca na miligram świeżej i suchej masy we
wszystkich badanych kulturach, była porównywalna z kontrolą (Tab. 20).
0
20
40
60
80
100
2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir K 2µM 4µM 6µM
*
0
5
10
15
20
25
2 3 4
Lic
zba
ko
rzen
i/ek
spl
[szt
]
Czas wzrostu [tydzień]
Szafir K 2µM 4µM 6µM

139
Tab. 20. Świeża i sucha masa eksplantatów z korzeniami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir, rosnących na pożywce korzeniowej z
dodatkiem SNP. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05
Wariant
doświadczenia
Świeża masa
[mg ekspl.-1
]
Sucha masa
[mg ekspl.-1
]
Zawartość H2O
[mg H2O mg-1
św.m.]
Zawartość H2O
[mg H2O mg-1
s.m.]
K 240,00 ± 34,58 21,40 ± 2,82 0,91 ± 0,004 10,38 ± 0,28
2 µM 301,20 ± 47,20 28,37± 3,27* 0,91 ± 0,00 10,70 ± 0,18
4 µM 305,72 ± 76,54 27,30 ± 4,26 0,89 ± 0,032 7,78 ± 1,94
6 µM 279,08 ± 29,60 24,48 ± 2,25 0,91 ± 0,015 11,59 ± 1,23
4.13 Wpływ par wydzielających się z wodnego roztworu SNP na przebieg
organogenezy w kulturach in vitro lnu zwyczajnego (Linum
usitatissimum L.) odm. Szafir i odm. Selena
4.13.1 Wpływ par wydzielających się z wodnego roztworu SNP na przebieg
organogenezy pędowej w kulturach in vitro lnu zwyczajnego odm. Szafir
24-godzinna ekspozycja kultur pędowych lnu odm. Szafir na pary wydzielające
się z wodnego roztworu SNP o wybranych stężeniach, spowodowała opóźnienie
procesu kaulogenezy (Ryc. 47 A, B). W kolejnych tygodniach wzrostu kultur
poddanych na 24-godzinnemu działaniu SNP o stężeniu 250 µM i 500 µM, tak jak w
kontroli zaobserwowano 100% organogenezę (Ryc. 47 A). Liczba pędów
indukowanych na eksplantatach była podobna we wszystkich testowanych wariantach
doświadczenia (Ryc. 47 B). Eksplantaty poddane ekspozycji na 5 mM i 10 mM roztwór
SNP, obumarły.

140
A)
B)
Ryc. 47. Efektywność formowania pędów w kulturach in vitro lnu zwyczajnego odm. Szafir
poddanych 24-godzinnej ekspozycji na działanie par wydzielających się z 40 ml wodnego
roztworu SNP, rosnących na pożywce pędowej. Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05.
Świeża i sucha masa eksplantatów poddanych 24-godzinnej ekspozycji na
działanie 250 µM oraz 500 µM roztworu SNP, rosnących przez 4 tygodnie na pożywce
pędowej, była porównywalna z kontrolą. W przypadku zawartości wody, przypadającej
na miligram świeżej i suchej masy, również nie zaobserwowano istotnych różnic
między kulturami poddanych działaniu 250 µM oraz 500 µM roztworu SNP a kontrolą
(Tab. 21). Eksplantaty poddane działaniu par wydzielających się z 5 mM i 10 mM
wodnego roztworu SNP, obumarły.
0
20
40
60
80
100
120
1 2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir K 250µM 500µM 5mM 10mM
0
4
8
12
16
20
24
28
1 2 3 4
Lic
zba
pęd
ów
/ek
spl.
[sz
t.]
Czas wzrostu [tydzień]
Szafir K 250 µM 500 µM 5mM 10mM

141
Tab. 21. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir poddanych 24-godzinnej ekspozycji na
działanie par wydzielających się z wodnego roztworu SNP, rosnących na pożywce pędowej.
Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05
Wariant
doświadczenia
Świeża masa
[mg ekspl.-1
]
Sucha masa
[mg ekspl.-1
]
Zawartość H2O
[mg H2O mg-1
św.m.]
Zawartość H2O
[mg H2O mg-1
s.m.]
K 646,70 ± 99,67 40,43 ± 5,67 0,94±0,011 15,30 ± 4,03
250 µM 698,32± 163,71 34,97± 10,69 0,95 ± 0,024 21,05 ± 9,78
500 µM 759,42± 58,79 40,01 ± 1,99 0,95 ± 0,007 18,20 ± 2,85
5 mM - - - -
10 mM - - - -
W kolejnych doświadczeniach zastosowano 3-godzinną ekspozycję na pary
wydzielające się z 5mM oraz 10 mM wodnego roztworu SNP.
Procent reagujących eksplantatów był niższy w kulturach poddanych działaniu
SNP. Kultury poddane ekspozycji na 5 mM roztwór SNP, charakteryzowały się o około
35% słabszą efektywnością organogenezy pędowej, natomiast kultury traktowane 10
mM roztworem SNP o około 50% słabszą efektywnością organogenezy w porównaniu
do kultur kontrolnych we wszystkich tygodniach wzrostu (Ryc. 48 A). W 2, 3 i 4
tygodniu wzrostu kultur, zaobserwowano mniejszą liczbę powstających pędów o około
47% w kulturach traktowanych parami wydzielającymi się z roztworu SNP, w stosunku
do kontroli (Ryc. 48 B).

142
A)
B)
Ryc. 48. Efektywność formowania pędów w kulturach in vitro lnu zwyczajnego odm. Szafir
poddanych 3-godzinnej ekspozycji na działanie par wydzielających się z 40 ml wodnego
roztworu SNP, rosnących na pożywce pędowej. Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05.
Eksplantaty poddane 3-godzinnej ekspozycji na pary wydzielające się z 5 mM i
10 mM roztworu SNP, po 4 tygodniach wzrostu na pożywce pędowej,
charakteryzowały się podobną świeżą i suchą masą, w stosunku do kontroli (Tab. 22).
Zawartość wody, przypadająca na gram świeżej i suchej masy w porównaniu do
eksplantatów pochodzących z kultur kontrolnych, była podobna w kulturach poddanych
działaniu SNP (Tab. 22).
0
20
40
60
80
100
120
1 2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir K 5mM 10mM
*
* *
* *
* * *
0
4
8
12
16
20
24
1 2 3 4
Lic
zba
pęd
ów
/ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Szafir K 5mM 10mM
* * * * * *

143
Tab. 22. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir poddanych 3-godzinnej ekspozycji na
działanie par wydzielających się z 40 ml wodnego roztworu SNP, rosnących na pożywce
pędowej. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05
Wariant
doświadczenia
Świeża masa
[mg ekspl.-1
]
Sucha masa
[mg ekspl.-1
]
Zawartość H2O
[mg H2O mg-1
św.m.]
Zawartość H2O
[mg H2O mg-1
s.m.]
K 610,61 ± 64,82 41,72 ± 4,77 0,93±0,023 16,81 ± 3,96
5 mM 682,30± 76,32 48,12± 3,60 0,92 ± 0,018 14,85 ± 3,66
10 mM 722,50± 54,25 60,30 ± 3,43* 0,93 ± 0,008 16,00 ± 1,67
Na podstawie opisanych wyżej doświadczeń (Ryc. 47; Ryc. 48) do dalszych
analiz wybrano 3-godzinną ekspozycję na pary wydzielające się z 5 mM wodnego
roztworu SNP. Zastosowano różną ilość: 5 ml, 10 ml, 20 ml oraz 30 ml roztworu SNP,
których działanie na efektywność organogenezy testowano w kulturach dwóch odmian
lnu, Szafir oraz Selena.
4.13.2 Wpływ par wydzielających się z wodnego roztworu SNP na przebieg
organogenezy pędowej w kulturach in vitro lnu zwyczajnego
Opary wydzielające się z wodnego roztworu SNP nie wpłynęły na poprawę
organogenezy pędowej obu badanych odmian lnu przez 4 tygodnie wzrostu kultur (Ryc.
49,A, B; Fot. 10). W kulturach odm. Szafir (typ oleisty lnu), poddanych działaniu
roztworu SNP w ilości 30 ml, w pierwszym tygodniu wzrostu procent eksplantatów z
formującymi się pędami był niższy o około 25% w porównaniu do kultur kontrolnych
(Ryc. 49 A). W pozostałych tygodniach wzrostu efektywność kaulogenezy była
podobna do kontroli (Ryc. 49 A, B). Ekspozycja na roztwór SNP nie wpłynęła na liczbę
powstających pędów na eksplantatach we wszystkich testowanych wariantach
doświadczalnych (Ryc. 50 A, B).

144
Fot. 10. Eksplantaty hipokotylowe lnu zwyczajnego odm. Szafir oraz odm. Selena z
uformowanymi pędami, poddane 3-godzinnej ekspozycji na działanie par wydzielających się z
5mM wodnego roztworu SNP w ilości: 5 ml,10 ml, 20 ml i 30 ml, po 4 tygodniach wzrostu na
pożywce pędowej.
A)
B)
Ryc. 49. Efektywność organogenezy pędowej w kulturach in vitro lnu zwyczajnego odm. Szafir
(A) oraz Selena (B) poddanych 3-godzinnej ekspozycji na działanie par wydzielających się z
5mM wodnego roztworu SNP, rosnących na pożywce pędowej. Wyniki średnie ± SD. *Różnice
istotne statystycznie, przy p≤0,05.
0
20
40
60
80
100
120
1 2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir K 5ml SNP 10ml SNP 20ml SNP 30ml SNP
*
0
20
40
60
80
100
120
2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Selena K 5ml SNP 10ml SNP 20ml SNP 30ml SNP

145
A)
B)
Ryc. 50. Liczba pędów formujących się na eksplantatch hipokotylowych lnu zwyczajnego odm.
Szafir (A) oraz Selena (B) poddanych 3-godzinnej ekspozycji na działanie par wydzielających
się z 5mM wodnego roztworu SNP, rosnących na pożywce pędowej. Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05.
Eksplantaty badanych odmian lnu, niezależnie od ilości SNP jakim były
traktowane, po 4 tygodniach wzrostu na pożywce pędowej odznaczały się podobną do
kontroli świeżą i suchą masą oraz zawartością wody przypadającą na miligram świeżej i
suchej masy (Tab. 23 A i B).
0
4
8
12
16
20
24
28
32
1 2 3 4
Lic
zba
pęd
ów
/ek
spl.
[sz
t.]
Czas wzrostu [tydzień]
Szafir K 5ml SNP 10ml SNP 20ml SNP 30ml SNP
0
4
8
12
16
2 3 4
Lic
zba
pęd
ów
/ek
spl.
[sz
t.]
Czas wzrostu [tydzień]
Selena K 5ml SNP 10ml SNP 20ml SNP 30ml SNP

146
Tab. 23. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir (A) oraz Selena (B) poddanych 3-godzinnej
ekspozycji na działanie par wydzielających się z 5mM wodnego roztworu SNP, rosnących na
pożywce pędowej. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05
A)
Wariant
doświadczenia
Świeża masa
[mg ekspl.-1
]
Sucha masa
[mg ekspl.-1
]
Zawartość H2O
[mg H2O mg-1
św.m.]
Zawartość H2O
[mg H2O mg-1
s.m.]
K 532,66 ± 149,81 34,14 ± 9,84 0,91±0,021 14,92 ± 3,38
5 ml 600,47± 101,51 32,54± 4,89 0,90 ± 0,008 12,70 ± 0,94
10 ml 631,10± 150,21 41,47 ± 6,79 0,91 ± 0,015 16,04 ± 1,65
20 ml 534,38±152,42 31,99±9,85 0,91±0,023 15,28±2,64
30 ml 598,43±187,21 34,90±11,88 0,88±0,041 15,98±3,23
B)
Wariant
doświadczenia
Świeża masa
[mg ekspl.-1
]
Sucha masa
[mg ekspl.-1
]
Zawartość H2O
[mg H2O mg-1
św.m.]
Zawartość H2O
[mg H2O mg-1
s.m.]
K 106,65 ± 40,20 14,40 ± 4,01 0,85±0,083 7,77 ± 1,56
5 ml 114,32± 12,71 14,97± 1,69 0,87 ± 0,016 7,04 ± 1,08
10 ml 100,42± 10,79 12,01 ± 1,99 0,87 ± 0,018 7,17 ± 1,27
20 ml 139,25±52,12 17,20±6,02 0,86±0,068 7,81 ± 1,70
30 ml 100,25±12,42 13,41±2,54 0,86±0,019 6,42 ± 1,05
4.13.3 Wpływ par wydzielających się z wodnego roztworu SNP na przebieg
organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego, rosnących
na pożywkach bez dodatku hormonów
Efektywność organogenezy korzeniowej była niższa o około 50% w kulturach
odm. Szafir, poddanych działaniu par wydzielających się z 30 ml roztworu SNP, w
porównaniu do kontroli już w pierwszym tygodniu wzrostu (Ryc. 51 A). Efekt ten
zaobserwowano także w 4 tygodniu wzrostu kultur (Fot. 11). Ryzogeneza była o 30%
niższa w kulturach narażonych na działanie roztworu SNP w ilości 30 ml, w stosunku
do kultur kontrolnych (Ryc. 51 A). W kulturach odm. Szafir, jedynie na początku
wzrostu kultur, liczba uformowanych korzeni przypadająca na eksplantat była wyższa

147
(o około 30%) w kulturach poddanych działaniu 5 ml wodnego roztworu SNP, w
porównaniu do kontroli (Ryc. 52 A). W pozostałych tygodniach wzrostu liczba korzeni
była podobna, jak w kulturach kontrolnych (Ryc. 52 A).
Efektywność ryzogenezy w kulturach odm. Selena wzrosła w kulturach
poddanych działaniu par wydzielających się z 5 ml roztworu SNP (Ryc. 51 B; Fot. 11).
W trzecim tygodniu wzrostu kultur była o około 30% wyższa, a w 4 tygodniu wzrostu o
około 15% wyższa, w porównaniu do kultur kontrolnych (Ryc. 51 B). Ekspozycja
eksplantatów odm. Selena na pary wydzielające się z 5 ml wodnego roztworu SNP,
spowodowało zwiększenie liczby korzeni w kulturach w 4 tygodniu wzrostu o około
15%, w porównaniu do kontroli (Ryc. 52 B).
Fot. 11. Eksplantaty hipokotylowe lnu zwyczajnego odm. Szafir oraz odm. Selena z
uformowanymi korzeniami, poddane 3-godzinnej ekspozycji na działanie par wydzielających
się z 5 mM wodnego roztworu SNP w ilości: 5 ml,10 ml, 20 ml i 30 ml, po 4 tygodniach
wzrostu na pożywce korzeniowej.

148
A)
B)
Ryc. 51. Efektywność organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego odm.
Szafir (A) oraz Selena (B) poddanych 3-godzinnej ekspozycji na działanie par wydzielających
się z 5 mM wodnego roztworu SNP, rosnących na pożywce korzeniowej. Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05.
0
20
40
60
80
100
120
2 3 4 % r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir K 5ml 10ml 20ml 30ml
*
*
0
20
40
60
80
100
120
2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Selena K 5ml SNP 10ml SNP 20ml SNP 30ml SNP
*
*

149
A)
B)
Ryc. 52. Liczba korzeni formujących się na eksplantatch hipokotylowych lnu zwyczajnego
odm. Szafir (A) oraz Selena (B) poddanych 3-godzinnej ekspozycji na działanie par
wydzielających się z 5mM wodnego roztworu SNP, rosnących na pożywce korzeniowej.
Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Eksplantaty odm. Szafir, niezależnie od ilości roztworu SNP jakim były
traktowane, po 4 tygodniach wzrostu na pożywce korzeniowej charakteryzowały się
podobną świeżą oraz sucha masą, a także zawartością wody, w porównaniu do kultur
kontrolnych (Tab. 24 A).
Świeża masa oraz zawartość wody przypadająca na miligram suchej masy eksplantatów
odm. Selena poddanych działaniu roztworu SNP w ilości 20 ml, była najniższa, w
porównaniu do eksplantatów kultur kontrolnych (Tab. 24 B). Sucha masa, a także
zawartość wody przypadająca na miligram świeżej masy eksplantatów z korzeniami we
wszystkich badanych wariantach, była zbliżona do kontroli (Tab. 24 B).
0
4
8
12
16
20
24
2 3 4
Lic
zba
ko
rzen
i/ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Szafir K 5ml 10ml 20ml 30ml
*
0
4
8
12
16
20
24
2 3 4
Lic
zba
ko
rzen
i/ek
spl.
[sz
t.]
Czas wzrostu [tydzień]
Selena K 5ml SNP 10ml SNP 20ml SNP 30ml SNP
*

150
Tab. 24. Świeża i sucha masa eksplantatów z korzeniami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir (A) oraz Selena (B) poddanych 3-godzinnej
ekspozycji na działanie par wydzielających się z 5 mM wodnego roztworu SNP, rosnących na
pożywce korzeniowej. Wyniki średnie ± SD.
A)
Wariant
doświadczenia
Świeża masa
[mg ekspl.-1
]
Sucha masa
[mg ekspl.-1
]
Zawartość H2O
[mg H2O mg-1
św.m.]
Zawartość H2O
[mg H2O mg-1
s.m.]
K 409,50 ± 128,39 33,31 ± 8,63 0,92±0,017 12,39 ± 2,63
5 ml 243,66± 131,76 26,97± 5,21 0,89 ± 0,033 10,80 ± 2,28
10 ml 352,63± 50,33 33,71 ± 3,92 0,87 ± 0,067 10,85 ± 1,23
20 ml 289,59±61,31 28,18±6,08 0,88±0,024 11,12±1,89
30 ml 312,56±75,71 29,83±7,40 0,87±0,058 11,74±1,91
B)
Wariant
doświadczenia
Świeża masa
[mg ekspl.-1
]
Sucha masa
[mg ekspl.-1
]
Zawartość H2O
[mg H2O mg-1
św.m.]
Zawartość H2O
[mg H2O mg-1
s.m.]
K 341,28 ± 34,56 22,59 ± 3,83 0,93±0,029 14,85 ± 2,40
5 ml 301,06± 30,30 19,90 ± 4,40 0,91 ± 0,042 14,54 ± 1,49
10 ml 319,96± 36,31 21,93 ± 2,50 0,92 ± 0,033 14,09 ± 1,86
20 ml 214,23±29,95* 19,55± 2,50 0,92±0,012 10,02 ± 1,45*
30 ml 340,84± 51,61 22,96± 4,00 0,92±0,040 15,25 ± 3,76
4.13.4 Wpływ par wydzielających się z wodnego roztworu SNP na przebieg
procesu organogenezy w kulturach in vitro lnu zwyczajnego, rosnących na
pożywkach bez dodatku hormonów
W kolejnym wariancie doświadczalnym postanowiono sprawdzić jak opary
wydzielające się z wodnego roztworu SNP wpływają na kultury rosnące na podłożu bez
dodatku hormonów.
W kulturach rosnących na podłożu bez dodatku hormonów zaobserwowano
powstawanie zarówno pędów jak i korzeni. W przypadku lnu oleistego na eksplantatach
pojawiały się tylko pędy, zarówno w kontroli jak i wariantach poddanych działaniu

151
SNP. W kulturach odm. Szafir rosnących, na podłożu bez dodatku hormonów,
poddanych fumigacji SNP, nie zaobserwowano różnic w organogenezie pędów, w
porównaniu do kontroli (Ryc. 53 A; Fot. 12).
W kulturach odm. Selena rosnących na podłożu bez dodatku hormonów,
odnotowano powstawanie pędów, jak i korzeni, na eksplantatch (Ryc. 53 B, C; Fot. 13).
Istotne różnice w organogenezie pędowej w porównaniu do kultur kontrolnych
obserwowano w kulturach poddanych działaniu 10 ml SNP w 3 i 4 tygodniu wzrostu
(Ryc. 53 B). Wyższą organogenezą korzeniową charakteryzowały się kultury poddane
działaniu 5 oraz 10 ml roztworu SNP. W drugim tygodniu wzrostu organogeneza była
wyższa o około 40% w kulturach narażonych na działanie SNP w ilości 5 ml, w
porównaniu z kontrolą. W trzecim i czwartym tygodniu ryzogeneza była efektywniejsza
od kontroli o 40% (kultury poddane działaniu 5 ml roztworu SNP) i o około 35% w
kulturach poddanych ekspozycji na 10 ml roztworu SNP (Ryc. 53 C).
Efektywniejsze formowanie się korzeni zaobserwowano w kulturach odm.
Selena poddanych działaniu roztworu SNP w ilości 5 ml, w porównaniu do kultur
kontrolnych. W drugim i trzecim tygodniu wzrostu liczba korzeni w kulturach lnu
włóknistego narażonych na działanie SNP była około dwukrotnie wyższa, niż liczba
korzeni powstających w kulturach kontrolnych (Ryc. 54 C).
Liczba powstających pędów w kulturach odm. Szafir, jak i odm. Selena,
poddanych działaniu SNP, nie różniła się istotnie w stosunku do liczby tych organów
otrzymanych w kulturach kontrolnych prze cały okres wzrostu kultury (Ryc. 54 A, B).

152
Fot. 12. Kultury in vitro oraz eksplantaty hipokotylowe lnu zwyczajnego odm. Szafir, poddane 3-godzinnej ekspozycji na działanie par wydzielających się z
5mM wodnego roztworu SNP w ilości: 5 ml,10 ml, 20 ml i 30 ml, po 4 tygodniach wzrostu na pożywce MS bez dodatku hormonów.

153
Fot. 13. Kultury in vitro oraz eksplantaty hipokotylowe lnu zwyczajnego odm. Selena, poddane 3-godzinnej ekspozycji na działanie par wydzielających się z
5 mM wodnego roztworu SNP w ilości: 5 ml,10 ml, 20 ml i 30 ml, po 4 tygodniach wzrostu na pożywce B5 bez dodatku hormonów.
K 5ml 10ml 20ml 30ml

154
A)
B)
C)
Ryc. 53. Efektywność organogenezy pędowej w kulturach in vitro lnu zwyczajnego odm. Szafir
(A) i Selena (B) oraz organogenezy korzeniowej w kulturach odm. Selena (C) poddanych
3-godzinnej ekspozycji na działanie par wydzielających się z 5mM wodnego roztworu SNP,
rosnących na podłożu bez dodatku hormonów. Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05.
0
20
40
60
80
100
120
1 2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Szafir K 5ml SNP 10ml SNP 20ml SNP 30ml SNP
0
20
40
60
80
100
120
1 2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Selena K 5ml SNP 10ml SNP 20ml SNP 30ml SNP
* *
0
20
40
60
80
100
120
2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Selena K 5ml SNP 10ml SNP 20ml SNP 30ml SNP
*
* *
* *

155
A)
B)
C)
Ryc. 54. Liczba pędów formujących się na eksplantatch hipokotylowych lnu zwyczajnego odm.
Szafir (A) i Selena (B) oraz liczba korzeni formujących się na eksplantatch hipokotylowych
odm. Selena (C) poddanych 3-godzinnej ekspozycji na działanie par wydzielających się z 5 mM
wodnego roztworu SNP, rosnących na pożywce bez dodatku hormonów. Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05.
0
4
8
12
16
20
1 2 3 4
Lic
zba
pęd
ów
/ ek
spl.
[sz
t.]
Czas wzrostu [tydzień]
Szafir K 5ml SNP 10ml SNP 20ml SNP 30ml SNP
0
4
8
12
16
20
1 2 3 4
Lic
zba
pęd
ów
/ek
spl.
[sz
t.]
Czas wzrostu [tydzień]
Selena K 5ml SNP 10ml SNP 20ml SNP 30ml SNP
0
4
8
12
2 3 4
Lic
zba
ko
rzen
i/ek
spl.
[sz
t]
Czas wzrostu [tydzień]
Selena K 5ml SNP 10ml SNP 20ml SNP 30ml SNP
* *

156
Świeża i sucha masa eksplantatów odm. Szafir, poddanych działaniu SNP w
ilości 10, 20 oraz 30 ml i rosnących na podłożu bez dodatku hormonów, była istotnie
niższa, w porównaniu do kontroli (Tab. 25 A). W przypadku zawartości wody,
przypadającej na miligram świeżej i suchej masy, nie zaobserwowano różnic między
badanymi wariantami a kontrolą (Tab. 25 A).
Eksplantaty odm. Selena, poddane działaniu roztworu SNP w ilości 5 i 10 ml,
charakteryzowały się wyższą świeżą masą, w stosunku do kontroli (Tab. 25 B). Sucha
masa eksplantatów narażonych na działanie 10 ml SNP, była najwyższa. Zawartość
wody przypadająca na miligram suchej masy w kulturach, których eksplantaty poddane
były działaniu SNP w ilości 20 i 30 ml, była istotnie wyższa niż w kulturach
kontrolnych (Tab. 25 B).
Tab. 25. Świeża i sucha masa eksplantatów z pędami i korzeniami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir (A) oraz Selena (B) poddanych 3-godzinnej
ekspozycji na działanie par wydzielających się z 5 mM wodnego roztworu SNP, rosnących na
pożywce bez dodatku hormonów. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy
p≤0,05
A)
Wariant
doświadczenia
Świeża masa
[mg ekspl.-1
]
Sucha masa
[mg ekspl.-1
]
Zawartość H2O
[mg H2O mg-1
św.m.]
Zawartość H2O
[mg H2O mg-1
s.m.]
K 30,15 ± 6,89 4,46 ± 0,54 0,86±0,055 7,79 ± 1,28
5 ml 22,15± 4,82 2,88± 0,96 0,86 ± 0,086 6,98 ± 0,64
10 ml 14,89 ± 3,36* 1,87 ± 0,26* 0,85 ± 0,051 6,50 ± 0,76
20 ml 17,59 ± 3,84* 2,11± 0,53* 0,85±0,045 5,84± 0,96
30 ml 25,50 ± 5,52 3,26± 0,21* 0,87±0,082 9,59± 1,97
B)
Wariant
doświadczenia
Świeża masa
[mg ekspl.-1
]
Sucha masa
[mg ekspl.-1
]
Zawartość H2O
[mg H2O mg-1
św.m.]
Zawartość H2O
[mg H2O mg-1
s.m.]
K 39,69 ± 4,14 7,36 ± 0,95 0,81±0,070 4,64 ± 0,58
5 ml 53,36± 2,25* 8,54± 0,64 0,85 ± 0,018 5,75 ± 0,84
10 ml 61,99± 5,42* 9,36 ± 0,29* 0,86 ± 0,017 6,04 ± 0,76
20 ml 33,38± 3,69 5,51± 0,86 0,84±0,081 6,09± 0,40*
30 ml 50,15±8,86 7,02± 0,65 0,85±0,047 6,13± 0,45*

157
Na podstawie przeprowadzonych doświadczeń, dotyczących wpływu par
wydzielających się z 5 mM wodnego roztworu SNP na efektywność organogenezy, do
dalszych doświadczeń wybrano: kultury odm. Selena rosnące na pożywce korzeniowej
poddane działaniu 5 ml roztworu SNP oraz kultury odm. Selena rosnące na podłożu bez
dodatku hormonów, poddane ekspozycji na 5 i 10 ml roztworu SNP, ponieważ dodatni
efekt SNP był w tych wariantach widoczny (Ryc. 51-54).
4.14 Wpływ c-PTIO (ang. 2-(4-carboxyphenyl)-4,4,5,5-
tetramethylimidazoline-1-oxyl-3-oxide) na proces organogenezy w
kulturach in vitro lnu zwyczajnego (Linum usitatissimum L.),
poddanych działaniu par wydzielających się z wodnego roztworu SNP
4.14.1 Intensywność procesu organogenezy korzeniowej w kulturach
korzeniowych in vitro lnu zwyczajnego, poddanych działaniu par
wydzielających się z wodnego roztworu SNP w obecności c-PTIO
W doświadczeniu zastosowano „wymiatacz” tlenku azotu c-PTIO w celu
potwierdzenia udziału egzogennego NO w stymulacji organogenezy w kulturach
in vitro lnu odm. Selena po ekspozycji na pary, wydzielające się z wodnego 5 mM
roztworu SNP.
W kulturach korzeniowych, poddanych działaniu SNP w obecności c-PTIO nie
zaobserwowano istotnych różnic w efektywności organogenezy, w porównaniu do
kultur, które inkubowane były tylko z roztworem c-PTIO (Ryc. 55). W 3 i 4 tygodniu
wzrostu kultur, najlepszą (o około 15% wyższą) organogenezą korzeniową odznaczały
się kultury poddane działaniu SNP, w stosunku do kultur poddanych fumigacji SNP w
obecności c-PTIO oraz kultur poddanych działaniu jedynie c-PTIO (Ryc. 55). Liczba
korzeni była wyższa, w kulturach poddanych działaniu roztworu SNP, w 2 tygodniu
wzrostu (o około 40%) oraz w 4 tygodniu wzrostu (o około 20%) kultur w porównaniu
z kulturami inkubowanymi z SNP+c-PTIO oraz z roztowrem c-PTIO (Ryc. 56).
Długość korzeni była większa w kulturach poddanych działaniu SNP w stosunku
do korzeni w kulturach inkubowanych jedynie z c-PTIO oraz kontroli (Ryc. 57).

158
Ryc. 55. Efektywność organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego odm.
Selena poddanych 3-godzinnej ekspozycji na działanie par wydzielających się z 5 mM wodnego
roztworu SNP w obecności c-PTIO, rosnących na pożywce korzeniowej. Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05.
(K- kultury nie poddane działaniu SNP i c-PTIO; 5 ml SNP – kultury poddane działaniu par
wydzielających się z roztworu SNP; c-PTIO- poddane działaniu c-PTIO; 5 ml SNP+c-PTIO –
kultury poddane działaniu par wydzielających się z roztworu SNP w obecności c-PTIO)
Ryc. 56. Liczba korzeni formujących się na eksplantatch hipokotylowych lnu zwyczajnego
odm. Selena poddanych 3-godzinnej ekspozycji na działanie par wydzielających się z 5 mM
wodnego roztworu SNP w obecności c-PTIO, rosnących na pożywce korzeniowej. Wyniki
średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Szczegółowy opis wariantów doświadczalnych – w opisie Ryc. 55.
0
20
40
60
80
100
120
2 3 4
% r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Selena K 5 ml SNP c-PTIO 5 ml SNP+c-PTIO
* *
0
4
8
12
16
2 3 4
Lic
zba
ko
rzen
i/ek
spl.
[sz
t.]
Czas wzrostu [tydzień]
Selena K 5 ml SNP c-PTIO 5 ml SNP+c-PTIO
*
*

159
Ryc. 57. Długość korzeni w kulturach in vitro lnu zwyczajnego odm. Selena poddanych
działaniu par wydzielających się z wodnego roztworu SNP w obecności c-PTIO, rosnących na
pożywce korzeniowej po 4 tygodniach wzrostu. Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05.
Szczegółowy opis wariantów doświadczalnych – w opisie Ryc. 55.
Najniższą świeżą masą charakteryzowały się eksplantaty poddane ekspozycji na
SNP w ilości 5 ml i rosnące na pożywce korzeniowej, w porównaniu z kulturami
inkubowanymi z SNP+c-PTIO oraz samego roztworu c-PTIO (Tab. 26). Sucha masa
eksplantatów inkubowanych przez 3 godziny w obecności c-PTIO oraz 5 ml roztworu
SNP, była istotnie niższa, niż eksplantatów pochodzących z kultur kontrolnych.
Zawartość wody była podobna we wszystkich badanych wariantach (Tab. 26).
Tab. 26. Świeża i sucha masa oraz zawartość wody w kulturach in vitro lnu zwyczajnego odm.
Selena po 4-ch tygodniach wzrostu na pożywce korzeniowej, poddanych działaniu par
wydzielających się z 5 mM wodnego roztworu SNP w obecności c-PTIO. Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05
Szczegółowy opis wariantów doświadczalnych – w opisie Ryc. 55
Wariant
doświadczenia
Świeża masa
[mg ekspl.-1
]
Sucha masa
[mg ekspl.-1
]
Zawartość H2O
[mg H2O mg-1
św.m.]
Zawartość H2O
[mg H2O mg-1
s.m.]
K 470,75± 66,70 44,36± 9,20 0,91± 0,04 11,15± 3,63
5 ml SNP 255,47± 35,43* 24,33±4,64* 0,91± 0,02 10,92± 3,39
c-PTIO 428,10± 37,86 27,90±2,66* 0,93± 0,01 14,44± 1,71
5 ml SNP+c-PTIO 410,75± 51,41 31,29± 4,58 0,93± 0,02 13,99± 4,37
0
1
2
3
4
K 5 ml SNP c-PTIO 5 ml SNP+c-PTIO
Dłu
go
ść k
orz
eni
[cm
]
Selena
*

160
4.14.2 Intensywność procesu organogenezy w kulturach in vitro lnu zwyczajnego
odm. Selena, rosnących na pożywce bez dodatku hormonów, poddanych
działaniu par wydzielających się z wodnego roztworu SNP w obecności c-
PTIO
Nie zaobserwowano istotnych różnic pomiędzy kulturami inkubowanymi z
SNP+c-PTIO oraz c-PTIO a kontrolą (Ryc. 58).
W kulturach poddanych działaniu 5 ml SNP, SNP +c-PTIO oraz inkubowanych
przez 3 godziny w obecności c-PTIO nie odnotowano różnic w efektywności
organogenezy pędowej, w porównaniu do kontroli (Ryc. 58 A). W przypadku kultur
poddanych fumigacji 10 ml SNP, kaulogenza była wyższa o około 20 % niż w kulturach
poddanych działaniu 10 ml SNP+c-PTIO w 3 tygodniu wzrostu oraz wyższa o około
10%, w porównaniu do kultur inkubowanych z 10 ml SNP+c-PTIO i samym c-PTIO w
4 tygodniu wzrostu (Ryc. 58 A).
Efektywność organogenezy korzeniowej była wyższa w kulturach poddanych
działaniu 5 ml i 10 ml SNP niż w kulturach poddanych działaniu SNP+c-PTIO oraz c-
PTIO (Ryc. 58 B). W 3 tygodniu wzrostu % eksplantatów z korzeniami, w kulturach
poddanych działaniu 5 ml SNP, był wyższy o około 40%, a w kulturach poddanych
działaniu 10 ml SNP, wyższy o około 30% od kultur inkubowanych z SNP+c-PTIO
oraz c-PTIO. W 4 tygodniu wzrostu, kultury poddane fumigacji 5 ml i 10 ml SNP,
charakteryzowały się wyższą (o około 30%) organogenezą korzeniową niż w kultury,
na które działano SNP+c-PTIO oraz c-PTIO (Ryc. 58 B).
Liczba pędów jak i korzeni powstających na pojedynczym eksplantacie w
kulturach poddanych działaniu SNP, jak i SNP+c-PTIO oraz roztworu c-PTIO, była
podobna (Ryc. 59 A i B).
Powstające na eksplantatach poddanych działaniu roztworu SNP w ilości 5 oraz
10 ml korzenie były istotnie (o około 90%) dłuższe, niż w pozostałych wariantach
doświadczenia (Ryc. 60).

161
A)
B)
Ryc. 58. Efektywność organogenezy pędowej (A) i korzeniowej (B) w kulturach in vitro lnu
zwyczajnego odm. Selena poddanych 3-godzinnej ekspozycji na działanie par wydzielających
się z 5mM wodnego roztworu SNP w obecności c-PTIO, rosnących na pożywce bez dodatku
hormonów. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
(K- kultury nie poddane działaniu SNP i c-PTIO; 5 ml SNP, 10 ml SNP – kultury poddane
działaniu par wydzielających się z roztworu SNP; c-PTIO- poddane działaniu c-PTIO; 5 ml
SNP+c-PTIO, 10 ml SNP+c-PTIO – kultury poddane działaniu par wydzielających się z
roztworu SNP w obecności c-PTIO)
0
20
40
60
80
100
120
1 2 3 4 % r
ea
gu
jący
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Selena K 5 ml SNP 10 ml SNP c-PTIO 5 ml SNP+c-PTIO 10 ml SNP+c-PTIO
* *
0
20
40
60
80
100
120
2 3 4 % r
ea
gu
jacy
ch e
ksp
lan
tató
w
Czas wzrostu [tydzień]
Selena K 5 ml SNP 10 ml SNP c-PTIO 5 ml SNP+c-PTIO 10 ml SNP+c-PTIO
* *
* *

162
A)
B)
Ryc. 59. Liczba pędów (A) i korzeni (B) formujących się na eksplantatch hipokotylowych lnu
zwyczajnego odm. Selena poddanych 3- godzinnej ekspozycji na działanie par wydzielających
się z 5mM wodnego roztworu SNP w obecności c-PTIO, rosnących na pożywce bez dodatku
hormonów. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Szczegółowy opis wariantów doświadczalnych – w opisie Ryc. 58.
Ryc. 60. Długość korzeni w kulturach in vitro lnu zwyczajnego odm. Selena poddanych
działaniu par wydzielających się z wodnego roztworu SNP w obecności c-PTIO, rosnących na
podłożu bez dodatku hormonów po 4 tygodniach wzrostu. Wyniki średnie ± SD. *Różnice
istotne statystycznie, przy p≤0,05.
Szczegółowy opis wariantów doświadczalnych – w opisie Ryc. 58.
0
4
8
12
16
20
1 2 3 4 Lic
zba
pęd
ów
/ek
spl.
[sz
t]
Czas wzrostu [tydzien]
Selena K 5 ml SNP 10 ml SNP c-PTIO 5 ml SNP+c-PTIO 10 ml SNP+c-PTIO
0
4
8
2 3 4 Lic
zba
ko
rzen
i/ek
spl
[szt
.]
Czas wzrostu [tydzień]
Selena K 5 ml SNP 10 ml SNP c-PTIO 5 ml SNP+c-PTIO 10 ml SNP+c-PTIO
* * *
0
4
8
12
16
20
24
28
32
36
K 5 ml SNP 10 ml SNP c-PTIO 5 ml SNP+ c-
PTIO
10 ml
SNP+c-PTIO
Dłu
go
ść k
orz
eni
[cm
]
Selena *
*

163
Świeża masa eksplantatów poddanych działaniu SNP w ilości 5 i 10 ml oraz 5
ml SNP+c-PTIO, a także inkubowanych w obecności c-PTIO, była wyższa, niż w
kulturach kontrolnych (Tab. 27). Wyższą suchą masą, w porównaniu do kontroli,
charakteryzowały się eksplantaty narażone na działanie SNP w ilości 5 i 10 ml oraz 5
ml SNP z dodatkiem c-PTIO. Zawartość wody, przypadająca na miligram świeżej i
suchej masy, była podobna pomiędzy wariantami. Jedynie w przypadku kultur, których
eksplantaty poddane zostały ekspozycji na 5 ml SNP w obecności c-PTIO, zawartość
wody, przypadająca na miligram suchej masy, była niższa, niż w kontroli (Tab. 27).
Tab. 27. Świeża i sucha masa oraz zawartość wody w kulturach in vitro lnu zwyczajnego odm.
Selena po 4 tygodniach wzrostu na pożywce bez dodatku hormonów, poddanych działaniu par
wydzielających się z 5 mM wodnego roztworu SNP w obecności c-PTIO. Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05
Szczegółowy opis wariantów doświadczalnych – w opisie Ryc. 58
Wariant
doświadczenia Świeża masa
[mg ekspl.-1
]
Sucha masa
[mg ekspl.-1
]
Zawartość H2O
[mg H2O mg-1
św.m.]
Zawartość H2O
[mg H2O mg-1
s.m.]
K 27,54 ± 8,03 5,36 ± 1,76 0,78± 0,06 6,47 ± 1,23
5 ml SNP 75,82± 5,93* 10,72±1,89* 0,86± 0,05 6,17 ± 1,36
10 ml SNP 57,08± 8,76* 8,77 ± 1,06* 0,85± 0,04 6,37 ± 1,38
c-PTIO 43,80± 6,05* 7,77± 1,33 0,82± 0,05 4,57± 0,88
5 ml SNP+c-PTIO 53,34± 10,23* 10,13±2,21* 0,80± 0,07 3,47± 0,78*
10 ml SNP+c-PTIO 41,17± 7,01 7,50± 1,35 0,84± 0,05 4,71± 1,38

164
4.15 Natężenie stresu oksydacyjnego w kulturach in vitro lnu zwyczajnego
(Linum usitatissimum L.) odm. Selena, poddanych działaniu par
wydzielających się z wodnego roztworu SNP
W celu określenia sposobu oddziaływania NO wydzielającego się z SNP na
stymulację organogenezy w kulturach lnu odm. Selena, parametry stresu
oksydacyjnego, zdolność przeciwwolnorodnikową oraz aktywność enzymów
antyoksydacyjnych zbadano najpóźniej po 15 dniach od inkubacji kultur z SNP.
4.15.1 Zawartość nadtlenku wodoru (H2O2) w kulturach in vitro lnu zwyczajnego
odm. Selena, poddanych działaniu par wydzielających się z wodnego
roztworu SNP
Ekspozycja kultur lnu włóknistego na działanie par wydzielających się z
wodnego roztworu SNP, spowodowała zwiększenie zawartości H2O2 w kulturach
rosnących na podłożu bez dodatku hormonów po 1 dobie oraz 5-ciu i 15-tu dniach od
ekspozycji (Ryc. 61 A). Zwiększenie zawartości H2O2 o 40% w stosunku do kontroli
nastąpiło po 1 dobie i po 5-ciu dniach od ekspozycji na działanie par wydzielających się
z 10 ml roztworu SNP, natomiast po 15-tu dniach od ekspozycji obniżenie zawartości
H2O2 o 35%. W kulturach poddanych działaniu par wydzielających się z 5 ml roztworu
SNP, zawartość H2O2 była wyższa po 5-ciu (o 40%) i 15-tu dniach (o 20%). W
kulturach kontrolnych, rosnących na podłożu bez dodatku hormonów, zawartość H2O2
obniżyła się po 5-ciu dniach wzrostu kultur (Ryc. 61 A).
W kulturach rosnących na pożywce korzeniowej zawartość H2O2 była niższa, w
porównaniu do kontroli o 36% bezpośrednio po ekspozycji na roztwór SNP, o 48% po 1
dobie od ekspozycji, a także o 13% niższa w kulturach po 15-tu dniach od działania
SNP (Ryc. 61 B). W kulturach korzeniowych po 5-ciu dniach od ekspozycji na SNP,
zawartość H2O2 była wyższa o 40%, w porównaniu do kultur kontrolnych (Ryc. 61 B).
W kontrolnych kulturach korzeniowych zawartość H2O2 obniżyła się wraz ze wzrostem
kultur. Po 15-tu dniach wzrostu była o 66% niższa, w porównaniu do kultur po 1 dobie
od działania SNP (Ryc. 61 B).

165
A)
B)
Ryc. 61. Zawartość nadtlenku wodoru (H2O2) w kulturach in vitro lnu zwyczajnego odm.
Selena rosnących na podłożu bez dodatku hormonów (A) i rosnących na pożywce korzeniowej
(B). Wyniki średnie ± SD. * Różnice istotne statystycznie, przy p≤0,05.
(K – eksplantaty hipokotylowe nie traktowane parami wydzielającymi się z SNP; 0 –
eksplantaty hipokotylowe bezpośrednio po 3-godzinnej ekspozycji na pary wydzielające się z
wodnego roztworu SNP; 1 – eksplantaty po 1-szej dobie od ekspozycji na pary wydzielające się
z wodnego roztworu SNP; 5, 15 – kultury in vitro w 5-tym, 15-tym dniu od ekspozycji na pary
wydzielające się z wodnego roztworu SNP)
0
200
400
600
800
0 1 5 15
H2O
2 [n
mo
l g
-1 ś
w.m
.]
Czas wzrostu [dni]
K 5 ml SNP 10 ml SNP
* * * *
*
0
200
400
600
800
0 1 5 15
H2O
2 [n
mo
l g
-1 ś
w.m
.]
Czas wzrostu [dni]
K 5 ml SNP
* * *
*

166
4.15.2 Zawartość produktów peroksydacji lipidów, reagujących z kwasem
tiobarbiturowym (TBARS) w kulturach in vitro lnu odm. Selena,
poddanych działaniu par wydzielających się z wodnego roztworu SNP
Wykazano zwiększenie zawartości (o 57%) produktów peroksydacji lipidów
reagujących z kwasem tiobarbiturowym (TBARS), w kulturach rosnących na pożywce
bez dodatku hormonów po 5-ciu dniach od ekspozycji na pary wydzielające się z 10 ml
SNP, w porównaniu do kultur kontrolnych. W kulturach poddanych ekspozycji na pary
wydzielające się z 5 ml roztworu SNP, nie zaobserwowano wzmożonej peroksydacji
lipidów (Ryc. 62 A).
Najwyższą zawartość peroksydacji lipidów zaobserwowano w kulturach
kontrolnych, o około 55% wyższą w stosunku do kultur bezpośrednio po ekspozycji na
roztwór SNP i o 55% (kultury poddane działaniu 5 ml roztworu SNP) oraz o 30%
(kultury poddane działaniu 10 ml roztworu SNP) wyższą, w porównaniu do kultur po
1– szej dobie od ekspozycji na SNP (Ryc. 62 A).
Zawartość TBARS w kulturach kontrolnych, rosnących na pożywce z dodatkiem
hormonów warunkujących powstawanie korzeni, była wyższa o 72% w porównaniu do
kultur poddanych działaniu SNP bezpośrednio (0 dni wzrostu) po wyłożeniu
eksplantatów na podłoże (Ryc. 62 B). Zawartość produktów peroksydacji lipidów w
kulturach kontrolnych obniżyła się wraz z czasem wzrostu kultur. Zawartość produktów
TBARS była najwyższa (około 70%) w kulturach poddanych działaniu par SNP, po 1
dobie od ekspozycji, a następnie obniżyła się (Ryc. 62 B).

167
A)
B)
Ryc. 62. Zawartość produktów peroksydacji lipidów (TBARS) w kulturach in vitro lnu
zwyczajnego odm. Selena rosnących na podłożu bez dodatku hormonów (A) i rosnących na
pożywce korzeniowej (B). Wyniki średnie ± SD. * Różnice istotne statystycznie, przy p≤0,05.
Szczegółowy opis wariantów doświadczalnych – w opisie Ryc. 61.
0
20
40
60
80
100
120
0 1 5 15
TB
AR
S [
nm
ol
g-1
św
.m.]
Czas wzrostu [dni]
K 5 ml SNP 10 ml SNP
* *
*
* *
0
20
40
60
80
100
120
0 1 5 15
TB
AR
S [
nm
ol
g-1
św
.m.]
Czas wzrostu [dni]
K 5 ml SNP
* *

168
4.16 Zdolność przeciwwolnorodnikowa oraz aktywność enzymów
antyoksydacyjnych w kulturach in vitro lnu zwyczajnego (Linum
usitatissimum L.) odm. Selena, poddanych działaniu par
wydzielających się z wodnego roztworu SNP
4.16.1 Zdolność przeciwwolnorodnikowa określona na zasadzie redukcji
stabilnego wolnego rodnika 1,1-difenylo-2-pikrylohydrazylowego (DPPH.)
w kulturach in vitro lnu odm. Selena, poddanych działaniu par
wydzielających się z wodnego roztworu SNP
Zbadano oddziaływanie ekstraktów, pozyskanych z kultur poddanych działaniu
par wydzielających się z roztworu SNP z rodnikiem DPPH. metodą EPR. Na rycinie 63
i 65 przedstawiono widmo EPR, typowe dla rodnika DPPH. (kontrola) oraz DPPH
., po
reakcji z ekstraktem uzyskanym z kultur. Dodanie badanych ekstraktów do roztworu
rodnika DPPH., spowodowało zmniejszenie amplitudy sygnału, co świadczy o
właściwościach przeciwwolnorodnikowych badanych kultur. W celu określenia
aktywności ekstraktów użytych w doświadczeniu w reakcji z DPPH., za 100 % przyjęto
intensywność środkowej linii sygnału widma (h).
Redukcja rodnika DPPH. pod wpływem ekstraktu z kultur, rosnących na
pożywce bez dodatku hormonów, po 15-tym dniu od ekspozycji eksplantatów na pary
wydzielające się z 10 ml SNP, obniżyła się o około 50% względem kultur kontrolnych
(Ryc. 64). W pozostałych wariantach doświadczalnych (po 0, 1, 5-ciu dniach wzrostu)
nie zaobserwowano istotnych różnic w ilości rodnika DPPH, pod wpływem ekstraktów
z kultur poddanych ekspozycji zarówno na 5 ml jak i 10 ml SNP, w porównaniu z
kontrolą (Ryc. 64).

169
Ryc. 63. Przykładowe widmo EPR DPPH.
– widmo rodnika DPPH. (linia czarna) oraz K –
DPPH. po reakcji z ekstraktem z 15-dniowych kultur odm. Selena rosnących na podłożu bez
dodatku hormonów (linia zielona), 5 ml SNP – DPPH. po reakcji z ekstraktem z 15-dniowych
kultur rosnących na podłożu bez dodatku hormonów, poddanych działaniu par wydzielających
się z 5 ml SNP (linia żółta) i 10 ml SNP – DPPH. po reakcji z ekstraktem z 15-dniowych kultur
rosnących na podłożu bez dodatku hormonów, poddanych działaniu par wydzielających się z 10
ml SNP (linia niebieska)
Ryc. 64. Redukcja stabilnego wolnego rodnika DPPH. w kulturach in vitro lnu zwyczajnego
odm. Selena, poddanych działaniu 5 mM roztworu SNP, rosnących na podłożu bez dodatku
hormonów. Wyniki średnie ± SD. * Różnice istotne statystycznie, przy p≤0,05.
Szczegółowy opis wariantów doświadczalnych – w opisie Ryc. 61.
9000
11000
13000
15000
17000
19000
21000
23000
330 332 334 336 338 340 342
Inte
nsy
wn
ość
sy
gn
ału
DP
PH
Pole magnetyczne [mT]
DPPH K 5 ml SNP 10 ml SNP
h
0
20
40
60
80
100
0 1 5 15 Red
uk
cja
ro
dn
ika
DP
PH
[%
]
Czas wzrostu [dni]
K 5 ml SNP 10 ml SNP
*

170
Ekstrakt z kultur korzeniowych, otrzymany bezpośrednio (0 dni wzrostu) po
ekspozycji na pary roztworu SNP, zmniejszył ilość rodnika DPPH. o około 25%,
względem kultur kontrolnych (Ryc. 66). W kulturach po 1 - szej dobie od zakończenia
ekspozycji na SNP, redukcja rodnika zmniejszyła się o około 35% w porównaniu do
kontroli (Ryc. 66).
Ryc. 65. Przykładowe widmo EPR DPPH. – widmo rodnika DPPH (linia czarna) oraz K –
DPPH, po reakcji z ekstraktem z kultur korzeniowych odm. Selena (linia czerwona) i 5 ml SNP
– DPPH, po reakcji z ekstraktem z kultur korzeniowych, bezpośrednio (0 dni wzrostu) po
działaniu par wydzielających się z 5 ml SNP (linia żółta)
Ryc. 66. Redukcja stabilnego wolnego rodnika DPPH w kulturach in vitro lnu zwyczajnego
odm. Selena, poddanych ekspozycji na pary wydzielające się z 5mM roztworu SNP, rosnących
na pożywce korzeniowej. Wyniki średnie ± SD. * Różnice istotne statystycznie, przy p≤0,05.
Szczegółowy opis wariantów doświadczalnych – w opisie Ryc. 61.
5000
10000
15000
20000
25000
30000
330 332 334 336 338 340 342
Inte
nsy
wn
ość
sy
gn
ału
DP
PH
Pole magnetyczne [mT]
DPPH K 5 ml SNP
0
20
40
60
80
100
0 1 5 15
Red
uk
cja
ro
dn
ika
DP
PH
[%
]
Czas wzrostu [dni]
K 5 ml SNP
*
*
h

171
4.16.2 Oznaczanie aktywności dysmutazy ponadtlenkowej (SOD) w kulturach in
vitro lnu odm. Selena, poddanych działaniu par wydzielających się z
wodnego roztworu SNP
Aktywność SOD w kulturach po 5-tym dniu wzrostu, poddanych działaniu par
wydzielających się z 5 i 10 ml roztworu SNP, była o około 20%, wyższa w porównaniu
z kulturami kontrolnymi (Ryc. 67 A).W pozostałych wariantach doświadczalnych, nie
zanotowano istotnych różnic w aktywności SOD, kultur narażonych na działanie SNP,
w stosunku do kontroli (Ryc. 67 A).
Najwyższą aktywność w kulturach lnu włóknistego rosnących na podłożu bez
dodatku hormonów, (zwłaszcza w 5 dniu wzrostu kultur) wykazywała CuZn SOD,
zarówno w kulturach poddanych działaniu par wydzielających się z 5 ml oraz 10 ml
SNP, jak i w kontroli (Ryc. 67 B). Bezpośrednio (0 dni wzrostu) po działaniu par
roztworu SNP na kultury, nie zaobserwowano istotnych różnic w aktywności tej
izoformy w stosunku do kontroli. Po 1 dobie od inkubacji kultur z roztworem SNP,
aktywność CuZn SOD wzrosła o około 30%, w porównaniu z kulturami kontrolnymi.
Wraz ze wzrostem kultur aktywność tej izoformy w kulturach poddanych działaniu
SNP, obniżyła się o około 24% (kultura poddana ekspozycji 10 ml roztworu SNP) w 5-
tym dniu wzrostu i o około 50% - kultury poddane działaniu 5 ml roztworu SNP oraz o
około 60 % - kultury eksponowane na 10 ml roztworu SNP w 15-tym dniu wzrostu, w
stosunku do kontroli (Ryc. 67 B).
Wzmożoną aktywność MnSOD zaobserwowano w kulturach poddanych
fumigacji 10 ml roztworu SNP, zarówno bezpośrednio (0 dni wzrostu) po ekspozycji na
SNP, jak i w 15-tym dniu wzrostu kultur (Ryc. 67 C). W kulturach po 1 dobie od
działania roztworu SNP, aktywność MnSOD spadła o około 45%, w porównaniu z
kontrolą (Ryc. 67 C).
Najniższą aktywność wykazywała FeSOD (Ryc. 67 D). W kulturach
inkubowanych z 5 ml roztworu SNP po 5-tym dniu wzrostu, zaobserwowano
podwyższenie aktywności FeSOD o około 70%, natomiast w 15-tym dniu wzrostu
obniżenie aktywności o około 60%, w porównaniu z kulturami kontrolnymi (Ryc. 67
D).

172
A)
B)
C)
0
4
8
12
16
20
24
0 1 5 15
SO
D [
U m
g-1
bia
łka
]
Czas wzrostu [dni]
K 5 ml SNP 10 ml SNP
* *
0
4
8
12
16
20
24
0 1 5 15
Cu
Zn
SO
D [
U m
g-1
bia
łka
]
Czas wzrostu [dni]
K 5 ml SNP 10ml SNP
* *
*
* *
0
4
8
12
16
20
24
0 1 5 15
Mn
SO
D [
U m
g-1
bia
łka
]
Czas wzrostu [dni]
K 5 ml SNP 10 ml SNP
*
*
*

173
D)
Ryc. 67. Aktywność dysmutazy ponadtlenkowej (SOD) i jej izoform w kulturach in vitro lnu
zwyczajnego odm. Selena, poddanych ekspozycji na pary wydzielające się z 5 mM roztworu
SNP, rosnących na podłożu bez dodatku hormonów. Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05.
Szczegółowy opis wariantów doświadczalnych – w opisie Ryc. 61.
Aktywność SOD w kulturach korzeniowych obniżyła wraz ze wzrostem kultur,
zarówno eksponowanych na SNP, jak i kontrolnych (Ryc. 68 A). W kulturach
bezpośrednio (0 dni wzrostu) po działaniu SNP odnotowano obniżenie aktywności
enzymu o 25%, w porównaniu z kontrolą. W 5-tym dniu od ekspozycji na SNP
aktywność SOD w kulturach obniżyła się o około 20%, w stosunku do kontroli (Ryc. 68
A).
Wzmożoną aktywność CuZn SOD (o około 35% wyższa od kontroli),
zaobserwowano w kulturach korzeniowych 5 dni po ekspozycji na działanie par
roztworu SNP (Ryc. 68 B). Po 15-tym dniu wzrostu w kulturach wykazano obniżenie
aktywności tej izoformy o około 80% w stosunku do kontroli (Ryc. 68 B).
W trakcie wzrostu kultur korzeniowych zaobserwowano spadek aktywności
MnSOD. Jedynie w kulturach po 5-tym dniu wzrostu od ekspozycji na pary roztworu
SNP, zanotowano wzmożoną aktywności MnSOD o około 75%, w porównaniu z
kontrolą (Ryc. 68 C).
Kultury korzeniowe odznaczały się najniższą aktywnością Fe SOD. W kulturach
po 15-tym dniu wzrostu od ekspozycji na roztwór SNP, zaobserwowano wyższą
aktywność FeSOD o około 65%, w stosunku do kontroli (Ryc. 68 D).
0
4
8
12
16
20
24
0 1 5 15
FeS
OD
[U
mg
-1 b
iałk
a]
Czas wzrostu [dni]
K 5 ml SNP 10 ml SNP
* *

174
A)
B)
C)
0
4
8
12
16
20
24
0 1 5 15
SO
D [
U m
g-1
bia
łka
]
Czas wzrostu [dni]
K 5 ml SNP
*
*
0
4
8
12
16
20
24
0 1 5 15
Cu
Zn
SO
D [
U m
g-1
bia
łka
]
Czas wzrostu [dni]
K 5 ml SNP
*
*
0
4
8
12
16
20
24
0 1 5 15
Mn
SO
D [
U m
g-1
bia
łka
]
Czas wzrostu [dni]
K 5 ml SNP
*

175
D)
Ryc. 68. Aktywność dysmutazy ponadtlenkowej (SOD) i jej izoform w kulturach in vitro lnu
zwyczajnego odm. Selena poddanych ekspozycji na pary wydzielające się z 5mM roztworu
SNP, rosnących na pożywce korzeniowej. Wyniki średnie ± SD. *Różnice istotne statystycznie,
przy p≤0,05.
Szczegółowy opis wariantów doświadczalnych – w opisie Ryc. 61.
4.16.3 Oznaczanie aktywności katalazy (CAT) w kulturach in vitro lnu odm.
Selena, poddanych działaniu par wydzielających się z wodnego roztworu
SNP
W kulturach poddanych działaniu 10 ml roztworu SNP, po 15-tym dniu wzrostu
aktywność CAT, była wyższa o 45% w stosunku do kontroli (Ryc. 69 A). Aktywność
CAT, w kulturach poddanych działaniu roztworu SNP, bezpośrednio (0 dni wzrostu) i
po 1 dobie od ekspozycji była zbliżona do kontroli. Po 5-tym dniu od działania SNP, w
kulturach rosnących na podłożu bez dodatku hormonów, aktywność CAT obniżyła się o
około 46%, w porównaniu do kontroli (Ryc. 69 A).
W kulturach korzeniowych bezpośrednio (o około 15%) i po 5-tym dniu (o
około 50%) po ekspozycji na roztwór SNP, odnotowano obniżenie aktywności CAT, w
porównaniu do kultur kontrolnych (Ryc. 69 B). Po 15-tym dniu wzrostu aktywność
CAT, była wyższa w kulturach poddanych fumigacji SNP, o około 40%, niż w kontroli
(Ryc. 69 B).
0
4
8
12
16
20
24
0 1 5 15
FeS
OD
[U
mg
-1 b
iałk
a]
Czas wzrostu [dni]
K 5 ml SNP
*

176
A)
B)
Ryc. 69. Aktywność katalazy (CAT) w kulturach in vitro lnu zwyczajnego odm. Selena,
poddanych ekspozycji na pary wydzielające się z 5 mM roztworu SNP, rosnących na podłożu
bez dodatku hormonów (A) i na pożywce korzeniowej (B). Wyniki średnie ± SD. Wyniki
średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Szczegółowy opis wariantów doświadczalnych – w opisie Ryc. 61.
4.16.4 Zawartość białka w ekstraktach wykorzystanych do określenia aktywności
enzymów antyoksydacyjnych w kulturach in vitro lnu zwyczajnego (Linum
usitatissimum L.) odm. Selena, poddanych działaniu par wydzielających się
z wodnego roztworu SNP
Zawartość białka w kulturach rosnących na pożywce bez dodatku hormonów,
poddanych działaniu par wydzielających się z 10 ml roztworu SNP, po 5-tym dniu
wzrostu obniżyła się o 18%, a po 15-tym dniu wzrostu o 26%, w porównaniu z kontrolą
(Ryc. 70 A).
0
4
8
12
16
20
24
0 1 5 15
CA
T [
mm
ol
H2O
2 m
in-1
mg
-1
bia
łka
]
Czas wzrostu [dni]
K 5 ml SNP 10 ml SNP
* * *
0
4
8
12
16
20
24
0 1 5 15
CA
T [
mm
ol
H2O
2 m
in-1
mg
-1
bia
łka
]
Czas wzrostu [dni]
K 5 ml SNP
*
* *

177
W kulturach korzeniowych poddanych ekspozycji na pary roztworu SNP,
zawartość białka bezpośrednio (0 dni wzrostu) (o 15%), po 1-szej dobie (o 23%) oraz
po 15-tym dniu (o 10%) od działania SNP, obniżyła się, w stosunku do kultur
kontrolnych (Ryc. 70 B).
A)
B)
Ryc. 70. Zawartość białka w kulturach in vitro lnu zwyczajnego odm. Selena poddanych
działaniu par wydzielających się z 5 mM roztworu SNP, rosnących na podłożu bez dodatku
hormonów (A) i na pożywce korzeniowej (B). Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05.
Szczegółowy opis wariantów doświadczalnych – w opisie Ryc. 61.
0
30
60
90
120
150
0 1 5 15 Za
wa
rto
ść b
iałk
a [
µg
g-1
św
.m.]
Czas wzrostu [dni]
K 5 ml SNP 10 ml SNP
* *
0
30
60
90
120
150
0 1 5 15 Za
wa
rto
ść b
iałk
a [
µg
g-1
św
.m.]
Czas wzrostu [dni]
K 5 ml SNP
* *
*

178
5 Dyskusja
5.1 Optymalne warunki wzrostu oraz przebieg wybranych procesów w
kulturach in vitro lnu zwyczajnego (Linum usitatissimum L.) odm.
Szafir (typ oleisty) i odm. Selena (typ włóknisty)
Początkowy etap przeprowadzonych badań dotyczył ustalenia optymalnych
warunków wzrostu i organogenezy badanych odmian lnu w kulturach
in vitro. Przebadano kilka pożywek: MS, B5 oraz MS+B5, a także różne rodzaje
i stężenia hormonów w celu wyboru odpowiednich dla kaulogenezy i ryzogenezy.
Efektywność organogenezy pędowej jak i korzeniowej w kulturach odm. Szafir,
zachodziła na wysokim poziomie na wszystkich przetestowanych podłożach. Jednak
pomimo 100% organogenezy pędowej w kulturach rosnących na pożywkach B5 oraz
MS+B5, widoczne były oznaki starzenia (4 tydzień wzrostu) w postaci żółknięcia
pędów. Kultury te odznaczały się również niższą świeżą oraz suchą masą (Tab. 8-9). W
kulturach korzeniowych odm. Szafir rosnących na podłożu MS, formujące się korzenie
były dłuższe niż na eksplantatach rosnących na pozostałych pożywkach. W przypadku
odm. Selena organogenezę pędową obserwowano na pożywce B5, gdzie była ona
najwyższa oraz na MS+B5. W kulturach korzeniowych tej odmiany najefektywniejsze
namnażanie korzeni zachodziło na podłożu B5. W przeciwieństwie do organogenezy
pędowej lnu włóknistego, ryzogeneza zachodziła w kulturach rosnących również na
pożywce MS, chociaż zdecydowanie słabiej. Na postawie przeprowadzonych badań
zaobserwowano nawet o 60% słabszą efektywność w formowaniu pędów i o 15-20% w
formowaniu korzeni w kulturach lnu włóknistego niż oleistego.
W przypadku kultur pędowych szybkość pojawiania się organów na
eksplantatach była różna u obu odmian. Pędy w kulturach lnu oleistego pojawiały się
już w pierwszym tygodniu wzrostu kultury. Natomiast u lnu włóknistego kaulogeneza
zachodziła wolniej, a organy widoczne były w 2 tygodniu wzrostu (Ryc. 8). Zauważono
również, że w kulturach pędowych odm. Selena, powstający kalus ulegał brązowieniu.
Biorąc pod uwagę powyższe obserwacje, do dalszych analiz dla odm. Szafir wybrano
podłoże MS, uznawane za najbardziej uniwersalne i najczęściej stosowane w kulturach
in vitro (George i wsp. 2008, Greenway i wsp. 2012), a dla odm. Selena - B5, pożywkę
nie zawierającą jonów amonowych. Pożywka MS okazała się odpowiednia również do
wzrostu kultur perowskii bylicowatej (Perovskia abrotanoides Karel.), a także w
kulturach gatunku z rodzaju pochrzyn (Dioscorea remotiflora (Kunth)) oraz lnu

179
zwyczajnego odm. Super (Bernabė-Antonio i wsp. 2012, Zaker i wsp. 2013, Takáč i
wsp. 2016). W przypadku kultur rośliny z rodzaju kufea (Cuphea aequipetala Cav.)
najlepszą do wzrostu i ryzogenezy była pożywka B5 (Martínez-Bonfil i wsp. 2014).
Spośród przetestowanych cytokinin, stymulujących organogenezę pędową u
obu odmian lnu, do dalszych doświadczeń wybrano BA. Liczba pędów formujących się
na eksplantatach hipokotylowych u odm. Szafir, rosnących na podłożu z dodatkiem BA,
była nawet 4-krotnie wyższa, niż na pożywkach z dodatkiem TDZ czy KIN. Najwyższą
efektywność BA w formowaniu pędów z eksplantatów hipokotylowych lnu odm. Szafir
obserwowano także we wcześniejszych badaniach własnych (Baran 2007). W
przypadku odm. Selena powstawanie pędów obserwowano jedynie w obecności dwóch
cytokinin BA oraz KIN. Dodanie do pożywki TDZ powodowało jedynie namnażanie
kalusa i zwiększenie świeżej masy kultur. Związek ten prowadzi do akumulacji wody i
w konsekwencji blokowania zdolności regeneracyjnych w warunkach in vitro (Paques
1991). Efektywność organogenezy, jak i liczba powstających pędów, była zbliżona
niezależnie od zastosowanej cytokininy. Stwierdzono jednak, że świeża masa i sucha
masa eksplantatów z pędami rosnących w obecności BA, była wyższa niż w obecności
KIN. Cytokinina BA również okazała się najbardziej efektywna w indukcji
organogenezy pędowej z eksplantatów liścieniowych śliwy (Prunus L.) czy Drymeria
cordata, tropikalnej rośliny z rodziny goździkowatych (Nas i wsp. 2010, Ghimire
2010). Odmiennych danych dostarczają natomiast badania Bretagne i
współpracowników (1994), którzy wykazali, iż formowanie pędów na eksplantatch
hipokotylowych lnu odmian Ariane, Antarĕs i Viking było wyższe w obecności TDZ.
Natomiast najefektywniejszą w organogenezie korzeni w kulturach obu odmian lnu
okazała się auksyna NAA (Ryc. 14-17.). Dodatek tego hormonu do podłoża sprzyjał
formowaniu korzeni, także w kulturach perowskii bylicowatej oraz bazylii świętej
(Ocimum sanctum L.) (Shilpa i wsp. 2010, Zaker i wsp. 2013). Z kolei w kulturach
Cuphea aequipetala i pochrzynu to IBA była efektywniejsza w stymulacji ryzogenezy
niż NAA (Bernabė-Antonio i wsp. 2012, Martínez-Bonfil i wsp. 2014).
Dostępnych jest szereg danych dotyczących efektywności wzajemnych proporcji
auksyn i cytokinin na wzrost kalusa i indukcję organogenezy w kulturach in vitro (Sha
Valli Khan i wsp. 1999, Martin-Uridoz i wsp. 2004). W przypadku roślin z rodzaju
Solanum brak auksyny w pożywce powodował obniżoną regenerację pędów (Hendrix i
wsp. 1987). Organogeneza pędów u żywopłonu (Aeschynomene spp.) była najwyższa,
gdy pożywka, na której namnażano kalus, zawierała niskie stężenie NAA (Rey i

180
Mroginski 1996). Przetestowano więc różne proporcje auksyny i cytokininy w
pożywce, w celu wyboru optymalnych zakresów stężeń tych hormonów na kierunek
organogenezy badanych odmian lnu. Badania potwierdziły ogólną zasadę, że im wyższe
stężenie cytokininy w stosunku do auksyny w pożywce, tym efektywniejsza
kaulogeneza, natomiast przy wyższej zawartości auksyny w porównaniu do cytokininy
następuje formowanie korzeni. Ustalono, że w obecności samej cytokininy w pożywce
(0:1, Ryc. 18-19), oraz gdy stężenie cytokininy BA jest co najmniej 40-krotnie wyższe
niż auksyny 2,4-D (1:40, Ryc. 18-19), kaulogeneza u obu odmian lnu zachodzi
najefektywniej. W przypadku kultur korzeniowych obserwowano zależności odwrotne.
To wzbogacenie podłoża samą auksyną NAA (0:1, Ryc. 20-21), lub auksyną i
cytokininą w stosunku 1:40 (BA:NAA, Ryc. 20-21), sprzyjało najlepszej organogenezie
korzeni w kulturach odm. Szafir, jak i Selena. Zmniejszenie proporcji stężeń
hormonów w pożywce powodowało obniżenie efektywności organogenezy, zwłaszcza
w kulturach lnu włóknistego. Podobne wyniki, dotyczące wpływu wzajemnych
proporcji stężeń hormonów na wydajność organogenezy, uzyskano w kulturach
pędowych szparaga (Asparagus sp. L.) oraz goryczki (Gentiana sp. L.) (Benmoussa i
wsp. 1996, Unda i wsp. 2007). Natomiast w przypadku kultur dzwonka karpackiego
(Campanula carpatica Jacq.), powstawanie pędów na drodze organogenezy pośredniej
stwierdzono przy równym stężeniu auksyny i cytokininy w pożywce (Frello i wsp.
2002).
Na podstawie powyższych danych można zauważyć znaczące różnice pomiędzy
warunkami sprzyjającymi optymalnej organogenezie lnu włóknistego i oleistego.
Dotyczą one nie tylko jakości użytego podłoża (składu pożywki, która okazała się
optymalną), ale także rodzaju i stężenia dodanych auksyn i cytokinin. Wymagania co do
składu pożywek w kulturach in vitro ściśle uzależnione są od badanego gatunku, typu, a
nawet odmiany.
Różnice w szybkości oraz intensywności organogenezy pędowej i korzeniowej
badanych typów lnu potwierdzono również na podstawie zmian anatomicznych
zachodzących w początkowej fazie wzrostu kultur. Należy zaznaczyć również, że tempo
rozwoju oraz pojawienia się organów na eksplantatach w obrębie tej samej szalki, w
której prowadzono kulturę, było bardzo niejednorodne. Na przekrojach poprzecznych
eksplantatów pochodzących z kultur pędowych odm. Szafir, już po 3 dobie wzrostu
można było zauważyć zgrupowania dzielących się komórek tworzące centra
merystematyczne (zawiązki pąków przybyszowych), które po 5 dobie zaczynają

181
uwypuklać się na powierzchni eksplantatu (Fot. 6.5 -6.5a). Tak wczesne pojawienie się
zawiązków pędów nie formujących się z tkanki kalusowej, sugeruje ich powstawanie na
drodze bezpośredniej organogenezy. W przypadku odm. Selena komórki miękiszu jak i
epidermy, dzielą się wolniej i z mniejszą intensywnością niż u odm. Szafir. Zawiązki
pędów przybyszowych zaczynają uwypuklać się na powierzchni eksplantatu później niż
u lnu oleistego, bo po 7 dobie wzrostu (Fot. 7.7). Jednakże, tak jak w przypadku odm.
Szafir, podobny sposób formowania pędów sugeruje ich powstawanie na drodze
organogenezy bezpośredniej. W ciągu pierwszego tygodnia wzrostu kultury
korzeniowej lnu oleistego na przekrojach poprzecznych eksplantatów zaobserwowano
tworzenie się korzeni przybyszowych z kambium walca osiowego, co świadczy o
powstawaniu tych organów na drodze organogenezy bezpośredniej (Fot. 8).
Pochodzenie korzeni w kulturach lnu oleistego może być jednak dwojakie.
Przypuszczalnie na dalszym etapie wzrostu korzenie powstają również z formującego
się kalusa. W przypadku kultur korzeniowych lnu włóknistego, po tygodniu wzrostu
powstają bardzo nieliczne zawiązki korzeni przybyszowych wyrastające z walca
osiowego niewidoczne jeszcze na powierzchni eksplantatu (Fot. 9). Późniejsze
pojawianie się organów na powierzchni eksplantatów tej odmiany sugeruje, że korzenie
mogą formować się także z powstającej tkanki kalusowej.
Zbadano zawartość barwników fotosyntetycznych, oraz wymianę gazową zarówno
w kulturach lnu na różnych etapach wzrostu, jak i w 7-dniowych sterylnych siewkach,
będących źródłem eksplantatów. Najwyższą zawartość barwników fotosyntetycznych
stwierdzono w siewkach. Poziom barwników fotosyntetycznych u obu odmian lnu był
podobny, najwyższy chlorofilu a, natomiast najniższy karotenoidów. Odnotowano
znaczący spadek poziomu barwników podczas wzrostu kultur. Stwierdzono różnice w
ich zawartości pomiędzy odmianami (Ryc. 22-23). Kultury odm. Szafir odznaczały się
wyższym poziomem barwników fotosyntetycznych w trakcie wzrostu, niż kultury odm.
Selena. Nie wydaje się, aby różnice te wynikały z odmiennego rodzaju i stężenia użytej
w pożywce cytokininy, jak w przypadku liliowca ogrodowego (Hemerocallis xhybrida
Hort.) oraz goździka ogrodowego (Dianthus caryophyllus L.) (Genkov i wsp. 1997;
Gabryszewska i wsp. 2009), ponieważ w doświadczeniach własnych wykorzystano tą
samą dla obu odmian cytokininę (BA) i jej jednakowe stężenie. Przypuszczać można, iż
obserwowane różnice uzależnione są od typu lnu (być może od nieco odmiennego
metabolizmu obu typów). Możliwe również, że zmiany zawartości barwników
fotosyntetycznych wynikają z różnic w składzie jakościowym pożywek, odmiennych

182
dla każdej z odmian. Różnice w poziomie chlorofili wykazano u siewek kukurydzy,
rosnących na podłożu wzbogaconym o wyższe stężenie molibdenu w porównaniu z
siewkami rosnącymi w warunkach kontrolnych (Pazurkiewicz-Kocot i wsp. 2009).
Przez wiele lat sądzono, że proces fotosyntezy w kulturach in vitro nie zachodzi lub
zachodzi z bardzo słabą wydajnością. Obecnie jest wiele dowodów na to, że fotosynteza
zachodzi w kulturach in vitro oraz ma bardzo duże znaczenie w procesach aklimatyzacji
i adaptacji do naturalnych warunków roślin powstałych dzięki tej technice (Borkowska
2003). Aktywność fotosyntetyczna w kulturach in vitro zależy od takich samych
czynników środowiskowych, jak w warunkach naturalnych: światła, CO2, wody,
temperatury, ale także (w sposób pośredni lub bezpośredni) od składu pożywki –
zwłaszcza od obecności cukrów, liczby pędów czy długości pojedynczego pasażu
(Serret i wsp. 2001, Borkowska 2003).
Oznaczenia natężenia fotosyntezy netto i oddychania ciemniowego z
zastosowaniem analizatora CO2 w podczerwieni (LI-COR 6262) przeprowadzono w
kulturach pędowych obu odmian lnu w 5-tym, 14-tym i 28-mym dniu wzrostu oraz w
7-dniowych sterylnych siewkach, stanowiących źródło eksplantatów. Natężenie
fotosyntezy obniżało się w czasie wzrostu kultur, aktywność procesu pod koniec ich
wzrostu była 4-krotnie niższa niż u siewek. Natężenie oddychania ciemniowego nie
zmieniało się znacząco w trakcie wzrostu kultur (Ryc. 24). Obniżenie zarówno
natężenia fotosyntezy, jak i zawartości barwników fotosyntetycznych u badanych
odmian, wynika prawdopodobnie ze starzenia się kultur.
Wstępne analizy LZO (lotne związki organiczne) oraz związków organicznych w
ekstraktach metanolowych wskazują na różnice w składzie chemicznym kultur lnu
oleistego i włóknistego. Dotyczą one nie tylko zmieniającego się w trakcie wzrostu
kultur pędowych badanych odmian procentowego udziału, ale również ilości
zidentyfikowanych związków. Ponadto, kultury odm. Selena charakteryzowała się
bardziej zróżnicowanym składem emitowanych związków, niż odm. Szafir (Tab. 14-15;
Ryc. 25-26). Również w obrębie jednej odmiany widoczne są wyraźne różnice w
składzie zidentyfikowanych związków organicznych. W przypadku lnu oleistego
obserwowano zmiany w ilości aminokwasów oraz kwasów alifatycznych i glicerydów
w trakcie wzrostu kultur, natomiast u lnu włóknistego również zmiany zawartości
związków aromatycznych. Wysoka zawartość związków z grupy „węglowodany i
glukozydy”, może częściowo wynikać z dużej ilości sacharozy dostarczonej z pożywką,
na której rosły kultury (Ryc. 25-26; Tab. I-II). Sugeruje to prawdopodobne różnice w

183
metabolizmie badanych odmian. Jednak określenie roli poszczególnych
zidentyfikowanych związków i powiązanie ich metabolizmu, m.in. z efektywnością
oraz szybkością formowania organów na eksplantatach, wymaga dalszych i bardziej
rozległych badań.
Kultury tkanek roślinnych są systemami, które podczas zakładania jak i wzrostu
narażone są na wiele czynników stresowych, takich jak: mechaniczne uszkodzenie
podczas wycinania eksplantatów, niedobór powietrza na skutek rozwarstwienia i szoku
osmotycznego wywołanych wnikaniem pożywki w przestrzenie międzykomórkowe,
zwiększonym stężeniem związków mineralnych lub hormonów. W zależności od
odpowiednio zaprojektowanej pożywki, jak i całego eksperymentu możliwe jest
wywołanie pozytywnego lub negatywnego efektu morfogenetycznego w warunkach in
vitro (Gaspar i wsp. 2002). Czynniki środowiskowe wywołujące stres oksydacyjny
kształtują strukturę oraz funkcjonowanie roślin. W przypadku kultur tkankowych są to
głównie zranienie, skład pożywek oraz warunki panujące wokół eksplantatów (Cassells
i Curry 2001). Czynniki stresowe, towarzyszące rozwojowi materiału roślinnego w
warunkach in vitro, mogą prowadzić do negatywnych skutków: redukcji wody w
tkankach, obniżenia zdolności regeneracji czy przyspieszenia procesu starzenia (Benson
2000). System antyoksydacyjny, którego aktywność wzrasta w warunkach stresowych,
odgrywa ważną rolę w regulacji morfogenezy w warunkach in vitro (Chen i Ziv 2001).
Zaobserwowano, że wzajemne zmiany aktywności enzymów, takich jak SOD, CAT czy
POD wpływały na organogenezę pędów lub na embriogenezę somatyczną u mieczyka
(Gladiolus L.) (Dutta Gupta i Datta 2004). Autorzy sugerowali, że endogenny poziom
H2O2 (najbardziej stabilnego związku wśród ROS) oraz zmiany aktywności POD, CAT,
SOD mogą stanowić ważne źródło oceny kompetencji roślin do regeneracji
(Szechyńska-Hebda i wsp. 2012). Dlatego też w badaniach własnych kultury
wybranych odmian lnu, rosnące we wcześniej dobranych optymalnych warunkach do
wzrostu oraz organogenezy, poddano analizie zawartości metabolitów wtórnych oraz
aktywności enzymów antyoksydacyjnych , takich jak SOD oraz CAT.
Zawartość fenylopropanoidów i flawonoidów w siewkach oraz we fragmentach
hipokotyli lnu oleistego (Szafir), pobranych do wzrostu w warunkach in vitro, była
zdecydowanie wyższa, niż lnu włóknistego (Selena), (Ryc. 27-28) . W trakcie wzrostu
kultur obu typów lnu, ilość tych związków uległ obniżeniu. Obserwowany wyższy
poziom fenylopropanoidów i flawonoidów w hipokotylach odm. Szafir może wynikać z
ich większej wrażliwości na uszkodzenie mechaniczne, które indukują syntezę

184
związków fenolowych, co wykazano m.in. w kulturach cisu pospolitego (Taxus baccata
L.) (Dubravina i wsp. 2005). Stężenie tej grupy metabolitów wtórnych wzrastało wraz z
wiekiem kultur korzeniowych u odm. Selena. Podobnie, zmiany zawartości fenoli, w
zależności od czasu trwania hodowli, oraz od poziomu rozwoju tkanek w warunkach in
vitro, obserwowano w kulturach rośliny z rodziny hiacyntowatych (Merwilla plumbea
(Lindl.) Speta) (Aremu i wsp. 2013). Wykazano, że wzrost produkcji metabolitów
wtórnych w tkankach, następuje podczas ich różnicowania (Palacio i wsp. 2012)
Zawartość fenylopropanoidów oraz flawonoidów jest różna w zależności od
indukowanej w kulturach in vitro organogenezy, co potwierdzono w badaniach kultur
Ceropegia santapaui (Chavan i wsp. 2014) i lnu zwyczajnego (Drozdowska 2013). W
przypadku antocyjanów, odnotowano o 50% wyższą zawartość tych związków w
eksplantatach pobranych z hipokotyli siewek lnu włóknistego w porównaniu do lnu
oleistego. Zawartość tych metabolitów kształtowała się na podobnym poziomie,
zarówno w kulturach pędowych, jak i korzeniowych badanych odmian. Jedynie w
przypadku 5-dniowych kultur korzeniowych odm. Szafir zawartość antocyjanów była
wyższa niż u odm. Selena (Ryc. 28). Prawdopodobnie pełnią one funkcje niezwiązane z
morfogenezą, bądź ich poziom ulega podwyższeniu w wyniku działania czynników
stresowych innych niż te, które towarzyszą wzrostowi i rozwojowi roślinie w
warunkach in vitro. Badania przeprowadzone na kulturach remanii kleistej (Rehmannia
glutinosa Libosch.) wykazały, że istnieje silna korelacja pomiędzy zawartością
polifenoli i flawonoidów, a zdolnościami antyoksydacyjnymi tkanek (Piątczak i wsp.
2014). Inne badania natomiast sugerują, iż tkanki słabo zróżnicowane odznaczają się
niską zawartością tych związków, natomiast wysoką w rozwijających się organach,
głównie w pędach (Palacio i wsp. 2012, Drozdowska 2013). Jednocześnie
zaobserwowano, że nie wszystkie związki z tej grupy metabolitów, występujące przede
wszystkim w korzeniach, posiadają właściwości antyutleniające (Piątczak i wsp. 2014).
W badaniach własnych zawartość polifenoli była wyższa w kulturach odmiany Selena
rosnących zarówno na pożywce pędowej (w 5 oraz 14 dniu wzrostu kultur), jak i
korzeniowej (w 14-tym i 28-mym dniu wzrostu), w porównaniu do odm. Szafir.
Również poziom tanin był wyższy (w kulturach pędowych w 5-tym dniu wzrostu, a w
kulturach korzeniowych w 14-tym oraz 28-mym dniu wzrostu) u odmiany Selena (Ryc.
30-31). Wyższy poziom związków polifenolowych i tanin w kulturach lnu włóknistego,
w korelacji z ich słabszą regeneracją (w stosunku do kultur lnu oleistego), może

185
świadczyć o negatywnym wpływie tych metabolitów na potencjał morfogenetyczny
tego typu lnu.
Wysoka aktywność SOD prowadzi do powstawania H2O2 w wyniku reakcji
dysmutacji anionorodnika ponadtlenkowego. Wykazano, że H2O2 może pełnić funkcję
sygnalizacyjną (Qiusheng i wsp. 2005). Endogenny H2O2 indukuje organogenezę
poprzez wpływ na ekspresję genów i syntezę białek (Batková i wsp. 2008; Puijalon
2008; Meratan i wsp. 2009). Jednocześnie generowany zbyt wysoki poziom stresu
oksydacyjnego w trakcie hodowli in vitro, może doprowadzić do obniżenia zdolności
regeneracyjnych oraz przyspieszyć starzenie tkanek (Benson 2000). Badane w pracy
kultury lnu oleistego (odm. Szafir), charakteryzujące się wysoką efektywnością
formowania pędów i korzeni, odznaczały się spadkiem aktywności SOD w czasie
wzrostu w porównaniu do typu włóknistego (odm. Selena) odznaczającego się niższym
potencjałem regeneracyjnym (Ryc. 32-33). Być może wysoka aktywność SOD w
początkowym etapie wzrostu odm. Szafir prowadzi do zwiększenia ilości H2O2, który
indukuje proces różnicowania, prowadzący do powstania organów. Utrzymująca się na
wysokim poziomie aktywność SOD przez cały okres wzrostu kultur odm. Selena
prawdopodobnie związana jest z wysokim poziomem stresu oksydacyjnego w tkankach
tej odmiany, co oddziałuje hamująco na organogenezę (Ryc. 32-33) i obserwowane w
trakcie wzrostu starzenie eksplantatów.
W czasie wzrostu kultur pędowych i korzeniowych badanych odmian lnu
obniżyła się aktywność CAT – enzymu odpowiadającego za usuwanie nadmiaru H2O2.
Enzym ten może uczestniczyć również w regulacji wzrostu i różnicowania komórek
(Molassiotis i wsp. 2004). Jednakże w kulturach pędowych lnu odm. Szafir, zmiany
aktywności CAT nie wpłynęły na zmianę potencjału formowania pędów (Ryc. 32), co
może być związane z jednoczesnym obniżeniem aktywności SOD. Możliwe również, że
wpływ systemu antyoksydacyjnego na zdolności regeneracyjne eksplantatów lnu jest
bardziej znaczący na początku wzrostu kultur, niż w ostatnich dwóch tygodniach. Warto
zwrócić uwagę na różnicę w aktywności CAT i SOD między badanymi odmianami lnu
w 5-tym dniu wzrostu kultur korzeniowych – są one wyższe w kulturach odm. Selena
(Ryc. 32-33). Jednakże zdolności regeneracyjne obu odmian w kierunku ryzogenezy
wydają się być podobne (Ryc. 20-21). CAT może być odpowiedzialny za usuwanie
nadmiaru H2O2 nagromadzonego w początkowym etapie wzrostu, również w wyniku
aktywności SOD (Dutta Gupta i Datta 2004).W przypadku kultur odm. Selena można
sądzić, iż niska aktywność CAT (zwłaszcza w 14-tym i 28-mym dniu wzrostu) przy

186
jednocześnie wysokiej aktywności SOD wpływa negatywnie na kaulogenezę i
ryzogenezę oraz powoduje brązowienie eksplantatów. Dutta Gupta i Datta (2004)
wyjaśniają, że jest to wynikiem utrzymującego się wysokiego poziom H2O2, co może w
konsekwencji doprowadzić do śmierci komórek. W kulturach kopru ogrodowego
(Anethum graveolens L.), Tacitus bellus L. czy szafranu uprawnego (Crocus sativus L.)
zanotowano podwyższony poziom SOD w początkowych etapach wzrostu kultur, przy
jednoczesnym obniżeniu aktywności CAT na dalszych etapach organogenezy tych
gatunków (Vatankhah i wsp. 2010, Jana i Shekhawat 2012, Mitrowić i wsp. 2012).
5.2 Oddziaływanie stresu osmotycznego oraz SNP na modyfikację
organogenezy lnu zwyczajnego (Linum usitatissimum L.) typu oleistego
(odm. Szafir) i typu włóknistego (odm. Selena)
W pracy podjęto próbę określenia czynników poprawiających organogenezę w
kulturach in vitro lnu zwyczajnego. Sprawdzono wpływ stresu osmotycznego
wywołanego zwiększeniem zawartości różnych cukrów w pożywkach, odpowiednich
do wzrostu kultur lnu oleistego i włóknistego oraz wpływ SNP, powszechnie
używanego donora NO.
Niektóre warunki stresowe zwiększają zdolności regeneracyjne roślin w
warunkach in vitro (Puijalon i wsp. 2008). W celu poprawy organogenezy badano
wpływ ekspozycji kultur tkankowych na krótkotrwałe działanie wybranych stresów
takich jak deficyt wody, którego działanie poprawiało regenerację w kulturach in vitro
ryżu (Jain i wsp. 1996) oraz kilku odmian pszenicy (Khanna i Deggard 2001).
Mundhara i Rashid (2001) zaobserwowali pozytywny efekt działania wysokiej
temperatury, stresu solnego oraz niedoboru składników mineralnych na formowanie
pąków pędowych na hipokotylach siewek lnu w warunkach in vitro. Niedobór wapnia
oraz oddziaływanie niektórych bodźców fizycznych jak susza czy wiatr miały
pozytywny wpływ na pobudzanie merystemów epidermalnych hipokotyli lnu (Verdus i
wsp. 1997). Wyniki badań własnych wskazują, że zastosowana podwyższona zawartość
sacharozy w pożywce pędowej nie miała wpływu na stymulację kaulogenezy w
kulturach obu badanych odmian lnu (Ryc. 37-38). W przypadku kultur korzeniowych
trzykrotne podwyższenie zawartości sacharozy w podłożu, u odm. Szafir skutkowało
zwiększeniem organogenezy w 3-cim tygodniu wzrostu kultury. Kultury odm. Selena,
rosnące na podłożu z dwukrotnie zwiększoną zawartością sacharozy, bezpośrednio po

187
działaniu warunków stresowych (2 tydzień wzrostu) charakteryzowały się
podwyższonym procentem eksplantatów z korzeniami. Jednak różnica w efektywności
organogenezy korzeniowej pomiędzy kulturami kontrolnymi, a stresowanymi u
badanych odmian nie utrzymała się do ostatniego tygodnia wzrostu (Ryc. 39 -40).
Badania Millam i współpracowników (1992) pokazują, iż kultury lnu odm. Stormont
Silver, rosnące na podłożu z wysoką zawartością sacharozy, charakteryzowały się
efektywniejszą ryzogenezą oraz wyższą świeżą masą eksplantatów. W kulturach
zawiesinowych głowienki pospolitej (Prunella vulgaris L.) zawartość sacharozy w
pożywce w granicach 20-25g l-1
, wywołująca stres osmotyczny wpływała pozytywnie
na podwyższenie biomasy, podwyższenie poziomu związków fenolowych,
flawonoidów, białek oraz podwyższenie aktywności enzymów antyoksydacyjnych. Z
kolei wyższe ilości sacharozy (40-50 g l-1
), wpływały negatywnie na aktywność
antyoksydacyjną w kulturach tego gatunku (Fazal i wsp. 2016). W przypadku kultur
korzeniowych dziurawca zwyczajnego (Hypericum perforatum L.) tak wysokie
zawartości sacharozy podwyższały aktywność systemu antyoksydacyjnego (Cui i wsp.
2010). Pozytywny efekt działania czynników stresowych na morfogenezę roślin,
związany jest ze zwiększoną produkcją ROS, zwłaszcza H2O2 i generowaniem stresu
oksydacyjnego (Kreslavski i wsp. 2012). Nadtlenek wodoru znany jest nie tylko jako
wskaźnik zachodzącego stresu, ale również jako cząsteczka sygnalna w procesie
wzrostu i rozwoju roślin (Śleak i wsp. 2007). Sakamoto i Murata (2002) stwierdzili, że
wysoka zawartość sacharozy wpływa na zwiększenie poziomu ROS, a zwłaszcza H2O2.
W badaniach własnych zaobserwowano podwyższenie zawartości H2O2 w kulturach
pędowych odm. Selena i korzeniowych odm. Szafir bezpośrednio po działaniu stresu.
Podwyższony poziom H2O2 stwierdzono również w końcowej fazie wzrostu kultur
korzeniowych badanych odmian (Ryc. 44). Sugerować można, że utrzymująca się tak
długo od zadziałania stresu wyższa zawartość H2O2, w porównaniu do kontroli, to efekt
innych procesów, np. związanych ze starzeniem się kultur.
Kolejne badania skoncentrowane były na określeniu oddziaływania roztworu
nitroprusydku sodu (SNP) dodanego do podłoża, oraz fumigacji kultur SNP na
organogenezę lnu zwyczajnego.
Najczęściej prowadzone doświadczenia w warunkach in vitro, dotyczące udziału
NO w regulacji wzrostu i rozwoju, dotyczyły obserwacji procesów morfogenetycznych
zachodzących pod wpływem dodanych do pożywki różnych donorów NO. Stymulujący
wpływ SNP na kaulogenezę stwierdzono w kulturach rośliny z rodziny bobowatych

188
Albizzia lebbeck L. (Kalra i Babbar 2012), zaś na kaulogenezę i ryzogenezę w kulturach
in vitro jabłoni hupeheńskiej (Malus hupehensis Rehd.) (Han i wsp. 2009).
Nitroprusydek sodu korzystnie wpływał na formowanie pędów w kulturach in vitro
wanilii płaskolistnej (Vanilla planifolia Andrews) (Tan i wsp. 2013). Pozytywny efekt,
dodanych bezpośrednio do pożywki donorów NO (m. in. SNP, SNAP), na
organogenezę pędów oraz korzeni, uzyskano również w kulturach lnu zwyczajnego
(Kalra i Babbar 2010). W przypadku kultur pochrzynu chińskiego (Dioscorea opposita
Thunb.) wykazano, że zastosowanie SNP przyczyniło się do ograniczenia brązowienia
eksplantatów, pochodzących z bulw i równocześnie do zwiększenia proliferacji kalusa
oraz regeneracji pędów (Xu i wsp. 2009). W badaniach własnych z kolei, gdy
dodawano SNP w różnych stężeniach bezpośrednio do pożywek odpowiednich do
wzrostu kultur pędowych i korzeniowych odm. Szafir (Ryc. 45 -46), podobnych
efektów nie obserwowano. Być może wynika to z odmiennej wrażliwości różnych
gatunków roślin na działanie NO wydzielającego się z SNP, jak również innych
cząsteczek (np. CN-, ROS) uwalnianych z SNP. Ponadto czas połowicznego rozpadu
tego donora wynosi 12 godzin (Gniazdowska i Bogatek 2007), więc uwalniane
cząsteczki (w tym NO) oddziaływały zbyt krótko i w zbyt małym stężeniu, aby wpłynąć
na organogenezę. Stwierdzono, że SNP charakteryzuje się maksymalnym wydzielaniem
NO w drugiej godzinie od naświetlania (Floryszak-Wieczorek i wsp. 2006), co przy
długotrwałym wzroście kultur lnu mogło nie wpłynąć na efekt morfogenetyczny.
Podjęto więc próbę zbadania oddziaływania par wydzielających się z wodnego
roztworu SNP na organogenezę lnu oleistego i włóknistego. Stwierdzono, iż opary
wodnego roztworu SNP wpływają stymulująco na ryzogenezę w kulturach in vitro odm.
Selena rosnących na podłożu z dodatkiem NAA (Ryc. 51-52). Zaobserwowano, że
najwyższy procent eksplantatów z korzeniami oraz liczba tych organów przypadająca
na eksplantat pojawiała się przy traktowaniu kultur niższymi dawkami SNP (5 ml),
natomiast organogeneza przy wyższych dawkach była porównywalna do kontroli (Ryc.
51-52; Fot. 11). Odmienne oddziaływanie SNP na ryzogenezę stwierdzono w
przypadku kultur lnu oleistego (odm. Szafir), gdzie SNP nie wpłynął na efektywność
organogenezy, a w wysokich dawkach (30 ml) obniżał namnażanie korzeni (Ryc. 51-52;
Fot. 11). W badaniach Pagnussat i współpracowników (2002) donory NO indukowały
organogenezę korzeni u ogórka, natomiast przy współdziałaniu SNP z zastosowaną z
auksyną (IAA), także wydłużanie tych organów nawet o 1,6 razy. Można więc
przypuszczać, że w warunkach eksperymentalnych na pobudzanie ryzogenezy lnu

189
włóknistego, w wyniku oddziaływania par wydzielających się z wodnego roztworu SNP
może mieć wpływ jego współdziałanie z auksyną. Warto podkreślić, że nie
zaobserwowano zmian w efektywności organogenezy pędowej w wyniku działania par
wydzielających się z roztworu SNP, zarówno w kulturach odm. Szafir jak i Selena
rosnących na pożywce z dodatkiem BA.
Przetestowano również działanie SNP na organogenezę w kulturach in vitro lnu,
rosnących na pożywce bez dodatku hormonów. Niższe dawki SNP (5 -10 ml) wpływały
stymulująco na organogenezę pędową i korzeniową w kulturach odm. Selena (Ryc. 53;
Fot. 13). Istotne jest, że w kulturach poddanych fumigacji SNP, korzenie były dłuższe i
lepiej rozwinięte, w porównaniu do kontroli, a zwłaszcza w kulturach poddanych
działaniu 5 ml oraz 10 ml SNP (Ryc. 60; Fot. 13). Zaobserwowano również dodatni
wpływ SNP na organogenezę pędową w kulturach tej odmiany, rosnących na podłożu
bez dodatku hormonów (Ryc. 53). W kulturach lnu odm. Szafir, rosnących na pożywce
bez hormonów, nie zaobserwowano wpływu SNP na efektywność organogenezy
pędowej i korzeniowej, gdyż potencjał regeneracyjny kultur kontrolnych i poddanych
ekspozycji na pary wydzielające się z SNP był podobny. Na postawie różnic w
efektywności organogenezy testowanych odmian lnu można sugerować o odmiennej ich
wrażliwości na pary wydzielające się z wodnego roztworu SNP. Obserwowany efekt
morfogenetyczny w kulturach odm. Selena może wskazywać, że NO, którego SNP jest
donorem, działając bezpośrednio lub współdziałając z auksynami, stymuluje proces
ryzogenezy. Nie wykluczony jest również efekt działania innych cząsteczek (np. CN-,
ROS) uwalnianych z SNP. Jednocześnie obniżenie efektywności organogenezy
korzeniowej w kulturach odm. Szafir rosnących na podłożu z dodatkiem NAA i
traktowanych SNP w dawce 30 ml może wskazywać na zbyt dużą ilość zastosowanego
roztworu, ale również na antagonistyczne działanie zastosowanego donora NO w
stosunku do auksyny. Podobnych wniosków dostarczyły również badania nad regulacją
wzrostu korzeni prowadzone na A. thaliana (Fernandez Marcos i wsp. 2011). Hamujący
wpływ donora na regenerację, obserwowano także u żyworódki pierzastej (Kalanchoë
pinnata (Lam.) Pres.) (Abat i Deswal 2013). Świadczyć to może o tym, iż efekt dawki
SNP i czas ekspozycji na związek jako czynników wpływających na organogenezę
zależy od odmiany/typu testowanej rośliny.
Przeprowadzono również doświadczenia z wykorzystaniem „wymiatacza” NO –
c-PTIO, mające na celu potwierdzenie udziału egzogennego NO w stymulacji

190
organogenezy w kulturach odm. Selena. Wyniki tych badań wskazują, że obserwowany
stymulujący wpływ SNP na organogenezę w kulturach lnu włóknistego jest efektem
działania NO, gdyż w kulturach poddanych działaniu c-PTIO oraz kontrolnych
potencjał morfogenetyczny był podobny (Ryc. 55 -60). Nie można jednak wykluczyć
również wpływu innych składników par wydzielanych z SNP, których w
doświadczeniach nie badano. Wyniki badań, dotyczące innych gatunków roślin, z
zastosowaniem „wymiataczy” NO (np. c-PTIO), dodawanych razem z donorami tlenku
azotu do pożywek, potwierdziły promujący wpływ tej cząsteczki na morfogenezę
(Song i wsp. 2006, Xu i wsp. 2009, Kalra i Babbar 2010). Uważa się, że SNP jest
skutecznym donorem NO w badaniach nad oddziaływaniem tej cząsteczki na roślinne
kultury in vitro (Rico-Lemus i Rodriguez-Garay 2014).
W przeprowadzonych badaniach wykazano odmienną reakcję kultur lnu
oleistego i włóknistego na działanie SNP. Do dalszych analiz, mających na celu
określenie prawdopodobnego sposobu działania NO, wybrano te warianty, w których
zaobserwowano poprawę organogenezy pod wpływem par wydzielających się z
roztworu SNP. Były to kultury lnu odm. Selena rosnące na podłożu bez dodatku
hormonów, w których obserwowano stymulację kaulogenezy i ryzogenezy oraz rosnące
na pożywce korzeniowej (z dodatkiem NAA), w których obserwowano tylko stymulację
ryzogenezy.
W kulturach lnu odm. Selena rosnących na pożywce korzeniowej (z dodatkiem
NAA), jak i bez dodatku hormonów oraz poddanych działaniu SNP, zawartość TBARS
obniżyła się bezpośrednio po ekspozycji (0 dzień hodowli) (Ryc. 62). Może to
świadczyć o ochronnej roli NO którego SNP jest donorem, przed uszkodzeniami
wynikającymi z peroksydacji lipidów (O’Donnell i wsp. 1997, Arasimowicz-Jelonek i
wsp. 2009). Zawartość H2O2 po ekspozycji obu typów kultur na SNP była jednak
odmienna. W rosnących na pożywce korzeniowej (z dodatkiem NAA) poziom H2O2 był
niższy od kontroli na początku wzrostu (0, 1 dzień) i ulegał podwyższeniu dopiero po 5-
tym dniu od ekspozycji na SNP. Natomiast w kulturach rosnących na podłożu bez
dodatku hormonów, zawartość H2O2 była wyższa 1-szego i 5-tego dnia (Ryc. 61).
Obserwowane w kulturach rozwijających się na pożywce bez dodatku hormonów i
poddanych działaniu SNP zmiany morfogenetyczne (stymulacja ryzogenezy i
kaulogenezy), mogły częściowo wynikać z generowanego w tkankach stresu
oksydacyjnego, o czym świadczy podwyższone stężenie H2O2 na początku wzrostu
kultur. NO, którego SNP jest donorem, jako przeciwutleniacz, poprzez regulację

191
stężenia ROS, uczestnicząc w utrzymywaniu homeostazy redoks, prowadzić może do
zwiększenia odporności roślin na czynniki stresowe (Arasimowicz i wsp. 2008). W
przypadku kultur pochrzynu, SNP, poprzez obniżenie stężenia H2O2, przyczyniło się do
ograniczenia brązowienia eksplantatów pochodzących z bulw i równocześnie do
zwiększenia proliferacji kalusa oraz kaulogenezy (Xu i wsp. 2009). Badania dotyczące
innych gatunków roślin, prowadzone w kulturach in vitro wskazują, że pozytywnym
efektem działania ROS może być zmiana potencjału antyoksydacyjnego tkanek. W
przypadku kultur pieprzu czarnego (Piper nigrum L.), potencjał ten ulegał znacznemu
podwyższeniu podczas powstawania pędów, w porównaniu do tkanek
niezróżnicowanych (Nisar i wsp. 2010). Zregenerowane tkanki biedrzeńca anyżu
(Pimpinella anisum L.) również wykazywały wysoki potencjał antyoksydacyjny. W
materiale tym stwierdzono równocześnie podwyższone stężenie fenoli, metabolitów
pełniących ochronne funkcje przed negatywnym działaniem ROS (Andarwulan i Shetty
1999, Mitrović i wsp. 2012). Zaobserwowano także, że wzajemne oddziaływanie H2O2 i
enzymów antyoksydacyjnych, wpływało korzystnie na formowanie pąków w kulturach
kalusowych truskawki (Tian i wsp. 2003). Sugerowano również sygnalną rolę H2O2 w
regulacji ekspresji genów kodujących enzymy systemu antyoksydacyjnego (Scandalios
2005, Skrzypek 2012). W badaniach własnych, jedynie w przypadku kultur odm.
Selena, rosnących na podłożu z dodatkiem NAA stwierdzono wzrost zdolności
przeciwwolnorodnikowej bezpośrednio po działaniu SNP (Ryc. 66). Wzrost potencjału
morfogenetycznego kultur pochrzynu był kojarzony z lepszymi zdolnościami
antyoksydacyjnymi eksplantatów traktowanych SNP, przejawem których była
podwyższona aktywność SOD i wyższe stężenie antyoksydantów nieenzymatycznych
(glutation, prolina) (Xu i wsp. 2009). Zaobserwowano, że kultury pomarańczy
trójlistkowej (Poncirus trifoliata L.) poddane działaniu SNP i stresowi suszy,
charakteryzowały się niższym stężeniem ROS, podwyższoną aktywnością enzymów
antyoksydacyjnych oraz były bardziej odporne na utratę wody (Fan i Liu 2012). W
badaniach własnych stwierdzono jednak obniżenie aktywności SOD w kulturach lnu
rosnących na pożywce korzeniowej bezpośrednio po działaniu SNP, natomiast w
kulturach rosnących na podłożu bez dodatku hormonów, aktywność tego enzymu
wzrosła, ale dopiero po 5-tym dniu od ekspozycji na SNP (Ryc. 67). Aktywność CAT
bezpośrednio po działaniu SNP (0 i 1 dzień) również nie uległa podwyższeniu w obu
badanych typach kultur (Ryc. 69). Niski poziom SOD może potwierdzać, że aktywność
enzymu nie jest związana z organogenezą korzeni, tak jak w przypadku kultur lnu odm.

192
Super oraz w kalusie przypołudnika (Mesembryanthemum sp. L.), zdolnego do
formowania korzeni (Libik-Konieczny i wsp. 2012, Takáč i wsp. 2016). Jednocześnie
wzrost aktywności MnSOD oraz CuZnSOD (odpowiednio 0 i 1 dzień po działaniu
SNP) w kulturach rosnących na podłożu bez dodatku hormonów oraz po 5-tym dniu w
kulturach korzeniowych (Ryc. 67-68), może sugerować udział tych izoform w
stymulacji organogenezy. W kulturach przypołudnika kryształowego
(Mesembryanthemum crystallinum L.) odnotowano podwyższenie aktywności izoformy
CAT-2 oraz MnSOD w czasie ryzogenezy (Konieczny i wsp. 2014). Sugeruje się
powiązanie aktywności NO, u roślin z aktywnością hormonów np. ABA, etylenu,
kwasu jasmonowego oraz innych cząsteczek sygnalnych (H2O2) (Simontacchi i wsp.
2013; Qiao i wsp. 2014). Dane literaturowe wskazują, że NO jako cząsteczka sygnalna,
może uruchamiać inne elementy szlaku transdukcji sygnału, tj. cGMP, cADPR, Ca2+
,
kinazy MAP, prowadząc w konsekwencji do zmiany ekspresji genów i podwyższenia
tolerancji na stres (Gill i wsp. 2013, Mur i wsp. 2013).
Regulacja morfogenezy w kulturach odm. Selena (typ włóknisty lnu) zachodzi
za pośrednictwem egzogennego NO, który indukuje ciąg zdarzeń, prowadzący do
stymulacji kaulogenezy i ryzogenezy. W kulturach rosnących na pożywce korzeniowej
(z dodatkiem NAA) i na pożywce bez dodatku hormonów (-NAA), reakcje inicjowane
przez NO mogą przebiegać w sposób nieco odmienny, prowadząc do tego samego
efektu, czyli stymulacji formowania organów. W kulturach rosnących na podłożu bez
hormonów, NO może wpływać na biosyntezę cytokinin, lub związków
cytokininopodobnych, czy też regulować ich aktywność. Możliwe następstwa reakcji,
które mogą mieć miejsce w czasie wzrostu tych kultur po fumigacji SNP przedstawiono
na Ryc. 71. Przypuszczać można, że w regulację organogenezy w kulturach odm. Szafir
(typ oleisty lnu) zaangażowany jest NO endogenny, którego odpowiedni poziom w
komórkach kultur tej odmiany skutkuje wysoką efektywnością formowania pędów i
korzeni.

193
Ryc. 71. Efekt działania NO na procesy morfogenetyczne w kulturach in vitro lnu odm. Selena
rosnących na pożywce korzeniowej (+NAA), oraz bez dodatku hormonów (-NAA).
(+) – podwyższona zawartość/aktywność; (-) – obniżona zawartość/aktywność; (=) – brak
różnic: (dotyczy początkowych etapów wzrostu kultur - 0, 1 dzień po fumigacji SNP)
Uzyskane wyniki wskazują na złożoność procesów stymulujących organogenezę
w kulturach in vitro lnu. Aby wyciągnąć jednoznaczne wnioski należałoby
kontynuować niniejsze badania. Wydaje się, że ciekawym uzupełnieniem uzyskanych w
pracy wyników byłyby oznaczenia endogennych stężeń hormonów (zwłaszcza auksyn i
cytokinin), zarówno w kulturach lnu rosnących w warunkach optymalnych, jak i
poddanych działaniu SNP lub innych donorów (np. SNAP) na różnym etapie ich
wzrostu. Ciekawym aspektem badań byłoby również zbadanie oddziaływania innych
cząsteczek wydzielających się z roztworu SNP – np. anionów cyjankowych (CN-), a
także ich współdziałania z NO (i hormonami) w regulacji morfogenezy lnu.

194
6 Podsumowanie i wnioski
1. Badane odmiany lnu zwyczajnego: Szafir (typ oleisty) i Selena (typ włóknisty)
mają różne wymagania pod względem składu pożywki. Optymalną pożywką do
wzrostu i organogenezy kultur lnu odm. Szafir jest podłoże MS, natomiast w
przypadku odm. Selena – B5.
2. Len oleisty oraz len włóknisty charakteryzują się podobnymi wymaganiami co
do rodzaju zastosowanych auksyn oraz cytokinin, a także ich wzajemnych stężeń
w podłożu.
3. Efektywniejszą organogenezę pędową oraz korzeniową w optymalnych
warunkach wzrostu obserwowano w kulturach lnu oleistego niż u włóknistego.
4. Szybkość pojawiania się organów na eksplantatach zależy od odmiany lnu - pędy
i korzenie formowały się wcześniej w kulturach odm. Szafir, niż u odm. Selena.
5. Kultury odm. Szafir charakteryzują się wyższą zawartością barwników
fotosyntetycznych oraz wyższym natężeniem fotosyntezy netto niż kultury odm.
Selena. Przejawem tych różnic może być obserwowana efektywniejsza
organogeneza pędowa w kulturach lnu oleistego.
6. Zawartość metabolitów wtórnych obniżała się w trakcie wzrostu kultur, przy
czym kultury lnu włóknistego, w odróżnieniu od oleistego, charakteryzują się
zwiększoną zawartością większości badanych metabolitów oraz wyższą
aktywnością enzymów antyoksydacyjnych SOD i CAT. Mogło to przyczynić
się do obniżenia potencjału regeneracyjnego włóknistego typu lnu.
7. Stres osmotyczny (wywołany zwiększoną ilością cukrów w podłożu), ani
nitroprusydek sodu (SNP) - dodany bezpośrednio do podłoża - nie wpływały
stymulująco na organogenezę w kulturach lnu.
8. Opary (m.in. NO) wydzielające się z wodnego roztworu SNP wpływały
stymulująco na organogenezę w kulturach lnu włóknistego, przy czym:
9. W kulturach rosnących w obecności auksyny NAA (pożywka korzeniowa)
obserwowano poprawę ryzogenezy;
10. W kulturach rosnących na pożywkach bez dodatku auksyny obserwowano
stymulację ryzogenezy, ale również organogenezy pędowej.

195
11. Zastosowanie „wymiatacza NO” c-PTIO, wskazuje, że efekt morfogenetyczny
obserwowany w kulturach odm. Selena pod wpływem par wydzielających się z
roztworu SNP wynika z działania NO.
12. Kultury odm. Selena wykazują aktywność przeciwwolnorodnikową o czym
świadczy redukcja rodnika DPPH.
13. W kulturach lnu odm. Selena, niezwłocznie po ekspozycji na SNP, zawartość
TBARS obniżyła się. Fumigacja SNP nie wpłynęła jednak znacząco na
podwyższenie aktywności enzymów antyoksydacyjnych (SOD i CAT).
14. Zawartość H2O2 po ekspozycji kultur na SNP kształtowała się różnie w
początkowym etapie wzrostu (0, 1 dzień):
a) w kulturach rosnących na pożywce korzeniowej (z dodatkiem NAA)
obniżyła się;
b) w kulturach rosnących na podłożu bez dodatku hormonów podwyższyła się.
15. Regulacja organogenezy przez NO w kulturach lnu włóknistego może przebiegać
w dwojaki sposób:
a) NO, współdziałając z auksyną (NAA) dodaną do podłoża, inicjuje łańcuch
zdarzeń, prowadzący do poprawy ryzogenezy;
b) NO, prawdopodobnie w interakcji z H2O2, (którego poziom w kulturach
rosnących na podłożu bez hormonów podwyższa się w początkowych
etapach wzrostu po traktowaniu SNP) inicjuje łańcuch zdarzeń prowadzący
do wzmożonej syntezy auksyny i poprawy ryzogenezy, oraz syntezy
cytokininy lub jej analogów (wpływających na formowanie pędów).
16. W regulację organogenezy w kulturach lnu włóknistego, zapoczątkowaną przez
NO (i/lub inne gazy uwalniające się z SNP) może być zaangażowany również
system antyoksydacyjny, regulujący poziom ROS (szczególnie H2O2).

196
Streszczenie
Procesy morfogenetyczne w kulturach in vitro są regulowane zarówno przez
czynniki endogenne jak i egzogenne. Poszukiwanie elementów usprawniających
organogenezę w warunkach in vitro to aktualny problem badawczy dotyczący
efektywnego mikrorozmnażania roślin. W niniejszych badaniach wykorzystano kultury
in vitro lnu zwyczajnego (Linum usitatissimum L.) typu oleistego (odm. Szafir) i typu
włóknistego (odm. Selena) rosnące w warunkach umożliwiających optymalny wzrost i
rozwój eksplantatów. Kultury lnu poddano działaniu wybranych czynników (stresu
osmotycznego oraz oparów zawierających NO), które mogłyby wpłynąć na
efektywniejszą organogenezę. Celem niniejszej pracy było porównanie zdolności
morfogenetycznych obu typów lnu oraz określenie możliwych mechanizmów
regulujących procesy organogenezy w wyniku działania stresu osmotycznego lub po
traktowania kultur oparami z nitroprusydku sodu (SNP). Odmiany lnu, będące obiektem
badań, nie były jak dotychczas poddawane analizom w tym kierunku.
Wybrane odmiany lnu odznaczają się odmiennymi wymaganiami co do składu i
rodzaju pożywki wykorzystywanej do wzrostu kultur. Charakteryzują się natomiast
podobnymi wymaganiami co do rodzaju zastosowanych auksyn oraz cytokinin, a także
ich wzajemnych stężeń w podłożu. W dobranych optymalnych warunkach wzrostu
kultur, efektywniejszą organogenezą odznaczała się odm. Szafir, w porównaniu do
odm. Selena. Formowanie pędów i korzeni w kulturach lnu oleistego (Szafir)
obserwowano wcześniej i było ono efektywniejsze pod względem ilościowym, w
porównaniu z organogenezą u lnu włóknistego. W kulturach lnu oleistego obserwowano
także zwiększoną zawartość barwników fotosyntetycznych oraz wyższe natężenie
fotosyntezy. Jednocześnie, w kulturach odm. Szafir obserwowano zmniejszoną
zawartość większości badanych metabolitów wtórnych (polifenoli, tanin,
fenylopropanoidów i flawonoidów) w porównaniu do kultur odm. Selena,
wykazujących obniżony potencjał regeneracyjny. Ponadto odm. Selena
charakteryzowała się bardziej zróżnicowanym składem chemicznym związków
(analizowanych GC/MS) w porównaniu do odm. Szafir. Warto zwrócić uwagę że
aktywność badanych antyoksydantów enzymatycznych (SOD, CAT) w kulturach lnu
włóknistego (Selena), na początku wzrostu była również wyższa niż w kulturach lnu
oleistego.

197
Stres osmotyczny wywołany dodatkiem zwiększonej ilości cukrów do podłoża, nie
wpłynął na poprawę organogenezy w kulturach badanych odmian. Natomiast
zastosowanie par wydzielających się z wodnego roztworu SNP, zawierających NO,
przyczyniło się do poprawy ryzogenezy w kulturach lnu włóknistego, zarówno
rosnących na pożywce korzeniowej (wzbogaconej o NAA), jak i bez dodatku
hormonów. Warto podkreślić, że pary z SNP w kulturach tego typu lnu, rosnących na
pożywce bez hormonów również stymulowały kaulogenezę. Doświadczenia z użyciem
c-PTIO potwierdziły udział NO w regulacji organogenezy w kulturach lnu włóknistego.
Traktowanie kultur lnu włóknistego oparami z SNP spowodowało podwyższenie ich
zdolności przeciwwolnorodnikowej. Jednocześnie, niezwłocznie po fumigacji SNP,
obniżyła się zawartość TBARS w tych kulturach. Natomiast poziom H2O2 kształtował
się różnie: w kulturach rosnących na pożywce korzeniowej obniżył się, a uległ
podwyższeniu na podłożu bez dodatku hormonów. Wzmożona synteza H2O2 na
późniejszym etapie wzrostu kultur rosnących na podłożu bez dodatku hormonów
wskazuje na prawdopodobną rolę sygnalną tego związku. Fumigacja SNP nie wpływała
na podwyższenie aktywności enzymów antyoksydacyjnych (SOD i CAT) w większości
przypadków, jednak w późniejszym etapie wzrostu kultur odm. Selena odnotowano
podwyższoną aktywność MnSOD (prawdopodobnie związaną z inną funkcją enzymu).
W kulturach odm. Selena poprawa efektywności organogenezy w wyniku działania NO
uwolnionego z roztworu SNP może być spowodowana współdziałaniem tego gazu z
hormonami dodanymi do podłoża, lub indukować syntezę innych hormonów (np.
cytokinin), lub cząstek sygnalnych (np. H2O2).

198
Summary
Morphogenetic processes in in vitro cultures are regulated by various
endogenous and exogenous factors. The search for new factors improving
organogenesis in vitro is a current problem for effective micropropagation of crop
plants. In this study, the flax plants (Linum usitatissimum L.), oil flax (cv. Szafir) and
fibrous (cv. Selena), are grown in an in vitro culture, under optimal growth conditions
enabling effective development of explants. Flax cultures were subjected to selected
treatments (osmotic stress or NO gas fumes) possibly affecting organogenesis. The aim
of this work was to compare the morphogenetic abilities of both cultivars of flax plants
and to study mechanisms regulating processes of organogenesis, as an affected by
osmotic stress or after sodium nitroprusside (SNP, donor of NO) treatments of culture.
The cultivars of flax, that were subject of the research, have not been analyzed so far in
this direction. Cultivars of flax have same different requirements for composition and
type of nutrient media used for in vitro growth. Both cultures required similar types of
auxins and cytokinins, as well as the same concentrations of hormones in the medium.
Under optimum conditions of growth, more effective organogenesis were distinguished
on cultures of flax cv. Szafir, compared to the Selena cultures. Formation of shoots and
roots in oil flax cultures (cv. Szafir) has been observed earlier and was more effective
(in quantitative terms) than fiber flax organogenesis. In the oil flax cultures also
chlorophylls and carotenoids content increased and a high net intensity of
photosynthesis was observed. At the same time, in the cultures of the cv. Szafir, a
decrease in secondary metabolites content (polyphenols, tannins, phenylpropanoids and
flavonoids) was observed, in comparison with the cv. Selena. In addition, Selena
cultures were characterized by a more diverse chemical composition of the LZO
compounds (analyzed by GC/MS), when compared to the oil flax. It should be noted
that the activity of the antioxidant enzymes (SOD, CAT) determined in fiber flax
cultures was also higher than in cultures of oil flax in an early stage of development.
Osmotic stress, induced by an addition of sugars to the medium, did not improve
organogenesis in studied cultivars. On the other hand, the vapours from the SNP
solution (containing NO) were contributed to the regeneration improvement, both in
NAA-enriched root cultures and in in vitro cultures of roots and shoots of Selena -
grown without hormones. Experiments with c-PTIO have confirmed NO's contribution
to regulation of organogenesis in flax fiber cultures. The DPR-based EPR spectroscopy

199
results indicated that the cultures of Selena treated with NO vapours (from SNP
solution) showed better antioxidant capacity than control. At the early stage of
regeneration these cultures were also characterized by reduced H2O2 and TBARS
content. Increased synthesis of H2O2 at the later stage of growth in hormone-free
cultures probably indicates the signaling role of hydrogen peroxide. SNP fumigation did
not affect antioxidant enzymes activity (SOD and CAT) in most cases, but in the later
stage of cv. Selena growth, the increased activity of MnSOD was observed (indicating
different function of this isoform). In fiber flax cultures (Selena) the organogenesis
efficiency improvement, as the result of NO action (released from SNP), probably
occurred due to interaction of the nitric oxide and phytohormones in the nutrient
medium, or via other hormones synthesis (e.g. cytokinins) and/or signaling molecules
(e.g. H2O2) stimulation.

200
Bibliografia
1. Abat J.K., Deswal R. 2013. Nitric oxide modulates the expression of proteins
and promotes epiphyllous bud differentiation in Kalanchoë pinnata. J. Plant
Growth Regul. 32: 92-101.
2. Abbasi B. H., Khan M., Guo B., Bokhari S. A., Mir Ajab Khan M. A. 2011.
Efficient regeneration and antioxidative enzyme activities in Brassica rapa var.
turnip. Plant Cell, Tiss. Organ Cult. 105: 337–344.
3. Adamczuk A., Siegień I., Ciereszko I. 2012a. Morphogenesis of plants in vitro
under stress conditions. W: G. Łaska (red.) Biological diversity - from cell to
ecosystem. Polish Botanical Society - Branch in Białystok: 25-39.
4. Adamczuk A., Siegień I., Ciereszko I. 2012b. Roślinne kultury in vitro -
charakterystyka i zastosowania. Edukacja Biologiczna i Środowiskowa 4: 38-46.
5. Adamczuk A., Siegień I., Ciereszko I. 2015. Len zwyczajny (Linum
usitatissimum L.) – znana, a niezwyczajna roślina. Edukacja Biologiczna i
Środowiskowa 3: 15-21.
6. Aebi H. 1984. Catalase in vitro. Methods in Enzymology 105: 121-126.
7. Agati G., Azzarello E., Pollastri S., Tattini M. 2012. Flavonoids as antioxidants
in plants: location and functional significance. Plant Sci. 196: 67–76.
8. Ahmad M. Jarillo J.A., Smirnova O., Cashmore A.R. 1998. The CRY1 blue light
photoreceptor of Arabidopsis interacts with phytochrome A in vitro. Molecular
Cell 1: 939–948.
9. Amalesh S., Gouranga D., Sanjoy K.D. 2011. Roles of flavonoids in plants. Int.
J. Pharm. Sci. Tech. 6: 12–35.
10. Amarowicz R., Pegg R. B., Rahimi-Moghadddam R., Barl B., Weil J. A. 2004.
Free-radical scavenging capacity and antioxidant activity of selected plant
species from the Canadian prairies. Food Chem. 84: 551-562.
11. Andarwulan N., Shetty K. 1999. Phenolic content in differentiated tissue
cultures of untransformed and Agrobacterium-transformed roots of anise
(Pimpinella anisum L.). J. Agric. Food Chem. 47: 1776-1780.
12. Andrys D. 2014. The importane of jasmonic acid and its metyl ester in tissue
cultures. W: From biotechnology to environmental protection. Walińska K.
(red.). Faculty of Biological Sciences University of Zielona Góra: 129-139.

201
13. Apel K., Hirt H. 2004 Reactive oxygen species: metabolism, oxidative stress,
and signal transduction. Plant Biol. 55: 373-399.
14. Aphalo P.J. 2006. Light signals and the growth and development of plants – a
gentle introduction. Plant Photobiology Notes 1: 1–39.
15. Arasimowicz M., Floryszak-Wieczorek J., Milczarek G., Jelonek T. 2008. Nitric
oxide, induced by wounding, mediates redox regulation in pelargonium leaves.
Plant Biol. 11: 650-663.
16. Arasimowicz-Jelonek M., Floryszak-Wieczorek J., Kubiś J. 2009. Interaction
between polyamine and nitric oxide signaling in adaptive responses to drought
in cucumber. J. Plant Growth Regul. 28: 177-186.
17. Aremu A.O., Gruz J., Šubrtová M., Szűčová L., Doležal K, Bairu M.W., Finnie
J.F., van Staden J. 2013. Antioxidant and phenolic acid profiles of tissue
cultured and acclimatized Merwilla plumbea plantlets in relation to the applied
cytokinins. J. Plant Physiol. 170: 1303–1308.
18. Asada K. 2000 The waterwater cycle as alternative photon and electron sinks.
Philos. Trans. R. Soc. London B. 355: 1419-1431.
19. Attree S.M., Fowke L.C. 1993. Embryogeny of gymnosperms: advances in
synthetic seed technology of conifers. Plant Cell, Tiss. Org. Cult. 35: 1-35.
20. Baba‐Kasai A.K.I.K.O., Hara N., Takano M. 2014. Tissue‐specific and
light‐dependent regulation of phytochrome gene expression in rice. Plant, Cell
Environ. 37: 2654-2666.
21. Bach A., Pawłowska B. 2009. Procesy rozwojowe w kulturze in vitro i typy
kultury. W: Malepszy S. (red.). Biotechnologia roślin. Wydawnictwo Naukowe
PWN. Warszawa: 21-38.
22. Bajguz A., Hayat S. 2009. Effects of brassinosteroids on the plant responses to
environmental stresses. Plant Physiol. Biochem. 47: 1-8.
23. Baran A. 2007. Regeneracja pędów w kulturach in vitro lnu (Linum
usitatissimum L.). Praca magisterska. Uniwersytet w Białymstoku.
24. Barbehenn R.V., Constabel C.P. 2011. Tannins in plant-herbivore interactions.
Phytochemistry 72: 1551-1565.
25. Bartosz G. 2013. Druga twarz tlenu. Wolne rodniki w przyrodzie. .
Wydawnictwo Naukowe PWN, Warszawa.

202
26. Bartwal A., Mall R., Lohani P., Guru S.K., Arora S. 2013. Role of secondary
metabolites and brassinosteroids in plant defense against environmental stresses.
J. Plant Growth Regul. 32: 216-232.
27. Batková P., Pospišilová J., Synková H. 2008. Production of reactive oxygen
species and development of antioxidative systems during in vitro growth and ex
vitro transfer. Biol. Plantarum 52: 413-422.
28. Beligni M. V., Lamattina L. 2000. Nitric oxide stimulates seed germination and
de-etiolation, and inhibits hypocotyls elongation, three light-inductible responses
in plants. Planta 210: 215-221.
29. Belonogova M. A., Raldugina G. N. 2006. Shoot regeneration from cotyledon
explants of fibre flax (Linum usitatissimum L.) and their subsequent rooting.
Russ. J. Plant Physiol. 53: 501-506.
30. Benmoussa M., Mukhopadhyay S., Desjardins Y. 1996. Optimization of callus
culture and shoot multiplication of Asparagus densiflorus. Plant Cell, Tiss. Org.
Cult. 47: 91-94.
31. Benson E. E. 2000. In vitro plant cell recalcitrance: an introduction. In Vitro
Cell Dev. Plant. 36: 141–148.
32. Bernabė-Antonio A., Santacruz-Ruvalcaba F., Cruz-Sosa F. 2012. Effect of
plant growth regulators on plant regeneration of Dioscorea remotiflora (Kunth)
through nodal explants. Plant Growth Regul. 68: 293-301.
33. Bertram L., Lercari B. 2000. Phytochrome A and phytochrome B1 control
the acquisition of competence for shoot regeneration in tomato hypocotyl. Plant
Cell Rep. 19: 604-609.
34. Bishop G., Sakakibara M.S., Yamaguchi S. 2015. Biosynthesis of hormones. W:
Buchanan B. B., Gruissem W., Russell L.J. Biochemistry and molecular biology
of plants. Wiley Blackwell, UK: 769-833.
35. Blokhina O., Virolainen E., Fagerstedt K.V. 2003. Antioxidants, oxidative
damage and oxygen deprivation stress: a review. Ann. Bot. 91: 179-194.
36. Bogunia H., Przywara L. 1999. Rola cukrowców w roślinnych kulturach in
vitro. Wiadomości Botaniczne 43: 25-36.
37. Borkowska B. 1997. Cytokininy. W: Jankiewicz L.S. Regulatory wzrostu i
rozwoju roślin. Właściwości i działanie. Tom I. Wydawnictwo Naukowe PWN.
Warszawa: 60-69.

203
38. Borkowska B. 2003. Fotosynteza jako marker fizjologiczny jakości kultur
pędowych i otrzymanych roślin. Biotechnologia 3: 30-38.
39. Bradford M. M. 1976. A rapid and sensitive for the quantitation of microgram
quantitites of protein utilizing the principle of protein-dye binding. Anal.
Biochem. 72: 248-254.
40. Bretagne B., Chupeau M-Ch., Chupeau Y., Fuilloux G. 1994. Improved flax
regeneration from hypocotyls using thidiazuron as a cytokinin source. Plant Cell
Rep. 14: 120-124.
41. Burbulis N., Blinstrubienė A., Kuprienė R., Sliesaravičius A., Venskutonienė E.
2007. Optimization of linseed flax (Linum usitatissimum L.) in vitro cultures.
Agriculture 94: 120 -128.
42. Burza W. 1995. Sterowanie morfogenezą roślin w kulturach in vitro. Kosmos
44: 691-701.
43. Busch F.A., Sage T.L., Cousins A.B., Sage R.F. 2013. C3 plants enhance rates
of photosynthesis by reassimilating photorespired and respired CO2. Plant Cell
Environ. 36: 200-212.
44. Cantrill L. Overall R.L., Goodwin P.B. 2001. Changes in simple permeability
during adventitious shoot regeneration in tobacco thin cell layers. Planta 214:
206-214.
45. Casal J.J. 2000. Phytochromes, cryptochromes, phototropin: photoreceptor
interactions in plants. J. Photoch. Photobio. B. 71: 1–11.
46. Cashmore A.R., Jarillo J.A., Wu Y.–J., Liu D. 1999. Cryptochromes: blue light
receptors for plants and animals. Science 284: 760–765.
47. Cassells A.C., Curry R.F. 2001. Oxidative stress and physiological, epigenetic
and genetic variability in plant tissue culture: implications for micropropagators
and genetic engineers. Plant Cell, Tiss. Org. Cult. 64: 145-157.
48. Chavan J.J., Gaikwad N.B., Umdale S.D., Kshirsagar P.R., Bhat K.V., Yadav
S.R. 2014. Efficiency of direct and indirect shoot organogenesis, molecular
profiling, secondary metabolite production and antioxidant activity of
micropropagated Ceropegia santapaui. Plant Growth Reg. 72: 1-15.
49. Chen J., Ziv M. 2001. The effect of ancymidol on hyperhydricity, regeneration,
starch and antioxidant enzymatic activities in liquid-cultured Narcissus. Plant
Cell Rep. 20: 22–27.

204
50. Cho K., Agrawal G.K., Shibato J., Jung Y.H., Kim Y.K., Nahm B.H., Jwa N.S.,
Tamogami S., Han O., Kohda K., Iwahashi H., Rakwal R. 2007. Survey of
differentially expressed proteins and genes in jasmonic acid treated rice seedling
shoot and root at the proteomics and transcriptomics levels. J. Proteome Res. 6:
581-603.
51. Chung H.S., Koo A.J., Gao X., Jayanty S., Thines B., Jones A.D., Howe G.A.
2008. Regulation and function of Arabidopsis jasmonate zim-domain genes in
response to wounding and hebivory. Plant Physiol. 146: 952-964.
52. Ciąćka K., Krasuska U., Gniazdowska A. 2016. Modyfikacja endogennego
stężenia tlenku azotu w regulacji spoczynku nasion. W: Bajguz A., Ciereszko I.
(red.). Różnorodność biologiczna - od komórki do ekosystemu. Rośliny i grzyby
– badania środowiskowe i laboratoryjne. Polskie Towarzystwo Botaniczne
Białystok 2016. Agencja Wydawnicza EkoPress, Białystok: 21-32.
53. Ciereszko I. 2006. Kontrola metabolizmu sacharozy u roślin w odpowiedzi na
zmienne warunki środowiska. Kosmos 55: 229-241.
54. Ciereszko I. 2007. Odbiór i przekazywanie sygnału wywołanego zmianami
poziomu cukrów w komórkach roślin. Post. Biol. Kom. 34: 693-711.
55. Ciereszko I. 2016. Cukry jako regulatory wzrostu i rozwoju roślin. W:
Różnorodność biologiczna - od komórki do ekosystemu. Rośliny i grzyby –
badania środowiskowe i laboratoryjne. Bajguz A., Ciereszko I. (red.). Polskie
Towarzystwo Botaniczne Białystok 2016. Agencja Wydawnicza EkoPress,
Białystok :21-32 .
56. Corpas F. J., Leterrier M., Valderrama R., Airaki M., Chaki M., Palma J. M.,
Barroso J. B. 2011. Nitric oxide provokes nitrosative response in plants under
abiotic stress. Plant Sci. 181: 604-611.
57. Corpas F. J., Sandalio L. M., del Rio L. A., Trelese R. N. 1998. Copper–zinc
superoxide dismutase is a constituent enzyme of the matrix of peroxisomes in
the cotyledons of oilseed plants. New Phytol. 138: 307-314.
58. Creelman R.A., Mullet J.E. 1997. Biosynthesis and action of jasmonates in
plants. Annu. Rev. Plant Biol. 48: 355-381.
59. Cui X.H., Murthy H.M., Wu C.H., Paek K.Y. 2010. Sucrose induced osmotic
stress affects biomass, metabolite, and antioxidant levels in root suspension
cultures of Hypericum perforatum L. Plant Cell, Tiss. Org. Cult. 124: 573-581.

205
60. Czaplińska M., Czepas J., Gwozdziński K. 2012. Budowa, właściwości
przeciwutleniające i przeciwnowotworowe flawonoidów. Post. Bioch. 58: 235-
240.
61. Czerpak, R., Piotrowska, A. 2003. Cytokininy, ich struktura, metabolizm i
aktywność biologiczna. Kosmos 52: 203-215.
62. De Klerk G.J., Guan H., Huisman P., Marinova S. 2011. Effects of phenolic
compounds on adventitious root formation and oxidative decarboxylation of
applied indoleacetic acid in Malus ‘Jork 9’. Plant Growth Reg. 63: 175-185.
63. Demarsy E., Fankhauser C. 2009. Higher plants use LOV to perceive blue light.
Curr. Opin. Plant Biol. 12: 69–74.
64. Demmig-Adams B., Adams W.W. 1996. Xanthophyll cycle and light stress in
nature: uniform response to excess direct sunlight among higher plant species.
Planta 198: 460–470.
65. Dixon R.A., Paiva N.L. 1995. Stress-induced phenylpropanoid metabolism.
Plant Cell 7: 1085-1097.
66. Dolcet-Sanjuan R. i Claveria E. 1995. Improved shoot-tip micropropagation of
Pistacia vera L. and the beneficial effects of methyl jasmonate. J. Amer. Soc.
Hort. Sci. 120: 938-942.
67. Drozdowska K. 2013. Zmiany składu podłoża hodowlanego a wzrost lnu
włóknistego (Linum usitatissimum L.) w warunkach sterylnych. Praca
magisterska. Uniwersytet w Białymstoku.
68. Dubravina G.A., Zaytseva S.M., Zagoskina N.V. 2005. Changes in Formation
and Localization of Phenolic Compounds in the Tissues of European and
Canadian Yew during Dedifferentiation in vitro. Russ. J. Plant Physiol. 52: 672-
678.
69. Dutta Gupta S., Datta S. 2004. Anioxidant enzyme activities during in vitro
morphogenesis of gladiolus and the effect of application of antioxidants on plant
regeneration. Biol. Plantarum 47: 179-183.
70. Echeverrigaray S., Fracaro F., Andrade L.B., Biasio S., Atti-Serafini L. 2000. In
vitro shoot regeneration from leaf explants of Roman Chamomile. Plant Cell,
Tiss. Org. Cult. 60: 1-4.
71. Eckstein A., Zięba P., Gabryś H. 2012. Sugar and light effects on the condition
of the photosynthetic apparatus of Arabidopsis thaliana in vitro. J. Plant Growth
Regul. 31: 90–101.

206
72. Emons A.M.C., Samallo-Droppers A., Van der Torn C. 1993. The influence of
sucrose, manitol, L-proline, abscisic acid and gibberelic acid on the maturation
of somatic embryos of Zea mays L. from suspension cultures. J. Plant Physiol.
142: 597-604.
73. Fan Q., Liu J. 2012. Nitric oxide is involved in dehydration/drought tolerance in
Poncirus trifoliata seedlings through regulation of antioxidant systems and
stomatal response. Plant Cell Rep. 31: 145-154.
74. Fazal H., Abbasi B.H., Ahmad N., Ali M., Ali S. 2016. Sucrose induced
Osmotic stress and phtoperiod regimes enhanced the biomass and production of
antioxidant secondary metabolites in shake-flask suspension cultures of Prunella
vulgaris L. Plant Cell, Tiss. Org. Cult. 124: 573-581.
75. Fernandez-Marcos M., Sanz L., Lewis D.R., Munday G.K., Lorenzo O. 2011.
Nitric oxide causes root apical meristem detects and growth inhibition while
reducing PIN-FOR-MED1 (PIN1)-dependent acropetal auxin transport. PNAS
108: 18506-18511.
76. Figueroa C. M., Lunn J. E. 2016. A tale of two sugars: trehalose 6-phosphate
and sucrose. Plant Physiol. 172: 7-27.
77. Floryszak-Wieczorek J., Milczarek G., Arasimowicz M., Ciszewski A. 2006. Do
nitric oxide donors mimic endogenous NO-related response in plants? Planta
224: 1363-1372.
78. Foyer C.H., Noctor G. 2005. Oxidant and antioxidant signaling in plants: a
reevaluation of the concept of oxidative stress in a physiological context. Plant
Cell Envir. 28:1058-1070.
79. Foyer C.H., Shigeoka S. 2011. Understanding oxidative stress and antioxidant
functions to enhance photosynthesis. Plant Physiol. 155: 93–100.
80. Franklin K.A., Quail P. 2010. Phytochrome functions in Arabidopsis
development. J. Exp. Bot. 61: 11–24.
81. Frankowski K., Kęsy J., Kopcewicz J. 2007. Regulacja biosyntezy etylenu u
roślin. Post. Bioch. 53: 66-73.
82. Frankowski K., Świeżawska B., Wilmowicz E., Kęsy J., Kopcewicz J. 2009.
Szlak sygnałowy kwasu jasmonowego - nowe informacje. Post. Bioch. 55: 337-
341.

207
83. Frello S., Stummann B.M., Serek M. 2002. Shoot regeneration of Campanula
carpatica Jacq. (Campanulaceae) via callus phase. Sci. Hort. 93: 86-90.
84. Frohlich A., Durner J. 2011. The hunt for plant nitric oxide synthase (NOS): is
one really needed?. Plant Sci. 181: 401-404.
85. Fuentes G., Talavera C., Desjardins Y., Santamaria J. 2005. High irradiance can
minimize the negative effect of exogenous sucrose on the photosynthetic
capacity of in vitro grown coconut plantlets. Biol. Plantarum 49: 7-15.
86. Gabryś H. 2012. Regulacja procesów wzrostu i rozwoju przez czynniki
środowiskowe. W: Kopcewicz J., Lewak S. (red.). Fizjologia roślin. PWN,
Warszawa: 176-198.
87. Gabryszewska E., Węgrzynowicz-Lesiak E., Kawa-Miszczak L., Góraj J.,
Saniewski M. 2009. Wpływ cytokinin i TDZ na namnażanie liliowca in vitro
oraz na zawartość węglowodanów i chlorofilu w pędach. Zeszyty Problemowe
Postępów Nauk Rolniczych 534: 31-42.
88. Gairi A., Rashid A. 2002. In vitro stimulation of shoot –buds on hypocotyls of
Linum seedlings, by flooding and ethereal treatment of cultures. Plant Sci. 163:
691-694.
89. Gamborg O. L., Miller R. A., Ojima K. 1968. Nutrient requirements of
suspension cultures of soybean root cells. Exp. Cell Res. 50: 151-158.
90. Garstka M. 2007. Strukturalne podstawy reakcji świetlnych fotosyntezy. Post.
Biol. Kom. 34: 445-476.
91. Gaspar T., Franck T., Bisbis B., Kevers C., Jouve L., Hausman J.F., Dommes J.
2002. Concepts in plant stress physiology. Application to plant tissue cultures.
Plant Growth Reg. 37: 263-285.
92. Gaspar T., Kevers C., Penel C., Creppin H., Reid M.D., Thorpe T.A. 1996. Plant
hormones and plant growth regulators in plant tissue culture. In Vitro Cell. Dev.
Biol.- Plant 32: 272-289.
93. Genga A., Allavena A. 1991. Factors affecting morphogenesis from immature
cotyledons of Phaseolus coccineus L. Plant Cell, Tiss. Org. Cult. 27: 189-196.
94. Genkov T., Tsoneva P., Ivanova I. 1997. Effect of cytokinins on photosynthetic
pigments and chlorophyllase activityin in vitro cultures of axillary buds of
Dianthus caryophyllus L. J. Plant Growth Reg. 16: 169-172.

208
95. George E.F., De Klerk G-J. 2008. The components of plant tissue culture media
I: macro- and micro-nutrients. W: George E.F., Hall M.A., De Klerk G-J. (red.).
Plant propagation by tissue culture 3rd edition. Springer: 65-115.
96. Gerlach D. 1972. Badanie materiału utrwalonego. Utrwalanie. W: Zarys
mikrotechniki botanicznej; red. Michalkiewicz K. Państwowe Wydawnictwo
Rolnicze i Leśne, Warszawa: 37-53.
97. Ghimire B.K., Seong E.S., Goh E.J., Kim N.Y., Kang W.H., Kim E.H., Yu C.Y.,
Chung I.M. 2010. High-frequency direct shoot regeneration from Drymaria
cordata Willd. leaves. Plant Cell, Tiss. Organ Cult. 100: 209-217.
98. Ghimire B.K., Seong E.S., Goh E.J., Kim N.Y., Kang W.H., Kim E.H., Yu C.Y.,
Chung I.M. 2010. High-frequency direct shoot regeneration from Drymaria
cordata Willd. leaves. Plant Cell, Tiss. Org. Cult. 100: 209-217.
99. Giannopolitis C.N., Ries S.K. 1977. Superoxide dismutases I. Occurrence in
higher plants. Plant Physiol. 59: 309-314.
100. Gieczewska K. 2015. " Napędzane światłem"- od fotosyntezy do fotoogniwa.
Kosmos 64: 387-399.
101. Gill S.S., Hasanuzzaman M., Nahar K., Macovei A., Tuteja N. 2013. Importance
of nitric oxide in cadmium stress tolerance in crop plants. Plant Physiol. Bioch.
63: 254-261.
102. Gniazdowska A., Bogatek R. 2007. Regulacyjna rola tlenku azotu w
kiełkowaniu nasion. Post. Biol. Kom. 34: 431-443.
103. Gniazdowska A., Dobrzyńska U., Babańczyk T., Bogatek R. 2007. Breaking the
apple dormancy by nitric oxide involves the stimulation of ethylene production.
Planta 225: 1051-1057.
104. Gniazdowska A., Krasuska U., Bogatek R. 2010. Dormancy removal in apple
embryos by nitric oxide or cyanide involves modifications in ethylene
biosynthetic pathway. Planta 232: 1397-1407.
105. Gniazdowska A., Krasuska U., Czajkowska K., Wierzbicki M., Bogatek R.
2009. Tlenek azotu i hemoglobiny roślinne. Post. Biol. Kom. 36: 233-250.
106. Górecka K., Krzyżanowska D., Glapś T., Górecki R. 1997. Porównanie wzrostu
i owocowania roślin pomidora otrzymanych w kulturach tkanek i tradycyjnie z
siewu. W: Dubert F., Skoczowski A. (red.). Zastosowanie kultur in vitro w
fizjologii roślin. ZFR PAN, Kraków: 87-92.

209
107. Greenway M.B., Phillips I.C., Lloyd M.N., Hubstenberger J.F., Phillips G.C.
2012. A nutrient medium for diverse applications and tissue growth of plant
species in vitro. In Vitro Cell. Dev. Biol..-Plant 48: 403-410.
108. Gruszczyńska A., Rakoczy-Trojanowska M. 2007. Charakterystyka genów
ulegających ekspresji podczas somatycznej embriogenezy u roślin.
Biotechnologia 76: 96-106.
109. Grzegorzewska W., Jaworski K., Szmidt-Jaworska A. 2009. Rola tlenku azotu w
odpowiedzi roślin na stres abiotyczny. Post. Biol. Kom. 4: 663-678.
110. Guha S., Rao I. U. 2012. Nitric oxide promoted rhizome induction in
Cymbidium shoot buds under magnesium deficiency. Biol. Plant. 56: 227-236.
111. Gupta K.J., Fernie A.R., Kaiser W.M., vanDongen J.T. 2011. On the origins of
nitric oxide. Trends Plant Sci. 16: 160-168.
112. Gupta K.J., Igamberdiev A.U. 2015. Compartmentalization of reactive oxygen
species and nitric oxide production in plant cell: an overview. W: Gupta K.J.,
Igamberdiev A.U. (red.). Reactive oxygen and nitrogen species signaling and
communication in plants. Springer International Publishing, Seria Signaling and
Communication in Plants, Szwajcaria: 1-14.
113. Gupta S. D., Datta S. 2003. Antioxidant enzyme activities during in vitro
morphogenesis of gladiolus and the effect of application of antioxidants on plant
regeneration. Biol. Plant. 47: 179–183.
114. Han X., Yang H., Duan K., Zhang X., Zhao H., You S., Jiang Q. 2009. Sodium
nitroprusside promotes multiplication and regeneration of Malus hupehensis in
vitro plantlets. Plant Cell Tiss. Org. Cult. 97: 175-185.
115. Haq I., Chang-Xing Z., Mukhtar Z., Jaleel C. A., Azooz M. M. 2009. Effect of
physical desiccation on plant regeneration efficiency in rice (Oryza sativa L.)
variety super basmati. J. Plant Physiol. 166: 1568-1575.
116. Hasia Ch., Korban S.S. 1996. Organogenesis and somatic embryogenesis in
callus cultures of Rosa hybrida and Rosa chinensis minima. Plant Cell, Tiss.
Org. Cult. 44: 1-6.
117. Hebelstrup K. H., Shah J. K., Igamberdiev A. U. 2013. The role of nitric oxide
and hemoglobin in plant development and morphogenesis. Physiol. Plant. 148:
457-469.

210
118. Heller K. 2007. Technologie uprawy i przerobu lnu i konopi w warunkach
zrównoważonego i wielofunkcyjnego rozwoju rolnictwa polskiego. Fragmenta
Agronomica 3: 181-186.
119. Heller K. 2012. Metodyka integrowanej ochrony roślin dla uprawy lnu
włóknistego. Dostępne na www.minrol.gov.pl dostęp 05.04.2017
120. Heller K., Wielgusz K. 2011. Plonowanie odmiany lnu oleistego Bukoz w
gospodarstwach ekologicznych i konwencjonalnych. J. Res. Appl. Agric. Engng.
56: 138-142.
121. Hernández I., Alegre L., Van Breusegem F., Munné-Bosch S. 2008. How
relevant are flavonoids as antioxidants in plants?. Trends Plant Sci. 14: 125-132.
122. Ho S.L., Chao Y.C., Tong W.F., Yu S.M. 2001. Sugar coordinately and
differentially regulates growth- and stress-related gene expression via a complex
signal transduction network and multiple control mechanisms. Plant Physiol.
125: 877-890.
123. Hopkins W.G., Hüner N.P.A. 2004. Introduction to plant physiology. John
Wiley&Sons, USA.
124. Hu X.Y., Neill S.J., Tang Z.C., Cai W.M. 2005. Nitric oxide mediates
gravitropic bending in soybean roots. Plant Physiol. 137: 663-670.
125. Hu Y. X., Bao F., Li J. Y. 2000. Promotive effect of brassinosteroids on cell
division involves a distinct CycD3-induction pathway in Arabidopsis. Plant J.
24: 693–701.
126. Igamberdiev A.U., Eprintsev A.T., Fedorin D.N., Popov V.N. 2014.
Phytochrome–mediated regulation of plant respiration and photorespiration.
Plant Cell Environ. 37: 290–299.
127. Jain R. K., Jain S., Wu R. 1996. Stimulatory effect of water stress on plant
regeneration in aromatic Indica rice varieties. Plant Cell Rep. 15: 449–454.
128. Jaiswal S., Sawhney S. 2006. Modulation of TDZ-induced morphogenetic
responses by anti-auxin TIBA in bud-bearing foliar explants of Kalanchoë
pinnata. Plant Cell, Tiss. Organ Cult. 86: 69-76.
129. Jana S., Shekhawat G.S. 2012. In vitro regeneration of Anethum graveolens,
anioxidative enzymes during organogenesis and RAPD analysis for clonal
fidelity. Biol. Plant. 56: 9-14.

211
130. Janas K.M, Dzięgielewski M., Szafrańska K., Posmyk M. 2010. Karrikiny -
nowe regulatory kiełkowania nasion i wzrostu roślin. Kosmos 59: 581-587.
131. Janeczko A. 2005. Brasinosteroidy w rolnictwie, ogrodnictwie i kulturach in
vitro. Kosmos 54: 2005.
132. Janowicz J., Wojciechowski A. 2009. Ocena zdolności regeneracyjnych dwóch
odmian lnu (Linum usitatissimum L.) w kulturach in vitro. Rośliny Oleiste 30:
35-49.
133. Jasiński M., Mazurkiewicz E., Rodziewicz P., Figlerowicz M. 2009.
Flawonoidy- budowa, właściwości i funkcja ze szczególnym uwzględnieniem
roślin motylkowych. Biotechnologia 2: 81-94.
134. Jaspers P., Kangasjarvi J. 2010. Reactive oxygen species in abiotic stress
signaling. Physiol. Plant. 138: 405-413.
135. Kacperska A. 2012. Reakcje roślin na stresowe czynniki środowiska. W:
Kopcewicz J., Lewak S. (red.). Fizjologia roślin. PWN. Warszawa: 634-708.
136. Kalra C., Babbar S. B. 2010. Nitric oxide promotes in vitro organogenesis in
Linum usitatissimum L. Plant Cell, Tiss. Org. Cult. 103: 353-359.
137. Kalra C., Babbar S. B. 2012. Stimulatory and period-specific effect of nitric
oxide on in vitro caulogenesis in Albizzia lebbeck (L.) Benth. Acta Physiol.
Plant. 34: 387-392.
138. Keller M.M., Jaillais Y., Pedmale U.V., Moreno J.E., Chory J., Ballaré C.L.
2011. Cryptochrome 1 and phytochrome B control shade–avoidance responses
in Arabidopsis via partially independent hormonal cascades. Plant Journal 67:
195–207.
139. Kępczyńska E. 2006. Kiełkowanie i konwersja somatycznych zarodków in vitro.
Biotechnologia 4: 78-94.
140. Khan H., Siddique I., Anis M. 2006. Thidiazuron induced somatic
embryogenesis and plant regeneration in Capsicum annuum. Biol. Plant. 50:
789-792.
141. Khanna H. K., Daggard G. E. 2001. Enhanced of shoot regeneration in nine
Australian wheat cultivars by spermidine and water streatments. Australian J.
Plant Physiol. 28: 1243–1247.

212
142. Kim Y.S., Hahn E.J., Murphy H.N., Paek K.Y. 2004. Adventitious root growth
and ginsenoside accumulation in Panax ginseng cultures as affected by methyl
jasmonate. Biotechnol. Lett. 26: 1619-1622.
143. Koch K. E. 1996. Carbohydrate modulated gene expression in plants. Annu.
Rev. Plant Physiol. Plant Mol. Biol. 47: 509-540.
144. Kong S.-G., Okajima K. 2016. Diverse photoreceptors and light responses in
plants. J. Plant Res. 129: 111-114.
145. Konieczny R., Banaś A., Surówka E., Michalec Ż., Miszalski Z., Libik-
Konieczny M. 2014. Pattern of antioxidant enzyme activites and hydrogen
peroxide kontent during developmental stages of rhizogenesis from hypocotyls
explants of Mesembryanthemum crystallinum L.. Plant Cell Rep. 33: 165-177.
146. Kopcewicz J. 2012. Wzrost i rozwój roślin. W: Kopcewicz J., Lewak S. (red.).
Fizjologia roślin. PWN, Warszawa: 539-575.
147. Korach A., Juliani H.R., Kapteyn J., Simon J.E. 2002. In vitro regeneration of
Echinacea purpurea from leaf explants. Plant Cell, Tiss. Org. Cult. 69: 79-83.
148. Kowalewska E., Litwinienko G. 2010. Fenolowe antyoksydanty interwentywne-
aktywność i mechanizmy działania. Post. Bioch. 56: 274-283
149. Kozłowska-Szerenos B., Ciereszko I. 2013. Udział askorbinianu w odpowiedzi
roślin na niekorzystne czynniki środowiska. W: I. Ciereszko i A. Bajguz (red.).
Różnorodność biologiczna - od komórki do ekosystemu. Rośliny i grzyby w
zmieniających się warunkach środowiska, Białystok, Pol. Tow. Botaniczne: 69-
82.
150. Krasuska U., Ciacka K., Orzechowski S., Fettke J., Bogatek R., Gniazdowska A.
2016. Modification of the endogenous NO level influences apple embryos
dormancy by alterations of nitrated and biotinylated protein patterns. Planta 244:
877-891.
151. Kreslavski V. D., Los D. A., Allakhverdiev S. I., Kuznetov Vl. V. 2012.
Signailng role of reactive oxygen species in plants under stress. Russ. J. Plant
Physiol. 59: 141-154.
152. Krishna P. 2003. Brassinosteroid-mediated stress responses. J. Plant. Growth
Regul. 22: 289-297.
153. Kubo A., Aono M., Nakajima N., Saji H., tanaka K., Kondo N. 1999.
Differential responses in activity of antioxidant enzymes of different
environmental stresses in Arabidopsis thaliana. J. Plant Res. 112: 279-290.

213
154. Kulus D. 2013. Embriogeneza somatyczna in vitro. W: Kuczera M. (red.). Nowe
trendy w naukach przyrodniczych 4. CreativeTime, Kraków: 45-53.
155. Leshem Y. Y., Haramaty E. 1996. The characterization and contrasting effects
of the nitric oxide free radical in vegetative stress and senescence of Pisum
sativum Linn. foliage. J. Plant Physiol. 148: 258-263.
156. Libik –Konieczny M., Konieczny R., Surówka E., Ślesak I., Michalec Ż.,
Rozpądek P., Miszalski Z. 2012. Pathways of ROS homeostasis regulation in
Mesembryanthemum crystallinum L. calli exhibiting differences in rhizogenesis.
Plant Cell, Tiss Org. Cult. 110: 123-131.
157. Libik M., Konieczny R., Pater B., Ślesak I., Miszalski Z. 2005. Differences in
the activities of some antioxidant enzymes and in H2O2 content during
rhizogenesis and somatic embryogenesis in callus cultures of the ice plant. Plant
Cell Rep. 23: 834–841.
158. Lin C. 2000. Plant blue–light receptors. Trends Plant Sci. 5: 337–342.
159. Liu X., Deng Z., Cheng H., He X., Song S. 2011. Nitrite, sodium nitroprusside,
potassium ferricyanide and hydrogen peroxide release dormancy of Amaranthus
retroflexus seeds in a nitric oxide-dependent manner. Plant Growth Regul. 64:
155-161.
160. Ljung K., Nemhauser J.L., Perata P. 2015. New mechanistic links between sugar
and hormone signalling networks. Curr. Opin. Plant Biol. 25: 130-137.
161. Luesse D. R., DeBlasio S. L., Hangarter R. P. 2010. Integration of phot1, phot2,
and PhyB signalling in light–induced chloroplast movements. J. Exp. Bot. 61:
4387–4397.
162. Luo Z.B., Janz D., Jiang X., Göbel C., Wildhagen H., Tan Y., Rennenberg H.,
Feussner I., Polle A. 2009. Upgrading root physiology for stress tolerance by
ectomycorrhizas: Insights from metabolite and transcriptional profiling into
reprogramming for stress anticipation. Plant Physiol. 151: 1902-1917.
163. Maciejewska B., Kopcewicz J. 2002. Inhibitory effect of methyl jasmonate on
flowering and elongation growth in Pharbitis nil. J. Plant Growth Regul. 21:
216-223.
164. Magioli C., roch A.P.M., De Oliveira D.E., Mansur E. 1998. Efficient shoot
organogenesis of eggplant (Solanum melongena L.) induced by thidiazuron.
Plant Cell Rep. 17: 661-663.

214
165. Makkar H.P.S., Blummel M., Becker K. 1995. Formation of complexes between
polyvinylpyrrolidones or polyethylene glycols and tannins, and their implication
in gas production and true digestibility in in vitro techniques. British Journal of
Nutrition 73: 897-913.
166. Małecka A., Tomaszewska B. 2005. Reaktywne formy tlenu w komórkach
roślinnych i enzymatyczne systemy obronne. Post. Biol. Kom. 32: 311-325.
167. Martínez-Bonfil B.P., Cruz-Hernández A.C., López-Laredo A.R., Trejo-Tapia
G., Trejo-Espino J.L.2014. Effects of culture medium and auxins on growth of
adventitious root cultures of Cuphea aeguipetala Cav. and their ability to
produce antioxidant compounds. Plant Cell, Tiss. Org. Cult. 118: 401-408.
168. Martín-Urdíroz N., Garrido-Gala J., Martin J., Barandiaran X. 2004. Effect
of light on the organogenic ability of garlic using a one-step in vitro system.
Plant Cell Rep. 22: 721-724.
169. Marzec M., Kuczynska E.U. 2014. Importance symplasmic communications in
cell differentiation. Plant Signal Behav. 9: e27931.
170. Marzec M., Kurczyńska E. U. 2008. Rola komunikacji-izolacji symplastowej w
różnicowaniu komórek na wybranych przykładach. Post. Biol. Kom. 35: 369-
389.
171. Marzec M., Muszyńska A. 2012. Strigolaktony-nowi kandydaci na hormony
roślinne. Post. Biol. Kom. 39: 63 – 86.
172. Mazorra L.M. Nunez M., Hechavarria M., Coll F., Schanchez-Blanco M.J. 2002.
Influence of brassinosteroids on antioxidant enzymes activity in tomato under
different temperatures. Biol. Plantarum 45: 593-596.
173. Meeussen J.L., Keizer M.G., van Riemsdijk W.H. 1992. Dissolution behavior od
ion cyanide (Prussian blue) in contaminated soils. Environmental Science and
Toxicology 26: 1832-1838.
174. Meratan A.A., Ghaffari S.M., Niknam V. 2009. In vitro organogenesis and
antioxidant enzymes anctivity in Acanthophyllum sordidum. Biol. Plantarum 53:
5-10.
175. Mikuła A., Pożoga M., Tomiczak K., Rybczyński J. J. 2015. Somatic
embryogenesis in ferns: a new experimental system. Plant Cell Rep. 34: 783-
794.

215
176. Mikuła A., Skierski J., Rybczyński J. J. 2002. Somatic embryogenesis of
Gentiana genus III. Characterization of three-year-old embryogenic suspensions
of G. pannonica originated from various seedling explants. Acta Physiol. Plant.
24: 311-322.
177. Mikuła A., Wesołowska M., Kapusta J., Skrzypczak L., Rybczyński J. J. 1996.
Cytomorphological studies on somatic embryogenesis of Gentiana tibetica
(King) and G. cruciata (L.). Acta Soc. Bot. Pol. 65: 47-51.
178. Mikuła A., Wilbik W., Rybczyński J.J. 1997. Wpływ regulatorów wzrostu na
somatyczną embriogenezę Gentiana sp. w kulturach in vitro. W: Dubert F.,
Skoczowski A. (red.). Zastosowanie kultur in vitro w fizjologii roślin. ZFR
PAN, Kraków: 141-154.
179. Millam S., Davidson D., Powell W. 1992. The use of flax (Linum usitatissimum)
as a model system for studies on organogenesis in vitro: the effect of different
carbohydrates. Plant Cell Tiss. Org. Cult. 28: 163-166.
180. Millam S., Obert B., Preťová A. 2005. Plant cell and biotechnology studies in
Linum usitatissimum – a review. Plant Cell, Tiss Org Cult. 82: 93-103.
181. Mitrović A., Bogdanović J. 2008. Activities of antioxidative enzymes during
Chenopodium rubrum L. ontogenesis in vitro. Arch. Biol. Sci. 60: 223-231.
182. Mitrović A., Janošević D., Budimir S., Bogdanović Pristov J. 2012. Changes in
antioxidative enzymes activities during Tacitus bellus direct shoot
organogenesis. Biol. Plantarum 56: 357-361.
183. Mohr H., Schofer P. 1995. Plant physiology. Springer-Verlag Berlin Heidelrberg
184. Molassiotis A.N., Dimassi K., Diamantidis G., Therios I. 2004. Changes in
peroxidases and catalase activity during in vitro rooting. Biol. Plant. 48: 1-5.
185. Morkunas I., Borek S., Formela M., Ratajczak L. 2012. Plant responses to sugar
starvation. W: Chang C.-F. (red.), Carbohydrates – comprehensive studies on
glycobiology and glycotechnology. InTech 409-438.
186. Mundhara R., Rashid A. 2001. Regeneration of shoot-buds on hypocotyl of
Linum seedlings: a stress related response. Plant Sci. 161: 19–25.
187. Mundhara R., Rashid A. 2006. TDZ-induced triple-response and shoot
formation on intact seedlings of Linum, putative role of ethylene in regeneration.
Plant Sci. 170: 185–190.
188. Munné-Bosch S., Alegre L. 2002. The function of tocopherols and tocotrienols
in plants. Crit. Rev. Plant Sci. 21: 31-57.

216
189. Mur L. A. J., Mandon J., Presijn S., Cristescu S. M., Moshkov I. E., Novikova
G. V., Hall M. A., Harren F. J. M., Hebelstrup K. H., Gupta K. J. 2013. Nitric
oxide in plants: an assessment of the current state of knowledge. AoB Plants,
doi. 10.1093/aobpla/pls052.
190. Murashige T., Skoog F. 1962. A revised medium for rapid growth and bio-
assays with tobacco tissue cultures. Physiol. Plant. 15: 473-497.
191. Nas M.N., Bolek Y., Sevgin N. 2010. The effects of ex plant and cytokinin type
on regeneration of Prunus microcarpa. Sci. Hort. 126: 88-94
192. Neill S. J., Desikan R., Hancock J. T. 2003. Nitric oxide signaling in plants.
New Phytol. 159: 11-35.
193. Neto V.B.P., Otoni W.C. 2003. Carbon sources and their osmotic potential in
plant tissue culture: does it matter? Sci. Hort. 97: 193-202.
194. Niedźwiedź-Siegień I. 1998. Cyanogenic glucosides in Linum usitatissimum.
Phytochemistry 49: 59–63.
195. Nisar A., Hina F., Bilal H. A., Muhammad R., Tariq M., Nighat F. 2010.
Efficient regeneration and antioxidant potential in regenerated tissues of Piper
nigrum L. Plant Cell ,Tiss. Org. Cult. 102: 129-134.
196. Nowicka B., Kruk J. 2013. Reaktywne formy tlenu w roślinach – więcej niż
trucizna. Kosmos 62: 583-596.
197. Nunez M., Siqueira W. J., Hernandez M., Zullo M. A. T., Robaina C., Coli F.
2004. Effect of spirostane analogues of brassinosteroids on callus formation and
plant regeneration in lettuce (Lactuca sativa). Plant Cell, Tiss. Org. Cult. 78: 97–
99.
198. O’Donell V.B., Chumley P.H., Hogg P.H., Blooodsworth A., Darley-Usmar
V.M., Freeman B.A. 1997. Nitric oxide inhibition of lipid peroxidation: kinetic
of reaction with lipid peroxyl radicals and comparsion with alpha-tocopherol.
Biochemistry 36: 15216-15223.
199. Obert B., Bensosn E. E., Millam S., Pret'ova A., Bremner D. H. 2005.
Moderation of morphogenetic and oxidative stress responses in flax in vitro
cultures by hydroxynonenal and desferrioxamine. J. Plant Physiol. 162: 537–
547.

217
200. Olchowik-Grabarek E., Mavlyanov S., Abdullajanova N., Gieniusz R.,
Zamaraeva M. 2016. Specificity of hydrolysable tannins from Rhus typhina L. to
oxidants in cell and cell-free models. Appl. Biochem. Biotechnol. DOI
10.1007/s12010-016-2226-1.
201. Oomah B. D., Mazza G., Kenaschuk E. O. 1992. Cyanogenic compounds in
flaxseed. J Agric Food Chem. 40: 1346 – 1348.
202. Oracz K., El-Maarouf Bouteau H., Kranner I., Bogatek R., Corbineau F., Bailly
C. 2009. The mechanisms involved in seed dormancy alleviation by hydrogen
cyanide unravel the role of reactive oxygen species as key factors of cellular
signaling during germination. Plant Physiol. 150: 494-505.
203. Orlikowska T. 1997. Regulatory roślinne w kulturach in vitro. W: Jankiewicz
L.S. (red.). Regulatory wzrostu i rozwoju roślin. Zastosowanie w ogrodnictwie,
rolnictwie, leśnictwie i w kulturach tkanek. Tom II. Wydawnictwo Naukowe
PWN. Warszawa: 219-233
204. Ostaszewska-Bugajska M., Podgórska A., Rychter A. M., Szal B. 2015.
Roślinny mitochondrialny łańcuch oddechowy. Kosmos 64: 401-414.
205. Pagnussat G. C., Lanteri M. L., Lamattina L. 2003. Nitric oxide and cyclic GMP
are messengers in the indole acetic acid-induced adventitious rooting process.
Plant Physiol. 132: 1241–1248.
206. Pagnussat G.C., Simontacchi M., Puntarulo S., Lamattina L. 2002. Nitric oxide
is required for root organogenesis. Plant Physiol. 129: 954-956.
207. Pak H., Guo Y., Chen M., Chen K., Li Y., Hua S., Shamsi I., Meng H., Shi C.,
Jiang L. 2009. The effect of exogenous methyl jamonate on the flowering time,
floral organ morphology, and transcript levels of a group of genes implicated in
the development of oilseed rape flowers (Brassica napus L.). Planta 231: 79-91.
208. Palacio L., Cantero J.J., Cusidó R.M., Goloniowski M.E. 2012. Phenolic
compound production in relations to differentiation in cell and tissue cultures of
Larrea divaricata (Cav.). Plant Sci. 193-194: 1-7.
209. Papadakis A. K., Siminis C. I., Roubelakis-Angelakis K. A. 2001. Reduced
activity of antioxidant machinery is correlated with suppression of totipotency in
plant protoplasts. Plant Physiol. 126: 434-444.
210. Paques M. 1991. Vitrification and micropropagation: causes, remedies and
prospects. Acta Hort. 289: 283-290.

218
211. Park Y.S., Barrett J.D., Bonga J.M. 1998. Application of somatic embryogenesis
in high-value clonal forestry:deployment, genetic control, and stability of
cryopreserved clones. In Vitro Cell. Dev. Biol.-Plant 34: 231-329.
212. Pazurkiewicz-Kocot K., Kita A., Krzykawska A. 2009. Oddziaływanie
molibdenu na zawartość barwników chlorofilowych w liściach siewek Zea mays
L. Zeszyty Problemowe Postępów Nauk Rolniczych 534: 207-215.
213. Piątczak E., Grzegorczyk- Karolak I., Wysokińska H. 2014. Micropropagation
of Rehmannia glutinosa Libosch.: production of phenolics and flavonoids and
evaluation of antioxidant activity. Acta Physiol. Plant. 36: 1693-1702.
214. Pilarska, M., Skowron, E., Niewiadomska, E. 2015. Cytokininy a fotosynteza.
Postępy Biochemii 61: 61-68.
215. Polit J.T, Ciereszko I. 2009. In situ activities of hexokinase and fructokinase in
relation to phosphorylation status of root meristem cells of Vicia faba during
reactivation from sugar starvation. Physiol. Plant. 135: 342-350.
216. Popis E., Ratusz K., Przybysz M., Krygiel K., Sakowska A., Konarska M. 2015.
Światowa oraz polska produkcja lnu oleistego i oleju lnianego. Zeszyty
Problemowe Szkoły Głównej Gospodarstwa Wiejskiego w Warszawie,
Problemy Rolnictwa Światowego 15: 106-116.
217. Puijalon S., Piola F., Bornette G. 2008. Abiotic stresses increase plant
regeneration ability. Evol. Ecol. 22: 493–506.
218. Pullman G. S, Zhang Y., Phan B. H. 2003. Brassinolide improves embryogenic
tissue initiation in conifers and rice. Plant Cell Rep. 22: 96–104.
219. Qiao W., Li C., Fan L. 2014. Cross-talk between nitric oxide and hydrogen
peroxide in plant responses to abiotic stresses. Environ. Exp. Bot. 100: 84-93.
220. Qiusheng Z., Bao J., Likun L., Xianhua X. 2005. Effects of antioxidants on the
plant regeneration and GUS expressive frequency of peanut (Arachis hypogaea)
explants by Agrobacterium tumefaciens. Plant Cell, Tiss Org. Cult. 81: 83-90.
221. Ramage C.M., Williams R.R. 2002. Mineral nutrition and plant morphogenesis.
In Vitro Cell. Dev. Biol. – Plant 38: 116-124.
222. Ravnikar M., Žel J., Plaper I., Špacapan A. 1993. Jasmonic acid stimulates shoot
and bulb formation of garlic in vitro. J. Plant Growth Regul. 12: 73-77.
223. Reuveni M., Evenor D. 2007. On the effect of light on shoot regeneration in
petunia. Plant Cel,l Tiss. Org. Cult. 89: 49-54.

219
224. Rey H.Y., Mroginski L.A. 1996. Regeneration of plants from callus tissue of
Aeschynomene spp. (Leguminosae). Plant Cell, Tiss. Org. Cult. 45: 185-190.
225. Rico-Lemus M., Rodriguez-Garay B. 2014. SNP as an effective donor of nitric
oxide for in vitro plant cell and tissue culture. J. Plant Biochem. Physiol. 2:
e127.
226. Rival A., Beule T., Lavergne D., Nato A., Havaux M., Puard M. 1997.
Developmant of photosynthetic characteristics in oil palm during in vitro
micropropagation. J. Plant Physiol. 150: 520-527.
227. Ružić Dj.V., Vujović T.I. 2008. The effects of cytokinin types and their
concentration on in vitro multiplication of sweet cherry cv. Lapins (Prunus
avium L.). Horticultural Science (Prague) 35: 12-21
228. Ryan K.G., Swinny E.E., Markham K.R., Winefield C. 2002. Flavonoid gene
expression and UV photoprotection in transgenic and mutant Petunia leaves.
Phytochemistry 59: 23-32.
229. Rybczyński J. J., Borkowska B., Fiuk A., Gawrońska H., Śliwińska E., Mikuła
A. 2007. Effect of sucrose concentration on photosynthetic activity of in vitro
cultures Gentiana kurroo (Royle) germlings. Acta Physiol. Plant. 29: 445-453.
230. Sakamoto A., Murata N. 2002. The role of glycine betaine in the protection of
plants from stress: clues from transgenic plants. Plant Cell Environ. 25: 163-171.
231. Sanikhani M., Frello S., Serek., M. 2006. TDZ induces shoot regeneration in
various Kalanchoe blossfeldiana Poelln. cutivars in the absence of auxin. Plant
Cell, Tiss.Org. Cult. 85: 75-82.
232. Santos I., Salema R.2000. Promotion by jasmonic acid bulb formation in shoot
cultures of Narcissus triandrus. J. Plant Growth Regul. 30: 133-138.
233. Sasaki H. 2002. Brassinolide promotes adventitious shoot regeneration from
cauliflower hypocotyl segments. Plant Cell, Tiss. Org. Cult. 71: 111–116.
234. Scandalios J.G. 2005. Oxidative stress: molecular perception and transduction of
signals triggering antioxidant gene defenses. Braz. J. Med. Biol. Res. 38: 995-
1014.
235. Serret M.D., Trillas M.I., Araus J.L. 2001. The effect of in vitro culture
conditions on the pattern of photoinhibition during acclimation of gardenia
plantlets to ex vitro conditions. Photosynthetica 39: 67-73.

220
236. Sha Valli Khan P.S., Hausman J.F., Rao K.R. 1999. In vitro morphogenesis and
plantlet regeneration from seeds of Syzygium alternifolium. Biol. Plantarum 42:
177-184.
237. Sharma P., Jha A. B., Dubey R. S., Pessarakli M. 2012. Reactive oxygen
species, oxidative damage, and antioxidative defense mechanism in plants under
stressful conditions. J. Bot. 1–26.
238. Shen Q., Wang Y. T., Tian H., Guo F. Q. 2013. Nitric oxide-mediates cytokinin
functions in cell proliferation and meristem maintenance in Arabidopsis. Mol.
Plant. 6: 1214-1225.
239. Shilpa K., Selavakkumar C., Senthil A. K., Lakshmi B.S. 2010. In vitro root
culture of Ocimum sanctum L. and evaluation of its free radical scavenging
activity. Plant Cell, Tiss Org. Cult. 101: 105-109.
240. Shimasaki K., Wang T., Nishimura Y., Huyen N.T., Neera S., Hsiung T., Huang
C. 2010. Effect of chitosan and jasmonic acid related compounds on shoot
formation from rhizome cultures of an oriental Cymbidium species. Acta Hortic.
829: 399-402.
241. Siegień I. 2007. Cyjanogeneza u roślin i jej efektywność w ochronie roślin przed
atakiem roślinożerców i patogenów. Kosmos 56: 155 - 166.
242. Siegień I., Adamczuk A., Wróblewska K. 2013. Light affects in vitro
organogenesis of Linum usitatissimum L. and its cyjanogenic potential. Acta
Physiol. Plant. 35: 781-789.
243. Siegień I., Bogatek R. 2006. Cyanide action in plants – from toxic to regulatory.
Acta Physiol. Plant. 28: 483-497.
244. Silska G., Kozak J., Rajewicz M., Mańkowska G. 2014. Charakterystyka
morfologiczna genotypów lnu (Linum usitatissimum L.) pochodzących z Polski.
Polish J. Agron. 17: 38-47.
245. Simontacchi M., Garcia-Mata C., Bartoli C. G., Santa-Maria G. E., Lamattina L.
2013. Nitric oxide as a key component in hormone-regulated processes. Plant
Cell Rep. 32: 853-866.
246. Singh D., Verma K.1995. Response of the wild-type and high light-tolerant
mutant of Anacystis nidulans against photooxidative damage: differential
mechanism of high light tolerance. Photochem. Photobiol. 62: 314-319.
247. Sińska I. 1986. Poliaminy jako regulatory wzrostu i rozwoju roślin. Wiadomości
Botaniczne 30: 9-24.

221
248. Skoog F., Miller C.O. 1957. Chemical regulation of growth and organ formation
in plant tissue cultures in vitro. Symp. Soc. Exp. Biol. 11: 118-131.
249. Skrzypek E. 2012. Rola związków fenolowych i enzymów antyoksydacyjnych w
regeneracji in vitro wybranych gatunków roślin bobowatych (Fabaceae L.). IFR
PAN, Kraków.
250. Ślesak I., Libik M., Karpinska B., Karpinski S., Miszalski Z. 2007. The role of
hydrogen peroxide in regulation of plant metabolism and cellular signaling in
response to environmental stresses. Acta Bioch. Pol. 54: 39-50.
251. Sokołowska K. 2005. Regulacja łączności symplastowej w procesach wzrostu i
rozwoju roślin. Post. Biol. Kom. 35: 603-616.
252. Soler-Cantero A., Jové M., Cacabelos D., Boada J., Naudí A., Romero M.P.,
Cassanyé A., Serrano J.C.E., Arola L., Valls J., Bellmunt M.J., Prat J., Pamplona
R., Portero-Otin M., Motilva J.S. 2012. Plant-Derived Phenolics Inhibit the
Accrual of Structurally Characterised Protein and Lipid Oxidative
Modifications. PLoS ONE 7(8): e43308
253. Song L., Ding W., Shen J., Zhang Z., Bi Y., Zhang L. 2008. Nitric oxide
modulates abscisic acid induced thermotolerance in the calluses from two
ecotypes of reed under heat stress. Plant Sci. 175: 826-832.
254. Staikidou I., Watson S., Harvey B.M.R., Selby C. 2005. Narcissus bulblet
formation in vitro: effect of carbohydrate type and osmolarity of the culture
medium. Plant Cell, Tiss. Org. Cult. 80: 313-320.
255. Starck Z. 2008. Funkcja tkanek przewodzących: zaopatrzenie w substancje
pokarmowe i udział w koordynacji procesów w roślinach. Kosmos 57: 67-83.
256. Starck Z. 2014. Fizjologia roślin: jak było wczoraj, jak jest dziś, a co przyniesie
jutro?. Kosmos 4: 569-589.
257. Stefaniak B. 2004. Roślinne kultury in vitro. W: Woźny A., Przybył K. (red).
Regulatory wzrostu i rozwoju roślin cz.2. Wydawnictwo Naukowe UAM,
Poznań: 13-91.
258. Stöhr C., Strube F., Marx G., Ullrich W.R., Rockel P. 2001. A plasma
membrane-bound enzyme of tobacco roots catalyses the formation of nitric
oxide from nitrite. Planta 212: 835-841.
259. Strzałka K. 2012. Fotosynteza i chemosynteza. W: Kopcewicz J., Lewak S.
(red.). Fizjologia roślin. Wydawnictwo Naukowe PWN, Warszawa: 274 -444.

222
260. Su Y.H., Liu Y.B., Zhang X.S. 2011. Auxin–cytokinin interaction regulates
meristem development. Mol. Plant 4: 616–625.
261. Sulkiewicz M., Ciereszko I. 2016. Fluorescencja chlorofilu a – historia odkrycia
i zastosowanie w badaniach roślin. Kosmos 65: 103–115.
262. Szabó I., Bergantino E., Giacometti G.M. 2005. Light and oxygenic
photosynthesis: energy dissipation as a protection, mechanism against photo-
oxidation. EMBO Reports 6: 629–634.
263. Szczygieł K. 2005. Somatyczna embriogeneza - alternatywny sposób uzyskania
wyselekcjonowanego materiału sadzeniowego gatunków drzew iglastych. Leśne
Prace Badawcze 3: 71-92.
264. Szechyńska-Hebda M., Skrzypek E., Dąbrowska G., Biesaga-Kościelniak J.,
Filek M., Wędzony M. 2007. The role of oxidative stress induced by growth
regulators in the regeneration process of wheat. Acta Physiol. Plant. 29: 327–
337.
265. Szechyńska-Hebda M., Skrzypek E., Dąbrowska G., Wędzony M., van
Lammeren A. 2012. The effect of endogenous hydrogen peroxide induced by
cold treatment in the improvement of tissue regeneration efficiency. Acta
Physiol. Plant. 34: 547-560.
266. Szopa J., Kostyń K. 2006. Kultury komórkowe i rośliny transgeniczne w
biotechnologii. Biotechnologia 4: 7-17.
267. Szweykowska A. 1968. Postępy badań nad cytokininami. Post. Bioch. 14: 193-
200.
268. Taiz L., Zeiger E. 2006. Plant Physiology. 4th. Sinauer Associate, Sunderland,
Mass., EUA.
269. Takáč T., Obert B., Rolčík J., Šamaj J. Improvement of adventitious root
formation in flax using hydrogen peroxide. New Biotechnology 33: 728-734.
270. Tan B.C., Chin C.F., Alderson P. Effects of sodium nitroprusside on shoot
multiplication and regeneration of Vanilla planifolia Andrews. In Vitro Cell.
Dev. Biol.-Plant 49: 626-630.
271. Tanaka H., Dhonukshe P., Brewer P. B., Friml L. 2006. Spatiotemporal
asymmetric auxin distribution: a means to coordinate plant development. Cell
Mol. Life Sci. 63: 2738-2754.
272. Tavares F., Abreu I., Salema R. 1998. Regeneration of the actinorhizal plant
Myrica gale L. from epicotyl explants. Plant Sci. 135: 203-210.

223
273. Tian M., Gu Q., Zhu M. 2003. The involvement of hydrogen peroxide and
antioxidant enzymes in the process of shoot organogenesis of strawberry callus.
Plant Sci. 165: 701-707.
274. Tilkat E., Onay A. 2009. Direct shoot organogenesis from in vitro-derived
mature leaf explants of pistachio. In Vitro. Cell. Dev. Biol. Plant 45: 92-98.
275. Tremblay L., Tremblay F.M. 1995. Maturation of black spruce somatic
embryos: sucrose hydrolysis and resulting osmotic pressure of the medium.
Plant Cell, Tiss. Org. Cult. 42: 39-46.
276. Tretyn A. 2012. Mechanizmy wzrostu i rozwoju roślin. W: Kopcewicz J.,
Lewak S. (red.). Fizjologia roślin. Wydawnictwo Naukowe PWN, Warszawa:
474-502.
277. Tun N. N., Holk A., Scherer F. E. 2001. Rapid increase of NO in plant cell
cultures induced by cytokinin. FEBS Letters 509: 174-176.
278. Unda F., Kalynyak P., Riseman A. 2007. Organogenesis plant regeneration from
leaf explants of Exacum Styer Group. Plant Cell, Tiss. Org. Cult. 89: 105-111.
279. Van Den Dool H., Kratz P.D. 1963. A generalization of the retention index
system including linear temperature programmed gas—liquid partition
chromatography. J. Chromatogr. A 11: 463-471.
280. Van den Ende W. 2014. Sugars take a central position in plant growth,
development and, stress responses. A focus on apical dominance. Front. Plant
Sci. 5: 313.
281. Van Dingenen J., De Milde L., Vermeersch M., Maleux K., De Rycke R., De
Bruyne M., Storme V., Gonzalez N., Dhondt S., Inzé D. 2016. Chloroplasts are
central players in sugar-induced leaf growth. Plant Physiol. 171: 590-605.
282. Vatankhah E., Niknam V., Ebrahimzadeh H. 2010. Activity of enzyme during in
vitro organogenesis in Crocus sativus. Biol. Plantarum 54: 509-514.
283. Velikova V.,Yordanov I., Endreva A. 2000. Oxidative stress and some
antioxidant system in acid rain treated bean plants: protective role of exogenous
polyamines. Plant Sci. 151: 59-66.
284. Verdeil J.L., Hocher V., Huert C., Grosdemange F., Escoute J., Ferrieáre N.,
Nicole M. 2001. Ultrastructural changes in coconut calli associated with the
acquisition of embryogenic competence. Ann. Bot. 88: 9-18.

224
285. Verdus M. C., Thellier M., Ripoll C. 1997. Storage of environmental signals in
flax. Their morphogenetic effect as enabled by a transient depletion of calcium.
Plant J. 12: 1399-1410.
286. Wandehene D., Pugin A., Klessig D., Durner J. 2001. Nitric oxide: comparative
synthesis and signaling in animal and plant cells. Trends Plant Sci. 6: 177-183.
287. Wang L., Ruan Y.-L. 2013. Regulation of cell division and expansion by sugar
and auxin signaling. Front. Plant Sci. 4: 163.
288. Wang P.G., Xian M., Tang X., Wu X., Wen Z., Cai T., Janczuk J. A. 2002.
Nitric oxide donors: chemical activities and biological applications. Chemical
Reviews 102: 1091-1134.
289. Warening P.F., Philips I.D.J. 1985. Growth and differentiation in plants.
Pergamon Press, Oxford.
290. Wasąg P., Kowalczyk S. 2009. Wewnątrzkomórkowe i błonowe receptory
kwasu abscysynowego. Post. Biol. Kom. 36: 3-22.
291. Wellburn A. R. 1994. The spectra determination of chlorophylis a and b and
total carotenoids rusing various solvents with spectrophotometers of different
resolution. J. Plant Physiol. 144: 307-313.
292. Were B.A., Gudu S., Onkware A.O., Carlsson A.S., Welander M. 2006. In vitro
regeneration of sesame (Sesamum indicum L.) from seedling cotyledon and
hypocotyls explants. Plant Cell, Tiss. Org. Cult. 85: 235-239.
293. Werner T., Schmülling T. 2009. Cytokinin action in plant development. Curr.
Opin. Plant Biol. 12: 527-538.
294. Weryszko-Chmielewska E., Kozak D. 2002. Anatomical changes in Gloriosa
rothschildiana ‘O’Brien’ stems induced by JA-Me and ABA. Acta Hortic. 570:
433-436.
295. Wiktorowska E., Długosz M., Janiszowska W. 2010. Significant enhancement of
oleanolic acid accumulation by biotic elicitors in cell suspension cultures of
Calendula officinalis L. Enzyme Microb. Tech. 46: 14-20.
296. Wilmowicz E., Kućko A., Sidłowska M., Frankowski K., Maciejewska B.,
Glazińska P., Kopcewicz J. 2012. Rola jasmonianów w regulacji rozwoju
generatywnego. Kosmos 61: 603-612.

225
297. Wiśniewska J., Pietrzykowska M., Szyndel B., Tretyn A. 2009. Lokalizacja
gradientu auksyny oraz rozmieszczenie białek PIN w proliferującym i
różnicującym się transgenicznym kalusie Arabidopsis thaliana. Zeszyty
Problemowe Postępów Nauk Rolniczych 534: 297-305.
298. Wiśniewska J., Xu J., Seifertová D., Brewer P.B., Rûžčka K., Blilou I., Rouquie
D., Benková E., Scheres B., Friml J. 2006. Polar PIN localization directs auxin
flow in plants. Science 312: 883.
299. Wróbel-Marek J., Kulińska-Łukaszek K., Kurczyńska E. U. 2015. Komunikacja
symplastowa i jej rola w rozwoju roślin. Post. Biol. Kom. 42: 573–594.
300. Wu H.C., du Toit E.S., Reinhardt C.F., Rimando A.M., van der Kooy F., Meyer
J.J.M. 2007. The phenolic, 3,4-dihydroxybenzoic acid, is an endogenous
regulator of rooting in Protea cynaroides. Plant Growth Reg. 52: 207-215.
301. Xiong L., Schumaker K. S., Zhu J. K. 2002. Cell signaling during cold, drought,
and salt stress. Plant Cell 14: S165-S183.
302. Xu J., Yin H., Wang W., Mi Q., Liu X. 2009. Effects of sodium nitroprusside on
callus induction and shoot regeneration in micropropagated Dioscorea opposita.
Plant Growth Regul. 59: 279-285.
303. Yu J. Q., Huang L.F., Hu W., Zhou Y. H., Mao W. H., Ye S. F., Nogues S.
2004. A role of brassinosteroids in the regulation of photosynthesis in Cucumis
sativus. J Exp. Bot. 55: 1135-1143.
304. Yu M., Lamattina L., Spoel S.H., Loake G.J. 2014. Nitric oxide function in plant
biology: a redox cue in deconvolution. New Physiol. 202: 1142-1156.
305. Zagrobelny S., Bak S., Rasmussen V., Jorgrnsen B., Naumann C.M, Moller
B.L.2004. Cyanogenic glucosides and plant – insect interactions. Pytochem. 65:
293-306.
306. Zając T., Oleksy A., Klimek-Kopyra A., Kulig B. 2012. Biological determinants
of plant and crop productivity of flax (Linum usitatissimum L.). Acta Agrobot.
65: 3 - 14.
307. Zaker A., Abrishamchi P., Asill J., Mousavi S.H. Rezaee A. 2013. Induction of
callogenesis and rhizogenesis in Perovskia abrotanoides Karel., a little known
medicinal plant. J. Med. Plants Res. 7: 3385-3392.

226
308. Zang X., Mei X. G., Zhang C. H., Lu C. T., Ke T. 2001. Improved paclitaxel
accumulation in cell suspension cultures of Taxus chinensis by brassinolide.
Biotechnol. Lett. 23: 1047–1049.
309. Żebrowski J. 2009. Polyphenols. W: Narwall S. S., Bogatek R., Zadgańska
B.M., Sampietro D. A., Vattuone M. A. (red). Plant biochemistry. Studium Press
LLC: 239-261.
310. Zenkteler E., Borkowska B. 2002. The photosynthetic status of in vitro
strawberry shoots. Acta Hort. 567: 309-312.
311. Zhao Z.J., Song Y.G., Liu Y.L., Qiao M., Zhai X.L., Xiang F.N. 2013. The
effect of elicitors on oleanolic acid accumulation and expression of triterpenoid
synthesis genes in Gentiana straminea. Biol. Plantarum 57: 139-143.
312. Zhou J., Zhang L., Li X., Chang Y., Gu Q., Lu X., Xu G. 2012. Metabolic
profiling of transgenic rice progeny using gas chromatography-mass
spectrometry: the effects of gene insertion, tissue culture and breeding.
Metabolomics 8: 529-539.

227
Spis rycin
Ryc. 1. Drogi organogenezy i embriogenezy somatycznej w roślinnych kulturach in
vitro. Zmodyfikowane wg (Adamczuk i wsp. 2012).
Ryc. 2. Współdziałanie auksyn i cytokinin w indukcji organogenezy w kulturach
in vitro.
Ryc. 3. Podwójna rola reaktywnych form tlenu (ROS) oraz reaktywnych form azotu
(RNS)
w regulacji morfogenezy roślin w kulturach in vitro. Zmodyfikowane wg Adamczuk i
wsp. 2012).
Ryc. 4. Schemat przedstawiający eksplantaty hipokotylowe lnu zwyczajnego (Linum
usitatissimum L.) odmiany Szafir i Selena poddane działaniu par wydzielających
się z wodnego roztworu SNP.
Ryc. 5. Schemat przedstawiający eksplantaty hipokotylowe lnu zwyczajnego (Linum
usitatissimum L.) odmiany Szafir i Selena poddane działaniu par wydzielających
się z wodnego roztworu SNP w obecności c-PTIO.
Ryc. 6. Efektywność organogenezy pędowej w kulturach in vitro lnu zwyczajnego odm.
Szafir (A) i odm. Selena (B) rosnących na pożywkach MS, B5, MS+B5 z dodatkiem
BA (1mg l-1
) oraz 2,4-D (0,025 mg l-1
). Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05.
Ryc. 7. Liczba pędów formujących się na eksplantatch hipokotylowych lnu
zwyczajnego odm. Szafir (A) oraz Selena (B) rosnących na pożywkach MS, B5,
MS+B5 z dodatkiem BA (1mg l-1
) oraz 2,4-D (0,025 mg l-1
). Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05.
Ryc. 8. Efektywność organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego
odm. Szafir (A) i odm. Selena (B) rosnących na pożywkach MS, B5, MS+B5 z
dodatkiem NAA (1mg l-1
) oraz BA (0,025 mg l-1
). Wyniki średnie ± SD. *Różnice
istotne statystycznie, przy p≤0,05.

228
Ryc. 9. Liczba korzeni formujących się na eksplantatch hipokotylowych lnu
zwyczajnego odm. Szafir (A) oraz Selena (B) rosnących na pożywkach MS, B5,
MS+B5 z dodatkiem NAA (1mg l-1
) oraz BA (0,025 mg l-1
). Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05.
Ryc. 10. Efektywność organogenezy pędowej w kulturach in vitro lnu zwyczajnego
odm. Szafir rosnących na pożywkach MS (A), B5 (B), MS+B5 (C) z dodatkiem
wybranej cytokininy: BA, KIN, TDZ (1 mgl-1
) + 2,4-D (0,025 mgl-1
). Wyniki średnie ±
SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 11. Liczba pędów formujących się na eksplantatch hipokotylowych lnu
zwyczajnego odm. Szafir rosnących na pożywkach MS (A), B5 (B), MS+B5 (C) z
dodatkiem wybranej cytokininy: BA, KIN, TDZ (1 mgl-1
) + 2,4-D (0,025 mgl-1
).
Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 12. Efektywność organogenezy pędowej w kulturach in vitro lnu zwyczajnego
odm. Selena rosnących na pożywkach MS (A), B5 (B), MS+B5 (C) z dodatkiem
wybranej cytokininy: BA, KIN, TDZ (1 mgl-1
) + 2,4-D (0,025 mgl-1
). Wyniki średnie ±
SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 13. Liczba pędów formujących się na eksplantatch hipokotylowych lnu
zwyczajnego odm. Selena rosnących na pożywkach MS (A), B5 (B), MS+B5 (C) z
dodatkiem wybranej cytokininy: BA, KIN, TDZ (1 mgl-1
) + 2,4-D (0,025 mgl-1
).
Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 14. Efektywność organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego
odm. Szafir rosnących na pożywkach MS (A), B5 (B), MS+B5 (C) z dodatkiem
wybranej cytokininy: 2,4-D, NAA, IBA (1 mgl-1
) + BA (0,025 mgl-1
). Wyniki średnie ±
SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 15. Liczba korzeni formujących się na eksplantatch hipokotylowych lnu
zwyczajnego odm. Szafir rosnących na pożywkach MS (A), B5 (B), MS+B5 (C) z
dodatkiem wybranej cytokininy: 2,4-D, NAA, IBA (1 mgl-1
) + BA (0,025 mgl-1
).
Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.

229
Ryc. 16. Efektywność organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego
odm. Selena rosnących na pożywkach MS (A), B5 (B) z dodatkiem wybranej
cytokininy: 2,4-D, NAA, IBA (1 mgl-1
) + BA (0,025 mgl-1
). Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05.
Ryc. 17. Liczba korzeni formujących się na eksplantatch hipokotylowych lnu
zwyczajnego odm. Selena rosnących na pożywkach MS (A), B5 (B) z dodatkiem
wybranej cytokininy: 2,4-D, NAA, IBA (1 mgl-1
) + BA (0,025 mgl-1
). Wyniki średnie ±
SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 18. Efektywność organogenezy pędowej w kulturach in vitro lnu zwyczajnego
odm. Szafir (A) i odm. Selena (B) w zależności od zmieniających się stężeń auksyny
2,4-D (0-1 mg l-1
) przy stałym stężeniu cytokininy BA (1mg l-1
) – (2,4-D : BA). Wyniki
średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 19. Liczba pędów formujących się na eksplantatach hipokotylowych lnu
zwyczajnego odm. Szafir (A) i odm. Selena (B) w zależności od zmieniających się
stężeń auksyny 2,4-D (0-1 mg l-1
) przy stałym stężeniu cytokininy BA (1mg l-1
) – (2,4-
D:BA). Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 20. Efektywność organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego
odm. Szafir (A) i odm. Selena (B) w zależności od zmieniających się stężeń cytokininy
wzajemnych proporcji hormonów BA (0-1 mg l-1
) przy stałym stężeniu auksyny NAA
(1mg l-1
) – (BA : NAA). Wyniki średnie ± SD. *Różnice istotne statystycznie, przy
p≤0,05.
Ryc. 21. Liczba korzeni formujących się na eksplantatach hipokotylowych lnu
zwyczajnego odm. Szafir (A) i odm. Selena (B) w zależności od zmieniających się
stężeń cytokininy BA (0-1 mg l-1
) przy stałym stężeniu auksyny NAA (1mg l-1
) – (BA
: NAA). Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 22. Zawartość chlorofilu a (A), chlorofilu b (B), sumy chlorofilu a+b (C) w 7-
dniowych siewkach (Siewki), hipokotylach (czas wzrostu 0) oraz w kulturach in vitro
lnu zwyczajnego, rosnących na pożywce pędowej. Wartości średnie ±SD. * Różnice
istotne statystycznie, przy p≤0,05.

230
Ryc. 23. Zawartość karotenoidów w 7-dniowych siewkach (Siewki), hipokotylach (czas
wzrostu 0) oraz w kulturach in vitro lnu zwyczajnego, rosnących na pożywce pędowej.
Wartości średnie ±SD. * Różnice istotne statystycznie, przy p≤0,05.
Ryc. 24. Intensywność fotosyntezy netto (A) oraz oddychania ciemniowego (B)
w przeliczeniu na g św.m. 7-dniowych siewek, eksplantatów z kultur in vitro lnu
zwyczajnego, rosnących na pożywce pędowej. Wartości średnie ±SD. * Różnice istotne
statystycznie, przy p≤0,05.
Ryc. 25. Średni procentowy udział związków organicznych zidentyfikowanych w
ekstraktach metanolowych pozyskanych z 7-dniowych siewek (A), 5 (B), 14 (C) i 28
(D) -dniowych kultur pędowych in vitro lnu zwyczajnego odm. Szafir.
Ryc. 26. Średni procentowy udział związków organicznych zidentyfikowanych w
ekstraktach metanolowych pozyskanych z 7-dniowych siewek (A), 5 (B), 14 (C) i 28
(D) -dniowych kultur pędowych in vitro lnu zwyczajnego odm. Selena.
Ryc. 27. Zawartość fenylopropanoidów i flawonoidów (A) oraz antocyjanów (B)
w 7-dniowych siewkach, hipokotylach, kulturach pędowych in vitro lnu zwyczajnego
odm. Szafir oraz Selena. Wyniki średnie ± SD. * Różnice istotne statystycznie, przy
p≤0,05.
Ryc. 28. Zawartość fenylopropanoidów i flawonoidów (A) oraz antocyjanów (B)
w 7-dniowych siewkach, hipokotylach, kulturach korzeniowych in vitro lnu
zwyczajnego odm Szafir oraz odm. Selena. Wyniki średnie ± SD. * Różnice istotne
statystycznie, przy p≤0,05.
Ryc. 29. Zawartość białka w ekstraktach wykorzystanych do oznaczenia zawartości
związków fenolowych i antocyjanów w 7-dniowych siewkach (Siewki), hipokotylach
(czas wzrostu 0) oraz w kulturach pędowych (A) i korzeniowych (B) in vitro lnu
zwyczajnego odm. Szafir oraz odm. Selena. Wyniki średnie ± SD. * Różnice istotne
statystycznie, przy p≤0,05.
Ryc. 30. Zawartość związków polifenolowych (A) oraz tanin (B) w 7-dniowych
siewkach (Siewki), hipokotylach (czas wzrostu 0), kulturach pędowych in vitro lnu
zwyczajnego odm. Szafir oraz odm. Selena. Wyniki średnie ± SD. * Różnice istotne
statystycznie, przy p≤0,05.

231
Ryc. 31. Zawartość związków polifenolowych (A) oraz tanin (B) w 7-dniowych
siewkach (Siewki), hipokotylach (czas wzrostu 0), kulturach korzeniowych in vitro lnu
zwyczajnego odm. Szafir oraz odm. Selena. Wyniki średnie ± SD. * Różnice istotne
statystycznie, przy p≤0,05.
Ryc. 32. Aktywność dysmutazy ponadtlenkowej (A) oraz katalazy (B) w 7-dniowych
siewkach (Siewki), hipokotylach (0 dni wzrostu), kulturach pędowych in vitro lnu
zwyczajnego odm. Szafir oraz odm. Selena. Wyniki średnie ± SD. * Różnice istotne
statystycznie, przy p≤0,05.
Ryc. 33. Aktywność dysmutazy ponadtlenkowej (A) oraz katalazy (B) w 7-dniowych
siewkach (Siewki), hipokotylach (0 dni wzrostu), kulturach korzeniowych in vitro lnu
zwyczajnego odm. Szafir oraz odm. Selena. Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05.
Ryc. 34. Zawartość białka w ekstrakcie enzymatycznym wykorzystanym do oznaczenia
aktywności SOD i CAT w 7-dniowych siewkach (Siewki), hipokotylach (0 dni wzrostu)
oraz w kulturach pędowych (A) i korzeniowych (B) in vitro lnu zwyczajnego odm.
Szafir oraz odm. Selena. Wyniki średnie ± SD. * Różnice istotne statystycznie, przy
p≤0,05.
Ryc. 35. Efektywność organogenezy pędowej w kulturach in vitro lnu zwyczajnego
odm. Szafir rosnących w warunkach stresu osmotycznego na pożywce MS ze
zwiększoną zawartością sacharozy (A) lub sorbitolu+maltozy (B). Wyniki średnie ±
SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 36. Zawartość produktów peroksydacji lipidów (TBARS) w kulturach pędowych
lnu zwyczajnego odm. Szafir rosnących w warunkach stresu osmotycznego na pożywce
MS z dodatkiem sacharozy (A) lub sorbitolu+maltozy (B) w 14-tym dniu (bezpośrednio
po działaniu stresu) oraz w 28-mym dniu wzrostu kultur. Wyniki średnie ± SD.
* Różnice istotne statystycznie, przy p≤0,05.

232
Ryc. 37. Efektywność organogenezy pędowej w kulturach in vitro lnu zwyczajnego
odm. Szafir (A) i odm. Selena (B) rosnących w warunkach stresu osmotycznego
(dwukrotne (SI) i trzykrotne (SII) zwiększenie stężenia sacharozy w podłożu w
stosunku do kontroli (K)) w 14-tym dniu (bezpośrednio po działaniu stresu), 21-wszym
dniu oraz w 28-mym dniu wzrostu kultur. Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05.
Ryc. 38. Liczba pędów formujących się na eksplantatch hipokotylowych lnu
zwyczajnego odm. Szafir (A) oraz odm. Selena (B) rosnących w warunkach stresu
osmotycznego (dwukrotne (SI) i trzykrotne (SII) zwiększenie stężenia sacharozy w
podłożu w stosunku do kontroli (K)) w 14-tym dniu (bezpośrednio po działaniu stresu),
21-wszym dniu oraz w 28-mym dniu wzrostu kultur . Wyniki średnie ± SD. *Różnice
istotne statystycznie, przy p≤0,05.
Ryc. 39. Efektywność organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego
odm. Szafir (A) i odm. Selena (B) rosnących w warunkach stresu osmotycznego
(dwukrotne (SI) i trzykrotne (SII) zwiększenie stężenia sacharozy w podłożu w
stosunku do kontroli (K)) w 14-tym dniu (bezpośrednio po działaniu stresu), 21-wszym
dniu oraz w 28-mym dniu wzrostu kultur. Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05.
Ryc. 40. Liczba korzeni formujących się na eksplantatch hipokotylowych lnu
zwyczajnego odm. Szafir (A) oraz odm. Selena (B) rosnących w warunkach stresu
osmotycznego (dwukrotne (SI) i trzykrotne (SII) zwiększenie stężenia sacharozy w
podłożu w stosunku do kontroli (K)) w 14-tym dniu (bezpośrednio po działaniu stresu),
21-wszym dniu oraz w 28-mym dniu wzrostu kultur. Wyniki średnie ± SD. *Różnice
istotne statystycznie, przy p≤0,05.
Ryc. 41. Zawartość produktów peroksydacji lipidów (TBARS) w kulturach pędowych
lnu zwyczajnego odm. Szafir (A) oraz odm. Selena (B) rosnących w warunkach stresu
osmotycznego (dwukrotne (SI) i trzykrotne (SII) zwiększenie stężenia sacharozy w
podłożu
w stosunku do kontroli (K)) w 14-tym dniu (bezpośrednio po działaniu stresu) oraz w
28-mym dniu wzrostu kultur. Wyniki średnie ± SD. * Różnice istotne statystycznie,
przy p≤0,05.

233
Ryc. 42. Zawartość produktów peroksydacji lipidów (TBARS) w kulturach
korzeniowych lnu zwyczajnego odm. Szafir (A) oraz odm. Selena (B) rosnących w
warunkach stresu osmotycznego (dwukrotne (SI) i trzykrotne (SII) zwiększenie stężenia
sacharozy w podłożu w stosunku do kontroli (K)) w 14-tym dniu (bezpośrednio po
działaniu stresu) oraz w 28-mym dniu wzrostu kultur. Wyniki średnie ± SD. * Różnice
istotne statystycznie, przy p≤0,05.
Ryc. 43. Zawartość nadtlenku wodoru (H2O2) w kulturach pędowych lnu zwyczajnego
odm. Szafir (A) oraz odm. Selena (B) rosnących w warunkach stresu osmotycznego
(dwukrotne (SI) i trzykrotne (SII) zwiększenie stężenia sacharozy w podłożu w
stosunku do kontroli (K)) w 14-tym dniu (bezpośrednio po działaniu stresu) oraz w 28-
mym dniu wzrostu kultur. Wyniki średnie ± SD. * Różnice istotne statystycznie, przy
p≤0,05.
Ryc. 44. Zawartość nadtlenku wodoru (H2O2) w kulturach korzeniowych lnu
zwyczajnego odm. Szafir (A) oraz odm. Selena (B) rosnących w warunkach stresu
osmotycznego (dwukrotne (SI) i trzykrotne (SII) zwiększenie stężenia sacharozy w
podłożu w stosunku do kontroli (K)) w 14-tym dniu (bezpośrednio po działaniu stresu)
oraz w 28-mym dniu wzrostu kultur. Wyniki średnie ± SD. * Różnice istotne
statystycznie, przy p≤0,05.
Ryc. 45. Efektywność formowania pędów w kulturach in vitro lnu zwyczajnego odm.
Szafir w zależności od ilości SNP dodanego do pożywki pędowej. Wyniki średnie ±
SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 46. Efektywność formowania korzeni w kulturach in vitro lnu zwyczajnego odm.
Szafir w zależności od ilości SNP dodanego do pożywki korzeniowej. Wyniki średnie ±
SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 47. Efektywność formowania pędów w kulturach in vitro lnu zwyczajnego odm.
Szafir poddanych 24-godzinnej ekspozycji na działanie par wydzielających się z 40 ml
wodnego roztworu SNP, rosnących na pożywce pędowej. Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05.

234
Ryc. 48. Efektywność formowania pędów w kulturach in vitro lnu zwyczajnego odm.
Szafir poddanych 3-godzinnej ekspozycji na działanie par wydzielających się z 40 ml
wodnego roztworu SNP, rosnących na pożywce pędowej. Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05.
Ryc. 49. Efektywność organogenezy pędowej w kulturach in vitro lnu zwyczajnego
odm. Szafir (A) oraz Selena (B) poddanych 3-godzinnej ekspozycji na działanie par
wydzielających się z 5mM wodnego roztworu SNP, rosnących na pożywce pędowej.
Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 50. Liczba pędów formujących się na eksplantatch hipokotylowych lnu
zwyczajnego odm. Szafir (A) oraz Selena (B) poddanych 3-godzinnej ekspozycji na
działanie par wydzielających się z 5mM wodnego roztworu SNP, rosnących na
pożywce pędowej. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 51. Efektywność organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego
odm. Szafir (A) oraz Selena (B) poddanych 3-godzinnej ekspozycji na działanie par
wydzielających się z 5mM wodnego roztworu SNP, rosnących na pożywce
korzeniowej. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 52. Liczba korzeni formujących się na eksplantatch hipokotylowych lnu
zwyczajnego odm. Szafir (A) oraz Selena (B) poddanych 3-godzinnej ekspozycji na
działanie par wydzielających się z 5mM wodnego roztworu SNP, rosnących na
pożywce korzeniowej. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy
p≤0,05.
Ryc. 53. Efektywność organogenezy pędowej w kulturach in vitro lnu zwyczajnego
odm. Szafir (A) i Selena (B) oraz organogenezy korzeniowej w kulturach odm. Selena
(C) poddanych 3-godzinnej ekspozycji na działanie par wydzielających się z 5mM
wodnego roztworu SNP, rosnących na podłożu bez dodatku hormonów. Wyniki średnie
± SD. *Różnice istotne statystycznie, przy p≤0,05.

235
Ryc. 54. Liczba pędów formujących się na eksplantatch hipokotylowych lnu
zwyczajnego odm. Szafir (A) i Selena (B) oraz liczba korzeni formujących się na
eksplantatch hipokotylowych odm. Selena (C) poddanych 3-godzinnej ekspozycji na
działanie par wydzielających się z 5mM wodnego roztworu SNP, rosnących na
pożywce bez dodatku hormonów. Wyniki średnie ± SD. *Różnice istotne statystycznie,
przy p≤0,05.
Ryc. 55. Efektywność organogenezy korzeniowej w kulturach in vitro lnu zwyczajnego
odm. Selena poddanych 3-godzinnej ekspozycji na działanie par wydzielających się z
5mM wodnego roztworu SNP w obecności c-PTIO, rosnących na pożywce
korzeniowej. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 56. Liczba korzeni formujących się na eksplantatch hipokotylowych lnu
zwyczajnego odm. Selena poddanych 3-godzinnej ekspozycji na działanie par
wydzielających się z 5mM wodnego roztworu SNP w obecności c-PTIO, rosnących na
pożywce korzeniowej. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy
p≤0,05.
Ryc. 57. Długość korzeni w kulturach in vitro lnu zwyczajnego odm. Selena
poddanych działaniu par wydzielających się z wodnego roztworu SNP w obecności c-
PTIO, rosnących na pożywce korzeniowej po 4 tygodniach wzrostu. Wyniki średnie ±
SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 58. Efektywność organogenezy pędowej (A) i korzeniowej (B) w kulturach in
vitro lnu zwyczajnego odm. Selena poddanych 3-godzinnej ekspozycji na działanie par
wydzielających się z 5mM wodnego roztworu SNP w obecności c-PTIO, rosnących na
pożywce bez dodatku hormonów. Wyniki średnie ± SD. *Różnice istotne statystycznie,
przy p≤0,05.
Ryc. 59. Liczba pędów (A) i korzeni (B) formujących się na eksplantatch
hipokotylowych lnu zwyczajnego odm. Selena poddanych 3-godzinnej ekspozycji na
działanie par wydzielających się z 5mM wodnego roztworu SNP w obecności c-PTIO,
rosnących na pożywce bez dodatku hormonów. Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05.

236
Ryc. 60. Długość korzeni w kulturach in vitro lnu zwyczajnego odm. Selena
poddanych działaniu par wydzielających się z wodnego roztworu SNP w obecności c-
PTIO, rosnących na podłożu bez dodatku hormonów po 4 tygodniach wzrostu. Wyniki
średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Ryc. 61. Zawartość nadtlenku wodoru (H2O2) w kulturach in vitro lnu zwyczajnego
odm. Selena rosnących na podłożu bez dodatku hormonów (A) i rosnących na pożywce
korzeniowej (B). Wyniki średnie ± SD. * Różnice istotne statystycznie, przy p≤0,05.
Ryc. 62. Zawartość produktów peroksydacji lipidów (TBARS) w kulturach in vitro lnu
zwyczajnego odm. Selena rosnących na podłożu bez dodatku hormonów (A) i
rosnących na pożywce korzeniowej (B). Wyniki średnie ± SD. * Różnice istotne
statystycznie, przy p≤0,05.
Ryc. 63. Przykładowe widmo EPR DPPH. – widmo rodnika DPPH
. (linia czarna) oraz K
– DPPH. po reakcji z ekstraktem z 15-dniowych kultur odm. Selena rosnących na
podłożu bez dodatku hormonów (linia zielona), 5 ml SNP – DPPH. po reakcji z
ekstraktem z 15-dniowych kultur rosnących na podłożu bez dodatku hormonów,
poddanych działaniu par wydzielających się z 5 ml SNP (linia żółta) i 10 ml SNP –
DPPH. po reakcji z ekstraktem z 15-dniowych kultur rosnących na podłożu bez
dodatku hormonów, poddanych działaniu par wydzielających się z 10 ml SNP (linia
niebieska)
Ryc. 64. Redukcja stabilnego wolnego rodnika DPPH. w kulturach in vitro lnu
zwyczajnego odm. Selena, poddanych działaniu 5mM roztworu SNP, rosnących na
podłożu bez dodatku hormonów. Wyniki średnie ± SD. * Różnice istotne statystycznie,
przy p≤0,05.
Ryc. 65. Przykładowe widmo EPR DPPH. – widmo rodnika DPPH (linia czarna) oraz K
– DPPH, po reakcji z ekstraktem z kultur korzeniowych odm. Selena (linia czerwona) i
5 ml SNP – DPPH, po reakcji z ekstraktem z kultur korzeniowych, bezpośrednio (0 dni
wzrostu) po działaniu par wydzielających się z 5 ml SNP (linia żółta)
Ryc. 66. Redukcja stabilnego wolnego rodnika DPPH w kulturach in vitro lnu
zwyczajnego odm. Selena, poddanych ekspozycji na pary wydzielające się z 5mM
roztworu SNP, rosnących na pożywce korzeniowej. Wyniki średnie ± SD. * Różnice
istotne statystycznie, przy p≤0,05.

237
Ryc. 67. Aktywność dysmutazy ponadtlenkowej (SOD) i jej izoform w kulturach in
vitro lnu zwyczajnego odm. Selena, poddanych ekspozycji na pary wydzielające się z
5mM roztworu SNP, rosnących na podłożu bez dodatku hormonów. Wyniki średnie ±
SD. * Różnice istotne statystycznie, przy p≤0,05.
Ryc. 68. Aktywność dysmutazy ponadtlenkowej (SOD) i jej izoform w kulturach in
vitro lnu zwyczajnego odm. Selena poddanych ekspozycji na pary wydzielające się z
5mM roztworu SNP, rosnących na pożywce korzeniowej. Wyniki średnie ± SD. *
Różnice istotne statystycznie, przy p≤0,05.
Ryc. 69. Aktywność katalazy (CAT) w kulturach in vitro lnu zwyczajnego odm. Selena,
poddanych ekspozycji na pary wydzielające się z 5 mM roztworu SNP, rosnących na
podłożu bez dodatku hormonów (A) i na pożywce korzeniowej (B). Wyniki średnie ±
SD. Wyniki średnie ± SD. * Różnice istotne statystycznie, przy p≤0,05.
Ryc. 70. Zawartość białka w kulturach in vitro lnu zwyczajnego odm. Selena
poddanych działaniu par wydzielających się z 5mM roztworu SNP, rosnących na
podłożu bez dodatku hormonów (A) i na pożywce korzeniowej (B). Wyniki średnie ±
SD. * Różnice istotne statystycznie, przy p≤0,05.
Ryc. 71. Efekt działania NO na procesy morfogenetyczne w kulturach in vitro lnu
odm. Selena rosnących na pożywce korzeniowej (+NAA), oraz bez dodatku hormonów
(-NAA).

238
Spis tabel
Tab. 1. Skład pożywek hodowlanych.
Tab. 2. Wzajemne stężenia cytokininy BA i auksyny 2,4-D w poszczególnych
wariantach pożywki.
Tab. 3. Wzajemne stężenia auksyny NAA i cytokininy BA w poszczególnych
wariantach pożywki.
Tab. 4. Warunki wzrostu kultur in vitro lnu zwyczajnego na pożywkach ze zwiększoną
zawartością cukrów.
Tab. 5. Stężenia SNP dodanego bezpośrednio do pożywki.
Tab. 6. Czas i warunki ekspozycji kultur in vitro lnu zwyczajnego na opary gazów
wydzielających się z wodnego roztworu SNP.
Tab. 7. Warunki pracy układu chromatograficznego (GC/MS).
Tab. 8. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir oraz Selena rosnących na pożywce
MS, B5 oraz MS+B5 z dodatkiem BA (1mg l-1
) oraz 2,4-D (0,025 mg l-1
). Wyniki
średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Tab. 9. Świeża i sucha masa eksplantatów z korzeniami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir oraz Selena rosnących na pożywce
MS, B5 oraz MS+B5 z dodatkiem NAA (1mg l-1
) oraz BA (0,025 mg l-1
). Wyniki
średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Tab. 10. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody w kulturach
in vitro lnu zwyczajnego odm. Szafir rosnących na pożywce MS, B5 oraz MS+B5 z
dodatkiem wybranej cytokininy: BA, KIN, TDZ (1 mgl-1
) + 2,4-D (0,025 mgl-1
).
Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Tab.11. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody w kulturach
in vitro lnu zwyczajnego odm. Selena rosnących na pożywce MS, B5 oraz MS+B5 w
zależności od wybranej cytokininy BA, KIN, TDZ (1 mgl-1
) + 2,4-D (0,025 mgl-1
).
Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.

239
Tab. 12. Świeża i sucha masa eksplantatów z korzeniami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir rosnących na pożywce MS, B5 oraz
MS+B5 w zależności od wybranej auksyny 2,4-D, NAA, IBA (1 mgl-1
) + BA (0,025
mgl-1
). Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Tab. 13. Świeża i sucha masa eksplantatów z korzeniami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Selena rosnących na pożywce MS, B5 oraz
MS+B5 w zależności od wybranej auksyny 2,4-D, NAA, IBA (1 mgl-1
) + BA (0,025
mgl-1
). Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Tab. 14. Związki emitowane przez 7-dniowe siewki oraz kultury pędowe in vitro lnu
zwyczajnego odm. Szafir.
Tab. 15. Związki emitowane przez 7-dniowe siewki oraz kultury pędowe in vitro lnu
zwyczajnego odm. Selena.
Tab.16. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir rosnących w warunkach stresu
osmotycznego na pożywce MS z dodatkiem sacharozy (A) lub sorbitolu+maltozy (B) w
14-tym dniu (bezpośrednio po działaniu stresu) oraz w 28-mym dniu wzrostu kultur.
Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Tab. 17. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir (A) oraz odm. Selena (B) rosnących
w warunkach stresu osmotycznego (dwukrotne (SI) i trzykrotne (SII) zwiększenie
sacharozy w podłożu w stosunku do kontroli (K)) w 14-tym dniu (bezpośrednio po
działaniu stresu) oraz w 28-mym dniu wzrostu kultur. Wyniki średnie ± SD. *Różnice
istotne statystycznie, przy p≤0,05.
Tab. 18. Świeża i sucha masa eksplantatów z korzeniami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir (A) oraz odm. Selena (B) rosnących
w warunkach stresu osmotycznego (dwukrotne (SI) i trzykrotne (SII) zwiększenie
stężenia sacharozy w podłożu w stosunku do kontroli (K)) w 14-tym dniu (bezpośrednio
po działaniu stresu) oraz w 28-mym dniu wzrostu kultur. Wyniki średnie ± SD.
*Różnice istotne statystycznie, przy p≤0,05.

240
Tab. 19. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir rosnących na pożywce pędowej z
dodatkiem SNP. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Tab. 20. Świeża i sucha masa eksplantatów z korzeniami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir rosnących na pożywce korzeniowej z
dodatkiem SNP. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Tab. 21. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir poddanych 24-godzinnej ekspozycji
na działanie par wydzielających się z wodnego roztworu SNP, rosnących na pożywce
pędowej. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Tab. 22. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir poddanych 3-godzinnej ekspozycji na
działanie par wydzielających się z 40 ml wodnego roztworu SNP, rosnących na
pożywce pędowej. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Tab. 23. Świeża i sucha masa eksplantatów z pędami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir (A) oraz Selena (B) poddanych 3-
godzinnej ekspozycji na działanie par wydzielających się z 5mM wodnego roztworu
SNP, rosnących na pożywce pędowej. Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05.
Tab. 24. Świeża i sucha masa eksplantatów z korzeniami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir (A) oraz Selena (B) poddanych 3-
godzinnej ekspozycji na działanie par wydzielających się z 5mM wodnego roztworu
SNP, rosnących na pożywce korzeniowej. Wyniki średnie ± SD. *Różnice istotne
statystycznie, przy p≤0,05.
Tab. 25. Świeża i sucha masa eksplantatów z pędami i korzeniami oraz zawartość wody
w kulturach in vitro lnu zwyczajnego odm. Szafir (A) oraz Selena (B) poddanych 3-
godzinnej ekspozycji na działanie par wydzielających się z 5mM wodnego roztworu
SNP, rosnących na pożywce bez dodatku hormonów. Wyniki średnie ± SD. *Różnice
istotne statystycznie, przy p≤0,05.

241
Tab. 26. Świeża i sucha masa oraz zawartość wody w kulturach in vitro lnu
zwyczajnego odm. Selena po 4-ch tygodniach wzrostu na pożywce korzeniowej,
poddanych działaniu par wydzielających się z 5mM wodnego roztworu SNP w
obecności c-PTIO. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy p≤0,05.
Tab. 27. Świeża i sucha masa oraz zawartość wody w kulturach in vitro lnu
zwyczajnego odm. Selena po 4 tygodniach wzrostu na pożywce bez dodatku
hormonów, poddanych działaniu par wydzielających się z 5mM wodnego roztworu
SNP w obecności c-PTIO. Wyniki średnie ± SD. *Różnice istotne statystycznie, przy
p≤0,05.

242
Spis fotografii
Fot. 1. Pokrój ogólny form lnu zwyczajnego (Linum usitatissimum L.) odmiany Selena
(typ włóknisty lnu - A) oraz Szafir (typ oleisty lnu - B), (Fot. A. Adamczuk).
Fot. 2. Kultury pędowe lnu zwyczajnego odm. Szafir i odm. Selena po 4 tygodniach
wzrostu na pożywkach: MS, B5 oraz MS+B5 z dodatkiem z dodatkiem BA (1mg l-1
)
oraz 2,4-D (0,025 mg l-1
).
Fot. 3. Kultury korzeniowe lnu zwyczajnego odm. Szafir i odm. Selena po 4
tygodniach wzrostu na pożywkach: MS, B5 oraz MS+B5 z dodatkiem NAA (1mg l-1
)
oraz BA (0,025 mg l-1
).
Fot. 4. Eksplantaty hipokotylowe lnu odm. Szafir oraz odm. Selena ze
zregenerowanymi pędami w zależności od zmieniających się stężeń auksyny 2,4-D (0-1
mg l-1
) przy stałym stężeniu cytokininy BA (1mg l-1
) w pożywce (2,4-D:BA).
Fot. 5. Eksplantaty hipokotylowe lnu odm. Szafir oraz odm. Selena ze
zregenerowanymi korzeniami w zależności od zmieniających się stężeń cytokininy BA
(0-1mg l-1
) przy stałym stężeniu auksyny NAA (1 mg l-1
) – (BA:NAA).
Fot. 6. Organogeneza pędów na eksplantatach hipokotylowych lnu odm. Szafir
rosnących na pożywce pędowej.
Fot. 7. Organogeneza pędów na eksplantatach hipokotylowych lnu odm. Selena
rosnących na pożywce pędowej.
Fot. 8. Organogeneza korzeni na eksplantatach hipokotylowych lnu odm. Szafir
rosnących na pożywce korzeniowej.
Fot. 9. Organogeneza korzeni na eksplantatach hipokotylowych lnu odm. Selena
rosnących na pożywce korzeniowej.
Fot. 10. Eksplantaty hipokotylowe lnu zwyczajnego odm. Szafir oraz odm. Selena z
uformowanymi pędami, poddane 3-godzinnej ekspozycji na działanie par
wydzielających się z 5mM wodnego roztworu SNP w ilości: 5 ml,10 ml, 20 ml i 30 ml,
po 4 tygodniach wzrostu na pożywce pędowej.

243
Fot. 11. Eksplantaty hipokotylowe lnu zwyczajnego odm. Szafir oraz odm. Selena z
uformowanymi korzeniami, poddane 3-godzinnej ekspozycji na działanie par
wydzielających się z 5mM wodnego roztworu SNP w ilości: 5 ml,10 ml, 20 ml i 30 ml,
po 4 tygodniach wzrostu na pożywce korzeniowej.
Fot. 12. Kultury in vitro oraz eksplantaty hipokotylowe lnu zwyczajnego odm. Szafir,
poddane 3-godzinnej ekspozycji na działanie par wydzielających się z 5mM wodnego
roztworu SNP w ilości: 5 ml,10 ml, 20 ml i 30 ml, po 4 tygodniach wzrostu na pożywce
MS bez dodatku hormonów.
Fot. 13. Kultury in vitro oraz eksplantaty hipokotylowe lnu zwyczajnego odm. Selena,
poddane 3-godzinnej ekspozycji na działanie par wydzielających się z 5mM wodnego
roztworu SNP w ilości: 5 ml,10 ml, 20 ml i 30 ml, po 4 tygodniach wzrostu na pożywce
B5 bez dodatku hormonów.

244
Aneks
Tab. I. Wykaz związków organicznych zidentyfikowanych w ekstraktach metanolowych,
pochodzących z 7-dniowych siewek (A), 5 (B), 14 (C) i 28 (D) -dniowych kultur pędowych in
vitro lnu zwyczajnego odm. Szafir
A)
Lp. IR exp IR lit Nazwa związku Zawartość
[%]
Kwasy alifatyczne i glicerydy
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1068
1083
1152
1215
1322
1349
1509
1530
1573
1592
1652
1670
2049
2219
1070
1083
1153
1218
1321
1350
1510
1527
1574
1571
1652
1671
2052
2215
Kwas mlekowy, di-TMS
Kwas hydroksyoctowy, di-TMS
Kwas 3-hydroksypropanolowy, di-TMS
Kwas malonowy, di-TMS
Kwas bursztynowy, di-TMS
Kwas glicerynowy, tri-TMS
Kwas jabłkowy, tri-TMS
Kwas piroglutaminowy, di-TMS
Kwas erytromorfowy, tetra-TMS
Kwas rythronowy, tetra-TMS
Kwas D-arabinonowy, gamma-lactone, tri TMS
Kwas butanodiowy, tetra-TMS
Kwas palmitynowy, TMS
Kwas linolenowy, TMS
0,20
0,06
0,04
0,06
0,27
0,10
1,05
0,53
0,04
0,15
0,08
0,04
0,21
0,37
Aminokwasy
15
16
17
18
1089
1266
1303
1499
1090
-
1308
-
L-Walina, TMS
L-Seryna, O,O-di-TMS
L-Treonina, O,O-di-TMS
Aminokwas (84, 73, 75)
0,05
0,09
0,04
0,26
Związki aromatyczne
19 2151 2155 Kwas kawowy, TMS 0,43
Heterocykliczne związki zawierające azot
20 2467 2469 Urydyna, tri-TMS 0,08
Węglowodany i glukozydy

245
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
1832
1844
1852
1874
1878
1886
1930
1935
1939
1977
2028
2066
2094
2103
2142
2164
2178
2208
2594
2658
2713
2856
2888
2925
3003
3065
3110
3228
-
1843
1851
-
1879
1885
1930
-
1937
1978
2028
-
-
-
-
-
-
-
-
-
2714
2853
-
-
-
-
-
-
Monosacharyd (217, 73, 129)
β-Fruktofuranoza, penta-TMS
α-Fruktofuranoza, penta-TMS
Monosacharyd (204, 246, 191)
α-Glukofuranoza, TMS
β-Fruktofuranoza, penta-TMS
α-D-Glukopyranoza, penta-TMS
Monosacharyd (204, 73, 133)
α-D-Galaktopyranoza, penta-TMS
Sedoheptuloza, hexa-TMS
α-D-Glucopyranoza, penta-TMS
Węglowodan (204, 73, 217)
Węglowodan (204, 73, 217)
Węglowodan (217, 73, 129)
Węglowodan (204, 73, 217)
Węglowodan (204, 73, 217)
Węglowodan (73, 204, 129)
Węglowodan (204, 73, 217)
Węglowodan (361, 217, 73)
Węglowodan (361, 217, 73)
Sacharoza, octa-TMS
Leukroza, TMS
Węglowodan (204, 361, 437)
Węglowodan (217, 361, 437)
Węglowodan (204, 73, 205)
Węglowodan (204, 205, 361)
Węglowodan (204, 217, 73)
Węglowodan (204, 217, 361)
0,12
2,79
3,48
0,07
0,39
0,48
3,51
0,35
0,06
0,36
4,44
0,20
1,46
1,74
11,97
0,95
0,12
6,03
1,52
3,89
32,84
0,16
0,10
0,09
0,29
0,19
0,34
0,44
Alkohole polihydroksylowe
49 1536 1536 Treitol, tetra-TMS 0,10
Pozostałe
50
51
52
1288
1292
1739
1289
1293
-
Kwas fosforowy, tri-TMS
Glicerol, tri-TMS
NN (73, 147, 246)
6,36
0,48
0,48

246
53
54
55
56
57
58
59
60
61
62
63
64
1826
1956
1996
2003
2026
2043
2128
2532
2691
2701
2721
3098
-
1955
-
2004
2024
-
2128
-
-
-
-
-
NN (73, 437, 217)
muko-Inozytol, hexa-TMS
NN (204, 73, 205)
chiro-Inozytol, penta-TMS
scyllo-Inozytol, hexa-TMS
NN (217, 73, 305)
mio-Inozytol, hexa-TMS
NN (73, 287, 217)
NN (289, 361, 73)
NN (289, 361, 217)
NN (73, 217, 361)
NN (324, 361, 217)
0,12
0,14
0,31
0,51
3,04
0,11
0,80
0,66
0,13
0,29
2,16
0,88
B)
Lp. IR exp IR lit Nazwa związku Zawartość
[%]
Kwasy alifatyczne i glicerydy
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1066
1068
1080
1083
1215
1322
1349
1503
1509
1531
1592
2049
2216
2607
1069
1070
1078
1083
1218
1321
1350
1500
1510
1527
1571
2052
2215
Kwas etanodiowy
Kwas mlekowy, di-TMS
Kwas glikolowy, di-TMS
Kwas hydroksyoctowy, di-TMS
Kwas malonowy, di-TMS
Kwas bursztynowy, di-TMS
Kwas glicerynowy, tri-TMS
Kwas 2-piperydynokarboksylowy
Kwas jabłkowy, tri-TMS
Kwas piroglutaminowy, di-TMS
Kwas rythronowy, tetra-TMS
Kwas palmitynowy, TMS
Kwas linolenowy, TMS
Gliceryna 1-monopalmitoilowa
0,16
0,33
0,11
0,07
0,09
0,21
0,18
1,26
0,11
3,01
0,09
0,15
0,17
0,04
Aminokwasy
16
17
18
1089
1111
1194
1090
1119
1203
L-Walina, TMS
Alanina, di-TMS
Glicyna
0,30
0,30
0,04

247
19
20
21
1266
1304
1522
-
1308
-
L-Seryna, O,O-di-TMS
L-Treonina, O,O-di-TMS
N-Acetylometionina, di-TMS ? (73, 116, 261)
0,53
0,33
0,39
Związki aromatyczne
22
23
24
25
1244
1910
2098
2152
1243
2155
Kwas benzoesowy, TMS
Benzaldehyd
Benzhydrazyd
Kwas kawowy, TMS
0,06
0,02
0,08
0,08
Heterocykliczne związki zawierające azot
26
27
28
29
1036
1143
1950
2468
2469
Pirydyna, 3-trimetylosiloksyl
1- (trimetylosililo) -2-pirolidynon
Benzotiofen
Urydyna, tri-TMS
0,15
0,17
0,19
0,16
Diterpeny
30 2182 2183 Fitol, TMS
0,13
Węglowodany i glukozydy
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
1844
1852
1930
1936
2294
1978
2029
2067
2094
2145
2165
2203
2239
2373
2543
2594
1843
1852
1879
-
1977
1978
2030
-
-
-
-
2205
2239
2378
-
-
β-Fruktofuranoza, penta-TMS
α-Fruktofuranoza, penta-TMS
α-D-Glukopyranoza, penta-TMS
Monosacharyd (204, 73, 133)
D-Glukoza
Sedoheptuloza, hexa-TMS
β-D-Glukopyranoza, penta-TMS
Węglowodan (204, 73, 217)
Węglowodan (204, 73, 217)
Węglowodan (204, 73, 217)
Węglowodan (204, 73, 217)
α-D-Galaktopyranoza
α-D-Mannopyranoza
2-O-glicerol-α-d-galaktopiranozyd
Węglowodan (204 ,73, 105 )
Węglowodan (361, 217, 73)
0,45
0,57
0,23
0,36
0,07
3,45
0,25
0,81
0,14
28,05
0,02
0,13
0,16
0,04
0,09
0,17

248
47
48
49
50
51
52
53
54
55
56
57
2612
2628
2715
2829
2849
2945
2995
3003
3066
3110
3228
-
2630
2714
2829
-
2945
-
-
-
-
-
Glukuronolakton
D-Turanoza
Sacharoza, octa-TMS
Glukopiranozyd, p-etylofenol
α-D-Galaktopyranoza
Lyksoza
Węglowodan (73, 361, 308)
Węglowodan (204, 73, 205)
Węglowodan (204, 205, 361)
Węglowodan (204, 217, 73)
Węglowodan (204, 217, 361)
0,25
0,25
0,08
28,60
0,13
0,10
0,09
0,25
0,28
0,28
0,18
Alkohole polihydroksylowe
59
60
61
62
1538
1732
1746
1920
1538
1728
1740
1925
Treitol, tetra-TMS
Ksylitol, penta-TMS
Arabinitol, penta-TMS
Heksitol, TMS, isomere 1
0,02
0,05
0,01
0,17
Pozostałe
63
64
65
66
67
68
69
70
71
72
73
1289
1292
1411
1961
1996
2003
2128
2533
2692
2721
3098
1289
1293
-
1955
-
2004
2128
-
-
-
-
Kwas fosforowy, tri-TMS
Glicerol, tri-TMS
NN (73, 147, 245)
muko-Inozytol, hexa-TMS
NN (204, 73, 205)
chiro-Inozytol, penta-TMS
mio-Inozytol, hexa-TMS
NN (73, 287, 217)
NN (289, 361 , 73)
NN (73, 217, 361)
NN (324, 361, 217)
3,01
0,58
0,12
0,15
0,24
0,11
2,65
0,02
0,10
0,05
0,39
C)
Lp. IR exp IR lit Nazwa związku Zawartość
[%]
Kwasy alifatyczne i glicerydy
1 1068 1070 Kwas mlekowy, di-TMS 3,54
0,41

249
2
3
4
5
6
7
8
9
10
11
12
13
1083
1152
1214
1322
1349
1502
1509
1530
1573
1592
2050
2220
1083
1153
1218
1321
1350
1500
1510
1527
1574
1571
2052
2215
Kwas hydroksyoctowy, di-TMS
Kwas 3-hydroksypropanolowy, di-TMS
Kwas malonowy, di-TMS
Kwas bursztynowy, di-TMS
Kwas glicerynowy, tri-TMS
Kwas 2-piperydynokarboksylowy
Kwas jabłkowy, tri-TMS
Kwas piroglutaminowy, di-TMS
Kws erytomorfowy, tetra-TMS
Kwas rythronowy, tetra-TMS
Kwas palmitynowy, TMS
Kwas linolenowy, TMS
0,28
0,53
1,16
0,81
2,17
0,66
6,30
0,15
0,20
0,07
0,04
Aminokwasy
14
15
16
17
18
19
20
1089
1110
1159
1265
1303
1499
1521
1090
1119
1185
-
1308
-
-
L-Walina, TMS
Alanina, di-TMS
L-Leucyna
L-Seryna, O,O-di-TMS
L-Treonina, O,O-di-TMS
Aminokwas (84, 73, 75)
N-Acetylometionina, di-TMS ? (73, 116, 261)
1,72
1,60
0,34
2,37
2,58
0,69
1,27
Związki aromatyczne
21 1244 1243 Kwas benzoesowy, TMS
0,33
Heterocykliczne związki zawierające azot
22 2593 2469 Urydyna, tri-TMS 1,09
Diterpeny
23 2208 2183 Fitol, TMS 0,18
Węglowodany i glukozydy
24
25
26
27
28
29
1852
1878
1890
1894
1935
1950
1843
1852
1879
1889
1930
-
β-Fruktofuranoza, penta-TMS
α-Fruktofuranoza, penta-TMS
α-Glukofuranoza, TMS
α-DL-Arabinofuranozyd
α-D-Glukopyranoza, penta-TMS
Monosacharyd (204, 73, 133)
1,56
2,21
0,06
0,03
0,64
2,07

250
30
31
32
33
34
35
36
37
38
39
40
41
42
43
1978
1996
-
2094
2103
2128
2182
2371
2467
2606
2658
2701
3228
3257
1977
1978
-
-
-
-
-
2378
2460
-
2652
-
-
-
D-Glukoza
Sedoheptuloza, hexa-TMS
β-D-Glukopyranoza, penta-TMS
Węglowodan (204, 73, 217)
Węglowodan (204, 73, 217)
Węglowodan (217, 73, 129)
Węglowodan (204, 73, 217)
2-O-Glicerol-α-d-galaktopiranozyd
D-Fruktoza
Węglowodan (361, 217, 73)
Maltoza
Węglowodan (361, 217, 73)
Węglowodan (204, 217, 73)
Węglowodan (204, 217, 361)
0,17
9,95
0,25
2,01
1,72
0,16
21,04
0,30
0,02
0,10
0,31
0,13
0,08
1,10
Alkohole polihydroksylowe
44
45
46
47
48
49
50
1536
1568
1732
1745
1758
1844
1929
1536
1568
1728
1740
1755
1841
1925
Treitol, tetra-TMS
Pentitol
Ksylitol, penta-TMS
Arabinitol, penta-TMS
Arabitol, penta-TMS
Rybitol, penta-TMS
Heksitol, TMS, isomere 1
0,41
0,03
0,12
0,13
0,16
0,02
0,40
Pozostałe
51
52
53
54
55
56
57
58
59
60
61
1078
1194
1288
1292
1411
1459
1556
1906
1961
2003
2026
-
-
1289
1293
-
-
-
-
1955
2004
2024
NN (221,103,130,73)
NN (73, 170, 75, 141)
Kwas fosforowy, tri-TMS
Glicerol, tri-TMS
NN (73, 147, 245)
NN (155, 273, 73)
NN (73, 147, 218)
NN (159, 247, 303, 116, 160)
muko-Inozytol, hexa-TMS
chiro-Inozytol, penta-TMS
scyllo-Inozytol, hexa-TMS
0,23
0,17
9,08
4,90
0,35
0,02
0,14
0,04
0,32
0,28
0,61

251
62
63
64
2128
2142
3098
2128
-
-
mio-Inozytol, hexa-TMS
NN (289, 361, 217)
NN (324, 361, 217)
0,78
1,66
0,04
D)
Lp. IR exp IR lit Nazwa związku Zawartość
[%]
Kwasy alifatyczne i glicerydy
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1068
1083
1322
1349
1459
1501
1509
1516
1531
1573
1592
1652
1952
2216
2651
1070
1083
1321
1350
1460
1503
1510
1518
1527
1574
1571
1652
1953
2215
2653
Kwas mlekowy, di-TMS
Kwas hydroksyoctowy, di-TMS
Kwas bursztynowy, di-TMS
Kwas glicerynowy, tri-TMS
Kwas 2-izopropylo-3-ketobutanowy
Kwas butanodiowy
Kwas jabłkowy, tri-TMS
Kwas pentanowy
Kwas piroglutaminowy, di-TMS
Kws erytomorfowy, tetra-TMS
Kwas rythronowy, tetra-TMS
Kwas D-arabinonowy, gamma-lakton, tri-TMS
Kwas idonowy
Kwas linolenowy, TMS
Kwas Ribonic
0,55
0,08
0,15
0,07
0,15
0,81
0,82
0,04
0,04
0,04
0,03
0,10
0,03
0,15
6,51
Aminokwasy
16 1522 - N-Acetylometionina, di-TMS ? (73, 116, 261)
0,05
Związki aromatyczne
17 2730 2732 Deoksyfruktozazyna 0,25
Heterocykliczne związki zawierające azot
18
19
2468
2482
2469
-
Urydyna, tri-TMS
Deoksygedunina
0,07
0,08
Diterpeny

252
20 2182 2183 Fitol, TMS
0,04
Węglowodany i glukozydy
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
1761
1844
1852
1878
1893
1906
1930
1936
2294
1978
2029
2067
2075
2094
2102
2112
2141
2163
2177
2203
2208
2269
2287
2372
2450
2594
2612
2628
2658
2715
2829
2892
2905
1760
1843
1852
1880
1894
1908
1879
-
1977
1978
2030
-
2077
-
-
2112
-
-
-
2205
-
2269
2283
2371
-
-
-
2630
-
2714
2829
2890
2903
Glukofuranozyd
β-Fruktofuranoza, penta-TMS
α-Fruktofuranoza, penta-TMS
α-Glukofuranoza, TMS
α-D-Mannopyranozyd
Arabinofuranoza
α-D-Glukopyranoza, penta-TMS
Monosacharyd (204, 73, 133)
D-Glukoza
Sedoheptuloza, hexa-TMS
β-D-Glukopyranoza, penta-TMS
Węglowodan (204, 73, 217)
α-D-Galaktofuranozyd
Węglowodan (204, 73, 217)
Węglowodan (217, 73, 129)
Mannoza
Węglowodan (204, 73, 217)
Węglowodan (204, 73, 217)
Węglowodan (73, 204, 129)
α-D-Galaktopyranozyd
Weglowodan (204, 73, 217)
α-D-Fruktopyranoza
α-D-Fruktoza
Glicerol-α-d-galaktopyranozyd
Gulose
Węglowodan (361, 217, 73)
Glukuronolakton
D-Turanoza
Węglowodan (361, 217, 73)
Sacharoza, octa-TMS
Glukopiranozyd, p-etylofenol
Lyksopyranozyd
β-Cellobioza, octa-TMS
0,32
2,88
3,20
0,08
0,71
0,03
1,25
1,91
0,19
6,54
0,05
0,02
0,03
0,39
0,05
0,48
0,12
0,05
0,05
0,08
0,08
0,11
1,13
0,03
0,42
0,05
0,90
0,18
0,87
5,39
0,10
0,02
0,03

253
54 3228 -
Węglowodan (204, 217, 361)
0,03
Alkohole polihydroksylowe
55
56
57
1538
1539
1732
1538
1538
1735
Treitol, tetra-TMS
Erytritol,
Galaktitol
0,10
0,02
0,06
Pozostałe
58
59
60
61
62
63
64
65
66
67
68
69
70
71
72
73
74
75
76
1289
1292
1956
1919
1950
1996
2003
2025
2044
2127
2080
2506
2524
2531
2548
2691
2701
2722
3097
1289
1293
1955
-
-
-
2004
2024
-
2128
-
-
-
-
-
-
-
-
-
Kwas fosforowy, tri-TMS
Glicerol, tri-TMS
muko-Inozytol, hexa-TMS
NN (73, 147, 217)
NN (73, 204, 324)
NN (204, 73, 205)
chiro-Inozytol, penta-TMS
scyllo-Inozytol, hexa-TMS
NN (217, 73, 305)
mio-Inozytol, hexa-TMS
NN (73, 147, 217, 278)
NN (73, 147, 211, 325)
NN (73, 97, 362)
NN (73, 287, 217)
NN (73, 98, 215, 242, 361)
NN (289, 361, 73)
NN (289, 361, 217)
NN (73, 217, 361)
NN (324, 361, 217)
0,54
0,44
0,28
0,04
0,05
0,12
0,23
1,52
0,07
1,51
0,05
0,03
0,56
0,07
0,23
2,56
37,31
0,52
0,28

254
Tab. II. Wykaz związków organicznych zidentyfikowanych w ekstraktach metanolowych,
pochodzących z 7-dniowych siewek (A), 5 (B), 14 (C) i 28 (D) -dniowych kultur pędowych in
vitro lnu zwyczajnego odm. Selena
A)
Lp. IR exp IR lit Nazwa związku Zawartość
[%]
Kwasy alifatyczne i glicerydy
1
2
3
4
5
6
7
8
9
10
1068
1083
1215
1322
1349
1509
1652
1670
2049
2219
1070
1083
1218
1321
1350
1510
1652
1671
2052
2215
Kwas mlekowy, di-TMS
Kwas hydroksyoctowy, di-TMS
Kwas malonowy, di-TMS
Kwas bursztynowy, di-TMS
Kwas glicerynowy, tri-TMS
Kwas jabłkowy, tri-TMS
Kwas D-arabinonowy, gamma-lactone, tri TMS
Kwas butanodiowy, tetra-TMS
Kwas palmitynowy, TMS
Kwas linolenowy, TMS
0,19
0,08
1,67
0,69
0,44
1,67
0,04
0,07
0,01
1,05
Aminokwasy
11
12
13
14
1089
1111
1266
1303
1090
1119
-
1308
L-Walina, TMS
Alanina, di-TMS
L-Seryna. O,O-di-TMS
L-Treonina, O,O-di-TMS
0,21
0,33
0,51
0,20
Związki aromatyczne
15 2151 2155 Kwas kawowy, TMS 1,82
Heterocykliczne związki zawierające azot
16 2467 2469 Urydyna, tri-TMS 0,04
Węglowodany i glukozydy
17
18
19
20
21
22
1874
1878
1886
1935
1939
1977
-
1879
1885
-
1937
1978
Monosacharyd (204, 246, 191)
α-Glukofuranoza, TMS
β-Fruktofuranoza, penta-TMS
Monosacharyd (204, 73, 133)
α-D-Galaktopiranoza, penta-TMS
Sedoheptuloza, hexa-TMS
0,04
0,15
8,52
0,01
0,05
0,67

255
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
2028
2066
2094
2103
2112
2142
2164
2178
2208
2467
2594
2658
2856
2888
2925
3003
3065
3110
2028
-
-
-
2112
-
-
-
-
2460
-
-
2853
-
-
-
-
-
α-D-Glucopiranoza, penta-TMS
Węglowodan (204, 73, 217)
Węglowodan (204, 73, 217)
Węglowodan (217, 73, 129)
Mannoza
Węglowodan (204, 73, 217)
Węglowodan (204, 73, 217)
Węglowodan (73, 204, 129)
Węglowodan (204, 73, 217)
D-Fruktoza
Węglowodan (361, 217, 73)
Węglowodan (361, 217, 73)
Leukroza, TMS
Węglowodan (204, 361, 437)
Węglowodan (217, 361, 437)
Węglowodan (204, 73, 205)
Węglowodan (204, 205, 361)
Węglowodan (204, 217, 73)
0,41
0,29
0,43
1,85
0,94
0,05
0,17
0,08
0,29
0,65
0,39
0,28
0,07
13,16
0,03
0,40
0,13
0,05
Alkohole polihydroksylowe
41 1536 1536 Treitol, tetra-TMS 0,03
Pozostałe
42
43
44
45
46
47
48
49
50
51
52
53
1288
1956
1996
2003
2026
2043
2128
2532
2691
2701
2721
3098
1289
1955
-
2004
2024
-
2128
-
-
-
-
-
Kwas fosforowy, tri-TMS
muko-Inozytol, hexa-TMS
NN (204, 73, 205)
chiro-Inozytol, penta-TMS
scyllo-Inozytol, hexa-TMS
NN (217, 73, 305)
mio-Inozytol, hexa-TMS
NN (73, 287, 217)
NN (289, 361, 73)
NN (289, 361, 217)
NN (73, 217, 361)
NN (324, 361, 217)
15,45
0,24
2,31
10,23
4,04
0,07
9,49
0,05
0,12
14,86
3,16
0,88

256
B)
Lp. IR exp IR lit Nazwa związku Zawartość
[%]
Kwasy alifatyczne i glicerydy
1
2
3
4
5
6
7
8
9
10
1068
1083
1322
1349
1501
1509
1531
1652
1952
2216
1070
1083
1321
1350
1503
1510
1527
1652
1953
2215
Kwas mlekowy, di-TMS
Kwas hydroksyoctowy, di-TMS
Kwas bursztynowy, di-TMS
Kwas glicerynowy, tri-TMS
Kwas butanodiowy
Kwas jabłkowy, tri-TMS
Kwas piroglutaminowy, di-TMS
Kwas D-arabinonowy, gamma-lakton, tri-TMS
Kwas idonowy
Kwas linolenowy, TMS
4,67
1,18
0,32
0,07
1,81
2,99
0,16
0,50
0,03
4,98
Aminokwasy
11 1522 - N-Acetylometionina, di-TMS ? (73, 116, 261)
1,12
Związki aromatyczne
12 2730 2732 Deoksyfruktozazyna 1,90
Heterocykliczne związki zawierające azot
13
2468
2469 Urydyna, tri-TMS
1,12
Diterpeny
14 2182 2183 Fitol, TMS
0,12
Węglowodany i glukozydy
15
16
17
18
19
20
21
1844
1852
1878
1930
1936
2294
1978
1843
1852
1880
1879
-
1977
1978
β-Fruktofuranoza, penta-TMS
α-Fruktofuranoza, penta-TMS
α-Glukofuranoza, TMS
α-D-Glukopiranoza, penta-TMS
Monosacharyd (204, 73, 133)
D-Glukoza
Sedoheptuloza, hexa-TMS
2,13
2,30
0,08
1,75
1,91
0,89
11,69

257
22
23
24
25
26
27
28
29
30
31
42
43
44
44
45
46
47
48
49
50
2029
2067
2075
2094
2102
2112
2141
2163
2177
2203
2208
2269
2287
2450
2594
2628
-
2715
2829
2892
2030
-
2077
-
-
2112
-
-
-
2205
-
2269
2283
-
-
2630
-
2713
2829
2890
β-D-Glukopiranoza, penta-TMS
Węglowodan (204, 73, 217)
α-D-Galaktofuranozyd
Węglowodan (204, 73, 217)
Węglowodan (217, 73, 129)
Mannoza
Węglowodan (204, 73, 217)
Węglowodan (204, 73, 217)
Węglowodan (73, 204, 129)
α-D-Galaktopiranozyd
Weglowodan (204, 73, 217)
α-D-Fruktopiranoza
α-D-Fruktoza
Węglowodan (361, 217, 73)
Glukuronolakton
D-Turanoza
Węglowodan (361, 217, 73)
Sacharoza, octa-TMS
Glukopiranozyd, p-etylofenol
Lyksopyranozyd
0,03
0,12
0,02
0,59
0,05
0,58
0,13
0,05
0,05
0,18
0,08
0,11
1,13
5,59
0,05
0,18
0,87
24,29
0,11
0,02
Alkohole polihydroksylowe
51
52
53
1538
1539
1732
1538
1538
1735
Treitol, tetra-TMS
Erytritol
Galaktitol
1,10
0,21
1,06
Pozostałe
54
55
56
57
58
59
60
61
62
1289
1292
1956
1919
1950
1996
2003
2044
2080
1289
1293
1955
-
-
-
2004
-
-
Kwas fosforowy, tri-TMS
Glicerol, tri-TMS
muko-Inozytol, hexa-TMS
NN (73, 147, 217)
NN (73, 204, 324)
NN (204, 73, 205)
chiro-Inozytol, penta-TMS
NN (217, 73, 305)
NN (73, 147, 217, 278)
5,30
2,55
0,28
0,04
0,05
0,12
0,23
0,57
0,05

258
63
64
65
66
67
2506
2524
2531
2701
2722
-
-
-
-
-
NN (73, 147, 211, 325)
NN (73, 97, 362)
NN (73, 287, 217)
NN (289, 361, 217)
NN (73, 217, 361)
0,23
1,56
0,17
0,23
1,03
C)
Lp. IR exp IR lit Nazwa związku Zawartość
[%]
Kwasy alifatyczne i glicerydy
1
2
3
4
5
6
7
1068
1083
1215
1322
1349
2049
2216
1070
1083
1218
1321
1350
2052
2215
Kwas mlekowy, di-TMS
Kwas hydroksyoctowy, di-TMS
Kwas malonowy, di-TMS
Kwas bursztynowy, di-TMS
Kwas glicerynowy, tri-TMS
Kwas palmitynowy, TMS
Kwas linolenowy, TMS
1,68
0,02
1,70
0,86
1,35
0,26
0,12
Aminokwasy
8
9
10
11
12
1089
1111
1159
1304
1499
1090
1119
1185
1308
-
L-Walina, TMS
Alanina, di-TMS
L-Leucyna
L-Treonina, O,O-di-TMS
Aminokwas (84, 73, 75)
0,12
0,21
0,04
0,14
0,14
Heterocykliczne związki zawierające azot
13
2467 2469 Urydyna, tri-TMS 0,31
Diterpeny
14 2182 2183 Fitol, TMS
0,02
Węglowodany i glukozydy
15 1844 1843 β-Fruktofuranoza, penta-TMS 4,76

259
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
1852
1930
1978
2029
2067
2094
2145
2165
2203
2543
2594
2628
2715
2856
2995
3003
3066
3110
3228
1852
1879
1978
2030
-
-
-
-
2205
-
-
2630
2714
2853
-
-
-
-
-
α-Fruktofuranoza, penta-TMS
α-D-Glukopyranoza, penta-TMS
Sedoheptuloza, hexa-TMS
β-D-Glukopyranoza, penta-TMS
Węglowodan (204, 73, 217)
Węglowodan (204, 73, 217)
Węglowodan (204, 73, 217)
Węglowodan (204, 73, 217)
α-D-Galaktopyranoza
Węglowodan (204 ,73, 105 )
Węglowodan (361, 217, 73)
D-Turanoza
Sacharoza, octa-TMS
Leukoza, TMS
Węglowodan (73, 361, 308)
Węglowodan (204, 73, 205)
Węglowodan (204, 205, 361)
Węglowodan (204, 217, 73)
Węglowodan (204, 217, 361)
1,37
0,47
6,28
2,76
1,64
0,60
0,28
0,24
0,53
0,08
0,17
0,39
47,16
0,46
11,04
0,52
0,30
0,33
0,18
Alkohole polihydroksylowe
35 1538
1538 Treitol, tetra-TMS 0,02
Pozostałe
36
37
38
39
40
41
42
43
44
45
46
1289
1292
1411
1961
1996
2003
2128
2533
2692
2721
3098
1289
1293
-
1955
-
2004
2128
-
-
-
-
Kwas fosforowy, tri-TMS
Glicerol, tri-TMS
NN (73, 147, 245)
muko-Inozytol, hexa-TMS
NN (204, 73, 205)
chiro-Inozytol, penta-TMS
mio-Inozytol, hexa-TMS
NN (73, 287, 217)
NN (289, 361 , 73)
NN (73, 217, 361)
NN (324, 361, 217)
3,22
1,08
0,14
0,35
4,06
1,13
1,46
0,20
1,26
0,41
0,14

260
D)
Lp. IR exp IR lit Nazwa związku Zawartość
[%]
Kwasy alifatyczne i glicerydy
1
2
3
4
5
6
7
1068
1083
1322
1509
1530
2050
2220
1070
1083
1321
1510
1527
2052
2215
Kwas mlekowy, di-TMS
Kwas hydroksyoctowy, di-TMS
Kwas bursztynowy, di-TMS
Kwas jabłkowy, tri-TMS
Kwas piroglutaminowy, di-TMS
Kwas palmitynowy, TMS
Kwas linolenowy, TMS
4,55
0,19
0,74
4,04
0,44
1,60
0,40
Aminokwasy
8 1194
1203
Glicyna
0,40
Heterocykliczne związki zawierające azot
9 2593 2469 Urydyna, tri-TMS 0,56
Węglowodany i glukozydy
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
1852
1878
1935
1950
1978
2103
2128
2182
2371
2467
2606
2658
2701
2713
3228
1843
1852
1930
-
1977
-
-
-
-
2460
-
2652
-
2714
-
β-Fruktofuranoza, penta-TMS
α-Fruktofuranoza, penta-TMS
α-D-Glukopyranoza, penta-TMS
Monosacharyd (204, 73, 133)
D-Glukoza
Węglowodan (204, 73, 217)
Węglowodan (204, 73, 217)
Węglowodan (217, 73, 129)
Węglowodan (204, 73, 217)
D-Fruktoza
Węglowodan (361, 217, 73)
Maltoza
Węglowodan (361, 217, 73)
Sacharoza, octa TMS
Węglowodan (204, 217, 73)
6,62
4,26
2,59
4,07
20,24
0,65
0,05
0,16
1,06
0,30
5,10
0,04
0,13
24,26
0,36
Alkohole polihydroksylowe
25 1568 1568 Pentitol 0,08

261
26
27
28
29
1732
1745
1758
1844
1728
1740
1755
1841
Ksylitol, penta-TMS
Arabinitol, penta-TMS
Arabitol, penta-TMS
Rybitol, penta-TMS
0,21
0,13
0,18
0,01
Pozostałe
30
31
32
33
34
35
36
1078
1194
1288
1292
1961
2026
2128
-
-
1289
1293
1955
2024
2128
NN (221,103,130,73)
NN (73, 170, 75, 141)
Kwas fosforowy, tri-TMS
Glicerol, tri-TMS
muko-Inozytol, hexa-TMS
scyllo-Inozytol, hexa-TMS
mio-Inozytol, hexa-TMS
2,23
2,34
2,95
1,34
0,55
0,04
0,52