Tessuto Muscolare Striato Scheletrico
-
Upload
cinzia-modica -
Category
Documents
-
view
217 -
download
0
Transcript of Tessuto Muscolare Striato Scheletrico

TESSUTO MUSCOLARE STRIATO SCHELETRICO E' un tessuto costituito da cellule che prendono il nome di fibre muscolari: sono cellule di forma irregolarmente cilindrica, di notevoli dimensioni e soprattutto caratterizzate dall'essere polinucleate (oltre che ovviamente essere caratterizzate dalla tipica striatura trasversale, da cui il nome). Infatti sono dei sincizi, cioè derivano dalla fusione di più cellule embrionali mononucleate, i mioblasti, che fondendosi sono venuti a costituire un'unica massa citoplasmatica, in cui però si conservano distintamente i vari nuclei. Ovviamente il numero dei nuclei sarà variabile e dipenderà dal numero delle cellule che si sono fuse e quindi dalle dimensioni della fibra muscolare stessa (quelle lunghe alcuni cm possono contenerne parecchie centinaia).Il tessuto muscolare striato scheletrico deriva dal mesoderma (dei miotomi dei somiti e in piccola parte dal mesoderma degli archi branchiali): prima queste cellule indifferenziate mononucleate che sono i mioblasti si fondono in sincizi che prendono il nome di miotubi e in seguito questi si differenzieranno in fibre muscolari incapaci di moltiplicarsi. Le cellule costitutive di questo tipo di tessuto muscolare sono infatti cellule perenni.Ricapitolando: le fibre muscolari sono cellule di notevoli dimensioni polinucleate (sincizi) e presentano la caratteristica bandeggiatura.Il tessuto muscolare striato scheletrico è il costituente principale dei muscoli scheletrici che sono anche costituiti da vasi, nervi e connettivi.
Vediamo come è costituito il muscolo scheletrico.I muscoli scheletrici sono costituiti da un insieme di fascetti muscolari associati tra loro per mezzo di connettivo. Ognuno di questi fascetti muscolari che costituisce il muscolo,è formato a sua volta da diverse cellule, cioè da diverse fibre muscolari, associate anch'esse tra loro per mezzo di connettivo. Solitamente sono disposte parallelamente le une alle altre ma non sempre.
Ricapitolando: il muscolo è formato da più fascetti muscolari, ognuno dei quali è formato da più fibre muscolari.
Queste fibre muscolari contengono al loro interno degli elementi filamentosi che prendono il nome di miofibrille disposte tutte parallelamente le una alle altre e che costituiscono il 60-70% della cellula stessa. Queste miofibrille, che costituiscono gran parte delle cellule muscolari, sono a loro volta costituite da filamenti ancora più sottili che prendono il nome di miofilamenti. Già da ora potremmo dire che da un punto di vista dell'architettura muscolare, il muscolo scheletrico ha un'organizzazione "a encapsi", cioè andando dal livello macroscopico (muscolo) a quello submicroscopico (miofilamenti) le unità strutturali sono disposte ordinatamente tutte a incastro l'una dentro l'altra e tutte quasi parallelamente:
Muscolo Fascetti Muscolari Fibre muscolari Fasci di Miofibrille Fasci di Miofilamenti
Il tessuto muscolare è strettamente associato al tessuto connettivo e infatti ogni muscolo del corpo è avvolto da una lamina di tessuto connettivo, detta Epimisio. Questo epimisio si continua con il tendine, anch'esso di natura connettivale, tramite cui poi si inserisce nell'osso di cui quel muscolo causa il movimento. Dall'epimisio partono dei setti di connettivo più sottili che si approffondano nel muscolo e vanno ad avvolgere i singoli fascetti muscolari. Questo connettivo che avvolge i singoli fascetti muscolari prende il nome di Perimisio. A sua volta dal perimisio partono altri setti di connettivo che vanni ad avvolgere le singole fibre muscolari, cioè le singole cellule. Questo connettivo che avvolge le singole cellule prende il nome di Endomisio.
1

Insomma, la componente connettivale del muscolo si organizza a tre livelli (solitamente si tratta di connettivo lasso ma non sempre):
Epimisio Perimisio Endomisio
e costituisce lo stroma in cui si trovano vasi e nervi.I vari vasi sanguigni e nervi che raggiungono il muscolo seguono questi setti di connettivo e si vanno via via ramificando. Per quanto riguarda i vasi sanguigni, attraversano l'epimisio dove hanno calibro maggiore, già nell'epimisio hanno un calibro minore e a livello dell'endomisio troviamo una fitta rete di capillari. A livello del connettivo che circonda la singola cellula abbiamo capillari e quindi possiamo dire che ogni fibra muscolare è avvolta da una rete capillare. Per quanto riguarda i nervi, anche in questo caso si parte da un nervo formato da più neuroni, questo nervo attraversa il muscolo tramite l'epimisio, a livello del perimisio si suddivide nei suoi vari assoni e poi la singola terminazione nervosa del singolo assone raggiunge la singola fibra muscolare.
Il tessuto muscolare striato scheletrico è un tessuto volontario sotto il controllo del SNC e in particolar modo i nervi che raggiungono questo tessuto sono costituiti da motoneuroni. L'insieme del neurone con il suo assone e con tutte le fibre muscolari che innerva (perché sono raggiunte dalle sue innumerevoli terminazioni, e che sono 1-1000) prende il nome di unità motoria. I neuroni hanno quasi un ruolo trofico nei confronti delle fibre muscolari striate con cui prendono contatto, perché la lesione di un nervo motore può portare all'ipotrofia di quella parte di muscolo che andava innervare.
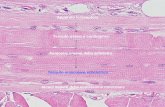
FIBRA MUSCOLARE SCHELETRICA Le fibre muscolari scheletriche sono le cellule che costituiscono il tessuto muscolare striato scheletrico. Sono cellule di forma irregolarmente cilindrica, fusiforme, quindi di forma allungata, e di notevoli dimensioni: spessore che va dai 10 ai 100 mm e lunghezza che può raggiungere alcuni centimetri (10 cm). Sono però solitamente più corte del muscolo cui appartengono, nel senso che queste fibre non si estendono dal tendine di origine al tendine terminale ma solitamente si congiungono con una estremità al tendine e con l'altra estremità sono connesse ai setti connettivali del perimisio. Perché hanno dimensioni così notevoli?Perché derivano dalla fusione di più cellule embrionali mononucleate, i mioblasti, che si sono fuse a formare un sincizio, un'unica massa citoplasmatica in cui sono evidenti i numerosi nuclei. Il numero dei nuclei può variare in base alla grandezza della fibra, nelle fibre più lunghe può raggiungere anche diverse centinaia. I nuclei si trovano però sempre in posizione periferica, cioè che si trovano al di sotto della membrana plasmatica e hanno forma allungata e in essi è ben evidente un nucleolo con numerose zolle di eterocromatina addossata alla lamina nucleare. Intanto abbiamo evidenziato già le due caratteristiche principali delle fibre muscolari: dimensioni notevoli e numerosi nuclei. Ma non sono solo queste. Infatti l'osservazione al M.O. permette di evidenziare subito la caratteristica bandeggiatura, cioè la striatura trasversale che ci permette di distinguere un tessuto striato da uno liscio. Questa striatura trasversale è dovuta all'alternanza di bande chiare poco colorabili e bande scure molto più colorabili. In realtà al M.O. oltre questa evidente e marcata striatura trasversale, si può notare anche una più delicata striatura longitudinale, dovuta al fatto che all'interno di ogni fibra muscolare sono presenti numerose e sottili fibrille tutte parallele fra di loro e di uno spessore che varia da 1-3 mm e che sono disposte lungo l'asse longitudinale della cellula e prendono il nome di miofibrille.
2

Ogni singola miofibrilla è caratterizzata da questa evidente striatura trasversale che è identica a quella dell'intera cellula. Quindi possiamo dire che la bandeggiatura della cellula dipende dal fatto che è costituita da queste numerose miofibrille striate, disposte parallelamente le una alle altre e con le bande chiare e scure allineate fra di loro, da miofibrilla a miofibrilla.
Come tutte le cellule eucariotiche, la fibra muscolare è delimitata da una membrana plasmatica che prende il nome di sarcolemma (spessa al solito circa 8 nm). Questo sarcolemma è a sua volta rivestito da una membrana basale dello spessore variabile di 80-100 nm, che è costituita da una matrice amorfa di natura proteico- polisaccaridica. Questa membrana basale poi a sua volta è rivestita da un intreccio di fibre reticolari argirofile dell'endomisio. Come la membrana basale degli epiteli, anche la membrana basale dei tessuti muscolari si può evidenziare con l'azione PAS che la fa apparire di colore rosso magenta, oppure con i metodi di impregnazione argentica che invece tingono di nero le fibre reticolari che circondano la membrana basale stessa. A ridosso della superficie interna del sarcolemma, è presente una rete di MF citoscheletrici connessi al sarcolemma dalla proteina distrofina, che assicura l'ancoraggio del sarcolemma al citoscheletro durante la contrazione. Il sarcolemma forma numerose sottilissime introflessioni che prendono il nome di tubuli trasversali o tubuli T. Questi tubuli T introflettendosi dalla membrana, attraversano il Citoplasma e si continuano con il sarcolemma dal lato opposto e sono in stretto rapporto con il reticolo sarcoplasmatico. Il reticolo sarcoplasmatico corrisponde al reticolo endoplasmatico liscio ed è un sistema molto elaborato di tubuli e cisterne, che circonda ogni singola miofibrilla. Il rapporto tra tubuli T e reticolo sarcoplasmatico è così stretto che spesso vengono a costituire delle strutture dette triadi, in quanto costituite da due cisterne del reticolo attraversate al centro da un tubulo T. Ogni fibra muscolare, circondata dal suo sarcolemma, conterrà al suo interno del citoplasma. Il citoplasma delle fibre muscolari prende il nome di sarcoplasma. Al suo interno troviamo un reticolo sarcoplasmatico abbondante che avvolge ogni singola miofibrilla, ma è anche ben rappresentato l'apparato di Golgi. Solitamente sono più di uno ma i diversi apparati di Golgi tutti in posizione paranucleare. Sono molto numerosi i mitocondri (un tempo detti sarcosomi) che spesso si trovano in posizione periferica o comunque in fila uno dietro l'altro tra una miofibrilla e l'altra. Sono numerose le gocce lipidiche e le particelle di glicogeno che fungono da riserva energetica. Nella cellula troviamo anche mioglobina, una proteina coniugata con ferro che è in parte responsabile del colore rosso del muscolo e che ha la funzione di immagazzinare ossigeno e cederlo durante la contrazione muscolare. Ovviamente il componente principale di ogni fibra muscolare sono proprio le miofibrille che rappresentano il 60-70% della cellula. Quindi il sarcoplasma è scarso perché è occupato da questa fibrille.
CELLULE SATELLITI I nuclei presenti all'interno delle fibre muscolari non hanno più la capacità di replicarsi, in quanto sono usciti dal ciclo in maniera irreversibile e si trovano in uno stato postmitotico permanente. La fibra muscolare di per sé non è in grado di rinnovarsi e di replicarsi e non può neanche andare a riparare eventuali perdite di tessuto muscolare che si possono verificare o per traumi o anche in seguito alcune miopatie degenerative, perché non può andare a ripristinare l'attività mitotica dei suoi nuclei. Infatti si dice che le fibre muscolari sono cellule perenni proprio perché non hanno più la capacità di dividersi. Tant'è che infatti l'aumento della massa muscolare che si ha durante la crescita e durante l'esercizio fisico non è tanto un aumento del numero delle cellule ma è dovuta a ipertrofia delle cellule stesse, cioè le cellule ingrossano ma se vengono danneggiate non sono in grado da sole di ripararsi.
3

La riparazione di porzioni limitate di tessuto muscolare avviene grazie alla presenza di cellule dette satellite che sono cellule staminali. Sono cellule mononucleate, normalmente quiescenti, cioè che non si replicano, e che si trovano tra il sarcolemma e la lamina basale. In questa sede non esprimono nessuna delle caratteristiche differenziative proprie della fibra muscolare ma si presentano solo come cellule staminali indifferenziate. In seguito ad una eventuale lesione che comporti perdita o degenerazione della fibra muscolare e un danneggiamento del tessuto, queste cellule satelliti vengono attivate e sono stimolate a proliferare, formando una progenie di cellule che sono in grado di riattivare un processo differenziativo analogo a quello che compiono i mioblasti durante il periodo embriofetale. Così le cellule riescono a riparare piccole lesioni del tessuto muscolare. Si ritiene che queste cellule satellite non derivino da mioblasti che non si sono fusi durante il periodo embrionale, ma piuttosto che siano una popolazione di cellule che si diversifica per alcune caratteristiche dai mioblasti stessi e che è programmata a svolgere questo processo soltanto nella vita post natale in seguito a stimoli ben precisi che probabilmente derivano proprio dalla fibra muscolare danneggiata. Quando la cellula satellite viene attivata, da il via all'espressione di tutti quei fattori trascrizionali miogenici e quindi da origine a cellule figlie, destinate a fondersi con le fibre persistenti.
LE MIOFIBIRLLE Le miofibrille rappresentano la componente principale delle fibre muscolari, di cui costituiscono il 60-70% tant'è che riempiono gran parte del sarcoplasma all'interno della cellula. Al M.O. appaiono come lunghi filamenti sottili spessi circa 1-3 mm e che decorrono parallelamente fra loro e parallelamente all'asse principale della cellula per tutta la lunghezza della cellula stessa, tant'è che sono responsabili della lieve striatura longitudinale che percorre tutte le fibre muscolari ma sono responsabili soprattutto della ben più evidente bandeggiatura trasversale che caratterizza le fibre muscolari del tessuto muscolare striato. Perché c'è questa striatura trasversale? Perché c'è un'alternanza di bande chiare poco colorabili dette bande I ed bande scure ben colorabili dette bande A. Il nome di queste bande deriva dal fatto che se osserviamo la fibra muscolare con un microscopio a luce polarizzata notiamo che le bande scure sono bande birifrangenti e definite, per questo, bande anisotrope (banda A), mentre le bande chiare sono monorifrangente e definite isotrope (bande I). Notiamo che ciascuna banda A presenta una zona centrale più chiara, che prende il nome di banda H o stria di Hensen. Questa è percorsa nel mezzo da una sottile linea scura, detta stria M o mesoframma che dipende dalla presenza di ponti costituiti da tutti i vari componenti che uniscono la banda A e che vedremo essere i miofilamenti stessi. Invece per quanto riguarda la banda chiara I, al centro è attraversata da una stria scura che prende il nome di stria Z o teloframma, che la divide esattamente in due semibande di dimensioni uguali.
Riepilogando: c'è la banda scura A con al centro la banda H con al centro la linea M; e le bande chiare I con al centro la linea Z.
La porzione di miofibrilla compresa tra due linee Z successive prende il nome di sarcomero , che è l'unità strutturale e funzionale della miofibrilla. Quindi il sarcomero è quella porzione di miofibrilla che comprende un'intera banda A e due semibande I, da linea Z a linea Z. Il sarcomero ha dimensioni che variano a seconda dello stato di contrazione del muscolo: solitamente nel muscolo a riposo il sarcomero è lungo 2,5 mm. Teniamo presente che la banda A avrà sempre dimensioni costante di 1,5 mm, mentre le bande I hanno dimensioni variabili a seconda dello stato di contrazione ma che possono anche raggiungere 1 mm di lunghezza. Se al M.O. le miofibrille appaiono come filamenti sottili, ad
4

un'osservazione con il M.E. vediamo che ogni miofibrilla è a sua volta costituita da filamenti ancora più sottili che prendono il nome di miofilamenti. Il sarcomero stesso osservato al M.E. mostra una complessa ed ordinata struttura filamentosa interna che spiega non solo la natura della caratteristica bandeggiatura della fibra, ma anche il meccanismo stesso della contrazione. In particolare il sarcomero e quindi le miofibrille sono costituiti da due tipi di miofilamenti che differiscono per dimensioni e composizione chimica: i miofilamenti spessi e i miofilamenti sottili. I miofilamenti spessi sono così definiti perché hanno uno spessore di 15 nm e sono lunghi 1,5 mm. Sono costituiti da una proteina che prende il nome di miosina. I miofilamenti sottili sono così definiti perché hanno uno spessore di 5 nm circa e una lunghezza di circa 1 mm e sono costituiti prevalentemente da actina. I filamenti spessi o filamenti di miosina occupano un'intera banda A, di cui determinano la lunghezza (infatti abbiamo detto che questi filamenti hanno una lunghezza di 1,5 mm e che la lunghezza della banda A è proprio 1,5 mm). Sono disposti parallelamente fra loro e distano l'uno dall'altro circa 45 nm. I filamenti spessi appaiono più grossi nella porzione centrale della banda A, dove appaiono muniti di ponti trasversali che nell'insieme costituiscono la linea M.I filamenti sottili invece si estendono a partire da una linea Z del sarcomero, lungo tutta la banda I, e penetrano per un certo tratto nella adiacente banda A, occupando gli interstizi compresi tra i filamenti spessi. Quindi la parte centrale della banda A chiamata banda H, è proprio quella porzione della banda A che non è invasa dai filamenti sottili ed ecco perché appare più chiara. Quindi la banda H è quella regione della banda A in cui non penetrano i filamenti di actina che provengono dalle due linee Z del sarcomero. L'ampiezza della banda H dipenderà da quanto profondamente i filamenti sottili si estendono all'interno della banda A e varia a seconda dello stato di contrazione del sarcomero, tant'è che questa banda sarà ben evidente nel sarcomero a riposo ma durante la contrazione finirà quasi con lo scomparire del tutto. L'aspetto chiaro delle bande I è dovuto invece al fatto che questa porzione del sarcomero è costituita solamente dai filamenti sottili, mentre l'aspetto scuro delle porzioni più esterne della banda A è dovuta al fatto che in questa porzione del sarcomero troviamo sia i filamenti spessi che i filamenti sottili, mentre la banda H è chiara perché come abbiamo già detto contiene soltanto i filamenti spessi. Insomma il sarcomero appare più scuro laddove i filamenti di actina occupano tutti gli spazi compressi tra un miofilamento spesso e l'altro. Nella fattispecie si può notare come ogni miofilamento di miosina sia circondato da sei filamenti di actina, disposti agli angoli di un esagono e si può anche vedere che da ciascun filamento spesso partono delle brevi propaggini laterali che si stendono radialmente verso i sei filamenti sottili. Questi ponti trasversali che collegano un filamento spesso e un filamento sottile distano tra loro 14,3 nm e si succedono con un andamento elicoidale attorno ciascun filamento spesso. Un giro completo di queste propaggini comprende sei ponti e si ripete a intervalli di 42,9 nm lungo il filamento. Questo tratto è chiamato periodo del filamento spesso. Vedremo che questi ponti trasversali sono parte integrante della molecola di miosina (sono le teste) e svolgono un ruolo importante nell'interazione con la actina durante la contrazione.
MIOFILAMENTI SPESSI Abbiamo detto che ciascuna miofibrilla è costituita da filamenti più piccoli detti mio filamenti, che possono essere classificati in due diversi tipologie in base alle loro dimensioni e alla loro composizione chimica: i miofilamenti spessi e i miofilamenti sottili. I miofilamenti spessi sono così detti perché hanno un diametro di circa 15 nm, contro i 5 nm dei filamenti sottili e hanno una lunghezza di 1,5 mm. Se andiamo a vedere la loro disposizione all'interno del sarcomero li ritroviamo soltanto a livello della banda A di cui determinano la lunghezza. Sono disposti parallelamente fra loro a una distanza di circa
5

45 nm l'uno dall'altro e appaiono un po' più spessi nella loro porzione centrale, cioè in corrispondenza della linea M, perché qui sono presenti dei ponti trasversali che li connettono l'uno con l'altro e che costituiscono insieme una zona a maggiore densità che al microscopio appare come la cosiddetta linea M. Ogni singolo miofilamento spesso presenta una porzione centrale corta completamente liscia. Questa porzione è lunga solo 0,15-0,20 mm circa, mentre le porzioni all'estremità sono più lunghe e presentano invece numerose proiezioni laterali ognuna di esse lunga circa 10 nm. Queste proiezioni sono quasi perpendicolari all'asse del mio filamento stesso e rappresentano proprio quei ponti trasversali che al microscopio c'appaiono come dei ponti di collegamento tra i miofilamenti spessi e quelli sottili all'interno del sarcomero. I miofilamenti spessi sono anche detti filamenti di miosina perché la proteina costitutiva di questi filamenti è la miosina. La miosina è una proteina filamentosa lunga circa 140-150 nm e larga 2 nm, del peso di 500.000 Da. Nella fattispecie i miofilamenti spessi presentano la miosina di II tipo (perché ci sono varie isoforme). Possiamo identificare all'interno di ogni molecola di miosina una porzione più bastoncellare e allungata che prende il nome di coda e le due estremità globose dette teste. Ogni molecola di miosina è un esamero: è costituita da sei differenti subunità e presenta una struttura quaternaria. Le subunità sono: due catene pesanti identiche e poi due coppie di catena leggere uguali a due a due. Ogni singola catena pesante presenta un dominio globulare all'estremità N terminale e una lunga catena di a.a. con conformazione ad a elica. Le due catene ad a elica delle due subunità pesanti si avvolgono fra di loro creando una struttura coiled-coil, mentre le due teste proposte non si associano e rimangono libere ad una estremità.
Ricapitolando: la miosina è un esamero: le due catene pesanti si avvolgono tra di loro e si forma questa porzione bastoncellare coiled coil, detta coda, e le due teste delle due catene globose sono libere.
Poi ci sono le quattro subunità leggere che si legano a due a due alla testa: cioè ogni testa lega due catene leggere diverse tra loro, in maniera tale che le due teste siano perfettamente identiche. Delle due catene leggere, una è definita essenziale ed è quella che ha un'alta attività atpasica, mentre l'altra catena leggera ha un ruolo modulatorio ed è infatti detta proteina regolatrice. Complessivamente la testa che include la porzione globose delle catene pesanti e le catene leggera, è il vero motore della molecola di miosina, perché è proprio a livello della testa che la molecola legherà l'actina e anche l'ATP da idrolizzare per ottenere l'energia per la contrazione. La singola molecola di miosina, utilizzando degli enzimi proteolitici come la tripsina, è ulteriormente scindibile in laboratorio in una porzione detta meromiosina pesante e in un'altra porzione detta meromiosina leggera. La meromiosina leggera è la porzione priva di attività ATPasica e che comprende gran parte della coda. La meromiosina pesante invece è la porzione dotata di attività ATPasica e della capacità di legare l'actina, e che comprende la testa e una porzione iniziale della coda. La meromiosina pesante poi è a sua volta scindibile in altri frammenti ancora più piccoli che chiamiamo S1 ed S2. S1 comprende le teste globose e le catene leggere e conserva ancora tutta l'attività ATPasica e legante actina, mentre S2 comprende la porzione iniziale della coda. Al confine tra tutti questi frammenti sono presenti dei punti detti cardini, estremamente flessibili. Al confine tra la meromiosina pesante e la meromiosina leggera e al confine tra il frammento S1 e quello S2, ci sono delle porzioni della proteina che non sono ad a elica ben resistenti, ma che sono rettilinei e quindi molto flessibili. Proprio a livello di questi punti è consentito il ripiegamento della molecola di miosina per favorire lo scorrimento del filamento di actina. Perché vedremo che per far avvenire la contrazione e quindi lo scivolamento dei filamenti di actina su quelli di miosina, la molecola di miosina deve piegarsi e si piegherà propria livello dei punti cardini.
6

Come si associano le molecole di miosina tra di loro per costituire un miofilamento spesso?Le varie molecole di miosina sono disposte tutte parallelamente tra loro e orientate longitudinalmente lungo l'asse del mio filamento. Sono tutte disposte un po' sfasate fra loro, però sempre con la porzione della coda rivolta verso il centro del filamento e la porzione della testa rivolta verso una delle due estremità del filamento stesso. Le teste delle molecole di miosina costituiscono quelle proiezioni trasversali che connettono i filamenti spessi ai filamenti sottili, mentre il segmento che abbiamo detto essere liscio (regione pseudo H) al centro del miofilamento spesso, è quella porzione costituita semplicemente dalle code che si affrontano, dove ancora non sono presenti le testa. In realtà le due metà del filamento spesso hanno una polarità opposta, perché se tutte le code guardano verso il centro e tutte le teste verso le estremità, evidentemente le molecole di metà del filamento guarderanno verso una estremità e le molecole di miosina dell'altra metà del filamento guarderanno verso l'estremità opposta. Le due metà di ogni filamento di miosina mostrano polarità opposta. Le teste che costituiscono i ponti trasversali che legano l'actina, sono disposte a intervalli di 14,3 nm l'uno dall'altro e si succedono lungo il filamento con un andamento elicoidale. Ogni giro completo comprende sei ponti trasversali e si ripete a intervalli di 43 nm lungo il filamento e prende il nome di periodo del filamento spesso.Sebbene le miofibrille siano costituite principalmente da filamenti di miosina e di actina, queste proteine presentano molte altre proteine associate che le aiutano a mantenersi allineate e a mantenere la struttura del sarcomero e quindi anche a svolgere la contrazione. Una delle proteine associate ai filamenti di miosina è una molecola detta titina che si estende dalla linea Z sino al centro del sarcomero a livello della linea M e che si continua con una molecola di titina che viene dal lato opposto, formando una sorta di linea continua. E' una molecola molto elastica che si può svolgere o ripiegare a molla a seconda dello stato funzionale della fibra, che sia rilassata o contratta, perché è una proteina accessoria che serve a mantenere i miofilamenti spessi al centro del sarcomero in posizione. I miofilamenti spessi sono ancorati al livello della linea M mentre i filamenti di actina si ancorano a livello della linea Z. Il significato funzionale della linea M è proprio di fornire una superficie di ancoraggio per i mio filamenti spessi, preservandone allineamento e orientamento. La linea M è costituita da diverse proteine: la proteina M, che però non è sempre presente, mentre altre proteine dette miomesina e CPK che sono proteine ubiquitarie. Sono associati ai filamenti spessi anche altre proteine come la proteina C, che si lega alla titina e la proteina H che ha una funzione analoga a quella della proteina C.
Riepilogando: i miofilamenti spessi sono costituiti da miosina, sono spessi 15 nm e lunghi 1,5 mm. La miosina è una proteina filamentosa con due teste e una corda. I miofilamenti presentano le code rivolte verso il centro e le teste verso l'estremità, con polarità opposta.
MIOFILAMENTI SOTTILI I miofilamenti sottili sono così detti perché hanno un diametro di circa 5-6 nm contro i 15 dei miofilamenti spessi e hanno una lunghezza di circa 1 mm. Li ritroviamo soprattutto a livello della banda I. In particolar modo ogni miofilamento sottile parte dalla linea Z a cui è ancorato tramite alcune proteine associate e si dirige verso il centro del sarcomero approfondandosi nella banda A. In particolar modo si dispongono occupando gli intervalli tra i miofilamenti spessi, disponendosi ad esagono attorno ciascun miofilamento spesso. In base a quanto i miofilamenti sottili si addentrano nella banda A, sarà determinato lo spessore della banda H. Basti pensare che al massimo grado di contrazione, quando i miofilamenti sottili sono tutti approfondati a livello della banda A, la banda H finisce con lo scomparire.
7

I miofilamenti sottili sono costituiti principalmente da filamenti di actina e poi da due proteine associate secondo dei precisi rapporti che sono la tropomiosina e la troponina. I filamenti di actina sono dei filamenti sottili costituiti da una proteina globulare che è la G actina. La G actina è il monomero proteico costitutivo dei miofilamenti sottili, ha un diametro di circa 5,5 nm. Ciascuno di questi monomeri si unisce ad altri, formando una sorta di catenella e poi due di queste catenelle (dette F actina) si avvolgono ad elica l'uno sull'altra con configurazione di elica destrorsa, formando il filamento sottile che ha un passo di circa 36 nm.
I filamenti sottili sono costituiti da due filamenti di F actina avvolti a elica e poi da troponina e tropomiosina. I filamenti di F actina sono costituiti da una subunità proteica globulare che è la G actina. Più molecole di G actina si uniscono a catenella, due catenelle si avvolgono fra di loro formano il filamento di actina vero proprio.
Una delle caratteristiche principali delle molecole di G actina è che queste molecole non sono simmetriche. Ognuna di queste proteine si comporta come se avesse un fronte rivolto verso la parte centrale del sarcomero e un retro orientato in direzione opposta. Tant'è che anche il filamento di actina stesso tende ad assumere una ben precisa polarità. Ogni filamento di actina infatti avrà un'estremità plus sfrangiata a spina detta barbed end (+) e un'estremità minus puntiforme detta pointed end (+). Poiché ogni molecola ha la sua polarità e ogni filamento ha la sua polarità, vedremo che l'estremità plus a spina sarà l'estremità del filamento di actina sempre rivolta verso la linea Z a cui ci ancora, mentre l'estremità minus detta a punta sarà sempre rivolta verso il centro del sarcomero. Ciò ci fa facilmente intuire che i filamenti di actina all'interno di un sarcomero hanno polarità opposta, (ad es: partono dalla linea Z di sinistra verso il centro e quindi verso destra, ma dall'altro lato partono dalla linea Z di destra verso il centro e quindi verso sinistra. Alla fine si affronteranno le due estremità minus a punta. Quindi mentre nei filamenti spessi è il singolo filamento di miosina ad avere le due metà con polarità opposta, in questo caso i filamenti di miosina che partono da due linee Z che delimitano lo stesso sarcomero hanno polarità opposta. Non solo a livello di due linee Z adiacenti i filamenti che da essa partono hanno polarità opposta: da una stessa linea Z partono dei filamenti diretti verso il centro di un sarcomero e altri filamenti diretti verso il centro del sarcomero adiacente. In ogni caso le estremità dei filamenti di actina sono sempre incappucciate: l'estremità plus è incappucciata dall' a actinina che è il principale costituente della linea Z, mentre l'estremità minus è incappucciata da un'altra proteina, la tropomodulina. Questo ci fa capire che questi filamenti di actina sono molto stabilizzati, a differenza di quelli citoscheletrici che sono delle strutture altamente dinamiche e instabili. Le altre due proteine principali che costituiscono i miofilamenti sottili sono la tropomiosina e la troponina. La tropomiosina è una proteina filamentosa, lunga circa 40 nm e costituita da due catene polipeptidiche a e b, avvolte fra di loro ad elica e che si dispongono in prossimità del solco determinato dalle due catenelle che si avvolgono nel filamento di actina. (La forma alfa prevale nei muscoli ricchi di fibre veloci, la forma beta nelle fibre di tipo lento).La troponina è una proteina globulare costituita da tre subunità: la troponina I (TNI), la troponina C(TNC) e la troponina T (TNT). La TNC ha una grande affinità per il calcio e svolge un ruolo importante nell'innesco della contrazione. La TNI va ad inibire il legame tra actina e miosina. Infine la TNT si lega alla tropomiosina. Ci sono dei precisi rapporti numerici tra queste tre proteine per cui possiamo dire che circa ogni sette subunità di G actina ci sarà una molecola di tropomiosina che si estende in lunghezza su tutti e sette i monomeri, e una molecola di troponina che è disposta a intervalli regolari lungo tutto il filamento di
8

actina ogni 40 nm. Quindi la troponina globulare la ritroviamo intervallata lungo il filamento, invece ogni molecola di tropomiosina ha una lunghezza tale da potersi estendere sui sette monomeri di actina. (I filamenti sottili del muscolo scheletrico sono lunghi 0,8-1 mm e contengono circa 300-400 molecole di G actina e 40-60 molecole di tropomiosina).
ALTRE MOLECOLE A LIVELLO DEL SARCOMERO La linea Z è una struttura di ancoraggio per i filamenti sottili di due sarcomeri adiacenti. A livello della linea Z ogni filamento sottile si collega all'estremità di quattro filamenti sottili appartenenti al sarcomero adiacente e delimitando così uno spazio quadrangolare tenuto assieme mediante molecole di a actinina. Questa molecola incappuccia l'estremità plus dei filamenti di actina e forma dei ponti trasversali tra i filamenti sottili ed è quindi responsabile della coesione tra i filamenti sottili di sarcomeri adiacenti proprio a livello della linea Z. L'alfa actinina connette questi filamenti a zig-zag trasversalmente. I filamenti sottili di due sarcomeri continui legati da ponti di alfa actinina hanno direzione opposta e sono antiparalleli: in questo modo potranno trasmettere e distribuire l'energia generata dalla contrazione. Un'altra proteina che troviamo al livello della linea Z è la connettina o titina, che è una fosfoproteina filamentosa molto grande circa 2800 KD ed è anche dotata di un alto grado di elasticità. In particolar modo parte dalla linea Z. ed è diretta verso la linea M. Le estremità N terminali della titina sono connesse a livello della linea Z tramite probabilmente i ponti dell'alfa actinina stessa, mentre l'estremità C terminale si ritrovano a livello della banda M e si connettono con estremità omologhe (C terminali) provenienti dal filamento di titina che proviene dal lato opposto. Quindi queste proteine di titina finiscono con l'unirsi tra di loro, venendo a formare una struttura filamentosa continua che passa da un sarcomero a quello successivo, con la funzione di preservare l'allineamento dei miofilamenti durante la contrazione. Un'altra proteina importante è la nebulina che si inserisce sempre a livello della linea Z, però poi decorre per tutta la banda I avvolgendosi a spirale attorno i miofilamenti sottili per tutta la loro lunghezza. Probabilmente svolge anch'essa un ruolo importante per l'allineamento dei filamenti sottili ma è probabile anche che serva a regolare la lunghezza dei filamenti sottili stessi. La titina e la nebulina le troviamo anche al livello delle bande I ed A. Nella banda I la titina si associa lateralmente ai filamenti sottili e qui presenta questa caratteristica struttura elastica che le consente di seguire lo scorrimento del filamento sottile durante la contrazione. Nella banda A la titina si lega alla coda della miosina per tutta la lunghezza del filamento spesso, legandosi anche ad altre proteine che si trovano nella banda M. Nella banda M, la titina è dotata di attività chinasica e si lega all'estremità della molecola di titina dell'emisarcomero opposto, tramite interazioni con la miomesina: il complesso titina, proteina C, miomesina forma un'impalcatura di sostegno che mantiene in registro i filamenti spessi.La nebulina si avvolge per tutta la lunghezza attorno al filamento sottile svolgendo un ruolo di supporto molecolare.
Altre proteine localizzate all'esterno della linea Z sono rappresentate soprattutto da molecole di desmina. La desmina è una proteina abbastanza grossa 55 KD, che appartiene alla famiglia dei FI. Questi filamenti di desmina avvolgono le miofibrille a livello della linea Z e congiungono le linee Z di fibrille adiacenti. Sono connessi alle miofibrille tramite un'altra proteina, la plectina, e si associano anche a all'alfa B cristallina, che è una heat shock protein che la protegge da alcuni stress meccanici. Complessivamente filamenti di desmina, la plectina e l'alfa B cristallina vengono a creare una struttura che svolge la funzione di mantenere in registro le miofibrille adiacenti tra loro, collegandole in maniera
9

tale da avere le linee Z allineate e da trasmettere l'accorciamento delle miofibrille al sarcolemma così da trasmettere la contrazione all'intera cellula e in seguito al muscolo, e formano in questo modo un reticolato molecolare che mantiene in registro le linee Z adiacenti, trasmettendo la forza generata dalla contrazione. Infine un'altra proteina molto importante è la distrofina che è una proteina ad alto peso molecolare 427 KD, di forma allungata che si trova in prossimità della faccia citoplasmatica del sarcolemma e che si lega all'actina citoscheletrica e a dei complessi glicoproteici di membrana, formando un complesso costituito da varie proteine transmembrana e proteine associate alla superficie della membrana stessa, un complesso che viene a formare una struttura ponte che unisce le molecole della matrice extracellulare e della membrana con l'actina citoscheletrica. La distrofina insieme alle altre molecole che si legano ad essa, viene a formare un reticolato molecolare detto costamero che lega l'apparato contrattile sarcomerico al sarcolemma, quindi svolge sempre un ruolo di trasmissione della contrazione dalle miofibrille a livello del sarcolemma e fa da tramite tra le miofibrille, il citoscheletro, la membrana e la matrice extracellulare. Infatti mutazioni del gene per la distrofina che si hanno in alcune sindromi, come la distrofia muscolare di Duchenne, sono caratterizzate da una progressiva distruzione dei tessuti muscolari. Ricapitolando le proteine importanti sono: titina e nebulina. La titina è associata ai miofilamenti spessi e la nebulina ai miofilamenti sottili ed entrambi servono a mantenerli in registro e a fare da supporto molecolare. E' importante l'alfa actinina che collega fra di loro diversi filamenti sottili e che è la principale costituente delle linee Z; poi la desmina che insieme alla plectina e alla alfa B cristallina costituisce dei filamenti che legano le miofibrille parallele tra di loro, in maniera da allineare le diverse linee Z tra loro. Infine la distrofina che forma questa struttura detta costamero, che permette di mediare tra miofibrille, citoscheletro, sarcolemma e matrice extracellulare.
RETICOLO SARCOPLASMATICO Il reticolo sarcoplasmatico è formato da un sistema continuo di tubuli e cisterne delimitati da membrana che compongono una rete attorno a ciascuna miofibrilla e avvolgono ciascuna di queste miofibrille assumendo dei rapporti precisi con le diverse bande del sarcomero. I tubuli longitudinali del reticolo sarcoplasmatico sono disposti parallelamente fra loro, orientati lungo l'asse maggiore della miofibrilla e finiscono con il confluire in cisterne reticolate dette Cisterne fenestrate Centrali che si trovano in corrispondenza della banda H e sono posizionate trasversalmente. Mentre i tubuli decorrono longitudinalmente e paralleli fra loro, queste cisterne fenestrate sono disposte trasversalmente a livello della banda H. I tubuli longitudinali confluiscono anche a livello delle cosiddette Cisterne Terminali che sono disposte sempre trasversalmente però al confine tra la banda A e I. Proprio tra le due cisterne terminali a livello del confine tra la banda A e I si interpone un elemento tubulare anch'esso trasversale e più sottile, diverso dal reticolo sarcoplasmatico, che è il cosiddetto tubolo T. I tubuli T sono delle introflessioni del sarcolemma che si spingono all'interno del sarcoplasma, lo attraversano e si continuano con il sarcolemma dal lato opposto e decorrono attorno le miofibrille sempre a livello della zona di confine tra la banda A e I, sulle miofibrille tutte adiacenti disposte in registro e quindi allineate fra loro. Ogni tubulo U passa per il centro delle cisterne terminali, costituendo una struttura detta triade sarcoplasmatica proprio perché formata da due cisterne terminali e da un tubulo T. Quindi ci sono due triadi per ogni sarcomero perché ci sono due regioni di confine A-I in ognuna delle quali ci sono le cisterne terminali che sono sempre attraversato dal tubulo T. I tubuli T sono strutture diverse da reticolo sarcoplasmatico perché sono introflessioni della membrana plasmatica e infatti il lume dei tubuli T non si continua con le cavità delle cisterne terminali, anzi le due membrane sono separate da uno spazio di qualche nm (10-15 nm). In questo spazio sporge una serie di proteine dette piedi, annesse
10

alla membrane delle cisterne come canali per il calcio, recettori, che permettono di mettere in comunicazione le membrane dei due sistemi.Quindi il tubulo T è una sottilissima introflessione del sarcolemma che attraversa tutto il citoplasma della cellula da parte a parte, è in comunicazione diretta con l'ambiente extracellulare e questo rapporto con l'ambiente extracellulare è importante per permettere una rapida diffusione del segnale nervoso all'interno della fibra. Il tubulo T attraversa le cisterne terminali senza prendere contatto diretto col loro, ma sono separati da un sottile spazio di qualche nm; questo spazio è attraversato ad intervalli periodici da ponti o piedi che congiungono le membrane dei due sistemi per permettere la loro comunicazione.
Le funzioni del reticolo sarcoplasmatico sono regolate dalle sue stesse proteine di membrana. Le proteine di membrana le possono essere intrinseche ed estrinseche. Tra le proteine intrinseche, troviamo una pompa ATP-asi dipendente da calcio e magnesio che permette di accumulare calcio all'interno delle cisterne in condizioni di riposo. Un'altra classe di proteine intrinseche sono i recettori rianodinici che sono delle proteine che permettono il rilascio di calcio quando arriva l'impulso nervoso. Questi recettori sono localizzati a livello delle cisterne terminali del reticolo sarcoplasmatico. Si tratta di un omotetramero. A livello ultrastrutturale, al M.E. , questi recettori rianodinici creano delle aree dense agli elettroni, allineate in file parallele e parallele all'asse del tubulo T, chiamate piedi giunzionali. A livello della membrana dei tubuli T ci sono altre proteine che svolgono un ruolo di recettori e che si trovano in corrispondenza delle subunità dei recettori rianodinici: sono i recettori diidropiridinici voltaggio dipendenti che hanno il compito di attivare il recettore rianodinico e di provocare il rilascio del calcio quando si ha una variazione del potenziale di membrana, in seguito allo stimolo nervoso. Sempre nel reticolo sarcoplasmatico ci sono alcune proteine estrinseche tra cui la calsequestrina e un'altra proteina ad alta affinità per il calcio, che hanno il ruolo di trattenere dentro le cavità del reticolo il calcio prelevato dal sarcoplasma ad opera di pompe per il calcio.
CONTRAZIONE MUSCOLARE A livello microscopico la contrazione muscolare è dovuta allo scivolamento dei filamenti sottili di actina sui filamenti spessi di miosina. Questo scivolamento provoca un accorciamento del sarcomero e delle miofibrille, questo conduce a un accorciamento dell'intera fibra muscolare e di conseguenza a un accorciamento del muscolo, che è poi quello che noi vediamo a livello macroscopico quando avviene la contrazione. Durante la contrazione quindi si ha una modificazione strutturale del sarcomero senza, che si vada modificare la lunghezza dei singoli filamenti. L'ampiezza della banda A rimane costante, l'ampiezza delle semibande I diminuisce e la banda H arriva a scomparire del tutto. Quindi complessivamente il sarcomero si riduce di lunghezza perché c'è un avvicinamento tra le due linee Z adiacenti. La contrazione di un muscolo scheletrico è controllata dal SNC e l'impulso nervoso che determina la contrazione è condotto da un neurone motorio. Ogni fibra muscolare si contrae e si accorcia in risposta un impulso nervoso che giunge tramite l'assone di una fibra nervosa motoria. La membrana plasmatica della fibra muscolare è, come tutte le membrane cellulari, una membrana elettricamente polarizzata con un interno negativo e un esterno positivo. Se questa membrana polarizzata viene eccitata da uno stimolo appropriato sino a polarizzarsi, inverte il suo potenziale di riposo e origina un potenziale d'azione che innesca la contrazione muscolare vera e propria. La zona di contatto fra la fibra nervosa e la fibra muscolare attraverso cui questo impulso nervoso passa da un tipo cellulare all'altro, prende il nome di giunzione neuromuscolare o placca motrice.
11

I muscoli sono innervati, quindi sono raggiunti dai nervi. I nervi sono fasci di neuroni. Quando parliamo di muscoli scheletrici, i nervi sono fatti da motoneuroni. Questi nervi penetrano nel muscolo attraverso l'epimisio, a livello del perimisio cominciano a suddividersi nei vari e singoli assoni e pian piano che si avvicinano alla membrana della singola fibra muscolare, gli assoni si ramificano ulteriormente formando un'arborizzazione terminale in prossimità del sarcolemma della fibra muscolare, costituendo la placca motrice. Quando l'assone si ramifica e con la sua terminazione raggiunge la singola cellula muscolare, la terminazione assonica si espande assumendo un aspetto simile al bottone sinapsi. Quindi si genererà nella terminazione assonica una struttura in cui sono assenti i neurotubuli e i MF ma che è invece ricca di mitocondri e soprattutto di vescicole dello spessore di circa 40-60 nm, dette vescicole sinaptiche, che sono le vescicole che contengono il neurotrasmettitore. Queste terminazioni assoniche prendono contatto con la fibra muscolare a ridosso di siti specifici che, al M.O. appaiono come dei piccoli rilievi sulla superficie della fibra. Questi rilievi sulla superficie della fibra sono zone che contengono un citoplasma addensato con numerosi granuli e con un accumulo di nuclei che determinano questa sporgenza al di sopra del fascio di miofibrille. Questa regione specializzata è detta suola terminale e i nuclei della fibra muscolare che sono localizzati a livello della suola terminale sono detti nuclei della suola. Quando la terminazione assonica prende contatto con la fibra muscolare a livello del suola assonica, l'assone perde il suo rivestimento della guaina mielinica, che altrimenti lo isolerebbe impedendo la trasmissione del segnale elettrico, e la terminazione assonica si va a inserire all'interno di piccole invaginazioni della fibra muscolare, dette fessure sinaptiche primarie. All'interno delle fessure sinaptiche primarie, l'assolemma e il sarcolemma non sono a diretto contatto ma sono separati da un sottile interstizio di circa 20-50 nm, quindi non si può parlare di continuità tra i due elementi cellulari, ma piuttosto di contiguità. Inoltre il sarcolemma che riveste la fessura sinaptica primaria presenta numerose pieghe che prendono il nome di fessure sinaptiche secondarie che hanno il compito di aumentare la superficie del sarcolemma che espone i recettori specifici per l'acetilcolina. Quando la terminazione assonica si inserisce a livello della fessura sinaptica primaria, avviene la fusione tra la membrana basale della cellula nervosa e la membrana basale della cellula muscolare. Infatti ricordiamo sempre che la terminazione assonica che raggiunge la fibra muscolare è già priva della sua guaina mielinica isolante, però mantiene questa membrana basale. Le membrane basali si fondono e nell'interstizio tra le due cellule ritroviamo questo materiale glicoproteico che è il costituente delle membrane basali.
La placca motrice quindi è costituita da tre elementi: la assolemma che è l'equivalente dell'elemento presinaptico, il sarcolemma che è l'equivalente dell'elemento postsinaptico e questo sottile interstizio compreso tra le due cellule di 20-50 nm che è l'equivalente dello spazio intersinaptico e che contiene soltanto il materiale glicoproteico derivato dalla fusione delle due membrane basali.
La contrazione si origina a livello del SNC: il messaggio parte dal SNC e l'impulso nervoso si propaga come un impulso elettrico lungo la membrana dell'assone sotto forma di potenziale d'azione. Quando parliamo di potenziale d'azione intendiamo una rapidissima inversione nella polarità elettrica della membrana plasmatica dei neuroni, per cui i neuroni nel giro di pochissimi millisecondi, passeranno da un potenziale a riposo di -70 mV a un potenziale d'azione di +30 mV. Questo potenziale d'azione (inversione nella polarità elettrica della membrana) si propagherà lungo tutto l'assone sino a raggiungere la terminazione assonica che prende contatto con la fibra muscolare a livello della placca motrice. Quando il potenziale d'azione raggiunge la terminazione assonica, avviene l'esocitosi delle vescicole sinaptiche. Queste vescicole si avvicinano al versante interno dell'assolemma, si fondono con esso e rilasciano nell'ambiente extracellulare il neurotrasmettitore, che nel caso della placca motoria è l'acetilcolina.
12

L'acetilcolina attraversa per diffusione il sottile interstizio che vi è fra il neurone e la fibra muscolare e raggiunge i recettori specifici che si trovano sulla superficie del sarcolemma. Questi recettori specifici sono dei canali ionici per il sodio. Quando avviene il legame acetilcolina-recettore si attivano questi canali che generano dei flussi ionici in ingresso e in uscita dalla cellula. Questi flussi ionici permettono l'insorgenza del potenziale d'azione. La membrana plasmatica della fibra muscolare è una membrana polarizzata, col versante citoplasmatico carico negativamente e il versante extracellulare carico positivamente. Se si aprono dei canali che fanno entrare ioni sodio si avrà l'inversione del potenziale di membrana che passa da un potenziale negativo a un potenziale positivo e si raggiunge il potenziale d'azione. Tramite il rilascio di acetilcolina, il potenziale d'azione è stato trasmesso dalla cellula nervosa alla fibra muscolare. Questo potenziale d'azione si propaga per tutta la membrana della fibra muscolare e di conseguenza raggiunge anche i tubuli T (che sono introflessioni della membrana stessa). Quando il potenziale d'azione raggiunge i tubuli T, si vengono ad attivare i recettori diidropiridinici che sono delle proteine voltaggio dipendenti (questo cambiamento nel voltaggio genera, cioè, l'attivazione del recettore). Questi recettori hanno il compito, una volta attivati, di attivare a loro volta i recettori rianodinici che si trovano sulle cisterne terminali del reticolo sarcoplasmatico. Una volta che sono stati attivati i recettori rianodinici, che sono dei canali per il rilascio del calcio, la loro attivazione permette la fuoriuscita del calcio immagazzinato all'interno del reticolo sarcoplasmatico e questo calcio finisce all'interno del sarcoplasma. Qui il calcio si va a allegare alla troponina C inducendo un cambiamento conformazionale nel complesso troponina-tropomiosina, che è legato ai filamenti di actina. Questo cambiamento conformazionale fa sì che questo complesso si sposti, sempre rimanendo attaccato ai filamenti di actina, ma in maniera tale da lasciare liberi i siti di legame per la miosina a livello dei filamenti di actina. In questo modo la miosina si può legare all'actina e innescare quei meccanismi che provocano la contrazione che vedremo in seguito e che portano a uno scivolamento dei filamenti sottili sui filamenti spessi.
Come finisce la contrazione muscolare?La contrazione muscolare finisce con tre modalità: a un certo punto la membrana plasmatica della fibra nervosa esaurisce il suo potenziale d'azione e ritorna al potenziale elettrico di riposo e non viene più rilasciata acetilcolina; nel mentre anche il calcio che era stato liberato nel sarcoplasma viene sequestrato nuovamente da reticolo sarcoplasmatico grazie all'opera di alcune pompe ATP dipendenti per il calcio che si trovano al livello delle cisterne terminali e nel momento in cui viene sequestrato il calcio e non si può legare alla troponina e si vanno bloccare i siti di legame della miosina sull'actina; inoltre l'acetilcolina che era stata liberata dal neurone e che ancora magari si trova al livello di quello spazio intesinaptico tra le due cellule viene degradata dall'attività enzimatica dell'acetilcolinesterasi.N.B. Pochi millisecondi (ms) per la contrazione, circa 30 ms per il ritorno allo stato di riposo.Inoltre possiamo notare che la contrazione dipende da due processi che consumano ATP: lo scivolamento dei filamenti e il pompaggio di calcio dentro il reticolo sarcoplasmatico.
I MECCANISMI DELLA CONTRAZIONE Abbiamo detto che normalmente il complesso troponina-tropomiosina va a bloccare i siti di legame per la miosina che sono presenti sui filamenti di actina: il muscolo è rilasciato e il sarcomero è a riposo. A un certo punto arriva l'impulso nervoso che attraverso una serie di meccanismi a cascata fa sì che il calcio si leghi alla troponina C, questo legame fa subire un cambiamento conformazionale al complesso troponina-tropomiosina, il complesso si sposta e rimangono liberi i siti di legame per la miosina. La testa della miosina può ora legarsi all'actina e comincia un ciclo che si ripete numerose volte per
13

ognuna delle teste del filamento spesso di miosina e il risultato di questi cicli sarà che si avrà lo scorrimento verso il centro il sarcomero dei filamenti sottili su quelli spessi, quindi si avrà un accorciamento del sarcomero e la contrazione. Ora vediamo cosa succede durante questo ciclo. All'inizio del ciclo la miosina si è appena legata saldamente al filamento di actina con un'inclinazione di circa 45° e la testa di miosina è priva di ATP e quindi a riposo. A un certo punto l'ATP si lega a un sito particolare della testa di miosina e ciò le fa provocare un cambiamento conformazionale tale per cui perde affinità per l'actina e si stacca dal filamento. Una volta che la testa della miosina si è staccata dal filamento, l'ATP che vi si era legato, si scinde in ADP e P però i prodotti dell'idrolisi non vengono rilasciati. (Questa reazione avviene anche in assenza di calcio e in effetti nel muscolo in condizioni normali, quasi tutte le molecole di miosina possiedono una molecola di ADP legata alla propria testa).Questa idrolisi è sufficiente a provocare un altro cambiamento conformazionale nella testa della miosina che quindi subisce un'inclinazione spostandosi da 45° a 90°. Dopo che la testa della miosina si è piegata 90° rilascia il P e ciò le fa subire un altro cambiamento conformazionale tale per cui la testa della miosina riacquista affinità per l'actina e vi si lega. Questa volta però vi si lega con un'inclinazione di 90°. (Questa seconda fase si verifica quando giunge nella fibra un impulso nervoso e si libera calcio che si lega alla TNC inducendo la liberazione dei siti di legame per la miosina sui filamenti di actina).Una volta che la testa della miosina si è riattaccata all'actina viene rilasciato anche l'ADP e subisce un altro cambiamento conformazionale che la fa tornare alla sua conformazione originaria e passa da un'inclinazione di 90° un'inclinazione di 45°. In questo modo viene dato il cosiddetto colpo di remo o colpo di potenza che fa si che la miosina si trascini dietro il filamento di actina e lo faccia scivolare. Si ritorna quindi all'inizio del ciclo a quello che viene detto complesso rigor perché dopo la morte quando scompare l'ATP non si può avere più la dissociazione del complesso acto-miosinico e quindi si ha il rigor mortis. La tappa finale del ciclo, cioè il distacco della miosina dall'actina, si ha quando una nuova molecola di ATP si lega alla miosina e si torna alla prima tappa del ciclo.Ricordiamo che le teste di miosina che troviamo nella banda A, si flettono in direzioni opposte alle due estremità perché ogni metà del filamento di miosina ha una polarità opposta rispetto l'altra metà e che anche i filamenti di actina stessi, che si trovano nelle due semibande I, hanno polarità opposta e questo fa si che si abbia uno scorrimento complessivo verso il centro del sarcomero stesso. Ciascuna testa di miosina agisce ciclicamente, tutte le teste agiscono sui filamenti di actina e un singolo ciclo di attacco-flessione-distacco determina un movimento relativo dei due filamenti di circa 10 nm.
Ricapitolando: nel momento in cui il calcio si lega alla troponina, il complesso troponina-tropomiosina si sposta, si espongono i siti di legame, la miosina si lega e interagendo con l'ATP subirà dei cambiamenti conformazionali della sua testa tali per cui passerà prima da un'inclinazione di 45° a una di 90° e poi viceversa, provocando lo scorrimento di pochi nm ma che comunque sono sufficienti (se consideriamo che lavorano tutte le teste insieme) a provocare l'accorciamento del sarcomero.
UNITÀ MOTORIA L'unità motoria è l'unità funzionale del muscolo che è formata da un motoneurone (dal suo assone e da tutte le sue terminazioni) e da tutte quelle fibre muscolari striate che le sue terminazioni riescono a innervare, inducendone una contrazione simultanea. Ricordiamo che ogni motoneurone può innervare più fibre muscolari, ma una fibra muscolare può essere innervata da una delle terminazioni di un motoneurone soltanto. Il numero delle fibre muscolari presenti in una unità motoria è inversamente proporzionale alla discriminazione dei movimenti: muscoli che devono compiere movimenti più fini e
14

precisi, come ad esempio i muscoli dell'occhio, conterranno poche fibre muscolari per ciascuna unità motoria, viceversa muscoli che devono compiere movimenti meno precisi potranno contenere un maggior numero di fibre muscolari per unità motoria. Le fibre nervose esercitano anche un'azione trofica nei confronti delle cellule muscolari che innervano, tant'è che una lesione del nervo motore può determinare ipotrofia del muscolo che andava di innervare.
ETEROGENEITÀ DELLE FIBRE MUSCOLARI SCHELETRICHE Un singolo muscolo può essere costituito da più tipi di fibre. Da un punto di vista funzionale possiamo distinguere: fibre veloci e fibre lente (poi realtà c'è un tipo di fibra intermedia tra le due). Le fibre veloci sono quelle fibre che danno una contrazione massima, intensa e molto rapida ma di breve durata e sono suscettibili alla fatica. Le fibre lente o fibre toniche danno una contrazione prolungata nel tempo, meno intensa però sono molto più resistenti alla fatica. Da un punto di vista metabolico le due tipologie di fibra differiscono per il meccanismo di produzione dell'ATP che viene utilizzato durante la contrazione. In particolar modo le fibre lente, cioè quelle più resistenti alla fatica, sono caratterizzate da un metabolismo di tipo ossidativo, cioè producono ATP attraverso la fosforilazione ossidativa mitocondriale, motivo per cui sono caratterizzate da un numero elevatissimo di mitocondri e anche da un elevato contenuto di mioglobina che è una proteina respiratoria di colore rosso che da il colore caratteristico alle fibre lente che sono anche dette per questo motivo fibre rosse (anche perché sono fibre riccamente vascolarizzate, cosa che accentua ancora di più questo colorito rosso). Perché hanno questo elevato contenuto di mioglobina? Perché la mioglobina immagazzina ossigeno che poi viene rilasciato durante la contrazione muscolare per produrre. Quindi queste fibre sono lente, sono toni che, sono resistenti alla fatica e producono ATP con fosforilazione ossidativa nei mitocondri sfruttando la respirazione cellulare, ecco perché queste cellule hanno un'attività respiratoria cellulare molto più elevata delle fibre veloci. Le fibre veloci invece hanno un metabolismo di tipo glicolitico e producono ATP essenzialmente mediante glicolisi anaerobica che è un processo che da ATP più istantaneamente (mentre la fosforilazione ossidativa è un processo più lento però alla fine è un processo molto più efficiente che permette alle fibre lente di resistere a lungo). La glicolisi anaerobica da ATP immediatamente, da qui deriva infatti l'intensità della contrazione iniziale, però è un processo poco efficiente che a lungo andare non dura e si vengono ad accumulare dei metaboliti come l'acido lattico che sono responsabili del senso di affaticamento, perché quando si accumula acido lattico si ha un abbassamento del pH nelle cellule e cessa la capacità del muscolo di contrarsi ulteriormente oppure il muscolo va incontro a contrazioni spasmodiche e si hanno i cosiddetti crampi muscolari. Proprio per il fatto che non sfruttano molto la fosforilazione ossidativa, queste fibre sono caratterizzate da un numero minore di mitocondri, da una minore attività respiratoria cellulare, da un minore quantitativo di mioglobina ed ecco perché sono dette fibre bianche. Invece presentano numerosi depositi di glicogeno che serve da riserva energetica istantanea. Quindi queste due tipologie di fibre differiscono da un punto di vista funzionale: un tipo è lento e un tipo veloce. Differiscono da un punto di vista metabolico: le fibre lente producono ATP per fosforilazione ossidativa mitocondriale mentre le fibre veloci producono ATP per glicolisi anaerobia. Tutte queste differenze funzionali metaboliche si traducono anche in differenze morfologiche delle cellule: le fibre rosse contengono mioglobina, sono riccamente vascolarizzate, contengono numerosi mitocondri che sono concentrati soprattutto al di sotto del sarcolemma o tra le miofibrille (in particolar modo a livello della linea Z e della banda I); il reticolo sarcoplasmatico è ben sviluppato e le linee Z sono molto spesse proprio per il maggior numero di legami crociati tra titina, alfa actinina e filamenti sottili.
15

Nelle fibre bianche invece il numero dei mitocondri è minore si trovano sempre sotto il sarcolemma ma soprattutto a livello del disco I; è molto scarsa la mioglobina; la linea Z è più sottile e il reticolo sarcoplasmatico meno sviluppato, mentre sono molto abbondanti depositi di glicogeno. Probabilmente la differenza nella velocità di contrazione dei due tipi di fibre dipende anche da differenze nell'attività ATPasica del complesso acto-miosina ed è quindi dovuto alla presenza di isoforme diverse di miosina nei due diversi tipi di fibra.Le fibre bianche le ritroviamo nei muscoli responsabili di movimenti rapidi, mentre le fibre rosse le ritroviamo prevalentemente nei muscoli responsabili del mantenimento della postura.N.B. solitamente le fibre rosse sono più piccole delle bianche.
TESSUTO MUSCOLARE STRIATO CARDIACO Il tessuto muscolare striato cardiaco o miocardio è il tessuto che costituisce la tonaca muscolare del cuore. È un tessuto che deriva dal mesoderma e che sebbene sia striato, presenta numerose differenze con il tessuto muscolare striato scheletrico. Senza dubbio una delle prime differenze è che l'attività contrattile del tessuto muscolare cardiaco non è controllata dalla volontà, così come nello scheletrico, ma è un'attività del tutto autonoma. Ciò significa che l'impulso per la contrazione del cuore non parte dal SNC, ma insorge spontaneamente, ritmicamente ad autonomamente a livello di alcune cellule del tessuto muscolare cardiaco stesso, in particolar modo in alcune cellule altamente specializzate che vanno a costituire il tessuto di conduzione del cuore o miocardio specifico. Da queste cellule altamente specializzate, che sono le cellule del nodo seno atriale, l'impulso si propagherà alle altre cellule muscolari cardiache. Il fatto che l'impulso alla contrazione sia autonomo, spontaneo e si generi nelle cellule muscolari stesse, non significa che il tessuto cardiaco non sia riccamente innervato,anzi. Il miocardio però a differenza del tessuto muscolare scheletrico, è innervato dal sistema nervoso autonomo, nella fattispecie dal sistema nervoso autonomo simpatico, il cui ruolo non è quello di andare a provocare l'insorgenza della contrazione. L'innervazione non è necessaria per iniziare il battito cardiaco: il suo compito è quello di andarne a regolare e a modificare la frequenza. Cioè la regolazione da parte del sistema nervoso autonomo serve solamente a regolare la frequenza del battito cardiaco: nella fattispecie la stimolazione da parte del sistema nervoso parasimpatico andrà a rallentare il battito cardiaco, una stimolazione da parte del sistema nervoso ortosimpatico andrà ad accelerare il battito cardiaco.
La differenza con il tessuto muscolare scheletrico non è semplicemente una differenza funzionale riguardo ai meccanismi che inducono la contrazione ma è proprio una differenza morfologica. Intanto è vero che entrambi i tessuti sono striati, quindi ciò significa che hanno qualcosa in comune: presentano entrambi questa caratteristica bandeggiatura e questo sta a significare che in entrambi tessuti i filamenti contrattili, i miofilamenti, sono disposti in maniera ordinata e regolare così da formare la struttura del sarcomero. Abbiamo la presenza del sarcomero, abbiamo la presenza degli stessi miofilamenti (sebbene presentino isoforme differenti), però i miofilamenti non si organizzano a formare le miofibrille. Mentre nelle fibre muscolari striate scheletriche abbiamo le unità miofibrillari nettamente distinte a forma di filamento allungato e ognuna di loro è avvolta dal reticolo sarcoplasmatico, nel miocardio tutto questo non c'è. Ci sono i miofilamenti ma si dispongono a formare quasi una massa unica, interrotta qua e là da setti di reticolo sarcoplasmatico. Non abbiamo presenza di miofibrille vere e proprie. Un'altra differenza forse ancora più importante che salta subito all'occhio, è il fatto che il tessuto muscolare cardiaco è formato da cellule, i cardiomiociti, che non sono sincizi polinucleati, cioè non sono cellule che derivano dalla fusione di cellule progenitrici ma sono delle cellule mononucleate.
16

Anch'esse dopo i primi anni di vita perdono la capacità rigenerativa e diventano cellule perenni così come le fibre muscolari scheletriche (sono cellule i cui nuclei hanno perso la capacità di dividersi e sono entrati in una fase postmitotica permanente) però sono cellule mononucleate. Inoltre il nucleo è situato in posizione centrale (altra differenza), sono cellule di dimensioni notevoli ma comunque sempre inferiori alle dimensioni delle fibre muscolari. Un'altra particolarità la possiamo osservare all'estremità di ciascuna cellula: queste cellule allungate presentano all'estremità delle ramificazioni, delle biforcazioni, per cui le zone di contatto tra le cellule adiacenti sono delle zone in cui la membrana è interdigitata e si viene a creare un dispositivo di connessione che prende il nome di stria intercalare o disco intercalare. Questa è una regione intensamente colorata nei preparati istologici allestiti con coloranti basici e si vede proprio che è una porzione in cui le membrane sono interdigitate fra loro formando una struttura a zig-zag: tutto ciò serve ad aumentare la superficie di contatto e quindi la coesione. La presenza di numerose giunzioni (gap junctions) è funzionale a una trasmissione più celere ed efficiente dell'impulso nervoso da cellula a cellula.
Ricapitolando le differenze col tessuto scheletrico: qui l'impulso alla contrazione insorge autonomamente a livello delle cellule muscolari cardiache stesse, non è controllato dal sistema nervoso centrale ma dal sistema nervoso autonomo simpatico che regola soltanto la frequenza cardiaca, i cardiomiociti sono cellule mononucleate con il nucleo di posizione centrale, sono connesse tramite i dischi intercalari e non c'è presenza di miofibrille. Il citoplasma è più abbondante e i mitocondri più numerosi. Il miocardio si distingue in miocardio comune e miocardio specifico. Il miocardio comune è il tessuto muscolare che costituisce le pareti degli atri e dei ventricoli del cuore ed ha quindi la classica funzione contrattile; il miocardio specifico è il tessuto che va a costituire il tessuto di conduzione del cuore, cioè quel tessuto in cui si origina l'impulso contrattile e da qui viene trasmesso all'intera cellula. Come distinguiamo il miocardio comune e specifico dobbiamo anche distinguere in cardiomiociti comuni e cardiomiociti specifici del sistema di conduzione. I primi saranno classiche cellule muscolari con funzione contrattile, i secondi saranno cellule altamente specializzate nel generare e condurre l'impulso contrattile alle cellule adiacenti.
MIOCARDIO COMUNE E CARDIOMIOCITI COMUNI Il miocardio comune è il tessuto muscolare che costituisce le pareti degli atri e dei ventricoli del cuore. È costituito da cellule che prendono il nome di cardiomiociti comuni, che hanno la classica funziona contrattile e che distinguiamo dai cardiomiociti specifici del tessuto di conduzione. I cardiomiociti comuni sono cellule mononucleate, quindi non sono sincizi, con un nucleo di forma ovale posizionato centralmente nella cellula ecosì come le fibre muscolari sono cellule perenni, cioè già dopo i primi anni di vita i cardiomiociti perdono la capacità rigenerativa e i loro nuclei non sono più capaci di entrare in mitosi, ma si trovano in una fase post mitotica permanente del ciclo. Sono cellule di forma allungata, cilindrica con dimensioni variabili dai 40 ai 100 mm di lunghezza e 15-20 mm di diametro: dimensioni notevoli ma solitamente inferiori a quelle delle fibre muscolari scheletriche che talvolta possono aggiungere lunghezza di qualche cm. In realtà bisogna fare delle ulteriori precisazioni perché i cardiomiociti atriali sono lievemente più piccoli dei cardiomiociti ventricolari. Il tessuto cardiaco è definito striato perché i cardiomiociti, così come le fibre muscolari scheletriche, presentano quella caratteristica striatura trasversale, cioè un'alternanza di bande chiare e bande scure dovuta alla caratteristica disposizione dei miofilamenti di actina e miosina, che si dispongono ordinatamente a formare delle strutture che si ripetono continuamente: i sarcomeri (formati sempre da
17

banda A, semibande I, ecc...). Sebbene i miofilamenti di actinina e miosina si dispongano a formare i sarcomeri con una struttura grosso modo identica a quella delle fibre muscolari, questi miofilamenti a differenza propria delle fibre muscolari non formano miofibrille, non si organizzano quindi a formare queste strutture filamentose ma vengono a costituire una massa unica e continua, separata qua e là da setti di reticolo sarcoplasmatico, mitocondri, ecc... Abbiamo la presenza dei sarcomeri, della bandeggiatura, dei miofilamenti, ma non ci sono miofibrille avvolte dal reticolo (se mai in questo caso il reticolo viene a creare dei setti che compartimentalizzano il sarcoplasma della cellula). Ovviamente ci sono altre differenze citologiche: il sarcoplasma è più abbondante che nelle fibre muscolari ed è particolarmente ricco di glicogeno e di gocce lipidiche che fungono da riserva energetica; è anche particolarmente ricco di mitocondri perché essendo cellule in continua contrazione necessitano continuamente di ATP come fonte di energia e quindi i mitocondri nei cardiomiociti sono più numerosi, più grossi e più ricchi di creste che non nelle fibre muscolari. C'è un apparato di Golgi non particolarmente sviluppato in posizione paranucleare ma le altre caratteristiche distintive le ritroviamo al livello del reticolo sarcoplasmatico e dei tubuli T. Il reticolo sarcoplasmatico non può avvolgere le singole miofibrille ma va' a creare dei settori all'interno della cellula, è meno sviluppato e meno elaborato che nelle fibre muscolari. Mancano le cisterne fenestrate a livello della banda H e mancano anche le due cisterne terminali che trovavamo al confine tra la banda A-I e che prendevano contatto con i tubuli T. Nei cardiomiociti al posto delle cisterne terminali ci sono delle piccole espansioni terminali discontinue dei tubuli longitudinali che prendono contatto con i tubuli T formando delle strutture dette diadi, perché formate soltanto da due elementi (una espansione e un tubulo) che svolgono una funzione equivalente a quella che abbiamo visto nelle triadi: cioè i tubuli T sono in comunicazione sempre con l'ambiente extracellulare così quando arriva l'impulso alla contrazione, comunicando con i recettori presenti sul reticolo sarcoplasmatico, dai tubuli T si manda il segnale al reticolo per il rilascio del calcio nel sarcoplasma. Le differenze le ritroviamo anche per i tubuli T che sono più grossi, hanno un diametro circa 3-4 volte maggiore che nelle fibre muscolari. Inoltre non scorrono al livello della zona di confine tra la banda A-I ma scorrono a livello della linea Z e inoltre la loro superficie interna è rivestita dalla stessa membrana basale (quella matrice amorfa e glicoproteica) che riveste l'intera cellula. Una caratteristica tipica dei cardiomiociti è la presenza di strutture di connessione tra le cellule che prendono il nome di dischi intercalari o strie intercalari. I cardiomiociti comuni presentano all'estremità delle ramificazioni o comunque presentano le estremità bifide tali per cui prendono contatto l'uno con l'altro tramite delle interdigitazioni di membrana che servono ad aumentare la superficie di contatto tra le cellule. Proprio a livello di queste zone di contatto dove le membrane sono interdigitale, vediamo quelle che chiamiamo dischi intercalari e che appaiano particolarmente colorate al M.O. (utilizzando coloranti basici). Queste strie intercalari sono cosiddette perché questa zona di confine tra le due cellule appare con un andamento a zig-zag, non ha mai un andamento rettilineo ma è costituito da un'alternanza di segmenti longitudinali e segmenti trasversali rispetto all'asse maggiore del cardiomiocita stesso. Questo disco appare quasi con un andamento simile ai gradini di una scala, tant'è che viene anche detto stria scalariforme proprio per questo caratteristico andamento a zig zag e presenta un'organizzazione molto complessa, soprattutto per la presenza di notevoli apparati giunzionali che sono differenti a seconda se prendiamo in considerazione segmenti trasversali o longitudinali. Consideriamo i segmenti trasversali rispetto all'asse maggiore della fibra: a livello di questi segmenti le membrane plasmatiche affrontate appaiono al M.E. come due linee dense più o meno parallele con un andamento ondulato, in maniera tale che l'estremità delle due cellule adiacenti sembrino quasi incastrarsi le une nelle altre (andamento ondulato con cavità e sporgenze complementari), però le due membrane sono separate da un sottile interstizio di circa 20 nm. Lungo questa membrana dei segmenti trasversali troviamo soprattutto desmosomi e zonule aderentes che sono delle giunzioni caratteristiche
18

delle cellule epiteliali. I desmosomi connettono i cardiomiociti tramite ancoraggi che interessano i FI, infatti le placche dei desmosomi sono ancorate dai filamenti di desmina. Le zonule aderentes si trovano solitamente in corrispondenza della linea Z del sarcomero e contengono alcune proteine di ancoraggio tra cui l'alfa actinina (interessano comunque aree di estensione limitata e non si estendono come cinture continue attorno la cellula). Se osserviamo al M.O. vediamo che in corrispondenza di queste zonule al di sotto del sarcolemma c'è un ispessimento dovuto probabilmente alla presenza di tutte queste proteine di ancoraggio che danno un aspetto filamentoso e denso (alfa actinina, vincolina, ecc...). Queste zonule permettono la connessione dei cardiomiociti ricorrendo alle interazioni con i miofilamenti sottili.Ricapitolando: a livello dei desmosomi si legano i FI di desmina, a livello delle zonule aderentes si legano i miofilamenti della banda I.
Per quanto riguarda i segmenti longitudinali troviamo soprattutto giunzioni di tipo gap, giunzioni comunicanti. A livello dei segmenti longitudinali le membrane che si affrontano sono separate da un interstizio ancora più piccolo (inferiore ai 2 nm) e proprio qui troviamo numerose giunzioni comunicanti che rappresentano dei siti di bassa resistenza elettrica che permettono la rapida diffusione dell'impulso contrattile da un elemento cellulare all'altro. Se nei segmenti trasversali si trovano desmosomi e zonule aderentes che hanno una funzione meccanica di dare coesione alla cellula ed di rinforzare la compattezza del tessuto, al livello dei segmenti longitudinali troviamo delle giunzioni che non svolgono un ruolo meccanico ma che servono a mettere in comunicazione i cardiomiociti. In questo tipo di tessuto infatti l'impulso contrattile non è trasmesso dalla terminazione nervosa direttamente ad ogni singola cellula muscolare, qui l'impulso contrattile si origina partire solo da alcune cellule muscolari cardiache e in qualche modo questo impulso si deve trasmettere da cellula a cellula e la presenza di questo giunzioni comunicanti permette e facilita la trasmissione dell'impulso contrattile da una cellula all'altra molto velocemente. Alcuni autori dicono che il miocardio si comporta elettricamente come un sincizio funzionale pur non essendolo da un punto di vista morfologico proprio perché le cellule sebbene morfologicamente appaiano distinte, poi in realtà formano un tutt'uno quando si tratta della trasmissione dell'impulso alla contrazione. Possiamo dire fin da ora che i meccanismi base della contrazione di queste cellule sono identici a quelli delle fibre muscolari scheletriche, cioè la contrazione dipende sempre allo scivolamento di filamenti sottili di actina su quelli spessi di miosina, l'unica differenza è che qui c'è un processo noto come "rilascio di calcio indotto dal calcio": arriva un potenziale d'azione che si trasmette da un cardiomiocita all'altro, partendo dalle cellule del nodo seno-atriale ai cardiomiociti comuni, l'arrivo del potenziale d'azione provoca già di per sé l'ingresso di alcuni ioni calcio attraverso la membrana plasmatica e attraverso i tubuli T. Questo ingresso di calcio scatena poi il rilascio di altro calcio a partire dal reticolo sarcoplasmatico.
MIOCARDIO SPECIFICO E CARDIOMIOCITI SPECIFICI Il miocardio comune è il tessuto muscolare che costituisce le pareti degli atri e dei ventricoli del cuore, mentre il miocardio specifico è il tessuto che costituisce il sistema di conduzione del cuore stesso. È un tessuto muscolare cardiaco specializzato nel generare e condurre l'impulso contrattile in tutto il cuore ed è costituito dai cardiomiociti specifici che si organizzano a formare delle strutture che prendono il nome di nodi e fasci. I cardiomiociti specifici sono specializzati nell'assicurare l'autonoma, spontanea e ritmica insorgenza dell'impulso elettrico alla contrazione e la sua rapida conduzione in tutto il miocardio. In particolar modo le strutture principali che costituiscono il miocardio specifico sono:
1) nodo seno-atriale2) nodo atrio-ventricolare3) fascio atrio-ventricolare di Hiss
19

ma è proprio il nodo seno-atriale il punto del tessuto di conduzione dove si genera spontaneamente ed autonomamente e ritmicamente l'impulso elettrico per la contrazione del cuore senza l'intervento del sistema nervoso autonomo. È qui che si trovano proprio quelle cellule altamente specializzate, capaci di depolarizzarsi da sole e di generare ritmicamente questo impulso alla contrazione. Dal nodo senoatriale l'impulso contrattile, attraverso la muscolatura atriale passerà prima al nodo atrio-ventricolare, da qui al fascio atrioventricolare di Hiss che presenta due branche: attraverso la branca di destra e di sinistra si trasmetterà ai ventricoli e quindi a tutti i cardiomiociti comuni. Queste cellule hanno la capacità di depolarizzarsi spontaneamente e di trasmettere questo impulso elettrico da una cellula all'altra proprio in virtù della presenza di numerose gap junctions, cioè giunzioni comunicanti, che rappresentano siti a bassa resistenza che permettono la rapida diffusione dell'impulso da un elemento cellulare all'altro. Sebbene l'attività cardiaca si attui indipendentemente dal sistema nervoso, il cuore comunque è innervato dal sistema nervoso autonomo parasimpatico ed ortosimpatico. In particolar modo i cardiomiociti, sia quelli specializzati sia quelli comuni, sono raggiunti da fibra amieliniche. Tra queste fibre nervose e tra le cellule muscolari cardiache non si vengono a creare quelle strutture caratteristiche che prendono il nome di placche motrici sebbene tra le terminazioni assoniche e il cardiomiocita si vengano a instaurare degli stretti rapporti funzionali (tant'è che nelle terminazioni assoniche di queste fibre amieliniche sono state ritrovate quelle stesse vescicole sinaptiche che avevamo visto essere coinvolte nella trasmissione dell'impulso nervoso interneuronale e dell'impulso contrattile nella placca motrice). Il sistema nervoso autonomo però va a regolare l'attività del miocardio modificando il ritmo del battito cardiaco:
- la stimolazione da parte del nervo vago del sistema nervoso parasimpatico rallenta il battito cardiaco,
- la liberazione di adrenalina da parte delle terminazioni nervose ortosimpatiche va ad accelerare il battito cardiaco.
Dobbiamo evidenziare delle differenze tra cardiomiociti specifici e quelli comuni. I cardiomiociti specifici del tessuto di conduzione, ad esempio, i cardiomiociti dei nodi seno-atriale e atrio-ventricolare, sono più piccoli dei cardiomiociti comuni e sono accolti in un abbondante tessuto connettivo denso. Caratteristici sono invece i cardiomiociti che troviamo al livello del fascio di Hiss tant'è che sono facilmente individuabili e denominati o cellule del Purkinje o cellule giganti proprio in virtù delle loro grosse dimensioni: sono cellule molto più grandi dei cardiomiociti comuni, caratterizzate da un nucleo (o tutt'al più possono essere binucleate). Il nucleo si trova sempre in posizione centrale, hanno un abbondante sarcoplasma ricco di mitocondri e glicogeno, i miofilamenti sono relativamente scarsi e tendono a concentrarsi alla periferia della cellula al di sotto del sarcolemma; il reticolo sarcoplasmatico è poco sviluppato ma senza dubbio la differenza strutturale più importante con gli altri cardiomiociti è l'assenza dei tubuli T. (Pasqualino: non presentano dischi intercalari ma sono connesse da desmosomi e giunzioni gap; le loro fini diramazioni formano quasi una rete). In realtà andrebbero fatte le differenze anche a livello dei cardiomiociti comuni: i cardiomiociti atriali sono solitamente più piccoli dei cardiomiociti ventricolari e presentano un sistema di tubuli T poco sviluppato ma una maggiore frequenza di giunzioni gap rispetto a quelli ventricolari. Ecco perché la contrazione dell'impulso contrattile è più veloce tra le cellule atriali che non tra quelle ventricolari: perché ci sono più giunzioni gap.
20

CELLULE MIOENDOCRINE DEL CUORE Il miocardio può svolgere anche delle importanti funzioni endocrine: può produrre ormoni in particolari condizioni. Questo perché nel miocardio sono presenti delle cellule dette cellule mioendocrine che sono dotate di funzione endocrina. Queste cellule cardiache con funzione endocrina sono situate in prevalenza nella parete degli atri, in particolar modo nelle pareti dell'atrio di destra e sono disperse in numero esiguo tra i cardiomiociti comuni. Sostanzialmente si trovano a livello del miocardio comune, assomigliano per molti aspetti citologici ai cardiomiociti comuni, però alla fine non svolgono una funzione contrattile quanto piuttosto la funzione endocrina (si ritiene appartengano al sistema endocrino diffuso). A un'osservazione al M.E. queste cellule presentano nel sarcoplasma dei granuli specifici con un contenuto omogeneo ed denso agli elettroni. Questi granuli sono perinucleari, sono spesso associati all'apparato di Golgi e hanno un diametro di 0,3-0,4 mm e sono avvolti da membrana. Contengono un polipeptide cioè un ormone detto Fattore Natriouretrico Atriale (ANF) che viene liberato in condizioni specifiche. Qual è questo stimolo adeguato affinché le cellule mioendocrine atriali rilascino nei capillari miocardici quest'ormone? Le cellule mioendocrine atriali rilasciano nei capillari mioendocrini quest'ormone quando si ha una distensione eccessiva degli atri. Questa distensione eccessiva degli atri si ha quando aumenta troppo il volume del sangue in circolo. Quando gli atri sono troppo distesi perché c'è un volume eccessivo di sangue in circolo, allora viene liberato nei capillari miocardici quest'ormone che agisce a due livelli:
- a livello del sistema vascolare provoca vasodilatazione,- a livello renale provoca l'escrezione di acqua sodio: si ha un aumento della diuresi con il
risultato complessivo che si riduce il volume del plasma e quindi si abbassa la pressione sanguigna.
Quest'ormone è coinvolto nel mantenimento dell'equilibrio idrosalino e va a regolare la pressione arteriosa. Il suo target ultimo è abbassare la pressione arteriosa quando si alza troppo.
TESSUTO MUSCOLARE LISCIO E' tipico della muscolatura involontaria, nel senso che la contrazione delle sue cellule non dipende dalla volontà. Costituisce la tonaca muscolare della parete di molti organi cavi degli apparati digerente, respiratorio, urinario e genitale. Lo troviamo nella parete di arterie e vene e nei tronchi linfatici maggiori, nei grossi dotti escretori delle ghiandole e anche nei muscoli erettori dei peli della cute, nei muscoli dell'iride e nei muscoli ciliari dell'occhio. Questo tessuto è costituito da cellule che prendono il nome di cellule muscolari lisce o fibrocellule, che non mostrano la caratteristica striatura trasversale, motivo per cui le cellule del tessuto vengono definiti lisce. Queste cellule mononucleate possono trovarsi raramente isolate, ma più spesso si organizzano a formare dei fascetti muscolari o delle lamine muscolari che prendono il nome di tonache. In ogni caso quando più cellule si riuniscono tendono a disporsi parallelamente tra di loro ma sfasate, in maniera tale che la parte centrale della cellula più grossa (perché contiene il nucleo) sia affiancata dalle estremità sottili e affusolate delle cellule adiacenti. Solitamente nella parete degli organi cavi, la muscolatura liscia è organizzata in strati con fasci orientati tutti nella stessa direzione però, ad esempio nella tonaca muscolare dell'intestino, sono presenti due strati: uno in direzione longitudinale e uno in direzione trasversale che contraendosi in maniera coordinata determinano la generazione di onde peristaltiche che fanno progredire il contenuto attraverso il lume. Oppure in altri organi cavi gli strati muscolari servono a modificare il calibro del lume e ad esempio negli acini secretori di ghiandole mammarie, salivari, lacrimali e sudoripare, tra le cellule epiteliali e la lamina basale sono presenti delle cellule muscolari lisce dette cellule mioepiteliali o cellule a canestro per la
21

loro caratteristica forma ramificata, che contraendosi spingono il segreto della ghiandola dagli alveoli ai dotti escretori e infine alla superficie. In ogni caso i fascetti o le lamine di cellule muscolari lisce sono avvolte da una trama di connettivo lasso in cui scorrono capillari sanguigni e fibre nervose. Questa trama di connettivo lasso prende il nome di guaina reticolare ed è costituita da fibre di collagene accompagnate da una certa quantità di sostanza amorfa di natura proteica e polisaccaridica e che penetra tra gli interstizi delle singole cellule formando questa rete che avvolge ciascuna cellula. Ciascuna cellule è avvolta da questa guaina reticolare che è simile per certi aspetti alla membrana basale delle cellule epiteliali e che si può evidenziare anch'essa con metodi di impregnazione argentica o con le relazioni di tipo PAS.
FIBRE MUSCOLARI LISCE Il tessuto muscolare liscio è costituito da cellule che prendono il nome di fibre muscolari lisce o fibrocellule. Si tratta di cellule mononucleate di forma allungata e fusiforme, il nucleo è di forma ovale o bastonciforme e si trova in posizione centrale e quindi la cellule è più spessa nella porzione centrale in cui si trova il nucleo, mentre l'estremità sono molto più sottili. Sono cellule di lunghezza variabile dai 20-200 mm, a seconda della sede e uno spessore che va dai 4-20 mm. Inoltre sono cellule che derivano per differenziazione dalle cellule mesenchimali e si tratta di cellule stabili, cellule che hanno una modesta capacità rigenerativa in caso di danno tissutale ma che possono aumentare di volume. Infatti possono essere soggette a ipertrofia più raramente a iperplasia, cioè a un aumento il numero. Sia l'ipertrofia che l'iperplasia sono conseguenti a delle sollecitazioni funzionali: basti pensare che ad esempio, nell'utero in gravidanza le cellule si ipertrofizzano sino ad arrivare a 500 mm di lunghezza, mentre solitamente la lunghezza massima sui 200. Sono cellule con dimensioni variabili e che difficilmente ritroviamo isolate perché si dispongono a formare o fascetti muscolari o lamine muscolari dette tonache. Quando le cellule si raggruppano tra loro tendono a disporsi parallelamente tra loro ma sfasate. Tutte le cellule muscolari lisce sono avvolte da una guaina di connettivo reticolare, costituita da fibre di collagene e da una matrice amorfa di natura proteico-saccaridica che è sensibile a reazioni PAS. Queste cellule muscolari sono separate da interstizi di 60-90 nm, occupati da questa guaina reticolare che è molto simile alla membrana basale che ritroviamo nelle cellule epiteliali.
Andiamo a osservare un po' meglio l'ultrastruttura di queste cellule che sono cellule mononucleate, di forma allungata e dimensioni variabili, che si dispongono in fascetti o lamine e che sono separati da interstizi di 60-90 nm occupati da fibre di collagene e da materiale proteico saccaridico.
Queste cellule sono avvolte da un sarcolemma che presenta numerose invaginazioni a superficie liscia, simili a vescicole di pinocitosi, che prendono il nome di caveole e che si pensa abbiano la funzione di aumentare la superficie della membrana e di prendere contatto con il reticolo endoplasmatico liscio, svolgendo una funzione analoga a quella dei tubuli delle fibre muscolari scheletriche. Perché nelle fibre muscolari lisce non troviamo tubuli T. Queste caveole, queste introflessioni di membrana, quando arriva il potenziale di membrana comunicano con il reticolo endoplasmatico che contiene il calcio, in maniera tale che il calcio venga liberato nel sarcoplasma. Il sarcoplasma contiene il nucleo che è uno solo e in posizione centrale, un piccolo apparato di Golgi solitamente in posizione paranucleare. Contiene molti granuli di glicogeno, gocce lipidiche, talvolta anche granuli di pigmenti e il reticolo endoplasmatico liscio che è poco sviluppato e localizzato prevalentemente vicino alle caveole del sarcolemma. Inoltre sono presenti ribosomi liberi e soprattutto mitocondri. Mentre i mitocondri sono disseminati un po' ovunque nel citoplasma, gli altri organelli citoplasmatici tendono a concentrarsi in una regione conica in corrispondenza di ciascun polo del
22

nucleo. Nel sarcoplasma troviamo i miofilamenti contrattili responsabili della contrazione della cellula. Questi filamenti però sono disposti disordinatamente. Sebbene siano sempre disposti parallelamente rispetto l'asse maggiore della cellula, non sono disposti in maniera ordinata e quindi non abbiamo né la formazione di miofibrille né tantomeno la formazione di sarcomeri. Ecco perché queste cellule vengono dette cellule muscolari lisce: perché non si può osservare la caratteristica bandeggiatura in quanto i miofilamenti non sono organizzati con questa alternanza di bande chiare e bande scure. Per quanto riguarda i miofilamenti abbiamo sempre i miofilamenti di actina con diametro di 4 nm e che sono i filamenti più numerosi. Sono costituiti da un'isoforma dell'actina diversa da quella che troviamo nelle fibre muscolari scheletriche, ma soprattutto la differenza sta nel fatto che sono formati da actina e tropomiosina soltanto: manca totalmente la troponina. Le differenze principali del ritroviamo osservando i filamenti spessi di miosina. Innanzitutto questi filamenti sono meno numerosi di quelli di actina e quindi meno numerosi facendo la proporzione con le fibre muscolari scheletriche. Sono più corti perché sono costituiti da un numero minore di molecole di miosina e soprattutto non sono assemblati in maniera stabile, nel senso che si osservano soltanto al momento della contrazione. Infatti sono costituiti anche in questo caso da una isoforma diversa da quella che troviamo nei muscoli striati: le catene leggera di questa molecola di miosina non sono fosforilate quando la cellula è a riposo e ciò conferisce alla molecola di miosina una conformazione del tutto particolare. Quando la cellula è a riposo e non c'è contrazione la molecola non è lineare (con una parte bastoncellare e le due teste) ma è ripiegata su se stessa, quindi non solo le teste non possono prendere contatto con i filamenti di actina, ma non possono nemmeno legarsi tra di loro a formare i filamenti spessi. Soltanto quando arriva il potenziale d'azione viene liberato il calcio: allora queste teste verranno fosforilate e potranno unirsi tra loro a costituire i filamenti spessi.Un'altra struttura che ritroviamo nel sarcoplasma della cellula sono i corpi densi. Sono delle zone più scure, che possono essere osservate al M.E. , che ritroviamo sia all'interno del citoplasma sia al di sotto del sarcolemma (lungo la superficie citoplasmatica del sarcolemma). Questi corpi densi prendono contatto sia con i miofilamenti sottili di actina sia con i FI di desmina, quindi svolgono una funzione simile alle linee Z della fibra muscolare striata e rappresentano un ancoraggio per questi due tipi di filamenti. I corpi densi sulla superficie interna del sarcolemma assumono l'aspetto di mezzi desmosomi e sono detti piastre di inserzione. I corpi densi contengono alfa actinina, un costituente della linea Z.Un'altra caratteristica delle fibrocellule è che hanno un'abbondante citoscheletro che svolge un ruolo fondamentale per la funzionalità della cellula. Sono costituite da un'abbondante rete citoscheletrica formata soprattutto da FI. Questi FI decorrono fra i fasci di filamenti di actina e miosina, si associano ai corpi densi citoplasmatici e subsarcolemmari e li collegano tra loro attraverso un reticolo fibrillare. Questo citoscheletro è costituito prevalentemente da desmina, ma in alcuni tipi muscolari possiamo ritrovare anche come costituente principale dei filamenti intermedi la vimentina.
Ricapitolando: il sarcolemma presenta invaginazioni simile a vescicole di pinocitosi, dette caveole che svolgono il ruolo dei tubuli T: prendono contatto con reticolo sarcoplasmatico che è poco sviluppato e poco elaborato. Sono presenti i corpi densi che connettono i FI e filamenti di actina, i miofilamenti non si organizzano né in miofibrille né in sarcomeri; i filamenti di miosina non sono stabili ma si costituiscono soltanto al momento della contrazione. Manca la caratteristica bandeggiatura.
Le cellule sono separate da un interstizio di 60-90 nm ma sono collegate da numerose gap junctions che le mettono in comunicazione per la diffusione dell'onda di depolarizzazione da una cellula all'altra.
23

CONTRAZIONE DELLA MUSCOLATURA LISCIA La muscolatura liscia si contrae più lentamente della muscolatura striata, ma si tratta di contrazioni più prolungate nel tempo e che si attuano con un consumo di ossigeno inferiore rispetto a quelle delle fibre muscolari. La muscolatura liscia è innervata dal sistema nervoso simpatico: è una contrazione di tipo involontario, ed è priva di placche motrici. Le fibrocellule muscolari lisce ricevano una doppia innervazione: da parte del sistema ortosimpatico e da parte del sistema parasimpatico, innervazione che produce effetti opposti. Infatti l'innervazione dell'ortosimpatico genera contrazione, l'innervazione dal parasimpatico genera rilasciamento. Le fibrocellule muscolari sono raggiunte da fibre simpatiche amieliniche che terminano ramificandosi ripetutamente attorno alle cellule con cui instaurano rapporti di tipo sinaptico, ma non generano quella struttura che abbiamo visto alla muscolatura striata,la placca motrice o giunzione neuromuscolare. Anche qui nelle terminazioni nervose sono presenti delle vescicole che poi si liberano nello spazio intersinaptico e la liberazione di queste vescicole comporta il rilascio del mediatore chimico. Questo mediatore chimico che va solitamente a generare l'impulso nervoso per la contrazione può essere o Acetilcolina o la Norepinefrina. La Acetilcolina è liberata dalle fibre parasimpatiche e quindi è quella che genera rilasciamento, mentre la Norepinefrina è liberata dalle fibre dell'ortosimpatico ed è quella che genera contrazione. Un'altra particolarità della muscolatura liscia è che la contrazione non dipende sempre soltanto direttamente dall'innervazione del sistema nervoso, ma talvolta si può avere una contrazione del tutto spontanea, generata dalle cellule muscolari stesse o in seguito a modificazioni del microambiente extracellulare o indotta da stimoli meccanici oppure ormonali. In ogni caso senza l'intervento diretto del sistema nervoso, che invece in questi casi interviene solo a regolare la frequenza della contrazione.
Vediamo le fasi con cui si attua la contrazione della muscolatura liscia. Lo stimolo nervoso provoca una depolarizzazione del sarcolemma. Questa depolarizzazione genera l'ingresso di ioni calcio all'interno del sarcoplasma o perché questi ioni affluiscono attraverso le caveole o perché vengono rilasciati direttamente dalle cisterne del reticolo sarcoplasmatico. Una depolarizzazione del sarcolemma porta a liberazione di calcio nel sarcoplasma. Il calcio libero nel Citoplasma si lega a una proteina detta calmodulina e il complesso calcio-calmodulina va ad attivare un enzima detto miochinasi delle catene leggere o chinasi delle catene leggere di miosina. Questo enzima attivato dal complesso calcio-calmodulina, va a fosforilare le catene leggere della miosina, che nella sua forma a riposo è ripiegata, ma una volta che le teste vengono fosforilate, assume conformazione aperta tale che può assemblarsi in filamenti spessi e interagire anche con i filamenti di actina. L'interazione della miosina con l'actina provoca lo scivolamento dei filamenti di actina su quelli spessi di miosina, con un meccanismo di contrazione simile a quello che abbiamo visto nelle fibre striate e poi al termine della contrazione il sistema del cAMP della cellula muscolare liscia attiva una fosfochinasi che, mediante l'aggiunta di radicali fosforici, impedisce l'ulteriore attivazione delle enzima chinarsi delle catene leggere di miosina, provocando il rilasciamento della cellula. Ricordiamo che nella cellula muscolare liscia non abbiamo la presenza di troponina. Nella muscolatura scheletrica una delle subunità della troponina, la troponina C, che aveva affinità per il calcio si legava ad esso e questo provocava un cambiamento conformazionale del complesso troponina-tropomiosina che lasciava liberi i siti di legame sull'actina. In questo caso il calcio si lega a un'altra proteina che mostra affinità per esso, la calmodulina: la calmodulina dovrà andare ad attivare la miosina attivando prima la chinarsi specifica, che si occuperà direttamente della fosforilazione delle teste della miosina così che essa possa assemblarsi in filamenti.
24

Nella muscolatura liscia della parete degli organi cavi (nella muscolatura liscia viscerale) si possono distinguere due forme diverse di attività contrattile: una contrazione ritmica o fasica e una contrazione tonica. La contrazione ritmica è caratterizzata da impulsi contrattili periodici, ritmici che si diffondono da un elemento cellulare all'altro con generazione di onde di contrazione peristaltiche. Ad es, nella parete intestinale o comunque in altri viscere di cavi dotati di un canale, in maniera tale che queste onde peristaltiche propagandosi lungo il canale assicurino l'avanzamento del contenuto del canale stesso. La contrazione tonica consiste in uno stato continuo e parziale di contrazione delle cellule muscolari, detto tono muscolare. La contrazione tonica della muscolatura liscia di un organo cavo contribuisce spesso a determinare il diametro dell'organo stesso. Per es, nella vasocostrizione o vasodilatazione a seconda della pressione sanguigna oppure nell'intestino in cui la contrazione perisistolica della parete permette un adattamento della parete al contenuto.
Quindi per quanto riguarda la muscolatura liscia viscerale abbiamo una contrazione ritmica e una contrazione tonica. Invece per quanto riguarda la modalità di diffusione dell'impulso contrattile i muscoli lisci possono essere distinti in muscoli lisci unitari o viscerali e muscoli lisci multiunitari. Nella muscolatura liscia unitaria, detta anche viscerale perché la ritroviamo ad esempio in quei visceri cavi come vie digerenti, vie urinarie eccetera, la contrazione insorge perché soltanto poche cellule ricevono terminazioni nervose che stabiliscono rapporti sinaptici di membrana. L'impulso contrattile che insorge spontaneamente per cause miogene in una fibra muscolare, o che vi giunge tramite una terminazione nervosa o in seguito stimolazione ormonale, si propaga liberamente alle cellule continue tramite connessioni di tipo gap junctions tra le membrane adiacenti vicine. L'impulso si genera solo in alcune cellule e poi si propaga al resto del tessuto per la presenza di giunzioni gap numerose. Solitamente questi muscoli lisci unitari sono caratterizzati da una contrazione di tipo ritmico e inoltre le cellule sono caratterizzate dalla presenza di sistemi giunzionali di tipo gap. La muscolatura liscia multiunitaria è ad esempio la muscolatura vascolare delle pareti dei vasi sanguigni o del dotto deferente o quella dei muscoli erettori del pelo, in cui le cellule non presentano gap junctions e la contrazione viene stimolata dalle fibre del simpatico che le innervano direttamente. Sostanzialmente ogni fibrocellula muscolare riceve una terminazione motrice, di modo che le cellule muscolari di una certa area si contraggano tutte contemporaneamente.
VEDI ISTOGENESI DEI VARI TESSUTI MUSCOLARI DAL MONESI, PAG 749.
25

26