Pewarnaan Tahan Asam
-
Upload
wirnagracesihombing -
Category
Documents
-
view
207 -
download
9
description
Transcript of Pewarnaan Tahan Asam
-
LAPORAN PRAKTIKUM MIKROBIOLOGI FARMASI
PEWARNAAN TAHAN ASAM
Selasa, 4 Maret 2015
Kelompok III
Selasa , Pukul 10.00 13.00 WIB
Nama NPM
WIRNA GRACE .S 260110130092
LABORATORIUM MIKROBIOLOGI FARMASI
FAKULTAS FARMASI
UNIVERSITAS PADJADJARAN
2015
Nilai TTD
(Casuarina) (Andini) ( Emanuella)
-
PEWARNAAN TAHAN ASAM
I. TUJUAN
Mengamati dua kelompok bakteri, yaitu bakteri tahan asam dan bakteri tak
tahan asam, dengan menggunakan prosedur pewarnaan tahan asam
pewarnaan (Ziehl-Neelsen). Memahami setiap langkah dan reaksi-reaksi
kimia yang terjadi dalam prosedur tersebut.
II. PRINSIP
1.Penetrasi zat warna
Bakteri ini dikenal tahan asam sebab bakteri tersebut resisten
terhadap dekolorisasi dengan alkohol asam. Dalam prosedur pewarnaan
tahan asam, Karbol fuchsin merupakan pewarna dasar, yang mengandung
fenol untuk membantu melarutkan dinding sel. Pemanasan biasanya
diperlukan untuk memperkuat penetrasi pewarna dasar ke dalam sel
bakteri.
2.Pewarnaan tahan asam
Pewarnaan tahan asam adalah tipe pewarnaan diferensial lebih dari
satu pewarna untuk membedakan suatu mikroorganisme dengan
kandungan dinding sel peptidoglikan serta disusun lebih dari 60% lipid
kompleks yang tahan terhadap dekolorisasi dengan alkohol asam.
3. Pemanasan
Untuk mewarnai spora dan di dalam proses pewarnaannya
melibatkan proses pemanasan, yaitu; spora dipanaskan bersamaan dengan
zat warna tersebut sehingga memudahkan zat warna tersebut untuk
meresap ke dalam dinding pelindung spora bakteri.
4. Impermeabilitas dinding sel bakteri tahan asam
Bakteri tahan asam memiliki kandungan senyawa dari
peptidoglikan dan lipid kompleks yang disebut asam mycolat yang
membangun struktur dinding selnya, sehingga menjadi impermeabel
terhadap macam-macam prosedur pewarnaan termasuk pewarnaan gram.
-
III. TEORI DASAR
Mikroorganisme yang ada di alam ini mempunyai morfologi, struktur dan
sifat-sifat yang khas, begitu pula dengan bakteri. Bakteri yang hidup hampir tidak
berwarna dan kontras dengan air, dimana sel-sel bakteri tersebut disuspensikan.
Salah satu cara untuk mengamati bentuk sel bakteri sehingga mudah untuk
diidentifikasi ialah dengan metode pengecatan atau pewarnaan. Hal tersebut juga
berfungsi untuk mengetahui sifat fisiologisnya yaitu mengetahui reaksi dinding
sel bakteri melalui serangkaian pengecatan.
Bakteri tahan asam merupakan bakteri yang kandungan lemaknya sangat
tebal sehingga tidak bisa diwarnai dengan reaksi pewarnaan biasa, tetapi harus
dengan pewarnaan tahan asam. Kelompok bakteri ini disebut bakteri tahan asam
(BTA) karena dapat mempertahankan zat warna pertama sewaktu dicuci dengan
larutan pemucat. Golongan bakteri ini biasanya bersifat patogen pada manusia
contohnya adalah Mycobacterium tuberculosis. Bakteri Mycobacterium
tuberculosis dapat diisolasi dari sputum penderita TBC. Reaksi hasil
pewarnaannya jika positif terdapat bakteri TBC berwarna merah. Selain
menyerang manusia juga menyerang hewan seperti marmut, dan kera.
Penularannya dapat melalui udara yang masuk ke saluran pernafasan (Pelczar dan
Chan, 1988).
Bakteri tahan asam adalah jenis bakteri yang tidak dapat diwarnai dengan
pewarnaan anilin biasa kecuali dengan menggunakan fenol dan dengan
pemanasan. Bakteri ini memilki dinding sel berlilin karena mengandung sejumlah
besar materi lipoidal oleh karena itu bakteri ini hanya dapat diwarnai dengan
pewarnaan BTA (Acid-Fast Stain). Dinding sel hidrofobik dan impermeabel
terhadap pewarnaan dan bahan kimia lain pada cairan atau larutan encer. Ketika
proses pewarnaan, bakteri tahan asam ini melawan dekolorisasi dengan asam
sehingga bakteri tersebut disebut bakteri tahan asam (Ball, 1997).
Pewarnaan diferensial artinya pewarnaan yang menggunakan lebih dari
satu macam zat warna, seperti pewarnaan gram dan pewarnaan tahan asam.
-
Sedangkan pewarnaan khusus artinya pewarnaan yang dipakai untuk mewarnai
bagian-bagian sel atau bakteri tertentu yang sukar diwarnai dengan menggunakan
pewarnaan biasa. Pewarnaan khusus dipakai untuk mewarnai bagian-bagian sel
kuman atau kuman tertentu yang sukar diwarnai (Noverita, 2009).
Bakteri tahan asam dapat diamati dengan teknik pewarnaan Ziehl Neelson,
Kinyoun Gabber, dan Fluorochrom. Pengambilan sputum (sekret paru-paru atau
ludah) untuk analisis tuberculosis dapat dilakukan setiap saat dikenal ada 3 jenis
sputum:
Sputum pagi : sputum yang dikeluarkan oleh penderita pada saat bangun
pagi.
Spot sputum : sputum yang dikeluarkan pada saat itu.
Collection sputum : sputum yang keluar dan ditampung selama 24 jam
Sputum yang telah diperoleh dapat disimpan dalam lemari es selama satu
minggu.
Teknik pewarnaan Ziehl-Neelsen, yaitu dengan menggunakan zat
warna carbol fuchsin 0,3 %, asam alkohol 3 %, dan methylen blue 0,3%. Pada
pemberian warna pertama, yaitu carbol fuchsin, BTA bersifat
mempertahankannya. Carbol fuchsinmerupakan fuksin basa yang dilarutkan
dalam larutan fenol 5 %. Larutan ini memberikan warna merah pada sediaan
dahak. Fenol digunakan sebagai pelarut untuk membantu pemasukan zat warna ke
dalam sel bakteri sewaktu proses pemanasan. Fungsi pemanasan untuk
melebarkan pori-pori lemak BTA sehingga carbol fuchsin dapat masuk sewaktu
BTA dicuci dengan larutan pemucat, yaitu asam alkohol, maka zat warna pertama
tidak mudah dilunturkan. Bakteri kemudian dicuci dengan air mengalir untuk
menutup pori-pori dan menghentikan pemucatan. BTA akan terlihat berwarna
merah, sedangkan bakteri yang tidak tahan asam akan melarutkan carbol
fuchsin dengan cepat sehingga sel bakteri tidak berwarna. Setelah penambahan zat
warna kedua yaitu methylen blue, bakteri tidak tahan asam akan berwarna biru
(Lay, 1994).
-
Metode Ziehl-Neelsen digunakan karena cukup sederhana dan mempunyai
sensitivitas serta spesifitas yang cukup tinggi. Spesifitas dan sensitivitas yang
tinggi sebenarnya dimiliki oleh metode fluorokrom. Bakteri yang terwarnai
menunjukkan warna yang kontras dengan lingkungannya dan tidak membutuhkan
perbesaran sampai 1000x sehingga bisa mempercepat waktu. Akan tetapi, alat
yang digunakan tidak ada yaitu mikroskop fluorescens (Kurniawati et al., 2005).
Mycobacterium tuberculosis berbentuk batang langsing, lurus atau
berbentuk filament. Bakteri ini bersifat aerobik, tidak membentuk spora, non
motil, tahan asam, dan merupakan bakteri gram positif. Namun, sekali
mycobacteria diberi warna oleh pewarnaan gram, maka warna tersebut tidak dapat
dihilangkan dengan asam. Oleh karena itu, maka mycobacteria disebut sebagai
Basil Tahan Asam atau BTA. Beberapa mikroorganisme lain yang juga memiliki
sifat tahan asam, yaitu spesies Nocardia, Rhodococcus, Legionella micdadei, dan
protozoa Isospora dan Cryptosporidium. Pada dinding sel mycobacteria, lemak
berhubungan dengan arabinogalaktan dan peptidoglikan di bawahnya. Struktur ini
menurunkan permeabilitas dinding sel, sehingga mengurangi efektivitas dari
antibiotik. Lipoarabinomannan adalah suatu molekul lain dalam dinding sel
mycobacteria, berperan dalam interaksi antara inang dan patogen, menjadikan M.
tuberculosis dapat bertahan hidup di dalam makrofaga. Mikobakteria dapat
tumbuh lebih cepat pada pH 6 dan 8 dengan pH optimum sekitar 6.5 - 6.8 untuk
tipe pathogen. Sel mikobakteria terdiri dari tiga lapisan penting yaitu lipid, protein,
dan polisakarida (Thomas, 1999).
Mycobacterium tuberculosis termasuk gram positif, berbentuk batang
panjang atau pendek, tidak berspora, tidak berkapsul, pertumbuhan sangat lambat
(2-8 minggu), suhu optimal 37-380C yang merupakan suhu normal manusia.
Pertumbuhannya membutuhkan tambahan makanan seperti darah, egg yolk, serum,
dan bahan kimia tertentu. Dalam jaringan, basil tuberkel adalah bakteri batang
lurus dengan ukuran sekitar 0,4 3 m. Pada media buatan, bentuk kokoid dan
filamentous tampak bervariasi dari satu spesies ke spesies lain. Segera setelah
diwarnai dengan pencelupan dasar mereka tidak dapat didekolorisasi oleh alkohol,
-
tanpa memperhatikan pengobatan dengan iodine. Basil tuberkel secara umum
dapat diwarnai dengan pewarnaan Ziehl-Neelsen. Media untuk membiakan
mikobakteria adalah media nonselektif dan media selektif. Media selektif
berisi antibiotik untuk mencegah pertumbuhan kontaminan bakteri dan fungi
yang berlebihan. Ada tiga formulasi umum yang dapat digunakan untuk kedua
media nonselektif dan selektif, yaitu media agar semisintetik (middlebrook 7H10
dan 7H11), media telur inspisasi (Lowenstein-jensen), media kaldu (broth media)
(Jawetz et al., 2001).
Mikobakteria merupakan aerobik obligat yang memperoleh energi dari
oksidasi beberapa senyawa sederhana. Penambahan CO2 meningkatkan
pertumbuhan. Tidak ada aktivitas biokimia yang menandai. Dan kecepatan
pertumbuhan lebih rendah dari pada sebagian besar bakteri. Waktu untuk
menggandakan basil tuberkel sekitar 18 jam, bentuk saprofit cenderung tumbuh
lebih cepat, poliferasi terjadi pada temperatur 22-23C, untuk menghasilkan
pigmen yang lebih banyak dan mengurangi bentuk cepat asam daripada bentuk
patogenik. Mikobakteria cenderung lebih resisten terhadap agen kimia daripada
bakteri lain karena sifat hidrofobik permukaan sel dan pertumbuhannya. Basil
tuberkel reisten terhadap kekeringan dan bertahan hidup selama periode waktu
yang lama dalam sputum kering. Variasi dapat terjadi dalam koloni, pigmentasi,
virulensi, temperatur petumbuhan yang optimal dan beberapa tanda pertumbuhan
atau seluler lainnya (Fardiaz, 1992).
Larutan kimia yang digunakan adalah alkohol asam 3% , carbol
fuchsin 0,3%, serta methylen blue 0,3% yang masing-masing mempunyai fungsi
antara lain asam alkohol digunakan sebagai peluntur, carbol fuchsin mempunyai
fungsi membuka lapisan lilin agar menjadi lunak sehingga cat dapat menembus
masuk ke dalam sel bakteri M. tuberculosis. Methylen blue berfungsi sebagai cat
lawan dan pada pemberian methylen blue pada bakteri akan tetap berwarna merah
dengan latar belakang biru atau hijau (Jutono dkk., 1980).
-
IV. ALAT
BAHAN
Alat :
1. Bak warna
2. Botol semprot
3. Kaca objek
4. Kapas
5. Kertas saring
6. Mikroskop
7. Ose
8. Pipet tetes
9. Spiritus
10. Tabung reaksi
V.
Bak warna Botol semprot Kaca objek
Kertas saring Mikroskop
Kapas
Tabung reaksi
Spiritus
Pipet Tetes
-
Bahan
1. Alkohol 70% 2.Air suling 3. Emerge oil
4.Suspensi Bakteri 5. Zat warna biru 6.Zat warna
saprofit Metilen karbol fuksin
VI. PROSEDUR
Mula-mula disediakan alat dan bahan yang diperlukan. Disiapkan kaca
obyek yang bersih dan buat olesan dari suspensi bakteri, olesan bakteri
digenangi dengan pewama karbol fuksin selama 5 menit, sambil
dipanaskan di atas penangas air. Jaga jangan sampai terlalu panas,
mendidih atau kering. Dibuang zat wama yang berlebih, lalu dibilas
dengan air suling. Dibilas dengan zat pemucat alkohol-asam selama 15
detik atau sampai latar belakang olesan berwarna merah muda pucat.
Digenangi olesan dengan pewarna tandingan biru metilen selama 2 menit,
dibuang zat warna yang berlebih, dibilas dengan air suling, lalu
dikeringkan dengan kertas saring. Diteteskan sedikit minyak imersi pada
preparat, lalu periksa di bawah mikroskop. Dimulai dengan obyektif
berkekuatan terendah 10X, lalu ganti dengan lensa obyektif berkekuatan
100X. Diamati dan digambarkan hasilnya. Bakteri tahan asam (ZN + )
-
akan berwarna merah dan bakteri tidak tahan asam (ZN -) akan berwarna
biru.
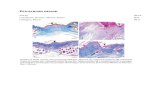
VII. DATA PENGAMATAN
SAMPEL LITERATUR
Bentuk dan warna bakteri tidak
terlihat jelas
(http://textbookofbacteriology.net/tuberculosis.html)
Bentuk Bakteri teramati,yaitu batang
Warna bakter teramati yaitu merah
VIII. PEMBAHASAN
Pada praktikum kali ini, percobaan untuk pewarnaan bakteri tahan asam
tidak dilakukan. Hanya dilakukan pengamatan pada preparat bakteri yang
telah disediakan. Pewarnaan pada bakteri tahan asam tidak dilakukan
karena bakteri sampel yang digunakan merupakan bakteri yang berbahaya.
Bakteri yang digunakan adalah bakteri Mycobacterium tuberculosis
Hal pertama yang dilakukan dalam praktikum ini adalah
menyiapkan alat dan bahan yag diperlukan . Setelah menyiapkan preparat
olesan bakteri. Langkah yang dilakukan sebelum menyiapkan preparat
yaitu membersihkan kaca obyek dengan cara merendam dalam alkohol
70% lalu keringkan dengan menggunakan lap/tissue yang telah ditetesi
dengan alkohol. Proses ini bertujuan untuk menghilangkan lemak dan
-
mikroorganisme yang menempel pada permukaan kaca obyek yang dapat
mengganggu hasil pengamatan. Kemudian pada salah satu sisi kaca
preparat dibuat lingkaran dengan menggunakan spidol. Hal ini bertujuan
sebagai batas pengamatan bakteri agar lebih mudah diamati dibawah
mikroskop.
Lalu,ose difiksasi melalui api hingga kawat ose berubah menjadi
merah dan didinginkan dekat api, yang menandakan bahwa ose sudah
panas dan bebas dari kontaminasi. Ini bertujuan untuk membunuh bakteri
yang menenmpel pada ose yang dapat mengganggu hasil pengamatan. Ose
yang digunakan harus dingin sebab jika masih panas dapat menyebabkan
pecahnya dinding sel bakteri sehingga bakteri sulit untuk diamati. Setelah
itu,tabung reaksi yang berisi suspense bakteri saprofit. dikocok dan dibuka
dekat sumber api untuk mengurangi kontaminasi. Pengocokan dilakukan
bertujuan agar suspense bakteri tercampur secara merata tidak berkumpul
di bagian bawah tabung. Lalu suspense bakteri diambil dengan
menggunakan ose. Setelah itu,penutup tabung dan mulut tabung difiksasi
untuk menghilangkan kontaminasi dan tabung ditutup. Kemudian olesan
bakteri dibuat dengan mengoleskan secara merata ose pada kaca preparat.
Olesan yang baik adalah olesan yang tidak terlalu tebal atau terlalu tipis
dan tahan terhadap pencucian satu kali atau lebih. Pada olesan yang terlalu
tebal, sel-sel bakteri akan bertumpuk sehingga sulit untuk diamati.
Sedangkan pada olesan yang terlalu tipis, akan sulit menemukan sel-sel
tersebut. ,lalu kaca preparat difiksasi dan dibiarkan dingin dan kering.
Lalu kaca preparat dibiarkan kering dan difiksasi. Fiksasi pada olesan
yang belum kering akan menyebabkan sel-sel bakteri seakan-akan terebus
dan bentuknya menjadi tidak karuan. Fiksasi adalah adalah proses
pengawetan dan pelekatan atau penempelan struktur sel mikroorganisme
pada suatu posisi. Hal yang diperhatikan dalam fiksasi adalah dilakukan
dengan cara melewatkan kaca preparat di atas api. Fiksasi dilakukan
sampai kaca preparat terasa hangat apabila ditempelkan pada punggung
-
tangan. Fiksasi yang dilakukan tidak boleh terlalu panas dan lama, karena
bakteri yang ada pada preparat bisa hangus terpanggang dan terjadi
perubahan bentuk dan penyusutan sel selain itu . Tujuan dari fiksasi adalah
pelekatan bakteri supaya pada saat pencucian, bakteri tersebut tidak ikut
hilang tercuci dan untuk menonaktifkan enzim lytic sehingga bakteri tidak
mengalami lisis dan berubah bentuk pada saat diamati.
Kemudian olesan bakteri digenangi dengan pewarna pertama
karbol fuksin,yang telah dicampur fenol selama 5 menit,sambil dipanaskan
diatas penangas air ( jaga jangan sampai terlalu panas,mendidih,atau
kering).Menunggu selama 5 menit setelah pewarnaan dengan warna carbol
fuchsin dan dilakukan pemanasan bertujuan agar cat ini dapat diserap dan
melekat sempurna pada dinding bakteri dan dinding selnya kembali seperti
semula setelah dilakukan pemanasan
Pada Bakteri Tahan Asam,pewarnaan pertama ini, akan sulit
menembus dinding dari Bakteri tahan asam yang memiliki lapisan lilin
( lemak ) yang tebal, sehingga dilakukan pemanasan untuk memuaikan
dinding sel bakteri tersebut sehingga warna carbol fuchsin ini mampu
diserap oleh sel-sel bakteri. Namun perlu diperhatikan, pemanasan
dilalukan jangan sampai mendidih cukup sampai menguap agar sel-sel
bakteri tersebut tidak rusak sedangkan fenol digunakan sebagai pelarut
untuk membantu pemasukan zat warna ke dalam sel bakteri . Namun
dalam dinding sel bakteri non BTA lapisan lemaknya tidak banyak
sehingga untuk melakuka penyerapan warna tidak perlu dilakukan
pemanasan dan pelunturan warna pun sangatmudah dilakukan saat
penambahan asam alkohol.
Setelah itu zat warna yang berlebih dibuang dan dibilas dengan air
suling yang bertujuan untuk membilas zat warna yang berlebih sebelum
dilanjutkan dengan pewarnaan berikutnya. Pencucian juga menyebabkan
-
lapisan lilin dan lemak yang terbuka akan merapat kembali
Kemudian olesan bakteri dibilas dengan pemucat alcohol-asam
selama 15 detik atau sampai latar belakang olesan berwarna merah muda
pucat. Penambahan alkohol berfungsi untuk membilas atau melunturkan
zat warna (decolorization) pada sel bakteri (mikroorganisme). Saat sel-sel
bakteri sudah mampu menyerap warna carbol fuchsin maka dinding sel
tersebut akan kembali tertutup dalam pada saat pencucian dengan air
sulinh.
Menunggu selama 15 detik setelah penambahan larutan asam
alkohol bertujuan agar zat warna dapat luntur secara sempurna dan tidak
ada yang tersisa. Saat penambahan asam alcohol ini, maka bakteri yang
bukan BTA akan dilunturkan kembali warna carbol fuchsin tersebut
karena tidak mampu mengikat kuat seperti halnya bakteri BTA yang
mampu mempertahankan zat warna karbol fuksin Karena BTA memiliki
lapisan lipid yang sangat tebal sehingga alkohol sukar menembus dinding
sel bakteri tersebut dan warna merah akibat pemberian carbol fuchsin tidak
hilang.
Dekolorisasi merupakan fase yang paling kritis. Pemberian asam
alkohol jangan sampai berlebih karena akan menyebabkan
overdekolorization sehingga sel BTA hampir sama dengan Non BTA yang
menyebabkan sulit membedakannya, tetapi jangan juga terlalu sedikit
dalam memberikan alkohol (underdecolorization) karena tidak akan
melunturkan warna secara sempurna sehingga sel Non BTA bisa saja
berwrna ungu mendekati warna sel BTA.
Olesan bakteri digenangi dengan pewarna tanding metilen biru
selama 2 menit,lalu zat warna yang berlebih dibuang dan preparat dibilas
dengan air suling. Tujuan pemberian methylen blue adalah memberi warna
-
background ( pewarna sekunder ). Zat ini berfungsi untuk mewarnai
kembali sel-sel yang telah kehilangan pewarna utama setelah perlakuan
dengan asam alkohol. Zat warna methylene blue masuk ke dalam sel
bakteri non BTA yang permeabilitas dinding selnya membesar akibat
lapisan lipid pada bakteri non BTA terekstraksi oleh asam alkohol,
sehingga menyebabkan sel bakteri non BTA tersebut menjadi berwarna
biru. Pada bakteri BTA dinding selnya sudah terdehidrasi dengan
perlakuan alkohol, sehingga pori pori mengkerut, daya rembes dinding
sel dan membran menurun sehingga zat warna methylene blue tidak dapat
masuk sehingga sel bakteri BTA berwarna merah.
Lalu preparat dikeringkan dikeringkan dengan kertas saring.
Penotolan dengan kertas saring harus hati-hati agar olesan bakteri tidak
terbawa pada kertas saring. Lalu,kaca preparat ditetesi dengan
menggunakan minyak imersi. Hal ini dikarenakan, cahaya yang datang
dibiaskan melalui 2 medium yang berbeda, yaitu udara dan kaca. Oleh
karena itu, dibutuhkan suatu bahan yang mampu membiaskan cahaya dari
medium udara dan medium kaca dengan pembiasan yang mendekati garis
normal. Bahan yang mampu membiaskan cahaya dari medium udara dan
medium kaca dengan pembiasan yang mendekati garis normal adalah
minyak imersi. Selain itu, minyak imersi juga mempunyai indeks bias
yang mendekati atau identik dengan kaca.Setelah itu diamati dibawah
mikroskop
Hasil Pengamatan pada praktikum kali ini sel bakterinya sulit untuk
diamati dan berbeda dengan hasil literature. Pada praktikum kali
ini,,bentuk sel bakteri Mycobacterium tubercolosis tidak terlihat batang
dan warnanya juga tidak merah sebagaimana literature.
Hal ini mungkin dapat disebabkan oleh :
1.Olesan bakteri tidak rata dan terlalu tipis sehingga sulit untuk diamati
pada mikroskop/ hasil pengamatan tidak jelas
-
2.Pada saat pengolesan bakteri dengan ose,ose yang digunakan masih
panas sehingga dinding bakteri pecah dan bentuknya tidak dapat diamati
3.Pembilasan dengan air suling yang terlalu keras menyebabkan olesan
bakteri terbawa oleh air
4.Proses penotolan dengan kertas saring yang tidak benar dan terlalu keras
sehingga bakteri sampel malah menempel pada kertas saring.
5. Zat warna tidak merata masuk ke dalam dinding bakteri / proses
pewarnaan yang kurang lama
6.Fiksasi yang terlalu lama dapat menyebabkan dinding bakteri pecah
sehingga sulit untuk diamati
IX. SIMPULAN
1.Dapat mengamati dua jenis bakteri yaitu bakteri tahan asam dan bakteri
tidak tahan asam, dengan menggunakan prosedur pewarnaan tahan asam
Pada bakteri tahan asam akan mempertahankan warna merah sedangkan
bakteri tidak tahan asam akan berwarna biru.
2. Bakteri tahan asam yang digunakan adalah sel Mycobacterium
tubercolosis
3.Praktikan dapat memahami cara pewarnaan bakteri tahan asam
-
DAFTAR PUSTAKA
Ball, A.S. 1997. Bacterial Cell Culture : Essential Data. John Wiley & Sons,
New
Fardiaz, S., 1992. Mikrobiologi Pangan I. Gramedia Pustaka Utama, Jakarta.
Jawetz, E., Joseph Melnick&Edward Aldeberg.1996. Mikrobiologi
Kedokteran, diterjemahkan oleh Edi Nugroho dan R. F
Maulany.Jakarta: Penerbit Buku kedokteran EGC.
Jutono dkk, 1980. PEDOMAN PRAKTIKUM MIKROBIOLOGI UMUM (untuk
perguruan tinggi). Fakultas Pertanian Universitas Gadjah Mada,
Yogyakarta.
Lay, B. W. 1994. Analisis Mikroba di Laboratorium. Jakarta: PT. Raga Grafindo
Persada.
Pelczar, M J.dan E.C.S Chan.1986.Dasar- dasar Mikrobiologi Jilid 1Jakarta:
UI Press.
-
LAPORAN PRAKTIKUM MIKROBIOLOGI FARMASI
PEWARNAAN SPORA
Selasa, 4 Maret 2015
Kelompok III
Selasa , Pukul 10.00 13.00 WIB
Nama NPM
WIRNA GRACE .S 260110130092
LABORATORIUM MIKROBIOLOGI FARMASI
FAKULTAS FARMASI
UNIVERSITAS PADJADJARAN
2015
Nilai TTD
(Casuarina) (Andini) ( Emanuella)
-
PEWARNAAN SPORA
I. TUJUAN
Mengamiati endospora bakteri dengan menggunakan prosedur pewarnaan
spora (pewarnaan Klein). Memahami setiap langkah dan reaksi-reaksi
kimia yang terjadi daam prosedur tersebut.
II. PRINSIP
1.Pewarnaan spora
Pewarnaan spora merupakan pewarnaan dengan menggunakan
malchit green dan safranin, yang dalam hasil pewarnaanya akan muncul
warna hijau pada sporanya, serta warna merah pada sel vegetatifnya, yaitu
pada Bacillus subtilis.
2.Teknik aseptis
Teknis aseptis merupakan suatu teknis yang dilakukan dalam
pemindahbiakan bakteri agar bakteri yang dibiakan tidak mengalami
kontaminasi, dengan teknis aseptis diharapkan bakteri yang
dipindahbiakan mempertahankan kemurniannya.
3. Impermeabilitas spora
Sifat spora yg tidak bisa ditembus oleh apapun. Maksudnya pori-pori
spora tersebut sangat rapat jadi tidak bisa dilewati oleh benda lain.
4. Penetrasi zat warna
Dalam pengamatan spora bakteri diperlukan pewarnaan tertentu
yang dapat menembus dinding tebal spora. Namun ada juga zat warna
khusus untuk mewarnai spora dan di dalam proses pewarnaannya
melibatkan proses pemanasan, yaitu; spora dipanaskan bersamaan dengan
zat warna tersebut sehingga memudahkan zat warna tersebut untuk
meresap ke dalam dinding pelindung spora bakteri.
III. TEORI DASAR
Spora bakteri ini dapat bertahan sangat lama, ia dapat hidup
bertahun-tahun bahkan berabad-abad jika berada dalam kondisi
-
lingkungan yang normal. Kebanyakan sel vegetatif akan mati pada suhu
60-70oC, namun spora tetap hidup, spora bakteri ini dapat bertahan dalam
air mendidih bahkan selama 1 jam lebih. Selama kondisi lingkungan tidak
menguntungkan, spora akan tetap menjadi spora, sampai kondisi
lingkungan dianggap menguntungkan, spora akan tumbuh menjadi satu sel
bakteri yang baru dan berkembangbiak secara normal (Volk & Wheeler,
1988).
Spora bakteri adalah bentuk bekteri yang sedang dalam usaha
mengamankan diri terhadap pengaruh buruk dari luar. Spora bakteri
mempunyai fungsi yang sama seperti kista amoeba, sebab bakteri dalam
bentuk spora dan amoeba dalam bentuk kista merupakan suatu fase
dimana kedua mikroorganisme itu berubah bentuk untuk melindungi diri
terhadap faktor luar yang tidak menguntungkan.(Dwidjoseputro, 2001)
Sepanjang pengetahuan yang kita miliki sekarang, hanya golongan
basillah yang dapat membentuk spora, akan tetapi tidak semua basil
mampu berbuat demikian. Beberapa spesies Bacillus yang aerob dan
beberapa spesies Clostridium yang anaerob dapat membentuk spora. Spora
ini lazim disebut endospora, dikarenakan spora itu dibentuk di dalam sel.
(Dwidjoseputro, 2001)
Endospora hanya terdapat pada bakteri. Merupakan tubuh
berdinding tebal, sangat refraktif, dan sangat resisten, dihasilkan oleh
semua spesies Bacillus, Clostridium dan Sporosarcina. Bakteri yang
mampu membentuk endospora dapat tumbuh dan bereproduksi selama
banyak generasi sebagai sel vegetatif. Namun pada beberapa tahapan di
dalam pertumbuhannya, terjadi sintesis protoplasma baru dalam
sitoplasma vegetatifnya yang dimaksudkan untuk menjadi spora.
(Pelczar,1986)
Bentuk spora ada yang bulat, ada pula yang bulat panjang, hal ini
bergantung pada spesies. Endospora ada yang lebih kecil dan ada pula
-
yang lebih besar daripada diameter sel induk. (Dwidjoseputro, 2001)
Letak endospora di dalam sel serta ukurannya selama
pembentukannya tidaklah sama bagi semua spesies. Sebagai contoh,
beberapa spora adalah sentral yaitu dibentuk di tengah-tengah sel, yang
lain terminal yaitu dibentuk di ujung; dan yang lain lagi subterminal yaitu
di dekat ujung. (Pelczar,1986)
Pada umumnya sporulasi itu mudah terjadi, jika keadaan medium
memburuk, zat-zat yang timbul sebagai pertukaran zat bertimbun-timbun
dan faktor-faktor luar lainnya merugikan. Tetapi pada beberapa spesies
mampu membentuk spora meskipun tidak terganggu oleh faktor luar.
Sporulasi dapat dicegah, jika selalu diadakan pemindahan piaraan ke
medium yang baru. Beberapa spesies bakteri dapat kehilangan
kemampuannya untuk membentuk spora. Spora dapat tumbuh lagi menjadi
bakteri biasa apabila keaadaan di luar menguntungkan. Mula-mula air
meresap ke dalam spora, kemudian spora mengembang dan kulit spora
menjadi retak karenanya. Keretakan ini dapat terjadi pada salah satu ujung,
tetapi juga dapat terjadi pada tengah-tengah atau dekat tengah-tengah
spora. Hal ini merupakan ciri khas bagi beberapa spesies Bacillus. Jika
kulit spora pecah di tengah-tengah, maka masing-masing pecahan akan
merupakan suatu tutup pada kedua ujung bakteri. (Dwidjoseputro, 2001)
Proses pewarnaan endospora dilakukan setelah fiksasi dan setelah
dibuat apusan preparat.Kemudian preparat diberikan malakit hujau yang
berfungsi sebagai pewarna primer yangdigunakan untuk melumuri fiksasi
panas. Preparat diuapkan diatas air mendidih dengan tujuanuntuk
memperbesar pori-pori bakteri agar pada saat pewarnaan dapat menembus
dindingendospora dan dijaga jangan sampai pewarna kering. Kemudian
dicuci dengan air dialirkan dariatas, yang bertujuanuntuk menghilangkan
malacite green dari seluruh bagian sel endospora.Pewarnaan safranin
-
bertujuan untuk counterstein yang digunakan untuk melumuri bagian
warnadari sel yang lain dari pada endospora. Hasil uji bakteri
Bacillus subtilis menghasilkan bakteri
gram positif. Prinsip pewarnaan spora didasarkan pada penggunaan zat wa
rna malachite green dan safranin dimana pada hasil pewarnaan akan
menghasilkan warna hijau pada spora dan warna merah pada sel
vegatitifnya (Lay 1994).
IV. ALAT BAHAN
-
Alat :
1. Bak warna
2. Botol semprot
3. Kaca objek
4. Kapas
5. Kertas saring
6. Mikroskop
7. Ose
8. Pipet tetes
9. Spiritus
10. Tabung reaksi
Botol semprot Kaca objek Bak warna
Kertas saring Mikroskop
Kapas
Tabung reaksi Spiritus
Pipet tetes
-
Bahan
1. Alkohol 70% 2.Air suling 3. Emerge oil
4.Asam Sulfat 1% 5.Supensi 6.NaCl Fisiologis
Bacillus subtilis
7. Zat warna 8. Zat warna
Biru Metilen Karbol Fuksin
V. PROSEDUR
Mula-mula disiapkan alat dan bahan yang dibutuhkan. dibuat suspensi
bakteri yang terdiri dari biakan bakteri dan NaCl fisiologis di tabung
reaksi. Ditambahkan korbol fuksin sebanyak 1:1 ke dalam suspensi
tersebut. Dipanaskan campuran tersebut dalam pemanas air bersuhu 800C
selama 10 menit. Daga jangan sampai mendidih atau kering. Disediakan
kaca obyek yang bersih dan buat olesan dari campuran tersebut. Digenangi
olesan dengan H2S04 1% selama 2 detik, lalu dicuci dengan air suling.
-
Digenangi olesan dengan pewarna tandingan biru metilen selama 5 menit,
dibuang zat warna yang berlebih, dibilas dengan air suling, lalu
dikeringkan dengan kertas saring. Diteteskan sedikit minyak imersi pada
preparat, lalu diperiksa di bawah mikroskop. Dimulai dengan obyektif
berkekuatan terendah 10X, lalu ganti dengan lensa obyektif berkekuatan
100X. Diamati dan digambarkan hasilnya. Endospora akan berwarna
merah dan badan vegetative akan berwarna biru.
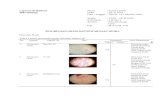
VI. DATA PENGAMATAN
SAMPEL LITERATURE
Bentuk bakteri : Batang
Warna Bakteri : Biru
Warna Spora : Tidak dapat
teramati
http://www.austincc.edu/microbugz/endospore_sta
in.php
Bentuk bakteri : Batang
Warna Bakteri : Biru
Warna Spora : Merah
VII. PEMBAHASAN
Telah dilakukan praktikum pewarnaan spora. Yang pertama kali harus
dilakukan adalah menyediakan alat dan bahan yang dibutuhkan diatas
meja. Hal ini dilakukan agar praktikum dapat berjalan dengan baik tanpa
kekurangan bahan-bahan yang diperlukan. Meja harus dibersikan dahulu
menggunakan desinfektan. Ini bertujuan untuk membunuh bakteri yang
-
ada pada meja yang mungkin akan mengontaminasi preparat bakteri yang
akan kita buat.
Menyiapkan alat dan bahan. Suspensi bakteri dibuat dari biakan bakteri
dan NaCl fisiologis steril di dalam tabung reaksi. Fungi NaCl Fisiologis
berfungsi sebagai pengencer agar suspense sampel yang akan digunakan
steril dan menghindari adanya kontaminan pada sampel. Selain itu,NaCl
Fisiologis juga mempertahankan kondisi pH dari sampel suspensi.
Sebagaimana telah diketahui bahwa pertumbuhan mikroorganisme sangat
peka terhadap perubahan pH . Larutan pengencer NaCl Fisiologis steril
merupakan larutan netral sehingga tidak mempengaruhi kondisi pH.
Lalu ditambahkan karbol fuksin sebanyak 1 : 1 ke dalam suspense
tersebut. Kemudian dipanaskan campuran tersebut dalam penangas air
bersuhu 80o C selama 10 menit. Penambahan karbol fuksin adalah sebagai
pewarna untuk mewarnai bakteri dengan warna merah. Hal ini bertujuan
untuk memperbesar pori-pori bakteri agar zat warna dapat menembus
dinding endospora serta jaga jangan sampai mendidih atau kering karena
dinding bakteri akan hancur jika terlalu panas.Pemanasan pada suhu 80o C
bermaksud untuk membunuh sel vegetative bakteri.Sedangkan sel spora
tidak akan mati pada suhu 80o C,bahkan spora masih dapat hidup selama 1
jam dalam air mendidih. Pada praktikum kali ini,pembuatan suspense
bakteri dilakukan dengan mencampurkan zat warna dengan suspense
bakteri secara bersama pada saat pemanasan. Hal ini bertujuan agar
memudahkan zat warna tersebut untuk meresap ke dalam dinding
pelindung bakteri. Spora sangat sulit untuk diwarnai,tetapi ketika sekali
diberikan pewarnaan maka zat warna tersebut akan sulit untuk dilepaskan
dari dinding spora Karena dinding spora mengandung asam
dupikolinat,yang mana substansi ini tidak dapat ditemui pada sel
vegetative atau dengan kata lain senyawa ini khas dimiliki oleh spora.
Karena mengandung senyawa ini lah spora memiliki dinding yang relatif
-
tidak permeable, namun zat warna bias menembusnya dengan cara
memanaskan preparat,selain itu senyawa ini juga menyebabkan
metabolismenya bersifat inaktif dan mampu bertahan dalam tekanan fisik
dan kimia seperti panas, kering, dingin, radiasi, dan bahan kimia.Oleh
sebab itu dengan bantuan pemanasan maka pori-pori pada dinding spora
akan melebar sehingga zat warna karbol fuksin lebih mudah masuk.
Selanjutnya adalah membuat olesan bakteri. Mengambil sebuah kaca
obyek dari larutan alcohol. Kaca obyek yang akan digunakan untuk
membuat olesan bakteri haruslah bersih dan steril. Itulah sebabnya kaca
obyek direndam terlebih dahulu pada larutan alcohol. Kaca obyek
kemudian dikeringkan dengan menggunakan kapas steril. Kaca obyek
dilap searah hingga kering. Hal ini bertujuan agar tidak ada sisa kapas
yang menempel pada kaca obyek yang dapat mengganggu hasil
pengamatan. Pada satu sisi kaca obyek diberi lingkaran dengan
menggunakan spidol, tidak terlalu besar dan tidak terlalu kecil. Hal ini
dilakukan untuk membuat batas pengamatan yang akan kita kerjakan.
Nyalakan pembakar spiritus menggunakan korek api. Panaskan
(fiksasi) ose hingga membara. Hal ini bertujuan untuk membunuh sisa
bakteri yang menempel di ose yang dapat mengganggu hasil pengamatan.
Ose didinginkan di dekat pembakar spiritus. Ambil suspensi bakteri
dengan menggunakan tangan kiri. Buka penutup tabung dan miringkan.
Ambil suspensi bakteri dengan menggunakan ose didekat api. Tabung
suspense dan penutupnya difiksasi didekat api dan disimpan pad arak
tabung. Suspensi bakteri pada ose dioleskan pada kaca obyek yang telah
diberi lingkaran secara merata. Ose difiksasi kembali hingga membara
untuk membunuh sisa bakteri yang menempel pada kawat ose. Olesan
yang baik adalah olesan yang tidak terlalu tebal atau terlalu tipis serta
tahan terhadap pencucian satu kali atau lebih. Pada olesan yang terlalu
tebal, sel-sel bakteri akan bertumpuk sehingga sulit untuk diamati pada
-
mikroskop. Sedangkan pada olesan yang terlalu tipis, akan sulit
menemukan sel-sel tersebut. Setelah itu fiksasi kaca obyek diatas
pembakar spiritus. Olesan bakteri harus betul-betul kering, olesan yang
belum kering akan menyebabkan sel-sel bakteri seakan-akan terbawa dan
bentuknya menjadi tidak karuan. Fiksasi ini berfungsi supaya bakteri
selain bakteri target yang akan diamati mati sehingga tidak mengganggu
hasil pengamatan, selain itu untuk menempelkan bakteri pada kaca supaya
bakteri tidak hilang saat mencuci. Fiksasi ini tidak boleh terlalu lama
karena dinding sel bakteri akan pecah jika terkena panas terlalu lama atau
panas yang berlebihan. Fiksasi yang baik adalah fiksasi yang tidak
merubah bentuk bakteri atau tidak menyusutkan / mengkerutkan bakteri.
Kemudian olesan bakteri ditetesi dengan H2SO4 1% dan dicuci dengan air
suling. Proses pencucian ini menyebabkan por-pori dinding spora yang
semula melebar,kembali mengecil. Tahapan ini lah yang mengakibatkan
dekolorisasi dengan asam-alkohol tidak akan melarutkan zat warna karbol
fuksin pada spora .Kemudian olesan digenangi dengan pewarna tanding
biru metilen selama 5 menit. Tujuan pemberian methylen blue adalah
memberi warna background ( pewarna sekunder ). Hal ini berfungsi untuk
mewarnai kembali sel-sel yang telah kehilangan pewarna utama setelah
perlakuan dengan asam alkohol. Bakteri yang tidak berspora cenderung
tidak tahan pengecatan karena hanya memiliki sel vegetatif. Saat diwarnai
oleh karbol fuksin, sel vegetatif dapat mengikat warna tetapi dapat luntur
setelah dilunturkan karena ikatannya tidak kuat. Setelah pewarnaan
selanjutnya dengan metilen biru, sel vegetatif mudah mengikat warna
kembali. Oleh karena itu, hasil pewarnaan akhir adalah biru dari metilen
biru.
Lalu zat warna yang berlebih dibilas dengan air suling dan
dikeringkan dengan kertas saring. Penotolan dengan kertas saring harus
hati-hati agar olesan bakteri tidak terbawa / menempel pada kertas saring.
-
Lalu,kaca preparat ditetesi dengan menggunakan minyak imersi. Hal ini
dikarenakan, cahaya yang datang dibiaskan melalui 2 medium yang berbeda,
yaitu udara dan kaca. Oleh karena itu, dibutuhkan suatu bahan yang mampu
membiaskan cahaya dari medium udara dan medium kaca dengan
pembiasan yang mendekati garis normal. Bahan yang mampu membiaskan
cahaya dari medium udara dan medium kaca dengan pembiasan yang
mendekati garis normal adalah minyak imersi. Selain itu, minyak imersi
juga mempunyai indeks bias yang mendekati atau identik dengan
kaca.Setelah itu preparat diamati dibawah mikroskop
Bakteri yang diamati adalah bakteri Bacillus subtilis memiliki sel
vegetative yang berwarna biru, spora yang berwarna merah tidak dapat
diamati. Hal ini mungkin disebabkan oleh :
1.Biakan spora suspense bakteri belum matang, seharusnya umur biakan
bakteri yang digunakan 36 jam. Tapi pada praktikum kali ini umur biakan
hanya 24 jam. Menyebabkan spora belum matang,sehingga karbol fuksin
tidak masuk secara sempurna dan sulit diamati
2.Proses pencucian yang terlalu lama dapat menyebabkan sel bakteri
terbawa air/ tercuci oleh air.
VIII. SIMPULAN
1.Endospora bakteri dapat diamati dengan mengggunakan prosedur
pewarnaan spora .
2. Hasil pengamatan :
Badan vegetative : warna biru
Spora : warna merah muda
Sel vegetative : bentuk batang
-
3. Praktikan dapat memahami pewarnaan spora dengan baik.
-
DAFTAR PUSTAKA
Dwidjoseputro, D.2005. Dasar- dasar Mikrobiologi. Jakarta: PT Penerbit
Djambatan.
Lay, B. W. 1994. Analisis Mikroba di Laboratorium. Jakarta: PT. Raga Grafindo
Persada.
Pelczar, M J.dan E.C.S Chan.1986.Dasar- dasar Mikrobiologi Jilid 1Jakarta:
UI Press.
Volk, W.A dan Margaret Fwheeler.1988.Mikrobiologi Dasar, diterjemahkan oleh:
Markham, M.sc.Jakarta: Erlangga.