MONITOREO_OCEANOGRÁFICO- PUCUSANA
-
Upload
steven-de-la-cruz -
Category
Documents
-
view
33 -
download
1
Transcript of MONITOREO_OCEANOGRÁFICO- PUCUSANA

MONITOREO OCEANOGRÁFICO EN LA CALETA DE PUCUSANA NOVIEMBRE 2013
Alva Pacheco, Joe De La Cruz Quispitongo, Hans Pajares Ato, JacquelinPomalaza Guerrero, Lynda Criss
CONTENIDO RESUMEN………………………………………………………………………………………………………………………….……………………………………….1INTRODUCCIÓN………………………………………..………………………………………………………………………………………………………..….……..2OBJETIVOS……………………………………………………………..…………………………………………………………………………………………………..2MATERIALES Y MÉTODOS…………………………………………………………..……………………………………………………………….…….……………2PROCEDIMIENTO……………………………………………….…………………………………….…………………………………………………………………..5RESULTADOS.…………………………….………………………………………………………………………….……………………………….…………………...8CONCLUSIÓN. ……………………….…………………………………………………………………………………………….……..……………………………...11REFERENCIA BIBLIOGRÁFICA ………………………………………………………………………..………………………………..…………………………….11ANEXOS………………………………………………………………………………………………………………….………………………………………………..12.
RESUMEN:
El monitoreo Oceanográfico en el área seleccionada en la caleta de Pucusana, fue realizado el 11 de noviembre
del 2013 y cubrió en área de Naplo con coordenadas de Latitud: -12.483333 y Longitud: -76.783333. La
temperatura fluctuó entre 17°C y 19°C, mostrando un ligero enfriamiento en las aguas. Además se evaluó
diferentes parámetros para analizar las condiciones ambientales de la Caleta de Pucusana para determinar si se
encuentra dentro de los estándares nacionales de calidad del agua.
1. INTRODUCCIÓN:
Durante el desarrollo de la evaluación en la caleta de Pucusana, se tomó un área de Naplo para realizar diferentes
pruebas de control de calidad del agua , la cual se realizado a 150 m de costa , se realizaron diferentes pruebas
para analizar diferentes parámetros para determinar de DBO5, nitritos, fosfatos, tipo de sedimentos, nitratos, SST,
oxigeno disuelto y aceites y grasas, con estos análisis tratamos de observar y medir los parámetros físicos y
químicos para luego evaluarlo con los estándares de calidad del agua y determinar si esta zona se encuentra
contaminada por diferentes factores externos que puedan alterar el ecosistema marino.
2. OBJETIVOS:
1Ingeniería de Flotas

1.1. Objetivo General:
Evaluar la calidad del agua en la Pucusana ( Naplo)
1.2. Objetivos Específicos:
Determinación de DBO5
Determinación de nitritos
Determinación de fosfatos
Determinación de tipo de sedimentos
Determinación de nitratos
Determinación de SST
Determinación de Oxigeno disuelto
Determinación de aceites y grasas
3. MATERIALES Y METODOS
3.1. MATERIALES:
ANALÍSIS MATERIALES EQUIPOS REACTIVOS
DBO5
Botellas de 300 mL con tapa, Erlenmeyers, Buretas, Pipetas de 2 ml, 10 ml Reactivos Incubadora
REACTIVO I: Sulfato manganoso, REACTIVO II: Soluc. Yoduro-alcalina, Acido sulfúrico concentrado, Tiosulfato de sodio 0,025 N, - Almidón al 10% en glicerina
Nitritos
Frascos, tubo de ensayo,
probetas, pipetas, pera de
goma, pisceta, rotulador y
fiolas.
Espectrofotómetro
Cloruro de amonio EDTA, R-1 Solución sulfanilamida, R-2 N-naftil etilendiamida, Solución estándar de nitrato 1000 ppm, Solución estándar de nitrito 1000 ppm
Fosfatos
Frascos, tubo de ensayo,
probetas, pipetas, pera de
goma, piseta, rotulador y
fiolas.
Espectrofotómetro
PO4 (1000ppm), H2SO4 , Acido Ascórbico, Amonio Molibdato, Solución Emético
Granulometría
Luna reloj, pinza de brazo
largo, cajas pequeñas,
espátula , y rotulador
Estufa , tamizador y
balanza manual
2Ingeniería de Flotas

Nitratos
Frascos, tubo de ensayo,
probetas, pipetas, pera de
goma, piseta, rotulador y
fiolas. Columna de reducción
de cadmio
Espectrofotómetro
Cloruro de amonio EDTA, R-1 Solución sulfanilamida, R-2 N-naftil etilendiamida, Solución estándar de nitrato 1000 ppm, Solución estándar de nitrito 1000 ppm, Limaduras de cadmio, Amalgama de Cobre
SSTCápsulas, desecador, papel
filtro,
Mufla, estufa, balanza
analítica
Oxigeno disuelto
Botellas de 300 mL con tapa,
Erlenmeyers ,Buretas,
Pipetas de 2 ml
Sulfato manganoso,
Soluc. Yoduro-
alcalina , Ácido
sulfúrico concentrado,
Tiosulfato de sodio
0,025 N y Almidón al
10% en glicerina
Aceites y grasas
Pera de decantación, soporte
universal, pinza tipo aro ,
probetas, pipetas, embudo ,
papel filtrador, placas petri ,
beaker
Balanza analítica NaSO4, HCl, hexano
Fito y zoo planctonPorta y cubre objetos, gotero,
pinza,Microscopio Formol
3.2. MÉTODOS:
Determinación de DBO5:
Metodo de Winkler: El método de winkler es el método más reproducible y más preciso para la
determinación de oxígeno disuelto a condición de respetar escrupulosamente ciertos puntos de
lal metodología.
Determinación de nitritos:
Método de Reducción: Este método es aplicable en el intervalo de concentraciones entre 0,01
mg de N-NO3-/L a 1,0 mg de N-NO3-/L. El método se recomienda especialmente para niveles
de nitrato por debajo de 0,1 mg N/L, donde otros métodos carecen de la sensibilidad adecuada.
Determinación de fosfatos:
3Ingeniería de Flotas

Colorimetría: Ciertas formas orgánicas pueden hidrolizarse durante el proceso de formación de
color y dar los ortofosfatos. El desarrollo de la coloración se acelerar utilizando un catalizador,
hermético, tartrato doble de antimonio hipotásico. La sensibilidad del método se aumenta
extrayendo la coloración azul con un disolvente
Determinación de tipo de sedimentos:
Método granulométrico: El método de determinación granulométrico más sencillo es hacer
pasar las partículas por una serie de mallas de distintos anchos de entramado (a modo
de coladores) que actúen como filtros de los granos que se llama comúnmente columna de
tamices.
Determinación de nitratos:
Método de Reducción: Este método es aplicable en el intervalo de concentraciones entre 0,01
mg de N-NO3-/L a 1,0 mg de N-NO3-/L. El método se recomienda especialmente para niveles
de nitrato por debajo de 0,1 mg N/L, donde otros métodos carecen de la sensibilidad adecuada.
Determinación de oxígeno disuelto:
Método de Winkler: El método de winkler es el método más reproducible y más preciso para la
determinación de oxígeno disuelto a condición de respetar escrupulosamente ciertos puntos de
la metodología.
Determinación de SST:
Método de gravimetría: Este método determina el residuo remanente después de secar una
muestra de agua.
Determinación de aceites y grasa:
Método gravimétrico: Se emplean varias fracciones de hexano, las que se agitan
sucesivamente con una muestra de agua a pH 6
4. PROCEDIMIENTO:
DBO5
Procedimiento
1. Coger la muestra y verter al beaker para luego en echar en forma laminar al frasco O.D. para evitar la presencia de burbujas luego tapar y botar el exceso.
2. Luego agregar 1ml del REACTIVO I (MnSO4) y REACTIVO II a cada uno de los frascos O.D y se mueve de 2-5min para homogenizar (se observa un color carmelita por la presencia de O2, se observa la separación de una fase liquida y otra precipitada).
4Ingeniería de Flotas

3. Los frascos se colocan a la incubadora por 5 dias a 20ºC.4. Se saca los frascos de la incubadora, Luego de 30 minutos se agrega 1 ml H2SO4 a
los frascos y tapar, luego verter el exceso y observar cambio a color ambar.5. Se miden 200ml de cada muestra con una probeta y se vierten en el matraz, se le
hecha gotas de almidón y se titula con tiosulfato.
NITRITOS
Procedimiento
1. Preparar la solución estándar, en la fiola. Se introduce 1ml de NO2- (1000ppm) con una pipeta volumétrica para una mejor precisión; luego se completa la fiola con agua destilada y homogenizar.
2. Preparación de los estándares, en 4 probetas: Probeta 1: 50ml de agua destilada Probeta 2: 0.1ml de alícuota de la fiola, completar con agua destilada hasta
50ml. Probeta 3: 0.2ml de alícuota de la fiola, completar con agua destilada hasta
50ml. Probeta 4: 0.4ml de alícuota de la fiola, completar con agua destilada hasta
50ml.3. Preparación de las muestras:
3 probetas de 50ml con agua de mar.4. Luego se les agrega a las 7 probetas, 1ml del reactivo I(Solución de Sulfalinamida) y
1ml del reactivo II (N-1 Naftilelilendiamida).5. Se deja reposar las probetas de 15 a 20 minutos.6. Luego cuando se observa el cambio de color a rojo claro, se lleva las muestras y los
estándares al espectrofotómetro para medir la absorbancia.
FOSFATOS
- Procedimientos para la Prueba
1. Antes de hacer la prueba, todos los frascos o tubos de ensayo usados deben limpiarse a fondo, preferiblemente se
deben lavar con agua destilada o desmineralizada.
2. Saca el equipo para la prueba de fosfatos. Sigue las instrucciones que vienen con el equipo cuidadosamente.
5Ingeniería de Flotas
Nivel de Fosfato
(en ppm)Calidad del Agua
0,0 - 1,0 Excelente
1,1 - 4,0 Buena
4,1 - 9,9 Aceptable
10,0 o más Mala

3. Cuando anotes tus resultados para este proyecto, debes reportar las mediciones de los
fosfatos en ppm.
- Procedimiento experimental:
1. Preparamos la Solución Hija con la solución Standard de 1000ppm.
2. Rotulamos 4 probetas, agregando a cada probeta la solución hija con sus respectivos ml y
enrasándolo con agua destilada.
3. Agregar 4ml de la mezcla de reactivos a cada probeta con sus respectivos ml y a las
muestras.
4. Luego esperar 20 min para llevar al espectrofotómetro y leer las absorvancias.
5. Registrar las absorvancias y analizar los resultados
GRANULOMETRÍA
1. Pesar en la balanza manual aproximadamente 100 g de muestra.2. Llevar con una pinza de brazo largo la muestra a la estufa a 110 °C por un día.3. Retirar la muestra y ponerla en el mortero para triturarla con el pilón, hacer esta operación
hasta obtener un grano muy pequeño.4. Poner la muestra en el tamizador correctamente y luego zarandear el tamiz para que las
partículas se depositen en la criba adecuada.5. Después de tamizar, se toma el material retenido de cada tamiz y se pesa.6. El % retenido será igual a la masa del material retenido en el tamiz multiplicado por 100
de la masa total de la muestra.7. El % que pasa será igual a 100 menos el % retenido acumulado8. Analizar los resultados según escala granulométrica de wentworth para determinar que
grano es.
NITRATOS
Procedimiento
1. Se toman 50ml de cada muestra en probetas.2. Se pasan las muestras por la columna de cadmio: Se hecha 20ml de cada muestra en la
columna para limpiarla y se deja pasar por la columna de cadmio, luego se echa el resto (30ml) y se recupera 25ml en una probeta. Se hace esto con todas las muestras.
3. Luego se le agrega a cada muestra de 25ml Reactivo I y Reactivo II.4. Se llevan las muestras al espectrofotómetro para hallar la absorbancia.5. Finalmente mediante el espectrofotómetro se determinara la ley de Beer para determinar
la curva de absorbancia con concentración. Con esta curva resultante se hallara las concentraciones de las muestras.
SÓLIDOS SUSPENDIDOS TOTALES
Procedimiento
Los sólidos en suspensión son los que tienen partículas superiores a 1 micrón. En la práctica los sólidos en suspensión son aquellos posibles de ser retenidos por una filtración en análisis de laboratorio.
1. Se calcina una cápsula de porcelana a 500°C durante una hora en la mufla.2. Se enfría, se deseca, pesa y almacena lista para su uso.3. Se transfiere la muestra a la cápsula y se lleva a la estufa para secar la muestra por
una hora a 103-105°C.4. Se enfría la cápsula en un desecador y se pesa.
6Ingeniería de Flotas

5. Se repite el ciclo de secado de 103-105°C, enfriando, desecando y pesando hasta obtener un peso constante o hasta que la pérdida de peso sea menor que 4% del peso anterior.
6. Realizar los cálculos:
mglresiduototal=
(A−B ) x100ml demuestra
OXÍGENO DISUELTO
Procedimiento1. A una muestra de 300ml contenida en una botella de OD, se adiciona 2ml de RI (solución
de sulfato de manganeso) seguidos por RII (solución de álcali yoduro nitruro) bajo la superficie del líquido.
2. Se tapa cuidadosamente para eliminar las burbujas de aire y se agita.3. Luego se deja reposar para que se sedimente y se agrega 2ml de ácido sulfúrico
concentrado, se tapa nuevamente, y se agita para homogenizar.4. Se toma 200ml de en un matraz Erlenmeyer, se le agrega gotas de almidón y se titula con
tiosulfato hasta el cambio de color (desaparición del color azul).
ACEITES Y GRASAS
Procedimiento1. Se toma un litro de muestra y se acidifica a pH 2 con HCL 6N (5ml)2. Se lleva a un embudo de separación de dos filtros, se agrega 30ml de hexano y se
agita, se deja separar las capas y se drena el solvente a una cápsula o plato de vidrio de peso constante, es recomendable recuperar el solvente empleando balones de destilación en lugar de cápsulas.
3. Se hace dos extracciones más con 30ml de hexano cada una y se lleva a destilar en baño maría a 80°C y luego a secar a 80°C por 15 minutos, se enfría en el desecador y se pesa. En el caso de formarse emulsiones muy fuertes filtrar los extractos en papel de filtro conteniendo Na2SO4 antes de destilar.
4. Hacer los cálculos
mgde aceite y grasa / l= B−A x 100mlde muestra
Fitoplancton y zooplancton:
1. Tomar la muestra de fitoplancton y zooplancton con ayuda de un gotero2. Poner una gota en el porta objeto3. Poner un cubre objeto en la gota 4. Colocarla muestra en el microscopio5. Identificarla muestra.
5. RESULTADOS:
ASPECTOS DE LA ACTIVIDAD DE LOS ANALÍSIS MARINO COSTERAS:
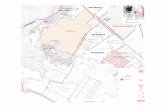
MONITOREO OCEANOGRAFÌALugar de muestreo: Bahía Naplo –distrito Pucusana
MUESTRA AGUA DE MAR
Estaciones de
muestreoNivel de muestreo
Nitritosmg/l
Nitratosmg/l
Fosfatosmg/l
Oxigeno disuelto
mg/lDBO5mg/l
SSTmg/l
Aceites y grasas
mg/l
7Ingeniería de Flotas

M-1 J.R
Superficie (0m) 0,042 0,728 0,074 3.10 2.25 38 < 1
Fondo(4m) 0,033 0,731 0,305 3.05 2.30 29 --
M-2 J.R
Superficie (0m) 0,038 0,736 0,232 3.10 2.05 36 < 1
Fondo(4m) 0,032 0,744 0,192 3.05 2.05 38 --
M-3 J.R
Superficie (0m) 0,034 0,696 0,204 3.15 1.98 39 < 1
Fondo(4m) 0,034 0,806 0,209 3.10 2.05 42 --
SEDIMENTO MARINO
GRANULOMETRIA
Malla (um) M-1 G.O% M-2 G.O% M-3 G.O%
--- Conchuelo Arena Conchuelo
> 3500 48,04 -- 29,25
> 1600 29,15 -- 24,85
> 1000 7,35 -- 6,09
> 500 7,23 13,68 13,52
> 355 4,23 32,09 12,03
> 250 2,99 31,20 8,74
> 180 0,77 15,80 3,54
> 125 0,14 5,46 1,47
> 90 0,07 1,64 0,41
> 53 0,01 0,13 0,07
< 53 0,01 0,01 0,01
Conchuelo: Residuos de las conchas
MATERIA ORGÁNICA
Estaciones de muestreo %
M-1 J.R 2.01
M-2 J.R 1.02
M-3 J.R 1.05
RESULTADO DE FITOPLANCTON
DIVISION / ESPECIE CÉLULAS/LITROBACILLARIOPHYTAChaetoceros affinis 1400Chaetoceros lorenzianus 2400Coscinodiscus radiatus 300
8Ingeniería de Flotas

Detonula pumila 440Ditylum brightwellii 200Eucampia zoodiacus 700Lithodesmium undulatum 1200Planktoniella sol 100Pleurosigma normanii 400Proboscia alata 300Thalassionema nitzschioides 800Thalassiosira anguste – lineata 600PYRROPHYTACeratium furca 100Ceratium tripos 200Dinophysis caudata 40Protoperidinium pellucidum 120Protoperidinium conicum 300Protoperidinium excentricum 100Protoperidinium sp 100CHRYSOPHYTADictyocha fibula 80
RESULTADO DE ZOOPLANCTONGRUPO ESTADIO Org.L-1
Phylum Annelida Clase Polychaeta Larvas 0,05Phylum Mollusca Clase Bivalvia Post larvas 0,1Phylum Arthropoda Subphylum Crustacea
Clase Clase Branchiopoda Orden Cladocera
Familia Podonidae
Podon polyphemoides Adultos y juveniles 1 Clase Maxillopoda
Subclase Copepoda Orden Calanoida
Familia Acartiidae
Acartia tonsa Adultos y copepoditos 3 Orden Cyclopoida Familia Oithonidae
Oithona sp. Adultos y copepoditos 3
RECURSOS HIDROBIOLOGICOS:
En la caleta del distrito de Pucusana, existe más de 90 especies de peces, de las cuales 15
especies son los más frecuentes siendo entre ellos las siguientes especies:
9Ingeniería de Flotas

6. Perico
7. Pejerrey
8. Bonito
9. Jurel
10. Tollo
11. Cabinza
12. Caracol
13. Tiburón
14. Pota
15. Choro
16. Machete
17. Lorna
18. Tiburón Azul
19. Caballa
6. CONCLUSIONES
DBO5
Los resultados obtenidos varían entre 1.98 – 2.25 mg/l, esto quiere decir que la demanda bioquímica de oxígeno es aceptable. Valores por encima de 30 mgO2/litro pueden ser indicativos de contaminación en aguas continentales, aunque las aguas residuales pueden alcanzar una DBO de miles de mgO2/litro.
Nitritos
Los resultado varían entre 0,032 - 0,042 mg/l. El agua de mar puede contener hasta 1mg/l (1ppm)de nitritos, pero aguas contaminadas pueden llegar a varios centenares de ppm
Fosfatos :
Los resultados de la muestra dieron que la cantidad de fosfatos que se ubican en esta zona se encuentran dentro del rango 1,1 - 4,0 con la categoría de bueno, esto quiere decir que el nivel de fosfatos se encuentra dentro de los estándares de calidad de agua que se acepta.
Granulometría :
El tipo de sedimento que se encontró en la muestra M-1 y M-3 fue conchuelo, por otro lado en la muestra M-2 se determino por el tipo de grano que es arena.
Nitratos Los resultados varían entre 0,696 - 0,806 mg/l, todas las concentraciones estuvieron debajo de los límites estándares.
Oxígeno disueltoLos resultados varían entre 3.05 – 3.15mg/l, el análisis de oxígeno disuelto es una prueba clave en el control de la polución del agua y en el control de los procesos de tratamiento de aguas residuales.
7. REFERENCAS BIBLIOGRÁFICAS:
- www.imarpe.gob.pe - www.minam.gob.pe
10Ingeniería de Flotas

- Análisis del agua – MERCK- Análisis de las aguas – J. RODIER
8. ANEXOS:ESTANDARES NACIONALES DE CALIDAD AMBIENTAL EN EL AGUA
Fuente: DECRETO SUPREMO N° 002-2008-MINAN
11Ingeniería de Flotas

ESCALA GRANULOMETRICA DE WENTWORTH
Escala granulométrica ( Geología)
Partícula Tamaño
Arcillas < 0,002 mm
Limos 0,002 – 0,06 mm
Arenas 0,06 – 2 mm
Gravas 2 – 60 mm
Cantos rodados 60 – 250 mm
Bloques >250 mm
Fuente: http://es.wikipedia.org/wiki/Clasificaci%C3%B3n_granulom%C3%A9trica
12Ingeniería de Flotas