El código visual del cerebro 1.0
-
Upload
diego-alexander-giraldo-garcia -
Category
Health & Medicine
-
view
534 -
download
5
Transcript of El código visual del cerebro 1.0
2
EL CÓDIGO VISUAL DEL CEREBRO
Por: Diego A. Giraldo G., OD, MSc.
COPYRIGHT © 2015
Documento de distribución gratuita y para uso académico
exclusivo. Como complemento formativo especialmente
dirigido hacia Profesionales de la Salud Visual en etapa de
pregrado o postgrado. Este documento, contiene material
que posee intrínsecamente derechos de autor como las
imágenes y textos de los artículos de investigación
publicados en la revista Franja Visual, que a su vez es
propiedad del Grupo Franja. Por lo cual, se recomienda su
utilización bajo los lineamentos legales nacionales e
internacionales que puedan aplicar al presente trabajo.
3
CONTENIDO PÁGINA
-Introducción al trabajo de David Marr………………………………………………………………………………6
-Referencias……………………………………………………………………………………………………………………….8
CAPÍTULO 1
TODO EMPEZÓ CON UN SENCILLO EXPERIMENTO PSICOFÍSICO…………………………………..…..9
-Experimentos Psicofísicos…………………………..……………………………………………………………………11
-Referencias……………………………………………………………………………………………………………………...15
CAPÍTULO 2
LA PERCEPCIÓN DE BORDES NO ES CUESTIÓN DE COLOR, ES CUESTIÓN DE ENERGÍA…...16
-Teoría del Contraste Espectral Acromático……………………………………………………………………..18
-Relación C.E.A-Mapeo Hemiretinotópico………………………………………………………………………..19
-Relación C.E.A.-Fenómeno Cognitivo……………………………………………………………………………….22
-Conclusión……………………………………………………………………….………………………………………………25
-Referencias……………………………………………………………………………………………………………………..25
CAPÍTULO 3
CONECTANDO EL PROCESAMIENTO DE BORDES CON LOS MOVIMIENTOS OCULARES….28
-La codificación de bordes es un paso necesario para la programación de los
movimientos oculares…………………………………………………………………………………………………….29
-Programación de los movimientos oculares con base en el ciclo LOCK-UNLOCK………..….30
-Bases Neurofisiológicas………………………………………………………………………………………………….31
-Conclusión……………………………………………………………………….…………………………………………….38
-Referencias……………………………………………………………………….…………………………………………..38
CAPÍTULO 4
CONECTANDO EL PROCESAMIENTO DE BORDES CON EL EQUILIBRIO CORPORAL………..43
-Papel de los bordes en el sentido del equilibrio corporal……………………………………………..44
-Teoría del mecanismo secundario para el equilibrio corporal en humanos…………………..45
-La codificación de bordes como posible base neural…………………………………………………….46
-Antecedentes experimentales…………………………………………………….……………………………….46
-Anatomofisiología comparativa entre el sistema vestibular y el sistema visual..……..…...47
-Una red de integración cortical…………………………………………………………………………………….50
-Conclusión……………………………………………………………………….…………………………………………..52
-Referencias……………………………………………………………………….………….…………………..…….……52
CAPÍTULO 5
CONECTANDO LOS BORDES CON LA PERCEPCIÓN DEL MOVIMIENTO………….……….….…..55
-Percepción visual del movimiento con base en el procesamiento del C.E.A……….….….…..57
-Introducción……………………………………………………………………….……………………………..……….…57
-Bases Neurofisiológicas……………………………………………………………………………………..……….…57
-Mecanismo neural básico de la percepción del movimiento……………………………….……...…59
-Modelo teórico para la percepción del movimiento por estimulación bidimensional.....62
-Modelo teórico para la percepción del movimiento por estimulación tridimensional..….63
-Deficiencias en la percepción del movimiento…………………………………………………………….…65
-Conclusión…………………………………………………………………………………………………………………….67
4
CAPÍTULO 6
NEURONAS SENSIBLES A LA DISPARIDAD Y CONTRALATERALIZACIÓN FUNCIONAL DEL
CEREBRO: BASES DE UN CEREBRO AL REVÉS……………………………………………………………….70
-Tenemos un cerebro al revés………………………………………………………………….…………………..71
-Neuronas sensibles a la disparidad y contralateralización funcional del cerebro:
Bases de un cerebro al revés ……………………………………………………………………………………….72
-Introducción……………………………………………………………………………………………………………..…72
-Definición de disparidad………………………………………………………………….…………………..…..…72
-Una amplia distribución anatómica……………………………………………………………………………..72
-Hipótesis sobre la contralateralidad funcional del cerebro………………………………………….73
-La existencia de economía conexional supone economía de procesamiento……………...76
-Neuronas que actúan como monitores tridimensionales de remapeo…………………..…….77
-Los bordes como base neural de la memoria por aferencias visuales……………..............78
-Discusión……………………………………………………………………….……………………………………….….79
-Referencias……………………………………………………………………….………………………………..………80
CAPITULO 7
PROYECTANDO EL MUNDO EXTERIOR DENTRO DEL CEREBRO………………………….…….….83
-Representación de la escena en la corteza visual………………………………………………………..85
-Mapas visuales……………………………………………………………………….…………………………………..85
-Mapa No.1.de acuerdo a la excentricidad en V1………………………………………………………...86
-Mapa No.2 Mapa angular de V1………………………………………………………………………………….87
-Mecanismo conexional de duplicación especular……………………………………………………....87
-Mapa No.3. Topografía en espejo de las áreas visuales………………………………………………88
-Mapa No.4.Sumatoria Perceptual en las áreas visuales……………………………………………...89
-Conclusión……………………………………………………………………….…………………………………………90
CAPÍTULO 8
IMAGINANDO CÓMO LAS NEURONAS VISUALES SE COMUNICAN……………………………..92
-El código de las neuronas visuales………………………………………………………………………………93
-Teoría sobre el procesamiento de la información visual……………………………………………..94
-Características genéticas y fotónicas……………………………………………………………………….….94
-Topografía y jerarquización de los procesos……………………………………………………………....95
-Procesamiento desde la retina hasta la corteza occipital…………………………………………….97
-Conclusión……………………………………………………………………………………………………………..……108
-Referencias……………………………………………………………………………………………………………...…108
CAPÍTULO 9
ROSTROS CODIFICADOS EN BORDES……………………………………………………………………………110
-La importancia del procesamiento de las caras……………………………………………………..……111
-Nos conocemos? Una breve mirada a la Prosopagnosia……………………………………………...112
-Antecedentes experimentales…………………………………………………………………………………....112
5
-localización de las zonas de procesamiento facial…………………………………………………………113
-Etiología de la Prosopagnosia………………………………………………………………………….……………114
-Conclusión…………………………………………………………………………………………………………………….116
-Referencias…………………………………………………………………………………………………………………..116
CAPÍTULO 10
RELACIONANDO LA CODIFICACIÓN DE BORDES CON LA IMITACIÓN………………….…………117
-Las neuronas espejo y su código……………………………………………………………………………………118
-Neuronas espejo y visión……………………………………………………………………………………………...119
-Distribución en la corteza cerebral…………………………………………………………………..……………119
-Visión y Neuronas Espejo……………………………………………………………………………………..……….121
-Los bordes: Código básico de las neuronas espejo? ……………………………………………………..121
-Conclusión……………………………………………………………………………………………………………………..122
-Referencias………..………………………………………………………………………………………………………….122
CAPÍTULO 11
RELACIONANDO LA CODIFICACIÓN DE BORDES CON LA NEUROREHABILITACIÓN………...124
-Los bordes: Señales rehabilitadoras………………………………………………………………………………..125
-Imágenes Motoras: Base de la neurorehabilitación por aferencias visuales…………………...126
-La caja con espejo…………………………………………………………………………………………………………..127
-Posible actividad neural generada con la caja con espejo……………………………………………....128
-Conclusión……………………………………………………………………………………………………………..……….130
-Referencias……………………………………………………………………………………………………………..……..130
CAPÍTULO 12
LA PERCEPCIÓN CICLÓPEA TRIDIMENSIONAL EN ACCIÓN…………………….…………………………131
-Señales que permiten multiprogramación motora………………………………………………………….132
-El reemplazo perfecto …………………………………………………………………………….……………….....…133
-Introducción…………………………………………………………………………………………………………………….133
-Antecedentes experimentales…………………………………………………………………………………..…….133
-Reemplazo motor…………………………………………………………………………………………………………...133
-Conclusión……………………………………………………………………………………………………………………….136
-Referencias……………………………………………………………………………………………………………………..136
CAPÍTULO FINAL
SEÑALES QUE REPRESENTAN LOS BORDES: EL PRINCIPAL CÓDIGO COMÚN
DEL CEREBRO HUMANO…………………………………………………………………………….….………………..137
-Referencias…………………………………………………………………………………………………………………....140
7
Aún recuerdo como si fuera ayer (estamos hablando de 1993), cuando solíamos recorrer las calles
de Bogotá después de clases en busca de algunas librerías con mi buen amigo el Dr. William Fernel
Gómez. Nuestra búsqueda era tan exhaustiva, que conseguimos muchos “tesoros literarios” a muy
buen precio, pero más allá del precio, el objetivo principal era satisfacer la curiosidad científica que
nos identificaba, situación que logramos con creces cuando William encontró varios libros de
Anatomía y yo, cuando tuve entre mis manos el libro “La Visión” del desaparecido Neurocientífico
del M.I.T., David Marr 1.
Una vez leí y comprendí los conceptos plasmados por Marr en ese libro, fueron mi inspiración para
continuar investigando sobre la codificación de bordes, especialmente dentro del contexto
estereoscópico. En el transcurso de casi 10 años, entendí que para los procesos básicos de la visión,
la codificación de bordes que se inicia en la retina, es supremamente esencial. Los bordes equivalen
para el Cerebro humano, lo mismo que el código binario representa para los microprocesadores de
una computadora. Por tal razón, siempre he postulado que los bordes (especialmente los
codificados estereoscópicamente) son el código neural por excelencia que utiliza nuestro cerebro
para planificar, construir y ejecutar todo proceso perceptual (visión), motor (seguimiento, sacadas
y vergencias) y cognitivo (memoria) que utilice aferencias visuales. Es así, como desde esa época
tuve la oportunidad de experimentar, compilar y posteriormente publicar (con la ayuda de Dios y
de colegas amigos de la ciencia como el Dr. Javier Oviedo), varias teorías que explicaré en detalle
en capítulos posteriores.
Como es imposible plasmar las ideas principales del libro de Marr en un solo capítulo, me propuse
a buscar para el lector en la Internet, una reseña sobre el mismo (cosa que no fue fácil). La mejor
explicada de todas y la más completa, es la ofrecida en idioma español por la Universidad de
Barcelona, en la web” http://www.ub.edu/pa1/node/93”, cuyo autor es el Dr. J. Antonio Aznar
Casanova, PhD, Miembro del Vision & Control of Action Group (VISCA), Departamento de
Psicología Básica, Facultad de Psicología, Universidad de Barcelona. Por su gran claridad, decidí
incluirla como introducción al resto de temas que se expondrán en los siguientes capítulos. (Para
acceder a la página web, el lector puede utilizar su Smartphone para escanear el siguiente código
QR o hacer clic en el link):
Es mi deseo sincero, que todos los conocimientos que nacieron de la mente de Marr y que ahora
adopté en la mía para gestar otros nuevos, también aniden en la mente de cada uno de los lectores
para comprender por qué tenemos un Cerebro destinado primordialmente para la Visión.
DIEGO A. GIRALDO G.
8
REFERENCIAS
1- Marr D. (1982) Vision: -A Computational Investigation into the Human Representation and Processing of Visual
Information, W.H.Freeman and Company, New York, 1.Ed.
10
TODO EMPEZÓ CON UN SENCILLO EXPERIMENTO
PSICOFÍSICO
Desde adolescente, me intrigaba saber el porqué de la profundidad que se percibe en las escenas
presentadas a través de las filminas rotatorias del View Master (Ver figura No.1). Sin embargo,
tuvieron que pasar muchos años para que conociera los principios básicos de la Estereopsis y por
ende, los requerimientos técnicos que permiten realizar la fotografía estereoscópica de una
escena.
Figura No.1. Ejemplar tradicional de View Master©
(VIEW-MASTER es una marca registrada de Mattel. ©2015 Mattel).
Con gran entusiasmo, inicié mi trabajo experimental realizando varias tomas fotográficas de
escenas naturales, alineando minuciosamente el objetivo de la cámara una y otra vez frente a cada
uno de mis ojos, con la finalidad de conseguir y plasmar la disparidad en cada fotografía (es decir,
la leve diferencia de perspectiva que siempre existe en la captura natural de la imagen realizada
por cada retina).
El resultado de lo que conseguí en esa época, fueron imágenes similares a las de la figura No.2 y
con las cuales inicié una serie de procesos informáticos experimentales, que me embarcarían
finalmente a estudiar el procesamiento de los bordes con más detenimiento. Debo sugerir al lector
que para fusionar los pares estereoscópicos que se exponen a continuación, es necesario que active
su convergencia, hasta que logre ver tres imágenes, la del centro es la fusionada y la única que
podrá ver tridimensionalmente. Puede hacerlo lentamente y a una distancia aproximada de 80 cm
o 100cm, para que logre enfocar sin tanto esfuerzo.
Otra opción, es buscar un prisma de 15-20 dioptrías prismáticas, lo ubica frente alguno de sus dos
ojos con base interna, para así conseguir de manera más confortable la fusión estéreo de los dos
pares.
11
EXPERIMENTO PSICOFÍSICO No.1 (Figura No.2)
- Par estereoscópico de una escena natural, nótese la facilidad con la que se pueden fusionar ambas imágenes.
-En este par estereoscópico, los colores del fondo han sido totalmente cambiados, sin embargo el Cerebro
se las arregla para fusionarlos y percibir la profundidad de la escena.
12
- Éste es un par estéreo imposible de fusionar para el Cerebro, nótese que no es posible controlar la fijación, ni los
movimientos de vergencia necesarios para lograrla.
Analizando todos los anteriores pares estereoscópicos, el lector puede notar la facilidad con que
su Cerebro puede fundir en una escena tridimensional los primeros tres pares estereoscópicos. Sin
embargo, con el cuarto par estereoscópico no es posible. Esto despertó dentro de mí mente gran
interés y me llevó a analizar profundamente cada par, hasta encontrar que la fusión y la
estereopsis se basan en el emparejamiento de bordes con similar valor, hablando en un argot
científico, es necesario que estén Correlacionados. Es decir, un borde de valor positivo sólo puede
emparejarse con un borde de valor positivo (de igual polaridad). De la misma manera, un borde de
-Sin importar que la
imagen de la izquierda
es monocromática y la
de la derecha es
policromática, el
Cerebro sigue
construyendo la
percepción de
profundidad de la
escena.
13
valor negativo sólo se empareja con un borde de valor negativo (aún siguen siendo de igual
polaridad). No obstante, un borde negativo NO puede emparejarse con un borde positivo, porque
están Anticorrelacionados, de ahí que no se logren fusionar y mucho menos, percibir dentro de
un contexto tridimensional. La Figura No. 3 muestra cómo un par estereoscópico conformado por
valores polares negativos, se puede fusionar sin problemas y percibir en profundidad. De acuerdo
al anterior experimento psicofísico, lo importante en cada imagen es la codificación polar de cada
borde y no el contexto cromático que ellos enmarcan.
Figura No.3. Par estereoscópico conformado por valores polares negativos que puede ser fusionado sin mayor
problema por el Cerebro.
Tal vez,…concluí..., todo esto de la polaridad de los bordes sirve también como un mecanismo
independiente de codificación que poseen las neuronas del sistema visual para conseguir la
percepción estereoscópica bajo diferentes condiciones de iluminación.
Cuando hablo de los bordes de las imágenes, estoy refiriéndome específicamente a las regiones de
la imagen delimitadas por los contornos de la figura No.4.
14
Figura No.4. Codificación de bordes extraídos mediante un operador Laplaciano de la imagen izquierda de los pares
estereoscópicos presentados anteriormente.
Después de practicar la fusión de los anteriores estereogramas y de que haya experimentado con
su propio Cerebro, espero que el lector logre concebir dentro de su mente la importancia de la
codificación de bordes para la percepción estereoscópica, la regulación de los movimientos de
oculares de vergencia y el proceso neuronal de la fijación.
15
El anterior experimento, fue publicado en la revista de la Fundación Universitaria del área Andina,
Visión Andina, hace 11 años.
Con la finalidad de complementar los conceptos experimentales emitidos en este capítulo, adjunto
el texto publicado sobre la teoría de los ceros (bordes). (Para acceder al artículo original, es
necesario escanear el siguiente código QR con su Smartphone).
REFERENCIAS
Giraldo D. (2004) Codificación Neural de la Estereopsis: Modelo teórico de la detección de ceros como base de la visión
estereoscópica. Visión Andina 6: 32-38.
17
LA PERCEPCIÓN DE BORDES NO ES CUESTIÓN DE COLOR, ES CUESTIÓN DE ENERGÍA
Como logramos observar a través de la experimentación con los pares estereoscópicos, la
percepción de profundidad no se altera por cambiar el trasfondo cromático que enmarcan los
bordes, sino cuando se altera la polaridad de los mismos. Esto me llevó a suponer, que tal vez, la
polaridad de los bordes debía basarse en la energía que lleva implícitamente cada fotón (porque el
cerebro era capaz experimentalmente de fusionar imágenes de pares estereoscópicos con colores
distintos de fondo y aún más, podía fusionar imágenes monocromáticas y policromáticas). Así, el
Cerebro humano, y más específicamente, las neuronas del sistema visual en su conjunto, son
sensibles tanto a la energía que contiene implícitamente cada fotón (para codificar los bordes y su
polaridad), como a la longitud de onda con la que vibran (para codificar el color). Con el tiempo,
concluí que estaba frente a los efectos que produce en las neuronas del Cerebro humano la
codificación, análisis y proyección del Contraste Espectral Acromático (C.E.A.).
Hacia mediados de 2004, estaba indagando sobre los últimos sistemas protésicos visuales. Durante
este proceso, pude establecer comunicación con el Dr. Gislin Dagnelie quien es Profesor Asociado
de Oftalmología del Lions Vision Center de la Universidad Jhons Hopkins, para que me comentara
sobre sus últimas investigaciones en el campo de las Prótesis Epiretinales. Como casualidad del
destino, y sobre todo, aprovechando la atención que puede prestar de manera muy limitada un
científico de talla mundial como el Dr. Dagnelie a un investigador principiante como yo, tuve la
oportunidad de comentarle muchas teorías, entre ellas la que explicaba la codificación del
Contraste Espectral Acromático (C.E.A.) como la base para todo proceso neural dentro del Cerebro
humano que utilice aferencias visuales. En uno de los pocos correos que pudo contestarme, el Dr.
Dagnelie me dijo que esperaba que conociera del trabajo del Dr. Henk Spekreijse quien fue la
primera persona que expresó esa misma idea en el año de 1967 (De lo cual obviamente, no tenía
algún conocimiento). Después de leer y de asimilar dentro de mi mente el calibre científico de la
respuesta del Dr. Dagnelie, en la cual comparaba mis conclusiones con las obtenidas por un
brillante científico como el Dr. Henk Spekreijse, mi entusiasmo creció exponencialmente hasta
formular la Teoría sobre el Contraste Espectral Acromático, que fue publicada con éxito en el 2005
por la revista Franja Visual.
Este, fue el contexto que me impulsó a construir desde muchos “retazos conceptuales”, las ideas
que describen la codificación, análisis y proyección del Contraste Espectral Acromático (C.E.A)
como la base neural de todo proceso perceptual, motor y cognitivo que utilice aferencias visuales .
A continuación, expongo el texto del artículo publicado en la Revista Franja Visual:
(Giraldo D. (2005) Teoría del Contraste Espectral Acromático: Codificación, decodificación, análisis y proyección como base neural del
procesamiento visual humano. Franja Visual 82:10-14.)
18
TEORIA DEL CONTRASTE ESPECTRAL ACROMÁTICO (C.E.A.) CODIFICACIÓN, DECODIFICACIÓN, ANÁLISIS Y PROYECCIÓN COMO BASE NEURAL DEL
PROCESAMIENTO VISUAL HUMANO
ABSTRACTO Después de algún tiempo de investigar sobre las posibles bases neurales del procesamiento visual humano y de integrar conceptos emitidos por algunos investigadores de la visión durante los últimos años, el autor concluyó que posiblemente la codificación, decodificación, análisis y proyección de señales que representan sectores de imagen de alto y bajo Contraste Espectral Acromático (C.E.A.) pueden ser necesarias en gran medida para la percepción estereoscópica, las funciones retroalimentadoras de los movimientos oculares, la compensación del equilibrio corporal , los fenómenos de transmisión y compensación sináptica a lo largo de la vía visual y en otras áreas relacionadas con la visión , para la cognición y como función clave en el mapeo hemiretinotópico de áreas relacionadas con la visión en cada hemisferio cerebral.
INTRODUCCIÓN La codificación, decodificación, análisis y proyección del Contraste Espectral Acromático (C.E.A.) parece ser muy importante para el sistema visual en el sentido de ofrecer un código neural de fácil traducción para los procesos perceptuales , motores y cognitivos realizados a nivel cortical entre el área visual primaria ( Área 17/V1) y las demás áreas corticales. Esta relevante propiedad de las neuronas del área 17, fue descrita por Semir Zeki (Zeki, 1993) al reportar que existe una gran diferencia entre el córtex estriado (área 17) y el área 19, encontrando que las células espectralmente selectivas del área 17 de monos anestesiados, responden mejor a la energía reflejada de los objetos y no a su color. En otras palabras: Objetos con diferentes colores pueden reflejar idénticas energías desde su superficie, evocando siempre las mismas respuestas cuando dichos estímulos son presentados a estas neuronas. De la misma forma, las células espectralmente selectivas del área 19 responden a los colores y no a las energías. Hace poco, compactando una teoría que explicara las bases neurales de la percepción estereoscópica humana, basada en la teoría de los Ceros formulada por David Marr (Marr, 1982), Giraldo (Giraldo, 2004) encontró mediante experimentación psicofísica que la percepción estereoscópica se establece de acuerdo al análisis binocular de la codificación de los Ceros que conforman los contornos o bordes de las imágenes proyectadas sobre sectores hemiretinales correspondientes. Función que al parecer es desempeñada por las neuronas de las capas superiores del área 17 (área que también se ha denominado como V1 o córtex visual primario). El principal objetivo del análisis binocular del C.E.A por parte de dichas neuronas del área 17 es codificar los sectores de bordes de una imagen en una "señal de fácil captación”, no sólo para las áreas de percepción visual (como las áreas 18 y 19), sino también para las demás áreas de la corteza cerebral sinápticamente relacionadas con la misma área 17. Permitiendo procesos modulativos a nivel global cortical de la información espacio-temporal capturada en tiempo real por hemiretinas correspondientes. Así, un código único se hace necesario para establecer la representación neuronal del mundo que nos rodea (Esto le ahorra tiempo de cómputo al cerebro), permitiéndonos ver los objetos y poder determinar que son (forma), donde están (ubicación en las coordenadas tridimensionales del campo visual) y si se mueven o no (percepción del movimiento).
19
De esta forma podemos suponer que el procesamiento (codificación, decodificación, análisis y proyección) del C.E.A. es la base neural por excelencia del sistema visual en lo perceptual, motor y cognitivo.
ANTECEDENTES DE LA RELACIÓN C.E.A-PERCEPCIÓN Y DEL C.E.A-MOTOR A nivel perceptual, Giraldo pudo apreciarla subjetivamente al demostrar que la percepción estereoscópica depende exclusivamente del análisis binocular de los bordes de una imagen llevado a cabo por el área 17 o V1. Fenómeno que como pudo comprobarse estudiando las respuestas del sistema visuo-motor al estimularlo con diferentes tipos de estereogramas compuestos por imágenes naturales, es muy independiente del proceso de análisis y proyección efectuado para la percepción del color, dependiendo exclusivamente del análisis binocular de los bordes de una imagen ( Giraldo, 2004). Las conclusiones de Giraldo se pueden relacionar con las encontradas por Semir Zeki (Zeki, 1993) y con los resultados de estudios neurofisiológicos realizados en primates por Masson y Col. (Masson et al, 1997).Unificando todos los anteriores resultados, se puede sugerir que el procesamiento del C.E.A. es la constante en todos ellos. Con todas las aplicaciones que se han encontrado para el procesamiento neuronal del C.E.A, es posible que su codificación pueda ser utilizada para el desempeño de más funciones cerebrales? El procesamiento del C.E.A puede ser relacionado con los fenómenos de compensación sináptica y de mapeo hemiretinotópico de diversas áreas cerebrales, como también con el fenómeno cognitivo.
RELACIÓN ENTRE EL C.E.A-FENÓMENOS DE COMPENSACIÓN SINÁPTICA Y DE MAPEO HEMIRETINOTÓPICO DE DIVERSAS ÁREAS CORTICALES.
Es conocido, que existen redes neuronales que soportan el patrón sináptico que deberá tener la vía visual durante toda la vida. Así, antes del nacimiento, existe un programa de interconexión sináptica que especifica la forma en que cada célula ganglionar se ha de conectar con sus directas representantes a nivel del Núcleo Geniculado Lateral y de las áreas visuales 17 (V1) ,18 (V2) y 19(V3). Construyéndose de esta forma, sectores hemiretinotópicos primarios en cada una de las partes mencionadas. Fenómeno extensible a las áreas Medial Temporal (MT), Supero Medial Temporal (SMT), 7 Parietal, 8 Frontal (área Ocular Frontal/FEF) y a muchas otras interrelacionadas sinápticamente con el área 17. Lo anterior se afirma con base en los hallazgos de Greiner y Wiedman (Greiner y Wiedman, 1981) y de Karne y Col. (Karne et al , 1997).,quienes demostraron que los primeros circuitos sinápticamente conectados, aparecen durante el desarrollo de la capa plexiforme interna retinal, realizándose sinapsis entre las células amacrinas y ganglionares. De la misma forma en los hallazgos de Penn y Col. (Penn et al ,1998), quienes describieron que antes de la maduración de los fotorreceptores y de la apertura ocular, las células ganglionares periódicamente realizan disparos de potenciales de acción. Estos potenciales se transmiten de una célula a la siguiente de la misma forma hacia la retina como hacia la Corteza Occipital. Como se puede apreciar disponemos de un "precableado neuronal primario” con actividad fisiológica espontánea, que garantizará la función visual en la etapa inmediata al nacimiento. La codificación del C.E.A. se ejecuta en primera medida por interacción entre las células fotorreceptoras a través de las células horizontales, bipolares y amacrinas, hasta ser finalmente secuenciada y enviada por las células ganglionares hacia el Núcleo Geniculado Lateral y desde allí, hacia la Corteza Occipital. No obstante, anomalías anatomofisiológicas que impidan detectar correctamente el patrón energético con el que vibre un fotón que proviene reflejado de la superficie de un objeto, producirán deficiencias principalmente de tipo perceptual y motor como
20
consecuencia del establecimiento de conexiones sinápticas defectuosas en varias regiones anatómicas de la vía visual. Estas anomalías se reflejan fielmente en una de las patologías que producen la mayor deficiencia en el procesamiento del C.E.A: El Albinismo. Patrones de organización anormal de la vía visual han sido descritos en distintos mamíferos albinos como el hurón ( Telkes et al, 2001; Akerman et al, 2003), en ratas ( Steininger et al, 1993), en ratones y conejos (Balkema et al, 1991) , en gatos (Leventhal et al, 1985; Ault et al,1995; Schmolesky et al, 2000), como también en seres humanos ( Carroll et al, 1980a ; Carroll et al, 1980b; Neveu et al, 2003). En otros estudios al examinar humanos albinos por medio de un nuevo método para determinar la sensibilidad al contraste, se pudo apreciar que en los pacientes albinos la sensibilidad al contraste de los patrones acromáticos y cromáticos presentados fue apreciablemente disminuida en el rango completo de frecuencias espaciales y totalmente ausente en el rango de altas frecuencias espaciales (Shanshinova et al, 1997). En estos pacientes, que pueden presentar diferentes grados de hipopigmentación, se estableció que aquellos quienes tienen más pigmento iridiano y mayor presencia de pigmento melanínico en la mácula, presentaban percepción estereoscópica gruesa y mejor agudeza visual que aquellos quienes tenían menor grado de pigmentación (Lee et al, 2001). También el desempeño oculomotor de estos pacientes ha sido estudiado, encontrándose que es inestable y deficiente debido a las proyecciones visuales anómalas subyacentes (Collewijin et al, 1985). Si atribuimos todas las compensaciones sinápticas anómalas que se realizan en estratégicos puntos de la vía visual de diferentes especies albinas al deficiente procesamiento del C.E.A. binocular, podemos postular que el debido procesamiento del C.E.A. binocular es el que hace posible la señal directora para que las neuronas de la vía visual establezcan conexiones sinápticas adecuadas que permitan el posterior desarrollo plenipotencial de las funciones perceptuales, motoras y cognitivas. Por lo tanto, se puede proponer a V1 como el área responsable del mapeo hemiretinotópico de alta o baja resolución de otras áreas corticales del cerebro. Primero, por estar estructurada en patrones hemiretinotópicos de alta resolución en los lóbulos occipitales de cada hemisferio cerebral y segundo, por proyectar continuamente señales referentes a la disparidad hacia neuronas ampliamente sensibles a la misma en cada una de las principales áreas relacionadas con la visual primaria de cada hemisferio cerebral. De ahí que sea deducible, que el análisis del C.E.A. transmitido por células ganglionares hemiretinales correspondientes , llevado a cabo por neuronas de capas superiores del área 17 (Posiblemente de la capa 3B, las cuales son del tipo excitatorio), es el cómputo necesario que permite construir la percepción de bordes de la imagen de un objeto , y estructurar tanto su forma como sus coordenadas de posicionamiento en el espacio tridimensional , permitiendo así también la percepción estereoscópica global. Los resultados de un incorrecto procesamiento binocular del C.E.A. que afecta los movimientos de vergencia y por ende la percepción de profundidad, se pueden apreciar en trabajos experimentales como los realizados por Masson y Col. (Masson et al ,1997) y Giraldo (Giraldo, 2004). Grupos de neuronas que son sensibles a la disparidad, han sido halladas en el área 17 (Poggio y Fisher, 1977) y en muchas otras áreas de la corteza , entre las que pueden mencionarse: El área Medial Temporal ( MT) (Maunsell y Van Essen, 1983), el área Supero-Medial Temporal (SMT)( Eifuku y Wurtz, 1999), el área Lateral Intraparietal (LIP) (Gnadt y Mays, 1995), y el área Ocular Frontal ( área 8/FEF) ( Ferraina et al, 2000). Otros estudios han postulado que las neuronas del área 8 u Ocular Frontal, son generalmente sensibles a la disparidad sólo cuando áreas corticales antecesoras lo han sido (Zeki, 1974; Sakata et al, 1985; Gnadt y Mays, 1995). Esto indica
21
un procesamiento que parte de la disparidad que inicialmente se proyecta desde el área 17/V1 hacia las demás áreas de la vía ventral y dorsal del procesamiento visual. De todas estas investigaciones, el trabajo de Ferraina y colaboradores (Ferraina et al, 2000) en el cual se demostró que las dos terceras (2/3) partes de las neuronas del área ocular frontal que fueron sometidas a estudio, presentaron diferentes patrones de sensibilidad a la disparidad, refuerza aún más la teoría del ciclo que sustenta la base neural retroalimentadora de los movimientos oculares y de los mecanismos de fusión: El ciclo Lock-Unlock. Este ciclo está basado en el procesamiento del C.E.A binocular llevado a cabo en el área 17/V1, con el fin de regular todo movimiento ocular antes, durante y después de su ejecución. Sus procesos de retroalimentación son constantes con el objetivo de conservar la percepción estereoscópica en todo momento y ante cualquier posición de los globos oculares o de la cabeza. Recientemente, se ha encontrado que existen cambios dependientes del contraste en las respuestas de sumación espacial y de modulación contextual en las neuronas del área 17 de primates (Angelucci et al ,2002.). Además, se han observado y descrito las propiedades dinámicas espaciales que poseen los campos receptivos de las neuronas del área 17, los cuales pueden modificar su tamaño dependiendo del contraste del estímulo que reciben. (Kapadia et al, 1999; Sceniak et al, 1999). Según Rodolfo Llinás (Llinás, 2001): " Cuando diversos grupos de neuronas, con patrones oscilatorios de respuesta, "perciben" o codifican diferentes aspectos de una misma señal de entrada, podrán unir sus esfuerzos para resonar en fase uno con otro, fenómeno éste que se conoce como Coherencia Neuronal Oscilatoria.”. El mismo autor afirma: "De hecho, un grupo local de neuronas que resuenan en fase entre sí, pueden hacerlo con un grupo distante de neuronas afines. (Llinás, 1988; Hutcheon y Yarom, 2000)". También argumenta lo siguiente: " Se dice que durante el desarrollo cerebral: Neuronas que disparan juntas, se conectan juntas. Si se superponen los mapas de conectividad temporal con los mapas de conectividad espacial, que de por sí son limitados, se genera un conjunto mucho mayor de posibles representaciones". Esto es muy cierto a nivel del sistema visual, pues en él, el enunciado de " Neuronas que disparan juntas, se conectan juntas ", se cumple a cabalidad, tanto a nivel del Núcleo Geniculado Lateral, como a nivel del Córtex Visual en sus patrones sinápticos tanto horizontales (Dentro de la misma área 17), como verticales (proyecciones hacia otras neuronas de otras áreas corticales). Es así, como la detección de los patrones oscilatorios iguales o muy parecidos que representan codificaciones de C.E.A. también similares, es el fenómeno que garantizará que las neuronas del sistema visual puedan establecer sinapsis funcionales o de compensación entre sí y de éstas, con otras que directa o indirectamente se interrelacionen con ellas.(A nivel hemisférico e interhemisférico). Produciendo de esta forma, grupos de neuronas hemiretinotópicamente organizadas, sensibles a la disparidad o en otras palabras, sensibles a la codificación del C.E.A. binocular transmitido desde células ganglionares ubicadas en zonas hemiretinales correspondientes. Para una versión detallada de las conexiones interhemisféricas de las áreas visuales, el lector puede consultar el interesante trabajo de Aboitiz y Col. (Aboitiz et al, 2003). En éste tipo de conexión ( Interhemisférica o Callosal) , el procesamiento del C.E.A. posiblemente es utilizado constantemente con el fin de establecer una correcta unión de las mitades derecha e izquierda del campo visual binocular ( sinapsis correspondientes) , como también para la regular los mecanismos de fusión y de vergencias a través del ciclo LOCK-UNLOCK.
22
Actualmente, se ha aceptado que existan dos vías principales de procesamiento para la información visual que parten del área 17: Las vías Ventral y Dorsal. Mishkin, Ungerleider y Macko ( Mishkin et al, 1983), después de realizar estudios de lesiones en el córtex de primates, diferenciaron dos rutas principales para el procesamiento de la información visual. Partiendo del córtex preestriado, una ruta procede ventralmente dentro del córtex Temporal Posterior. Lesiones en esta área resultan en pérdida de la discriminación de patrones o en deficiencias en el reconocimiento de objetos. Estos investigadores asignaron a esta vía la función de analizar las propiedades físicas de un objeto. (Forma, tamaño, color, textura). La otra ruta, procede desde el córtex preestriado dorsalmente hasta el córtex Parietal Posterior. Lesiones en dicha área, producían fallas en la capacidad de localizar un estímulo visual, concluyendo que esta vía procesa la percepción de las relaciones espaciales de los objetos y no sus características intrínsecas. Así mismo, éste estudio expuso que la vía Temporal (Ventral) es más sensible a las señales provenientes de las áreas foveales (Lo cual es esencial para la Percepción y la Cognición) y que la vía Parietal (Dorsal), era igualmente sensible tanto a las áreas foveales como a las periféricas. (Esencial en el suministro de coordenadas Motoras.). En otro estudio, Paradis y Col.( Paradis et al , 2000) manifestaron que los resultados de su investigación apoyan la existencia de una codificación de la forma tridimensional tanto para la vía ventral como para la vía dorsal del procesamiento visual cortical. Al parecer, el código suministrado por las neuronas de las capas superiores del área 17 al analizar el C.E.A. binocular, es la función clave del sistema visual humano para lograr la representación interna de la forma y localización en el espacio tridimensional subjetivo de cualquier objeto. Estudios recientes como el realizado por Sharma y Col.( Sharma et al , 2003), demuestran que las neuronas del área 17 (V1), pueden desplegar una señal de representación interna o modelo interno del estímulo visual y de su localización, que se proyecta hacia diversas redes corticales. Dicha representación está asociada a cambios sistemáticos tanto en la dinámica como en la selectividad de respuesta de los más tempranos estadíos del procesamiento visual cortical.
RELACIÓN DEL PROCESAMIENTO DEL C.E.A CON EL FENÓMENO COGNITIVO Si el procesamiento del C.E.A está íntimamente relacionado con la Estereopsis, la regulación de los movimientos oculares y de los mecanismos de fusión, los mecanismos compensatorios secundarios del equilibrio corporal, la función del mapeo hemiretinotópico de áreas corticales relacionadas con la visión en cada hemisferio que sean sensibles a su codificación, porque no establecer sus posibles relaciones con el fenómeno cognitivo logrado por aferencias visuales?. Rodolfo Llinás (Llinás, 2001) afirma que: "La raíz de la Cognición se encuentra en la resonancia, coherencia y simultaneidad de la actividad neuronal, generada no por azar, sino por la actividad eléctrica oscilatoria.". Observando también el mismo autor: " Se podría proponer que la sensibilidad eléctrica intrínseca de las neuronas y de las redes que entretejen, genera las representaciones internas de lo que ocurre en el mundo exterior". Tomando en cuenta lo anterior, las neuronas de las capas superiores del área 17 (V1) , serían teóricamente y dentro del contexto del presente planteamiento , las directas responsables de la hemirepresentación tridimensional interna de un objeto, la cual es producida por células que resuenan al presentar un mismo patrón de sensibilidad (C.E.A. binocular de valores similares), que posteriormente es proyectada con las mismas coordenadas hemiretinotópicas hacia cada una de las áreas destino que se ubican a lo largo de la vía ventral y de la vía dorsal. Permitiendo de este modo la foveación (procesamiento ventral), por medio de un preciso control motor (procesamiento dorsal).
23
Es conocido que los humanos no mantenemos la mirada fija ante una imagen, nosotros foveamos. El sistema de foveación consiste en llevar o centrar nuestros ojos (Fóveas) cerca o sobre puntos de interés visual de un objeto con el fin de establecer sus características (forma, tamaño, color, textura, etc...). El reconocido trabajo de Yarbus (Yarbus, 1967), confirma que los movimientos oculares reflejan eventos cognitivos. Estudios más recientes, demostraron que propiedades tales como contraste, frecuencia espacial y luminancia, juegan un papel importante en el control de los movimientos oculares cuando se observan complejas escenas del mundo real (Mannan et al, 1995; Reinagel y Zador, 1999; Krieger et al, 2000; Parkhurst y Neibur, 2003). (Ver Figura No.1).
FIGURA No.1. En (1) imagen original del busto de Nefertiti. En (2) Codificación monocromática de la imagen original. En (3) Codificación de los bordes de la imagen. En (4) Registro del rastreo ocular o foveaciones realizadas por un sujeto de experimentación que curiosamente se superponen con similar patrón, a la codificación de bordes ilustrados en 3.
Para relacionar el procesamiento del C.E.A binocular como regulador también del sistema de Foveación, Giraldo retomó el trabajo de Yarbus, en el cual se registraron los movimientos oculares realizados al examinar el perfil del busto presentado en la figura No.1 (numeral 1 y numeral 4), y lo comparó con el análisis computarizado realizado de las zonas de alto contraste acromático de la misma imagen, que como se ha dicho anteriormente, representan la codificación de los bordes (Figura No.1, numeral 3). En el numeral 2 se puede apreciar la simplificación computarizada de la imagen original desde varios niveles de grises, hasta lograr una imagen monocromática de alto contraste y fácil procesamiento. Si se observa con detenimiento (comparando los numerales 3 y 4), podemos decir que las fóveas del sujeto de experimentación, se desplazaron sobre o muy cercanas a las zonas de los bordes, a través de múltiples movimientos de seguimiento y sacádicos. Demostrando que existe interacción de la información procesada por la vía Ventral y Dorsal, posiblemente a través del procesamiento del C.E.A. binocular. Esto ratifica la hipótesis de que en el proceso de construcción de la hemirepresentación interna de la imagen de un objeto, el sistema visual humano, puede emplear el procesamiento del C.E.A. binocular en el objetivo de regular los movimientos oculares necesarios para centrar las fóveas durante el reconocimiento de un objeto estático o que esté en movimiento.
24
Deficiencias en la conducción y proyección de los bordes de la imagen de un objeto, a través de la vía ventral o dorsal se pueden traducir fácilmente en anomalías de tipo perceptual, motor o cognitivo. Casos como el de la Prosopagnosia y la Agnosia Visual, han sido descritos de forma extensiva en varios trabajos (Damasio et al, 1982; DeRenzi y Pellegrino, 1998.). La Prosopagnosia se puede definir como la deficiencia manifiesta en el reconocimiento facial. Así, rostros de cuyas imágenes han sido eficientemente procesados sus bordes por el área 17, no pueden ser correlacionados con los patrones hemiretinotópicos almacenados en las áreas Temporales debido al daño en las conexiones neurales subyacentes. Trabajos como el de Haxby y Col (Haxby et al, 1991) en el que se utilizó Tomografía por Emisión de Positrones (T.E.P), han encontrado que ante pruebas de reconocimiento facial, existe un aumento en la actividad neuronal de la región comprendida entre el polo Occipital y el córtex Temporal Posterior en todos los sujetos de experimentación. Investigaciones recientes con la misma técnica mostraron que durante la fase REM del sueño, existe activación de muchas áreas de la corteza, incluyendo la visual, exhibiendo patrones de funcionamiento muy similares a los que se presentan en estado de vigilia. Tal vez el córtex visual actúe durante los sueños y en los fenómenos ilusorios, como un monitor que emplea nuestro cerebro para proyectar en él, las representaciones aleatorias de retroalimentación que surgen del procesamiento de bordes almacenados en nuestras memorias. Una situación muy curiosa que puede ilustrar este último concepto es el que las personas de los sueños de los Prosopagnósicos carecen de rostro (Llinás y Paré, 1991).
FIGURA No.2. Aunque los patrones monocromáticos superiores estimulan contornos subjetivos, el patrón tetracromático inferior también lo consigue, fenómeno éste atribuible al procesamiento del C.E.A.
Los Contornos Subjetivos (Figura No.2), pueden ser la mejor demostración de la interacción entre los patrones codificados de los bordes de la imagen que se aprecia y de su producto retroalimentador que proviene desde las áreas de memoria, delineando sobre zonas vacías, la parte faltante del patrón geométrico percibido. Fenómeno también atribuible al procesamiento del C.E.A. (horizontal y vertical realizado dentro del área 17 y proyectado desde ella).
25
CONCLUSIÓN Toda la evidencia recopilada revela el importante papel que puede tener el procesamiento del C.E.A en todas las actividades relacionadas con la visión y en su implementación neural retroalimentadora con otras áreas de la corteza distribuidas a lo largo y ancho de cada hemisferio cerebral. El procesamiento del C.E.A, parece ser el código único que utiliza el cerebro humano para lograr la hemirepresentación interna del mundo exterior, asegurando de esta forma el desarrollo y retroalimentación de los fenómenos perceptuales, motores y cognitivos por medio de aferencias visuales.
REFERENCIAS
Aboitiz F., López J. , Montiel J. (2003).Long distance communication in the human brain: timing constraints for inter-hemispheric synchrony and the origin of brain lateralization. Biol. Res. 36(1). Akerman C.J., Tolhurst D.J., Morgan J.E, Baker G.E., Thompson I.D. (2003). Relay of visual information to the lateral geniculate nucleus and the visual cortex in albino ferrets. J.Comp Neurol, Jun 23;461(2):217-35. Angelucci A.,Levitt J.B., Walton E., Hupé J.M., Bullier J., Lund J.S. (2002) Circuits for local and global signal integration in Primary Visual Cortex. J.Neurosci. 22(19): 8633-8646 . Ault S. J., Leventhal A. G., Vitek D. J., Creel, D. J. (1995). Abnormal ipsilateral visual field representation in areas 17 and 18 of hypopigmented cats. J.Comp Neurol, 354(2), 181-92. Balkema G. W., Drager U. C. (1991). Impaired visual thresholds in hypopigmented animals. Vis. Neurosci, 6(6), 577-85. Carroll W. M., Jay B. S., McDonald W. I., Halliday A. M. (1980a). Pattern evoked potentials in human albinism. Evidence of two different topographical asymmetries reflecting abnormal retino-cortical projections. J Neurol Sci, 48(2), 265-86. Carroll W. M., Jay B. S., McDonald W. I., Halliday A. M. (1980b). Two distinct patterns of visual evoked response asymmetry in human albinism. Nature, 286(5773), 604-6. Collewijn H., Apkarian P., Spekreijse H. (1985). The oculomotor behaviour of human albinos. Brain, 108(Pt 1), 1-28. Damasio A.R., Damasio H. , Van Hoesen G.W. (1982). Prosopagnosia: Anatomic basis and behavioral mechanism. Neurology.32 :331-41. De Renzi E. , Pellegrino G.(1998).Prosopagnosia and alexia without object agnosia. Cortex 34: 403-15. Eifuku, S. y Wurtz , R. H. (1999) Response to motion in extrastriate area MSTl: Disparity sensitivity. J. Neurophysiol. 82: 2462–2475. Ferraina S., Paré M., Wurtz R.H. (2000). Disparity sensitivity of Frontal Eye Field neurons. J. Neurophysiol. 83: 625-629. Giraldo D.(2004) Codificación Neural de la Estereopsis: Modelo teórico de la detección de Ceros como base de la visión estereoscópica. Visión Andina 6:32-38. Gnadt J. W. , Mays L. E. (1995).Neurons in monkey parietal LIP are tuned for eye-movement parameters in three-dimensional space. J. Neurophysiol. 73:280 –297. Greiner J. V.,Weidman T. A. (1981). Histogenesis of the ferret retina. Exp. Eye Res. 33, 315-32. Haxby J. V., Grady C. L., Horwitz B., Ungerleider L. G., Mishkin M., Carson R. E., Herscovitch P., Schapiro M. B., Rapoport S. I. (1991). Dissociation of object and spatial visual processing pathways in human extrastriate cortex. National Academy of Sciences, USA 88:1621-25.
26
Hutcheon B.,Yarom Y.(2000).Resonance, oscillation and intrinsic frequency preferences of neurons. TINS 23:216-22. Kapadia M.K., Westheimer G., Gilbert C.D.(1999) Dynamics of spatial summation in primary visual cortex of alert monkeys. Proc Natl Acad Sci USA 96:12073-12078. Karne A., Oakley D. M., Wong G. K., Wong R. O. (1997). Immunocytochemical localization of GABA, GABAA receptors, and synapse- associated proteins in the developing and adult ferret retina. Vis. Neurosci 14, 1097-108. Krieger G., Rentschler I., Hauske G., Schill K. , Zetzche C. (2000). Object and scene analysis by saccadic eye-movements: An investigation with higher-order statistics. Spatial Vision 13: 201-214. Lee K.A, King R.A, Summers CG. (2001). Stereopsis in patients with albinism: clinical correlates. J AAPOS,Apr;5(2):98-104. Leventhal A. G., Creel D. J. (1985). Retinal projections and functional architecture of cortical areas 17 and 18 in the tyrosinase-negative albinocat. J.Neurosci, 5(3), 795-807. Llinás R.(2001)I of the vortex: From neurons to self. the M.I.T. press. Llinás R. y Pare D.(1991). Of dreaming and wakefulness. Neuroscience 44:521-35. Mannan S., Ruddock K. H., Wooding D.S. (1995). Automatic control of saccadic eye movements made in visual inspection of briefly presented 2-D images. Spatial Vision 9: 363-386. Marr D.(1982) Vision -A Computational Investigation into the Human Representation and Processing of Visual Information, W.H.Freeman and Company,New York ,1.Ed. Masson G.S, Busettini C., Miles F.A.(1997). Vergence eye movements in response to binocular disparity without depth perception. Nature 389: 283–286. Maunsell H. ,Van Essen D.C.(1983). Functional properties of neurons inmiddle temporal visual area of the macaque monkey. II. Binocular interac-tions and sensitivity to binocular disparity. J. Neurophysiol. 49: 1148 –1167. Mishkin M., Ungerleider L. G., Macko K. A. (1983). Object vision and spatial vision: Two cortical pathways. Trends in Neurosciences 6: 414-417. Neveu M.M., Jeffery G., Burton L.C., Sloper J.J., Holder G.E. (2003). Age-related changes in the dynamics of human albino visual pathways. Eur.J. Neurosci, Oct;18(7):1939-49. Paradis A.L. , Cornilleau-Pérès V. , Droulez J. , Van de Moortele P.F. , Lobel E. , Berthoz A. , Le Bihan D. , Poline J.B. ( 2000).Visual Perception of Motion and 3-D Structure from Motion: an fMRI Study. Cerebral Cortex 10(8): 772-783. Parkhurst D. J. , Niebur E. (2003). Scene content selected by active vision. Spatial Vision 16: 125-154. Penn A. A., Wong R. O., Shatz C. J. (1994). Neuronal coupling in the developing mammalian retina. J.Neurosci. 14, 3805-15. Poggio G. F . , Fisher B.(1977). Binocular interaction and depth sensitivity instriate and prestriate cortex of behaving rhesus monkey. J. Neurophysiol. 40:1392–1405. Reinagel P., Zador A. M. (1999). Natural scene statistics at the centre of gaze. Network: Computational Neural Systems 10: 1-10. Sakata H., Shibutani H., K awano K., H arrington T. L. (1985).Neural mechanisms of space vision in the parietal association cortex of the monkey. Vision Res. 25: 453– 463. Sceniak M.P., Ringach D.L., Hawken M.J,. Shapley R.M. (1999) Contrast's effect on spatial summation by macaque V1 neurons. Nat Neurosci. 2:733-739.
27
Schmolesky MT, Wang Y, Creel DJ, Leventhal AG. (2000). Abnormal retinotopic organization of the dorsal lateral geniculate nucleus of the tyrosinase-negative albino cat. J. Comp Neurol, Nov 13;427(2):209-19. Shamshinova A. M., Belozerov A. E., Shapiro V. M., Eskina E. N., Aref'eva Iu A., Barsegian G. L. (1997). [A new method of assessing contrast sensitivity in patients with eye diseases]. Vestn. Oftalmol, 113(1), 22-5. Sharma J., Dragoi V. , Tenenbaum J.B. , Miller E. K. , Sur M. (2003).V1 Neurons Signal Acquisition of an Internal Representation of Stimulus Location. Science 300 (5626): 1758-1763. Steininger T. L., Rye D. B., Gilliland M. A., Wainer B. H., Benca R. M. (1993). Differences in the retinohypothalamic tract in albino Lewis versus brown Norway rat strains. Neuroscience, 54(1), 11-4. Telkes I, Garipis N, Hoffmann KP. (2001). Morphological changes in the neuronal substrate for the optokinetic reflex in albino ferrets. Exp Brain Res, Oct;140(3):345-56. Yarbus A. L. (1967). Eye movements and vision. New York: Plenum Press. Zeki S.M. (1993) Vision of the Brain. Oxford, Blackwell Scientific. Zeki S. M. (1974)Cell responding to changing image size and disparity in the cortex of the rhesus monkey. J. Physiol. (Lond.) 242: 827– 841.
29
LA CODIFICACIÓN DE BORDES ES UN PASO NECESARIO PARA LA
PROGRAMACIÓN DE LOS MOVIMIENTOS OCULARES
Como hemos visto a través de las hipótesis expuestas y soportadas con evidencia científica en los
capítulos anteriores, las neuronas del Sistema Visual y del resto del Cerebro son muy dependientes
de las señales codificadas que representan los bordes extraídos del contraste acromático.
Cuando observamos detenidamente los pares estereoscópicos conformados por imágenes
naturales anticorrelacionadas (Ver Figura No.1), en las que los valores polares de los bordes son
diferentes para cada ojo, notamos que es imposible para el cerebro fusionar el estereograma,
sostener los movimientos de vergencia necesarios para lograr esa fusión y por lo tanto fijar las
fóveas en algún sitio de la imagen. Esta incómoda situación para el sistema visual, me llevó a
pensar que los bordes codificados estereoscópicamente son la base para programar y ejecutar los
movimientos oculares (voluntarios y tal vez. los involuntarios).
Bueno, si el mecanismo de estabilización motor binocular del sistema visual necesita de los bordes
para establecer la fijación, entonces debe existir un proceso que libere dicha fijación para ubicarla
sobre otra coordenada tridimensional del campo visual binocular por medio de un nuevo
movimiento ocular. La única forma probable, es mediante la ejecución de un ciclo retroalimentado
por la codificación de bordes y los procesos atencionales. Con base en estos conceptos, nació la
Teoría del ciclo Lock - Unlock (Asegurar – Desasegurar), publicado en la revista Franja Visual en el
año 2006.
Giraldo D.(2006) Programación de los movimientos oculares con base en el ciclo Lock-Unlock. Franja Visual 88: 48-50.
FIGURA No.1.
-Arriba, par estéreo
perfectamente fusionable.
Esto se logra porque la
polaridad de los bordes es
la misma, la percepción de
profundidad de igual forma
se hace manifiesta.
– Abajo, par estéreo cuyos
bordes son de diferente
polaridad y es imposible de
fusionar, no permite el
control fino de los
movimientos de vergencia
necesarios para fusionarla
y mucho menos estabilizar
la fijación binocular.
30
PROGRAMACIÓN DE LOS MOVIMIENTOS OCULARES CON BASE EN EL CICLO LOCK-UNLOCK
INTRODUCCIÓN
Esbozar los mecanismos de programación subyacentes en el cerebro humano para la realización de movimientos oculares fue una empresa un tanto oscura hasta hace aproximadamente dos décadas, cuando salieron a la luz algunas investigaciones psicofísicas, neurofisiológicas y de neuroimágen que exponían los procesos corticales necesarios para la programación oculomotora complementando las ya "bien conocidas" vías efectoras. La implicación de procesos atencionales dentro del contexto global cortical planificador de la motricidad ocular, es un hallazgo relativamente reciente. De ellos se afirma, que el solo hecho de dirigir la atención sobre un objeto de interés que se ubica en determinada locación espacial, mejora la detección y discriminación de dicho estímulo, ya sea que se desplieguen o no, movimientos oculares hacia él (Posner, 1980; Hawkings et al, 1988). Al parecer existen dos mecanismos regulatorios basados en procesos atencionales que son necesarios para la programación de los movimientos oculares, los que de acuerdo con sus secuencias lógicas conforman lo que Giraldo ha denominado el ciclo Lock-Unlock (L-U) , el cual se puede definir como aquel proceso retroalimentador llevado a cabo por diversas áreas del cerebro que se ocupa de seleccionar el objetivo visual sobre el que se deben ubicar ambas fóveas para sostener la percepción estereoscópica (Modo Lock), liberando en una segunda etapa el sistema de programación visuomotor con el fin de reiniciar un nuevo movimiento ocular (Modo Unlock). Ambos modos son complementarios, por ello se habla de un ciclo.
ANTECEDENTES Giraldo dedujo la posible existencia del ciclo L-U, cuando observó lo importante que era para el sistema visuomotor la codificación de bordes en polaridad en el objetivo de regular correctamente los movimientos oculares necesarios para la conservación de la percepción estereoscópica de una escena natural. Después de realizar experimentos psicofísicos conformados por estereogramas de imágenes naturales, encontró que era imposible la correcta coordinación de los movimientos oculares de vergencia cuando se alteraba la polaridad de los bordes codificados para cada ojo , observando también la incapacidad de frenar o estabilizar tales movimientos, impidiendo todas estas respuestas percibir tridimensionalmente la escena observada (Giraldo, 2004). Respuestas similares han sido encontradas anteriormente en experimentos neurofisiológicos llevados a cabo en primates (Cumming y Parker, 1997; Masson et al, 1997).Ver Fig.No.1.
31
FIGURA No.1: Arriba: Estereograma de patrón correlacionado que se puede fusionar (bordes de igual polaridad). Abajo: Estereograma de patrón anticorrelacionado que no se puede fusionar (bordes codificados en polaridad diferente para cada ojo.).
Si tomamos en cuenta la posibilidad de que el procesamiento del Contraste Espectral Acromático(C.E.A), sea la base neural utilizable por el cerebro humano para la mayoría de los procesos perceptuales, motores y cognitivos que se realizan por aferencias visuales (Giraldo, 2005), entonces tal procesamiento es el que permite efectivamente a las neuronas sensibles a la disparidad de las capas superiores del área 17/V1 codificar tridimensionalmente señales que representen los bordes de la imagen de un objeto y su polaridad inherente en el propósito de ser utilizadas en la regulación de los movimientos oculares a través del ciclo L-U. Por lo cual , no es de extrañar que de todos los atributos que posee un estímulo visual, el contraste efectivo sea lo que más resalten los procesos atencionales retroalimentadores en las neuronas del área 17/V1 como se apreciará en las siguientes líneas.
BASES NEUROFISIOLÓGICAS Recientemente Maurizio Corbetta y colaboradores (Corbetta et al, 1998), manifestaron que una amplia red compuesta por las mismas regiones corticales (área ocular frontal, el área ocular suplementaria y varias regiones parietales y temporales) era reclutada cuando se realizaban cambios de atención encubiertos o cuando se realizaban movimientos oculares sacádicos. El estudio de Corbetta y colaboradores evidenció que los procesos atencionales y oculomotores no solo están funcionalmente relacionados, sino que también exhibían las mismas áreas anatómicas en el cerebro humano. Se ha encontrado también en diversos estudios que los procesos atencionales retroalimentadores en el área 17/V1 aumentan la sensibilidad al contraste en el área hemiretinotópica en la que se ubica el estímulo atendido. Así, la atención estimula las señales que se procesan en V1, por incrementar el contraste efectivo del estímulo (Reynolds et al, 2000; Martinez-Trujillo y Treue, 2002). Otros trabajos han evidenciado que la atención sostenida puede reducir el ruido externo ,
32
por deprimir suficientemente las influencias de los estímulos no atendidos ( Luck et al , 1997), que la atención incrementa la ganancia sensorial en humanos estudiados electrofisiológicamente ( Hillyard et al, 1998) y que existe modulación atencional de la actividad neuronal en diversas áreas visuales que incluyen el área 17/V1, comprobable a través de neuroimágen ( Kastner y Ungerleider, 2000; Martinez et al, 1999 ).Masson y Castet ( Masson y Castet, 2002), realizando experimentos psicofísicos en humanos , encontraron que los movimientos oculares de seguimiento en su estadío más temprano, exhiben una alta dependencia del contraste del estímulo con una sensibilidad muy alta. Dependencias similares del contraste han sido encontradas en las neuronas del área M.T. de primates ( Sclar et al, 1990) , particularmente en aquellas neuronas que reciben proyecciones directas desde el área 17/V1 (Movshon y Newsome, 1996). Siendo también éstas funciones de respuesta al contraste, muy parecidas a las que presentan las neuronas de las capas magnocelulares del Núcleo Geniculado Lateral (Derrington y Lennie, 1984; Sclar et al, 1990). Por lo tanto, la rápida transferencia de información de proyección hacia las áreas M.T. y S.M.T, interviene en las etapas tempranas de los movimientos de seguimiento ocular (Masson y Castet, 2002). Proceso que de forma similar puede ser aplicable en las etapas tempranas de codificación sacádica de acuerdo a los estudios que relacionan los movimientos oculares sacádicos con los procesos atencionales y los que a su vez relacionan a éstos, con el incremento de la sensibilidad al contraste en el área 17/V1 para resaltar los estímulos visuales atendidos. De otra parte, el área ocular frontal (FEF) de los primates que siempre se había pensado responsable únicamente del control de los movimientos sacádicos, algunos estudios neurofisiológicos recientes también la han implicado en los procesos de control de los movimientos de seguimiento. Así, el área ocular frontal (FEF) parece estar conformada por dos subregiones funcionales, una que controla los movimientos sacádicos y otra situada más posteriormente que controla los movimientos de seguimiento (Gottlieb et al, 1994). En humanos, un estudio de neuroimágen demostró que la ejecución tanto de movimientos oculares de seguimiento como de sacádicos, inducía activaciones bilaterales de zonas específicas de FEF (Petit et al, 1997). Aunque dentro del anterior trabajo se encontró que la activación del área ocular frontal fué menor durante la ejecución de movimientos de seguimiento que cuando se realizaban sacádicos, tal hallazgo reflejó por primera vez una pequeña subregión ubicada dentro de FEF que se relacionaba directamente con los movimientos de seguimiento. Esta ubicación anatómica favorece la posible inclusión de procesos atencionales durante la realización de movimientos de seguimiento y por lo tanto apoya el desarrollo de ciclos L-U dentro de los mismos, tomando en cuenta también su estrecha dependencia del procesamiento del contraste. En el mono, diferentes tipos de neuronas sensibles a tareas de seguimiento, fijación y sacadas han sido identificadas en FEF (Goldberg y Segraves, 1990). Recientemente se ha postulado que los movimientos sacádicos se conforman principalmente de dos componentes: El "donde" y el "cuando", el primero decide el vector direccional y la extensión de una sacada inminente, el segundo se relaciona con el tiempo en el cual se debe liberar la fijación (Findlay y Walker, 1999), encontrándose también que ambos componentes se integran armoniosamente en FEF (Frens et al, 1999 ; Quaia y Optican, 1999). En seres humanos, el área ocular frontal (FEF) posee actividad " relacionada con el contexto" que refleja una estrecha interacción entre la cognición y el control motor (Georgopoulos, 2000). Así, el área ocular frontal puede llegar a presentar diferente patrón de actividad para movimientos oculares hechos hacia el objetivo elegido, comparada con la que se realiza para alejarlos de él (Connolly et al, 2000 ; Everling y Munoz, 2000). Toda la evidencia hasta ahora presentada, enmarca el área ocular frontal (FEF) como punto de partida de ciclos L-U para la ejecución de movimientos oculares. Por ello, investigadores como D. Gagnon y Colaboradores (Gagnon et al,
33
2002) cuando realizaron estudios de neuroimagen en humanos jóvenes, sugirieron que el área ocular frontal no solamente codifica la métrica de las sacadas, sino que también codificaba el contexto dentro del cual se efectúa cada sacada. Otras investigaciones pueden apoyar la existencia de los ciclos L-U por describir la existencia de neuronas de FEF envueltas tanto en "liberar la fijación" ( Dias y Bruce, 1994 ; Everling y Munoz, 2000) como también en la preparación oculomotora (Thompson et al, 1996). Si se tiene en cuenta que FEF proyecta hacia el Colículo Superior (CS)(Stanton et al, 1988) ,como también, que el área ocular frontal es la principal fuente responsable de incrementos en la actividad del CS (Everling y Munoz, 2000; Sommer y Wurtz, 2000), existiendo neuronas en la región rostral del CS con actividad relacionada con la fijación (Dorris et al, 1997) y que simultáneamente existen neuronas ubicadas en la región caudal del Colículo Superior que exhiben un notable aumento en su actividad cuando se prepara la ejecución de una sacada (Dorris et al, 1997; Sparks et al, 2000), se podría decir que todas estas investigaciones evidencian un patrón de actividad neuronal interactiva entre las regiones rostral y caudal del Colículo Superior que produce un balance en la actividad interna del mismo, favoreciendo aquellos grupos de neuronas cuyos campos de respuesta incluyan el objetivo elegido. Estos cambios en el balance aumentan la probabilidad de que la siguiente descarga de actividad neuronal evocada por aquel objetivo elegido (por medio de procesos atencionales) sea suficiente para disparar la sacada hacia su ubicación ( Edelman y Keller, 1996; Dorris et al, 1997; Sparks et al, 2000). Actualmente se conoce que las neuronas ubicadas en la región rostral del Colículo Superior modulan su actividad durante los movimientos de seguimiento, durante la fijación y cuando se realizan pequeñas sacadas (Krauzlis, 2003). Si se realiza microestimulación eléctrica o microinyección química en dicha zona, se puede alterar sustancialmente el componente métrico de los movimientos de seguimiento (Basso et al, 2000). En las regiones restantes del Colículo Superior, se han distinguido dos tipos de células con importante actividad: Células Colículares Constructoras y Células Colículares de Iniciación, las primeras se encargan de elaborar un mapa espacial que contiene la localización específica del estímulo objetivo dentro del espacio visual tridimensional. Las segundas codifican el vector sacádico especificando la dirección y magnitud del movimiento. Su actividad conjunta estructura los principales componentes espacio-temporales de un movimiento sacádico (Wurtz, 1996). De esta forma, el disparo de un movimiento sacádico es crucialmente dependiente de los eventos que ocurran en la zona de fijación (región rostral del Colículo Superior), mientras que la elección del destino de tales movimientos oculares, depende del patrón de actividad del sistema conformado por las células constructoras y de iniciación (Liversedge y Findlay, 2000). Además, las dos vías principales que llevan señales descendentes al Colículo Superior, provienen del área ocular frontal (FEF) y de la corteza parietal posterior (Schall y Thompson, 1999). El área lateral intraparietal (LIP) es un elemento clave dentro de los procesos atencionales (Colby y Goldberg, 1999), también para la selección de un objetivo y cuando se realizan transformaciones de las coordenadas necesarias para representar el espacio extrapersonal (Zhang y Barash, 2000), coordenadas que posiblemente sean extraídas de las señales provenientes del área 17/V1 que representan bordes codificados estereoscópicamente (Giraldo, 2005), de igual manera es importante para los procesos de decisión (Platt y Glimcher, 1999) como también cuando existe la intención de realizar un movimiento (Snyder et al , 1997). Recientemente se ha establecido que las neuronas del área LIP son fuertemente moduladas por la disparidad retinal (Gnadt y Beyer, 1998; Ferraina et al, 2002). Dichas señales que representan la disparidad retinal son relevadas desde LIP hacia el área ocular frontal y hacia las capas intermedias del Colículo Superior, regiones conocidas como dos importantes módulos en la red que controla los movimientos oculares. La presencia de neuronas sensibles a la disparidad que se caracterizan por un amplio rango espacial de sensibilidad tanto en LIP como en FEF, indica que tales vías
34
pueden ser usadas para generar movimientos oculares hacia objetivos que se localizan lejos del plano de fijación (Ferraina et al, 2002).Ver Fig.No.2.
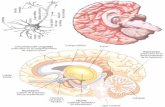
FIGURA No.2. Representación topográfica de algunas áreas corticales que contienen neuronas sensibles a la disparidad.
En el mono, Schall y Colaboradores encontraron que las respuestas hacia un estímulo distractor que se ubique dentro del campo receptivo de una neurona visual del área ocular frontal (FEF), se suprimen cuando el animal planea hacer un movimiento ocular hacia un estímulo objetivo localizado fuera del campo receptivo (Schall et al, 1995). De la misma forma Basso y Wurtz , encontraron en el Colículo Superior que la actividad de las células constructoras ubicadas en las capas intermedias es suprimida cuando existen muchos estímulos en el campo visual .Tal supresión cesa cuando un estímulo en particular (estímulo atendido) es elegido como objetivo (Basso y Wurtz, 1997). Esto sugiere que los efectos supresivos provocados por muchos estímulos distractores en el campo visual, se deben a interacciones mutuamente inhibitorias establecidas entre células que han sido previamente activadas a través del mapa que representa el campo visual en el Colículo Superior. Esas interacciones deberían entonces ser moduladas por procesos retroalimentadores hacia el Colículo, parcializándolas a favor de las células que representan las coordenadas de localización del objetivo (Desimone, 1998). En un nuevo trabajo, Maurizio Corbetta y colaboradores, reportaron señales BOLD* sostenidas en las regiones parietales y frontales comparadas con las obtenidas de regiones occipitales, durante el período siguiente a estimulación atencional espacial, concluyendo que las áreas parietales y frontales influencian la atención por tónicamente mantener el actual sitio de atención (Corbetta et al, 2000; Corbetta y Shulman, 2002). Sin embargo, Serences y colaboradores, encontraron que las regiones frontales y parietales también presentan actividad transitoria cuando se efectúan cambios de atención selectiva entre objetos. Concluyendo los mismos autores, que existe un doble papel para las regiones parietales y frontales en el control atencional que envuelve la iniciación (a
35
través de señales transitorias) y el mantenimiento (a través de señales sostenidas) de un determinado estado atencional (Serences et al, 2004). Éste doble papel podría también reflejar dentro del contexto del presente planteamiento teórico el mecanismo cíclico Lock-Unlock , así , las señales BOLD* transitorias se relacionarían directamente con el modo Unlock, pues apoyan la implementación de rápidos procesos inhibitorios en la zona de fijación liberando el sistema para efectuar un subsecuente movimiento ocular previamente vectorizado mediante procesos atencionales superiores, las señales BOLD* sostenidas pueden relacionarse con el modo Lock, pues aseguran la estabilidad de ambas fóveas sobre el nuevo objeto de atención , permitiendo la codificación tridimensional de nuevos parámetros motores que serán necesarios en subsecuentes procesos fijacionales, sacádicos o de seguimiento. *Blood Oxygen Level-Dependent (BOLD): Actividad cortical emisora de señales dependientes del nivel de oxígeno en la sangre captada fácilmente por Scanners.
FLUJO LÓGICO DEL CICLO LOCK-UNLOCK (FIG.No.3)
Tomando en cuenta que el sistema oculomotor siempre parte del modo Lock para la codificación y ejecución de un nuevo movimiento ocular, el siguiente podría ser el flujo lógico que se establece dentro del cerebro humano de acuerdo con la evidencia revisada: -Nivel BASE- Modo Lock: Estado oculomotor de procesamiento tónico estabilizado que facilita la codificación de estímulos presentes en la región foveal binocular del campo visual tridimensional durante un periodo determinado.
FIGURA No.3: Representación topográfica aproximada de los niveles de codificación del ciclo Lock-Unlock en las distintas áreas corticales.(Durante la ejecución de un movimiento sacádico hacia la derecha).
36
-Nivel 1: Codificación en tiempo real de señales que representen los bordes de los objetos presentes en una imagen y su polaridad inherente dentro de coordenadas tridimensionales en V1. Este procesamiento es llevado a cabo por las neuronas sensibles a la disparidad que se ubican en las capas 2 y 3. -Nivel 2a: Proyección de las señales que representan los bordes codificados tridimensionalmente en las áreas que componen la vía ventral de procesamiento visual (Ej.: V2, V3, VP, V4, IT.). -Nivel 2b: Proyección de las señales que representan los bordes codificados tridimensionalmente en las áreas que conforman la vía dorsal de procesamiento visual (Ej.: V3a, MT, SMT, LIP, FEF.). -Nivel 3a: Remapeo de las señales que representan los bordes codificados tridimensionalmente y demás atributos (ej.: color, textura) en las áreas temporales, procesamiento de velocidad más lenta (tónico) que el realizado a través de la vía dorsal. -Nivel 3b: Remapeo de las señales que representan los bordes codificados tridimensionalmente en las áreas parietales. Velocidad de procesamiento más rápida (fásica) con el fin de lograr sincronía perceptual, motora y cognitiva. Desde allí, se proyectan las señales que representan el espacio extrapersonal hacia las áreas frontales y posiblemente en un proceso paralelo al anterior, hacia el grupo de neuronas Coliculares Constructoras. -Nivel 4: Remapeo en las áreas frontales y en la región de neuronas constructoras del Colículo Superior de las señales que representan tridimensionalmente los bordes codificados, con el fin de proceder a seleccionar ( mediante procesos atencionales) el nuevo objetivo a fijar (fovear). -Nivel 5: En este momento, las conexiones de retroalimentación hacia V1 permiten resaltar el contraste efectivo del estímulo elegido en determinada coordenada tridimensional, lo cual se traduciría en señales que representan los bordes aún más fuertes , permitiendo a partir de éstas en la corteza parietal (área LIP), la codificación de nuevas señales que especifiquen a nivel motor las coordenadas del espacio tridimensional extrapersonal sobre las que se ubica, pasando de coordenadas retinotópicas a coordenadas centradas en la cabeza (craneotópicas) (Zipser y Andersen, 1988; Andersen et al, 1997; Brotchie et al, 2003 ). Así, el área LIP participa en codificar la información visuo-espacial a través de su propia red de neuronas ampliamente sensibles a la disparidad que pueden estructurar diferentes sistemas de coordenadas centrados en el ojo, la cabeza o el cuerpo (Genovesio y Ferraina, 2004). Siendo LIP, también sitio de convergencia de señales visuales y auditivas que son codificadas tanto en coordenadas retinotópicas como en coordenadas craneotópicas (Stricanne et al, 1996). Sistemas que para efectos de maniobras de prensión, movimientos oculares o de conservación secundaria del equilibrio corporal, tal vez utilicen las mismas coordenadas que son extraídas de la codificación de señales que representan bordes tridimensionales realizada inicialmente en V1. Desde LIP, se proyectan en paralelo las señales procesadas atencionalmente hacia las neuronas que presentan actividad constructora en las capas intermedias del Colículo Superior y hacia las áreas frontales (FEF), donde se tomará la decisión final, estructurándose de esta forma el nuevo vector oculomotor. -Nivel 6:-Modo UNLOCK: En este momento se inhibe el área de fijación por medio de procesos atencionales. Este mecanismo, que es muy rápido debido a las características fásicas del mismo, se inicia en el área ocular frontal (FEF) cuando se establecen interacciones inhibitorias en el centro del campo visual que permiten destacar la ubicación en el espacio extrapersonal periférico del nuevo estímulo atendido. El anterior mecanismo, facilita en las neuronas de preparación oculomotora la codificación de la extensión (métrica) y la dirección (vector tridimensional) del nuevo movimiento ocular que se hará necesario para llevar al centro del campo visual el objeto atendido. Tal proceso, es proyectado y centralizado fielmente en las diferentes capas del Colículo Superior como se relacionó en la evidencia presentada anteriormente. Es así, como se conforman procesos inhibitorios en las neuronas de la zona rostral del Colículo
37
Superior modulados por neuronas de la zona caudal, permitiendo la vectorización del nuevo movimiento ocular hacia las coordenadas tridimensionales donde se ubica el estímulo atendido. Todo lo anterior, resulta en una liberación del sistema oculomotor que desasegura la fijación bifoveolar del estímulo al cual se dejó de atender, llevando nuevamente la bifoveación sobre el nuevo estímulo atendido. Es de resaltar que durante el intervalo de tiempo existente entre el modo Unlock y el establecimiento del modo Lock, se presenta un fenómeno denominado "efecto de supresión”, que es más notorio cuando se realizan amplios movimientos sacádicos. Durante el periodo de supresión se dejan de percibir los estímulos visuales existentes a lo largo del recorrido de toda la sacada. El anterior mecanismo, permite que nuestro cerebro no sea confundido por el desplazamiento de imágenes retinales de alta velocidad durante los movimientos sacádicos. Tal vez éste mecanismo supresivo que se establece durante el tiempo de ejecución de una sacada, sea uno de los tantos mecanismos de refresco que posee el cerebro con el fin de obtener acertadamente nueva información. Situación que sirve también como puente entre la información perteneciente a la escena tridimensional codificada unos milisegundos antes de que iniciara el modo Unlock y la nueva información preliminar al despliegue del modo Lock, la cual se espera esté centrada en algún borde perteneciente al nuevo estímulo atendido. Actualmente, se ha investigado el efecto supresivo de los movimientos sacádicos sobre el procesamiento visual, encontrándose que el fenómeno perceptual causado por la supresión sacádica resulta de la interacción existente entre señales visuales y oculomotoras (Silvester et al ,2005; Diamond et al, 2000). Recientes observaciones fisiológicas han sugerido que el grupo de neuronas predorsales de proyección que existen en las capas profundas del Colículo Superior están implicadas en la ejecución de movimientos oculares (Dorris et al, 1997) y que estimular ésta misma población neuronal, evoca prolongados Potenciales Postsinápticos Inhibitorios (PPI) en el Núcleo Geniculado Lateral ( Zhu y Lo, 1996) y en las células que pertenecen al Complejo Pulvinar Lateral Posterior (CPLP), sugiriendo la anterior respuesta, que los circuitos inhibitorios proyectados desde las capas profundas del Colículo Superior hacia el Núcleo Geniculado Lateral ( NGL) y hacia CPLP, pueden proveer una prolongada inhibición para las vías visuales geniculadas (Retina-NGL-V1) y extrageniculadas (Retina-CS-CPLP-NGL-V1) durante la ejecución de movimientos sacádicos ( Zhu y Lo, 1998). La latencia de los PPI que parten del Colículo Superior hacia las células de relevo que se ubican en CPLP y en el NGL se ha encontrado dentro de un rango de 3-6 milisegundos, proceso que es mucho más rápido que el tiempo que tarda en dispararse un movimiento sacádico a partir de las mismas células del CS, el cual oscila entre 20-60 milisegundos (Moschovakis et al, 1988). Sugiriendo este patrón inhibitorio, un rápido y eficiente mecanismo de refresco para las señales que se proyectan desde la retina a través del NGL hacia V1, modulado por circuitos inhibitorios retroalimentadores provenientes de células del CS. Tal vez de esta forma se cierre el modo Unlock, pues existen estudios neurofisiológicos que han observado facilitación de la transmisión de nuevas señales hacia V1 en el periodo inmediato a la ejecución de un movimiento sacádico (Barlett et al, 1976). Situación que consecuentemente propicia nuevas codificaciones de bordes extraídos del procesamiento del Contraste Acromático y por lo tanto sustenta el desarrollo de nuevos estados atencionales que se enfoquen sobre el estímulo atendido, iniciando de nuevo el modo Lock, en el cual se foveará aquel nuevo estímulo localizado dentro de un entorno tridimensional también codificado a partir de los bordes. Por esto se podría afirmar, que en el periodo de equilibrio visuomotor ofrecido por el modo Lock subyacen las bases neurofisiológicas de los mecanismos de fusión.
38
Existe la posibilidad dentro de lo que ha correlacionado Giraldo durante los últimos años, que otra de las funciones de la poco entendida vía extrageniculada sea la de servir como red alternativa del Sistema Nervioso Central para lograr generar Potenciales Postsinápticos Inhibitorios (PPIs) en las capas profundas del Colículo Superior en el propósito de iniciar el modo Unlock, en aquellos casos en los que éste no se pueda generar en la corteza Frontal. La anterior afirmación es soportada por literatura de antaño y observaciones neurofisiológicas recientes: Jorge Corvera relata: "Las lesiones frontales bilaterales producen parálisis sacádica que no se recupera...La parálisis sacádica bilateral libera los reflejos de fijación de origen occipital y produce lo que fue denominado por Holmes (Holmes, 1938) "espasmo de fijación". Los ojos del paciente se fijan a un objeto y permanecen mirándolo sin poderse desviar de él hasta que la fijación se interrumpe por un parpadeo." (Corvera, 1978). De otra mano, recientes investigaciones han relacionado el fenómeno del parpadeo con la ejecución de movimientos oculares. En ellas, la evidencia recopilada indica que los parpadeos influyen en los movimientos sacádicos horizontales en humanos (Rottach et al, 1998) y en las sacadas verticales u horizontales realizadas por primates (Goossens y Van Opstal, 2000a).También se ha encontrado que el parpadeo produce disminución de la actividad neuronal durante la realización de sacadas en neuronas de la Formación Reticular Pontina Paramediana (Mays y Morisse,1995) y en neuronas relacionadas con los mismos movimientos en las capas intermedias del Colículo Superior (Goossens y Van Opstal, 2000b). Conjuntamente, los anteriores hallazgos apoyan la hipótesis presentada dentro de éste marco teórico de que la vía extrageniculada sea facilitadora de modalidades Unlock cuando existe ausencia de su normal codificación en la corteza Frontal. Por ello, Giraldo propone el fenómeno inhibitorio causado por el parpadeo, como mecanismo alternativo del cerebro humano para inducir la modalidad Unlock y así poder realizar un nuevo movimiento ocular.
CONCLUSIÓN Muchas de las piezas que componen los mecanismos de programación de los movimientos oculares se empiezan a manifestar a la luz de lo que implica el ciclo Lock-Unlock, del cual existe diversa evidencia tanto clínica como neurofisiológica, que apoyaría su real desarrollo dentro del cerebro humano. Ratificándose también dentro de la anterior propuesta teórica, la importancia de la codificación de señales que representen los bordes tridimensionales que se extraen del análisis del contraste acromático y de su necesario realce por medio de retroalimentación atencional desde las etapas más tempranas de procesamiento visual cortical , con el fin de establecer diferentes esquemas para la realización de movimientos oculares que lleven ambas fóveas sobre cualquier coordenada del campo visual tridimensional y así poder detallar (fovear) en alta resolución un objeto de forma sostenida.
REFERENCIAS Posner M.I.(1980).Orienting of attention. J. Exp. Psychol. 32: 3-25. Hawkings H.L., Shafto M.G. y Richardson K.(1988). Effects of target luminance and cue validity on the latency of visual detection.Percept. Psychophys. 44: 484-492. Giraldo D.(2004).Codificación Neural de la Estereopsis: Modelo teórico de la detección de Ceros como base de la visión estereoscópica.Visión Andina 6:32-38. Cumming B.G. y Parker A. J. (1997).Responses of primary visual cortical neurons to binocular disparity without depth perception. Nature 389: 280-283.
39
Masson G.S., Busettini C. y Miles F.A.(1997). Vergence eye movements in response to binocular disparity without depth perception. Nature 389: 283-286. Giraldo D. (2005).Teoría del contraste espectral acromático: Codificación, decodificación , análisis y proyección como base neural del procesamiento visual humano.(1a. parte) Franja Visual 82 :10 -14. Giraldo D. (2005).Teoría del contraste espectral acromático: Codificación, decodificación , análisis y proyección como base neural del procesamiento visual humano.(2a. parte) Franja Visual 83 :9-13. Corbetta M., Akbudak E., Conturo T. E., Snyder A. Z., Ollinger J. M., Drury H. A., Linenweber M. R., Petersen S. E., Raichle M. E., Van Essen D. C. y Shulman G. L. (1998).A common network of functional areas for attention and eye movements. Neuron 21: 761-773. Reynolds J.H., Pasternak T. y Desimone R. (2000) Attention increases sensitivity of V4 neurons. Neuron 26:703-714. Martinez-Trujillo J.C y Treue S.(2002). Attentional modulation strength in cortical area MT depends on stimulus contrast. Neuron 35:365-370. Luck S.J., Chelazzi L., Hillyard S.A. y Desimone R.(1997). Neural mechanisms of spatial selective attention in areas V1,V2 and V4 of macaque visual cortex. J. Neurophysiol. 77: 24-42. Hillyard S.A., Vogel E.K. y Luck S.J. (1998).Sensory gain control (amplification) as a mechanism of selective attention: electrophysiological and neuroimaging evidence. Philos. Trans. R. Soc. Lond. Biol. Sci. 353 : 1257-1270. Kastner S. y Ungerleider L.G.(2000). Mechanisms of visual attention in the human cortex. Annu.Rev. Neurosci. 23: 315-341. Martinez A., Anllo-Vento L., Sereno M.I. , Frank L.R., Buxton R.B., Dubowitz D.J., Wong E.C., Hinrichs H.,Heinze H.J. y Hillyard S.A.(1999). Involvement of striate and extrastriate visual cortical areas in spatial attention. Nat. Neurosci. 2:364-369. Masson G. S. y Castet E.(2002). Parallel Motion Processing for the Initiation of Short-Latency Ocular Following in Humans.J . Neurosc. 12: 5149-5163. Sclar G., Maunsell J.H y Lennie P. (1990). Coding of image contrast in central visual pathways of the macaque monkey. Vision Res 30:1-10. Movshon J.A. y Newsome W.T. (1996). Visual response properties of striate cortical neurons projecting to area MT in macaque monkeys. J. Neurosci. 16:7733-7741. Derrington A.M. y Lennie P.(1984). Spatial and temporal contrast sensitivities of neurons in lateral geniculate nucleus of macaque. J. Physiol.(Lon) 357: 219-240. Gottlieb J.P, McAvoy M.G., y Bruce C.J. (1994). Neural responses related to smooth-pursuit eye movements and their correspondence with electrically elicited smooth eye movements in the primate frontal eye field. J. Neurophysiol. 72 :1634-1653. Petit L., Ingeholm J.E., Clark V.P., Courtney S.M., Keil T., Maisog J.M. y Haxby J.V. (1997).fMRI study of visually guided saccadic and pursuit eye movements. Neuroimage 5: 248. Goldberg M.E. y Segraves M.A.(1990).The role of the frontal eye field and its corticotectal projection in the generation of eye movements. Vision and the brain, Cohen & Bodis-Wollner Eds,New York: 195-209. Findlay J.M y Walker R..(1999).A model of saccadic generation based on parallel processing and competitive inhibition.Behav. Brain Sci. 22: 661-721. Frens M.A., Hooge I.T.C. y Goossens H.H.L.M.(1999).Can parallel processing processing and competitive inhibition explain the generation of saccades?.Behav.Brain Sci. 22:685-686.
40
Quaia C. y Optican L.M.(1999).No "when" without "Where". Behav.Brain Sci. 22:696-697. Georgopoulos A.P.(2000).Neural aspects of cognitive motor control.Curr. Opin. Neurobiol. 10: 238-241. Connolly J.D., Goodale M.A., De Souza J.F.X., Menon R.S. y Vilis T.A.(2000).Comparison of frontoparietal fMRI activation during anti-saccades and anti-pointing. J. Neurophysiol. 84:1645-1655. Everling S. y Munoz D.P.(2000).Neuronal correlates for preparatory set associated with pro-saccades and anti-saccades in the primate frontal eye field. J. Neurosc. 20:387-400. Gagnon D.,O'Driscoll G.A., Petrides M. y Pike G.B.(2002).The effect of spatial and temporal information on saccades and neural activity in oculomotor structures. Brain 125:123-139. Dias E.C. y Bruce C.J.(1994).Physiological correlate of fixation disengagement in the primate's frontal eye field. J. Neurophysiol. 72:2532-2537. Thompson K.G., Hanes D.P., Bichot N.P. y Schall J.D.(1996).Perceptual and motor processing stages identified in the activity of macaque frontal eye field.J. Neurophysiol. 76:4040-4055. Stanton G.B.,Goldberg M.E. y Bruce C.J.(1988).Frontal eye field efferents in the macaque monkey:II.Topography of terminal fields in midbrain and pons. J. Comp.Neurol. 271:493-506. Sommer M.A. y Wurtz R.H.(2000).Composition and topographic organization of signals sent from the frontal eye field to the superior colliculus. J. Neurophysiol. 83:1979-2001. Dorris M.C., Paré M. y Munoz D.P.(1997).Neuronal activity in monkey superior colliculus related to the initiation of saccadic eye movements. J. Neurosc. 17:8566-8579. Sparks D., Roher W.H. y Zhang Y.(2000).The role of superior colliculus in saccade initiation: A study of express saccades and the gap effect. Vision Res. 40:2763-2777. Edelman J.A. y Keller E.L.(1996).Activity of visuomotor burst neurons in the superior colliculus accompanying express saccades. J. Neurophysiol. 76:908-926. Krauzlis R.J.(2003).Neuronal activity in the rostral superior colliculus related to the initiation of pursuit and saccadic eye movements. J. Neurosc. 23:4333-4344. Basso M.A., Krauzlis R.J. y Wurtz R.H.(2000).Activation and inactivation of rostral superior colliculus neurons during smooth-pursuit eye movements in monkeys. J. Neurophysiol. 84: 892-908. Wurtz R.H.(1996).Vision for the control of movement.I.O.V.S. 37:2131-2145. Liversedge S.P. y Findlay J.M.(2000).Saccadic eye movements and cognition. T.I.C.S. 4:6-14. Schall J.D. y Thompson K.G.(1999).Neural selection and control of visually guided eye movements.Annu. Rev. Neurosc. 22:241-259. Colby C.L. y Goldberg M.E.(1999).Space and attention in parietal cortex..Annu. Rev. Neurosc. 22:319-349. Zhang M. y Barash S.(2000).Neuronal switching of sensorimotor transformations for antisaccades.Nature 408:971-975. Platt M.L. y Glimcher P.W.(1999).Neural correlates of decision variables in parietal cortex. Nature 400:233-238. Snyder L.H.,Batista A.P y Andersen R.A.(1997).Coding of intention in the posterior parietal cortex. Nature 386:167-170. Gnadt J.W. y Beyer J.(1998).Eye movements in depth: What does the monkey's parietal cortex tell the superior colliculus?Neuroreport 9:233-298.
41
Ferraina S., Paré M. y Wurtz R.H.(2002).Comparison of cortico-cortical and cortico-collicular signals for the generation of saccadic eye movements. J. Neurophysiol. 87 :845-858. Schall J.D., Hanes D.P.,Thompson K.G. y King D.J.(1995).Saccade target selection in frontal eye field of macaque.I.Visual and premovement activation. J. Neurosc.15:6905-6918. Basso M.A. y Wurtz R.H.(1997).Modulation of neuronal activity by target uncertainty. Nature.389:66-69. Desimone R.(1998).Visual attention mediated by biased competition in extrastriate visual cortex.Phil. Trans. R. Soc. Lond. B. 353:1245-1255. Corbetta M.,Kincade J.M., Ollinger J.M., Mc.Avoy M.P. y Shulman G.L.(2000).Voluntary orienting is dissociated from target detection in human posterior parietal cortex. Nat. Neurosci. 3:292-297. Corbetta M. y Shulman G.L.(2002).Control of goal-directed and stimulus-driven attention in the brain. Nat. Rev. Neurosci. 3:201-215. Serences J.T., Schwarzbach J., Courtney S.M., Golay X. y Yantis S.(2004).Control of object-based attention in human cortex. Cerebral cortex 14:1346-1357. Zipser D. y Andersen R.A.(1988).A back-propagation programmed network that simulates response properties of a subset of posterior parietal neurons. Nature 331:679-684. Andersen R.A., Snyder L.H., Bradley D.C. y Xing J.(1997).Multimodal representation of space in the posterior parietal cortex and its use in planning movements.Annu. Rev. Neurosci. 20:303-330. Brotchie P.R., Lee M.B., Chen D.Y., Lourensz M., Jackson G., y Bradley W.G.(2003).Head position modulates activity in the human parietal eye fields. Neuroimage. 18:178-184. Genovesio A. y Ferraina S.(2004).Integration of retinal disparity and fixation-distance related signals toward and egocentric coding of distance in the posterior parietal cortex of primates.J. Neurophysiol. 91:2670-2684. Stricanne B., Andersen R.A. y Mazzoni P.(1996).Eye-centered, head centered, and intermediate coding of remembered sound locations in area L.I.P. J. Neurophysiol. 76:2071-2076. Sylvester R., Haynes J.D. y Rees G.(2005).Saccades differentially modulate human LGN and V1 responses in the presence and and absence of visual stimulation. Current Biol. 15:37-41. Diamond M.R., Ross J. y Morrone M.C.(2000).Extraretinal control of saccadic supression. J. Neurosci. 20:3449-3455. Zhu J.J. y Lo F.S.(1996).Time course of inhibition induced by a putative saccadic supression circuit in the dorsal lateral geniculate nucleus of the rabbit. Brain Res. Bull. 41:281-291. Zhu J.J. y Lo F.S.(1998).Control of recurrent inhibition of the lateral posterior-pulvinar complex by afferents from the deep layers of the superior colliculus of the rabbit.J Neurophysiol. 80:1122-1131. Moschovakis A.K., Karabelas A.B. y Highstein S.M.(1988).Structure function relationships in the primate superior colliculus.II.Morphological identity of presaccadic neurons. J. Neurophysiol. 60:263-302. Bartlett J.R., Doty R.W.Jr., Lee B.B. y Sahakara H.(1976).Influence of saccadic eye movements on geniculostriate excitability in normal monkeys.Exp. Brain Res. 25:487-509. Holmes G.(1938).The cerebral integration of ocular movements. Brit. Med. Journal. 2:107. Corvera J.(1978) Neurotología Clínica. México D.F:Salvat Mexicana de Ediciones. Rottach K.G., Das V.E., Wohlgemuth W., Zivotofsky A.Z. y Leigh RJ.( 1998).Properties of horizontal saccades accompanied by blinks. J. Neurophysiol 79: 2895-2902.
42
Goossens H.H. y Van Opstal A.J. ( 2000a ).Blink-perturbed saccades in monkey. I. Behavioral analysis. J. Neurophysiol 83: 3411-3429. Mays L.E. y Morisse D.W.(1995).Electrical stimulation of the pontine omnipause area inhibits eye blink. J .Am.Optom . Assoc. 66: 419-422. Goossens H.H. y Van Opstal A.J. (2000b).Blink-perturbed saccades in monkey. II. Superior colliculus activity. J Neurophysiol 83: 3430-3452.
44
PAPEL DE LOS BORDES EN EL SENTIDO DEL EQUILIBRIO CORPORAL
“Doctor, esos nuevos anteojos me marean mucho, creo que no podré utilizarlos
permanentemente”
Esta, tal vez es una de las expresiones que más se escuche decir a los pacientes a nivel mundial,
cuando reciben un nuevo par de anteojos y sobre todo, cuando la fórmula difiere de la anterior en
+-0.50 Dioptrías o más. Incluso, existen personas que son sensibles a cambios de tan sólo +-0,25
Dioptrías. Puedo decir de ellos que no están locos, ni que simplemente sea un capricho de la gran
mayoría de nuestros pacientes. Toda esta sintomatología, obedece a la relación existente entre la
codificación de bordes realizada por las células ganglionares de la retina y las codificaciones
emitidas por las células ciliadas de los órganos vestibulares, las cuales, dentro del cerebro humano
se funden con las procedentes de la propiocepción en una misma codificación, con la finalidad de
conservar el equilibrio corporal en la mayoría de los mamíferos, en especial en los primates y
humanos que por lo general pasan gran parte de su ciclo de vida en bipedestación.
En realidad, el nexo existente entre ambas codificaciones se manifiesta claramente en todo
paciente que cambia de anteojos. Por lo cual, aprendí a calmar su ansiedad, indicándoles que las
neuronas de sus cerebros debían ajustarse a la nueva situación de magnificación/minificación de la
imagen, de igual manera a la nueva velocidad con la que se deslizaban las imágenes sobre sus
retinas, que a su vez, debían sincronizarse con la que emitían sus vestíbulos en la corteza parietal
posterior, para que al final el cerebro logre adaptarse a las nuevas condiciones y dejar de sentir
mareo (para esto puede pasar hasta un mes, si se usa la nueva corrección con cierta continuidad).
Como cosa del destino, el gran laboratorio experimental tuve que desarrollarlo hace 4 años con
mi Esposa, quien quedó afectada por una laberintitis viral en su órgano vestibular derecho. Ella
sólo puede sostener el equilibrio eficientemente si mantiene los ojos abiertos, con los ojos
cerrados o en total oscuridad, tiende a caer hacia la derecha (Signo de Romberg positivo hacia la
derecha). Con ella y las manifestaciones de su patología, pude comprobar la necesaria codificación
de bordes como mecanismo secundario para el sostenimiento del equilibrio corporal.
Si el lector apropia dentro de su mente las hipótesis que aquí se exponen, y que no encontrará en
otro lugar fuera de estas líneas y de su primera publicación en el año 2007 por la revista Franja
Visual, tendrá un concepto neurofisiológico muy amplio y conciso con el que podrá explicar mucha
de la sintomatología que cotidianamente acusan los pacientes que acuden a su consultorio.
Giraldo D.(2007) Equilibrio corporal en humanos: Teoría del mecanismo secundario. Franja Visual 92: 47-50.
45
TEORÍA DEL MECANISMO SECUNDARIO PARA EL EQUILIBRIO CORPORAL EN HUMANOS
INTRODUCCIÓN
El papel contributivo del sistema visual en la conservación del equilibrio corporal es un tema del cual se dispone de muy poca información en la literatura. Siguiendo con el planteamiento originalmente propuesto de que el área 17/V1 es la que codifica los bordes de una imagen capturada por cada hemiretina , basándose en el procesamiento del Contraste Espectral Acromático (C.E.A.) para hacer posibles fenómenos Perceptuales, Motores y Cognitivos en cada hemisferio cerebral ( Giraldo, 2005). En el siguiente trabajo teórico se planteará la manera como las señales que representan el procesamiento 3D de los bordes, pueden llegar a ser eficientemente utilizadas para establecer coordenadas de posicionamiento en el propósito de sostener el equilibrio corporal en seres humanos, cuando las aferencias principalmente provistas por los Vestíbulos fallan.
ANTECEDENTES
Jorge Corvera (Corvera, 1978) en su libro “Neurotología Clínica”, describe una de las situaciones clínicas que más respalda la posible utilización de las aferencias visuales (Bordes) como marcadores de referencia espacial para mantener el equilibrio corporal después de que ambos vestíbulos sufran daños irreversibles. El autor realiza la siguiente descripción: “La afección total vestibular aguda bilateral se puede observar sobre todo en los casos de intoxicación con antibióticos aminoglicósidos. El complejo sindrómico es característico, constituyendo el cuadro clínico de la ataxia vestibular, muy semejante a la ataxia aguda cerebelosa, de la que se distingue por que aquella mejora con los ojos abiertos, en tanto que la cerebelosa no cambia ni con ojos abiertos ni con ojos cerrados. El daño vestibular bilateral agudo no produce vértigo, sino solamente un intenso desequilibrio, que se traduce, desde el punto de vista subjetivo del paciente, en una inseguridad total en sus movimientos. Tampoco hay náusea ni vómito. En la exploración clínica se observa pérdida completa del equilibrio. La prueba de Romberg es intensamente positiva y la marcha ciega es imposible. No hay nistagmus espontáneo ni nistagmus postural. La motilidad ocular, tanto voluntaria como refleja, es normal siempre y cuando se efectúe con la cabeza inmóvil. Cuando la cabeza se encuentra firme, las sacadas oculares y las derivas de rastreo tienen caracteres normales; al movilizar la cabeza, se pierde la estabilidad ocular y, si se intenta hacer una prueba de sacadas oculares con la cabeza en movimiento, por lento que éste sea, se manifiesta dismetría. El nistagmus optocinético activo es normal (siempre y cuando la cabeza esté quieta); el nistagmus optocinético pasivo se aprecia con caracteres clínicos de normalidad, aun cuando puede estar cuantitativamente deprimido hacia ambos lados. Las pruebas de estimulación vestibular, tanto térmicas como rotatorias, no dan respuesta nistágmica alguna. En la fase crónica del síndrome vestibular bilateral total, el equilibrio se recupera, al grado de poder reanudar una vida normal, siempre y cuando los movimientos se hagan con los ojos abiertos. Con los ojos cerrados persisten alteraciones del equilibrio, en particular cuando la base no es firme, o ante bases inestables.” Observando la anterior descripción, es evidente el procesamiento de las aferencias visuales como parámetro aplicable en la regulación motora del equilibrio corporal. Entonces: ¿Pueden utilizarse las señales que representan los bordes de una imagen que se proyecta sobre las retinas para reemplazar las funciones propias de un órgano tan distinto como el vestíbulo? ¿Es posible que en nuestro cerebro ambas codificaciones (potenciales de acción que provienen de cada hemiretina representando los bordes y los potenciales de acción que son conducidos por el nervio vestibular) se integren rutinariamente hasta el punto de funcionar como una sola codificación para la regulación oculomotora y del equilibrio? Si se aprecia la sorprendente similitud de los trazados nistagmográficos normales obtenidos mediante estimulación optovestibular y los obtenidos mediante estimulación vestibular pura (realizándose ésta última en ausencia de estímulos sonoros y visuales.), puede tenerse en cuenta tal posibilidad (Fig.No.1.).
46
FIGURA 1- Trazados nistagmográficos obtenidos por estimulación optovestibular (arriba) y por estimulación vestibular pura (abajo).
LA CODIFICACIÓN DE BORDES COMO POSIBLE BASE NEURAL
El procesamiento del Contraste Espectral Acromático (C.E.A.) ha sido relacionado teóricamente como base necesaria para la codificación neural de señales que representen los bordes de los objetos presentes en una imagen capturada por nuestras retinas, permitiendo procesar sus formas, sus coordenadas de ubicación en el espacio tridimensional y establecer si se mueven o no. Asegurando de esta manera la utilización de un código único para un coordinado y sincronizado establecimiento a nivel global cortical de los fenómenos perceptuales, motores y cognitivos por aferencias visuales (Giraldo, 2005). ¿Puede el procesamiento de los bordes 3D ejecutado por las neuronas de las capas superiores del área 17/V1 llegar a ser utilizado como sistema de coordenadas de posicionamiento para controlar el equilibrio corporal? Observando la descripción realizada en líneas anteriores sobre el fenómeno de compensación del equilibrio por aferencias visuales, podemos suponer que sí. En realidad, vimos que el procesamiento visual puede ser utilizado eficientemente como fuente secundaria de información para el sostenimiento del equilibrio, luego de que ambos órganos vestibulares (que son la fuente primaria de información del cerebro para establecer sus propias coordenadas de posicionamiento en el espacio tridimensional), no emitan señal alguna.
ANTECEDENTES EXPERIMENTALES
J. J. Gibson (Gibson, 1958) sugirió que el movimiento percibido visualmente, era una de las fuentes primarias de información para el organismo que se mueve sobre su propio movimiento con respecto al ambiente dentro del cual se desplaza. Los trabajos realizados por Lee y Colaboradores, establecieron la importancia del flujo óptico de información para el control postural. Estos investigadores observaron que niños en pie pueden perder fácilmente el equilibrio y caer como resultado del movimiento rotatorio del entorno visual que los rodea (Lee y Aronson ,1974). El mismo procedimiento experimental también puede desestabilizar el equilibrio en adultos, sugiriendo que el movimiento de información captada visualmente puede codificarse en un patrón específico que generalmente se obtiene de los receptores presentes en las extremidades y de los receptores gravitatorios del oído interno (Lee y Lishman, 1975). La percepción visual del movimiento puede causar una profunda sensación de automovimiento, ya sea cuando el campo observado rota sobre el eje vertical como sobre el eje horizontal (Brandt et al ,1973; Johanson ,1971; Dichgans y Brandt, 1978). El importante trabajo de Simpson y Colaboradores (Simpson et al, 1981) en el cual se estudiaron los registros individuales de neuronas pertenecientes al Sistema óptico accesorio y a la Oliva inferior del conejo, mientras se sometía al animal a rotaciones de todo su campo visual sobre varios ejes, demostró que las neuronas codificaban esencialmente tres ejes principales para la percepción rotacional de todo el campo visual. De esta forma, cuando el campo rotaba sobre el eje vertical (ósea, horizontalmente), dichas neuronas respondían mejor al movimiento horizontal. Los otros dos ejes cardinales de rotación, subyacían en el plano horizontal, aproximadamente a 45° a la derecha y 45° a la izquierda de la línea media. Finalmente el trabajo de Simpson y Colaboradores sugirió la existencia de analogías funcionales entre las tres clases de canales semicirculares presentes en los vestíbulos y estos tres tipos de células sensibles al movimiento del campo visual. Por lo tanto, la información visual que es utilizada para establecer la percepción del movimiento complementa la información obtenida por el sistema vestibular, exhibiendo organizaciones funcionales muy similares que utilizan el mismo sistema de coordenadas ( Nakayama, 1985).
47
ANATOMOFISIOLOGÍA COMPARATIVA ENTRE EL SISTEMA VESTIBULAR Y EL SISTEMA VISUAL
1. Ambos sistemas presentan actividad neuronal espontánea. -En el sistema vestibular: La actividad espontánea ha sido estudiada en las fibras del nervio vestibular de ranas ( Lowenstein y Sand, 1936) y del mono ardilla (Goldberg y Fernández , 1971), encontrando éstos últimos investigadores que todas las fibras del nervio vestibular sin excepción poseen actividad espontánea. -En el sistema visual: La actividad neuronal espontánea en el sistema visual ha sido descrita por Penn y Colaboradores ( Penn et al,1994) , relatando que antes de la maduración de los fotorreceptores y de la apertura ocular , las células ganglionares de la retina periódicamente realizan disparos de potenciales de acción . Dichas descargas se transmiten de una célula a la siguiente de la misma forma hacia la retina como hacia la corteza occipital. 2. Ambos sistemas pueden codificar el estímulo en polaridad , lo cual permite el despliegue de respuestas motoras bidireccionales. - En el sistema Vestibular: Lowenstein y Sand ( Lowenstein y Sand, 1936) registraron la actividad de las fibras nerviosas del nervio vestibular de la rana, encontrando que las rotaciones efectuadas en un sentido provocan aumento en la frecuencia de descarga , mientras que rotaciones en sentido contrario al inicial la disminuye. Así, quedó demostrado que las células ciliadas poseen una polarización estructural determinada por las posiciones relativas del kinocilio y de los estereocilios. En cualquiera de los tres conductos semicirculares, un estímulo que provoque desviación de los estereocilios hacia el kinocilio, desencadenará un aumento de las respuestas (por encima del nivel de actividad espontánea), mientras que desviaciones en el sentido opuesto ocasionan disminución de las mismas. (Fig.No.2.)
FIGURA 2- Representación de una célula ciliada y de sus cilios, indicando la dirección de excitación e inhibición de acuerdo al desplazamiento del kinocilio. -En el sistema visual: En la retina, existen células ganglionares con selectividad direccional que responden activamente a un estímulo que se desplace dentro de sus campos receptivos en la dirección preferida, siendo inhibidas cuando el estímulo se mueve en dirección opuesta a la anterior. (Barlow y Hill, 1963). También se ha encontrado evidencia de que éstas células ganglionares que presentan selectividad en la dirección, por sí mismas exhiben polarización morfológica (Jensen y De Voe, 1983; Amthor et al, 1989; Yang y Masland, 1992 ,1994.). Tomando en cuenta la codificación de bordes de los objetos presentes en una imagen como el parámetro más importante para el procesamiento visual humano (y robótico), una codificación de polaridad diferente para ambos ojos de dichos bordes plantearía problemas perceptuales tan profundos, que pueden afectar la percepción estereoscópica y la correcta retroalimentación regulatoria de los movimientos oculares necesarios para conseguirla y sostenerla. (Giraldo, 2004). La anterior afirmación está respaldada por reciente evidencia neurofisiológica de que las neuronas pertenecientes a las capas superiores (2 y 3) de las áreas 17/V1, 18/V2 y 19/V4 de los primates pueden codificar bordes, sus polaridades y sus extensiones (Zhou, Friedman y Von der Heydt, 2000). También se ha sugerido que dichas neuronas podrían ser plausiblemente las que efectúan el proceso de cancelación de la codificación de bordes cuando son analizados en diferente polaridad (Becker y Anstis, 2004).
48
El despliegue de respuestas inhibidoras de la percepción estereoscópica como resultado del análisis de la polaridad inherente de los bordes de los objetos presentes en una imagen, ya se ha manifestado experimentalmente en trabajos como el de Cumming y Parker (Cumming y Parker, 1997), en el cual se estudió dicho proceso en el área 17 de primates. Observándose en otro trabajo, que los mismos mecanismos se desempeñan también como activadores de movimientos oculares de vergencia que no se pueden coordinar, afectándose la percepción de profundidad a causa de ello. Dichas respuestas, fueron encontradas por los autores de este último estudio tanto en primates como en humanos (Masson et al, 1997). En un reciente trabajo de Von der Heydt y Colaboradores (Von der Heydt et al, 2000), en el cual se analizó la selectividad para la disparidad binocular en las neuronas de las capas superiores (2 y 3) del área 17/V1 y del área 18/V2 de primates, los autores concluyeron que la gran mayoría de las células de dichas capas son selectivas para la disparidad binocular. Otro aspecto de éste estudio que llama la atención es el siguiente: Mientras que la gran mayoría de las células estudiadas en el área 17/V1, respondían a superficies estereoscópicas, un 33% de las células del área 18/V2 respondían exclusivamente a los bordes y codificaban señales que representaban la orientación de los mismos. Estas células codificaban señales tanto de los contornos de figuras ciclópeas, como de los contornos definidos por el contraste de manera consistente. La mayoría de las células estudiadas podían también codificar la polaridad de los contornos, siendo esto evidencia directa de la necesidad de establecer los bordes estereoscópicos en polaridad para así codificar la dirección de movimiento de los contornos de objetos que se ubiquen en primeros planos y en planos de fondo (Von der Heydt et al, 2000). Aún con toda la importancia que representa la codificación de los bordes de los objetos presentes en una imagen para el procesamiento visual humano, ocuparía un lugar más importante para efectos motores la codificación de ellos en polaridad, pues ésta función es al parecer la base neural de integración motora para dos sistemas tan diferentes como el visual y el vestibular, pero que comparten un mismo sistema de coordenadas espaciales y presentan diseños anatómico-fisiológicos que perfectamente permiten codificar en nuestros cerebros cada una de éstas coordenadas de posicionamiento espacial. 3-Ambos sistemas presentan diseños anatómico-fisiológicos específicos relacionados con la detección y procesamiento en tiempo real de información tridimensional , que permiten codificaciones 3D del movimiento propioceptivo (Vestibular) y teleceptivo (Visual) integrándolas en un mismo sistema de coordenadas. Para tener una idea general del diseño funcional que ambos sistemas poseen, es preciso observar el sistema de coordenadas tridimensionales universales que está formado por 3 ejes principales sobre los cuales puede rotar todo el sistema. (Fig.No.3.)
FIGURA 3- Sistema de coordenadas Universales. -Rotaciones Horizontales: Se realizan sobre el eje Y. -Rotaciones Verticales: Se realizan sobre el eje X. -Rotaciones Torsionales: Se realizan sobre el eje Z.
49
El anterior modelo se aplica perfectamente en ambos sistemas: -En el sistema vestibular (Fig.No.4.):
FIGURA 4- Sistema de coordenadas aplicadas al vestíbulo.
-En él, cada canal semicircular posee una función específica: -Canal semicircular Horizontal: Sus receptores detectan y codifican rotaciones de la cabeza hacia la derecha o izquierda. (Sobre el eje Y). -Canal semicircular Vertical: Sus receptores detectan y codifican inclinaciones de la cabeza hacia adelante o hacia atrás. (Sobre el eje X). -Canal semicircular Posterior: Sus receptores detectan y codifican inclinaciones de la cabeza hacia la derecha o izquierda. (Sobre el eje Z). -En el sistema visual (Fig.No.5.):
FIGURA 5- Sistema de coordenadas aplicadas al globo ocular. Con respecto al sistema visual, es de apreciar que la disposición espacial de los músculos extraoculares permite la rotación del sistema detector-codificador que es la retina en todos los planos espaciales (Fig.No.6.).
50
FIGURA 6- Acción de los músculos extraoculares de acuerdo al eje sobre el cual giran para permitir la codificación tridimensional de bordes. -De esta manera, los músculos rectos medios o laterales se activarían como respuesta a la detección y codificación de bordes ubicados o que se desplacen sobre nuestras retinas en dirección horizontal, permitiendo una rotación de todo el sistema (globos oculares) sobre el eje Y. -Los músculos rectos superiores o rectos inferiores, se activarían como respuesta a la detección y codificación de bordes ubicados o que se desplacen sobre ambas retinas en dirección vertical, permitiendo una rotación de todo el sistema receptor sobre el eje X. -Los músculos oblicuos superiores o inferiores se activarían como respuesta a la detección y codificación de bordes que rotan sobre el eje Z. (Eje anteroposterior). Consiguiéndose por medio de estas tres acciones, el sostenimiento de una correcta codificación hemiretinal de los bordes estereoscópicos de cualquier imagen. Este proceso hace concordar eficientemente el sistema de coordenadas proporcionadas por el sistema visual al cerebro, con el sistema fijo de coordenadas espaciales de la escena observada. En éste momento, podríamos afirmar que se esbozan homologías funcionales entre las estructuras óseas laberínticas y las orbitarias oculares que se desempeñan como contenedores fijos de subsistemas dinámicos , que en el caso del sistema vestibular está conformado por la endolinfa y en el caso del sistema visual estaría conformado por los músculos extraoculares, siendo ambos a su vez facilitadores del desplazamiento rotacional de las entidades estimulatorias que para el sistema vestibular son los otolitos, los cuales como es conocido, actúan como estímulos mecánicos productores de descargas excitatorias o inhibitorias. En el sistema visual, los bordes codificados en polaridad en cada hemiretina actuarían como estímulos ópticos productores también de respuestas excitatorias o inhibitorias. Ambas percepciones, al parecer se integran a nivel cortical en una codificación homóloga con también similares consecuencias motoras. Las anteriores observaciones pueden apoyarse en reciente evidencia procedente de estudios neurofisiológicos y de neuroimagen que se relacionarán en las siguientes líneas, sustentando un posible proceso de integración cortical de los bordes y de las señales posicionamiento vestibular, codificados tridimensionalmente.
UNA RED DE INTEGRACION CORTICAL
Al parecer, el lugar de integración cortical para las señales codificadas por el sistema vestibular y sus homólogas codificadas por el sistema visual, es la corteza Parietal Posterior. Recientes investigaciones neurofisiológicas han relacionado la corteza Parietal Posterior como el lugar en el cual las señales que provienen de los órganos sensoriales se integran espacio-temporalmente para producir respuestas retroalimentadoras sensoriomotoras de diversa índole. Así lo demuestra el trabajo realizado en macacos por Klam y Graf ( Klam y Graf, 2003) en el cual se estudiaron las señales vestibulares proyectadas a la corteza Parietal Posterior durante la ejecución de movimientos activos y pasivos de cabeza. Concluyendo dichos autores, que el papel desempeñado por las neuronas parietales tiene más que ver con el establecimiento de representaciones del espacio sensorial que con comportamientos reflejos o de contextos de control motor. Agregando los mismos investigadores, que la corteza Parietal Posterior funciona como una estación intermedia
51
entre las cortezas sensorial y motora, para de esta forma participar en la formación de planos de ejecución motora como también en la de construir representaciones abstractas del espacio circundante ( Klam y Graf, 2003). En una situación experimental similar Genovieso y Ferraina (Genovieso y Ferraina, 2004), hallaron otra función de la corteza Parietal Posterior de los primates (específicamente del área Lateral IntraParietal (L.I.P)), dicha función es la de remapear las señales visuales provenientes de un sistema de coordenadas retinocéntricas en uno centrado en el cuerpo. Según los autores, la corteza Parietal Posterior integra información retinal y extraretinal para determinar la distancia egocéntrica de un objeto localizado en el espacio tridimensional. Para este cálculo, se requiere de una señal correspondiente a la disparidad retinal y de un estimado paralelo de la distancia de fijación. Estos investigadores observaron que cuando tanto la distancia de fijación como la disparidad del estímulo visual variaban, la sensibilidad a la disparidad registrada en neuronas individuales exhibía también diferente modulación. Actualmente, es ampliamente conocido que el área Lateral IntraParietal (L.I.P) hace parte de la vía dorsal del procesamiento visual cortical y que las señales que representan disparidades absolutas son las mayormente representadas en las áreas dorsales , mientras que las disparidades relativas son representadas (junto con las absolutas) en las áreas ventrales (Neri et al,2004). También se conoce que la disparidad absoluta puede ser utilizada para proveer un estimado de la distancia de un objeto que se aproxima, como también para controlar los movimientos oculares de vergencia (Howard y Rogers, 1995). Además, se ha sugerido que si las señales concernientes a la disparidad absoluta son las que están disponibles de forma más rápida para las áreas de procesamiento visual, entonces la navegación y orientación espacial se pueden beneficiar de esas señales (Neri et al, 2004). Tomando en cuenta los anteriores enunciados, como también que el área Lateral IntraParietal (L.I.P) está conectada anatómicamente con el área Ocular Frontal (FEF u área 8)(Schall et al, 1995). Tiene mucho sentido esperar que la representación del espacio circundante lograda en la corteza Parietal Posterior, como proyección de los bordes estereoscópicos que se procesaron inicialmente en el área 17/V1, se pueda sostener hasta la corteza Frontal para su utilización en procesos de retroalimentación sensoriales, motores y cognitivos. La relación retroalimentadora motora existente entre éstas dos áreas corticales ya fue observada durante la ejecución de movimientos sacádicos, sugiriéndose que probablemente la interactividad entre ellas, cumpla un papel muy importante en la programación y guía de movimientos oculares tanto conjugados como disconjugados (Ferraina et al, 2000). De esta forma, surge ante nuestros ojos una red neural conformada por las áreas 17/V1-18/V2-L.I.P y el Ocular Frontal (FEF), que utiliza posiblemente las señales que representan los bordes codificados estereoscópicamente en el área 17/V1 para procesos específicos en cada una de ellas, en el propósito final de conservar el equilibrio corporal o de coordinar otros procesos motores. (Ej. Regulación de los movimientos oculares por medio del ciclo Lock-Unlock.(Giraldo, 2006)). El trabajo de Ouchi y colaboradores (Ouchi et al, 1999) en el cual se utilizó Tomografía por Emisión de Positrones (T.E.P) para investigar el mecanismo regulatorio del equilibrio durante el proceso de estar en pie, puso al descubierto que el sólo hecho de cubrir los ojos del sujeto de experimentación durante la posición bipodálica ,es decir, parado sobre ambos pies ( Maniobra de Romberg), resultó en significante activación del giro Medial Frontal Bilateral (áreas de Brodmann 8 y 9)(Figura No.7.).
FIGURA 7- Activación significativa del Giro Medial Frontal Bilateral descrita por el equipo de Yasuomi Ouchi durante el proceso de estar en pie con los ojos cerrados. (Áreas de Brodmann 8 y 9).
52
Agregando los mismos autores, que el proceso de estar en pie con los ojos cerrados debe acudir a imágenes mentales, factor que explicaría la notable activación de las áreas 8 y 9. Como también, el solo hecho de estar en pie con los ojos abiertos, por sí mismo se acompaña de concurrente activación de las áreas visuales corticales (17/V1 y 18/V2), indicando que el cerebro se sirve de la percepción estereoscópica y del movimiento para mantener una apropiada postura corporal (Ouchi et al, 1999). Existe evidencia clínica de que la distorsión de los estímulos visuales puede causar deterioro del balance postural, cuando el sujeto que los percibe se encuentra de pie (Wolfson et al, 1992). Deterioro que probablemente se deba a un inadecuado procesamiento de los bordes tridimensionales y de sus respectivos movimientos. Por lo tanto, es deducible que si las áreas 17/V1 y 18/V2 efectivamente se activan durante todas las maniobras necesarias para el sostenimiento del equilibrio corporal cuando se tienen los ojos abiertos, lo más probable es que la base neural a utilizar por las demás áreas corticales que integran el sistema conexional sean los bordes codificados en disparidad o tridimensionalmente. De otra mano, la corteza Parietal Posterior actuaría como agente intermediario en la representación espacial proyectora /retroalimentadora de dichos bordes y como lugar de integración de esta información con las señales provenientes de los vestíbulos, obteniéndose de dicho proceso una homologada codificación utilizable en eferencias motoras, que como hemos visto es un mecanismo alternativo que eficientemente reemplaza la función vestibular bilateral ausente. Entre las muchas funciones que puede desempeñar la corteza Prefrontal (de la cual hace parte el área 9), es preciso resaltar la de dirigir los cambios atencionales de una dimensión perceptual a otra (Omori et al,1999). Como también la de permitir el establecimiento de diferencias entre las percepciones generadas por estímulos visuales provenientes del mundo exterior y aquellas generadas por nuestras imágenes mentales ( Frith y Dolan, 1997). Ambas situaciones son apreciables en el trabajo de Yasuomi Ouchi y Colaboradores ( Ouchi et al, 1999) y por lo tanto pueden ser aplicables en la conservación del equilibrio corporal, pues al ocluirse los ojos esta región cortical se activa , funcionando tal vez como área de asociación contextual que prepara a nuestros cerebros para un cambio de modalidad , pasando de un modo integracional (codificación de bordes estereoscópicos + codificación vestibular) a una modalidad de sólo aferencias vestibulares .Es por esto que cuando existe daño vestibular bilateral y se cierran los ojos, lo más seguro es que el individuo afectado pierda el equilibrio, situación atribuible a una conflictiva ausencia de la esencial información complementaria suministrada por la red que parte del área 17/V1.
CONCLUSIÓN
Los bordes codificados tridimensionalmente en polaridad se presentan como firmes candidatos para reemplazar las aferencias vestibulares en su ausencia, permitiendo la estructuración de un eficiente mecanismo secundario conservador del equilibrio corporal en seres humanos. Circunstancia que es aplicable también en ambientes de microgravedad como es investigado actualmente por varias agencias espaciales, pues en el espacio, el sistema vestibular deja de codificar quedando nuestros cerebros a merced de las aferencias visuales para proporcionar el equilibrio necesario para el cuerpo. Debido a esto, investigaciones más profundas respecto al tema serán necesarias. Aún para los profesionales de la salud visual, el conocer que los síntomas de vértigo y de pérdida del equilibrio referidos por algunos pacientes cuando utilizan correcciones ópticas por primera vez ó cuando la magnificación de la imagen plantea modificaciones en los mecanismos neurales de procesamiento de los bordes a los que sus cerebros ya se habían adaptado durante toda la vida , puede explicar la sensibilidad que para muchos de nosotros es “exagerada” en algunos de ellos, enmarcándola casi siempre dentro de contextos psicológicos cuando en realidad dicha sintomatología es de real origen neurofisiológico como se ha reportado en esta discusión teórica. Después de todo, se conoce que el desequilibrio es un problema común en personas ancianas, que ya ha sido revelado en estudios posturográficos ( Fife y Baloh, 1993). Manifestándose dicha inestabilidad en el equilibrio, como respuesta a la presentación de estímulos visuales conflictivos o distorsionados ( Nashner et al, 1982). Reclaman todas estas situaciones de parte de los profesionales de la salud visual, la elección del criterio de corrección óptico/quirúrgico más adecuado, en el sentido de que afecte en muy poco los procesos habituales de codificación estructurados en el cerebro de cada paciente.
REFERENCIAS Amthor F.R., Takahashi E.S. y Oyster C.W. (1989) Morphologies of rabbit retinal ganglion cells with complex receptive fields. J. Comp. Neurol. 280: 97-121. Barlow H B. y Hill R.M.(1963) Selective sensitivity to direction of movement in ganglion cells of the rabbit retina. Science 139: 412-414. Becker M.W. y Anstis S. (2004) Metacontrast masking is specific to luminance polarity .Vis. Res. 44: 2537-2543. Brandt T., Dichgans J. y Koenig E.(1973) Differential effects of central versus peripheral vision on egocentric and exocentric motion perception. Exp. Brain Res.16:476-491.
53
Corvera J.(1978) Neurotología Clínica. México D.F: Salvat Mexicana de Ediciones. Cumming B.G.y Parker A. J. (1997) Responses of primary visual cortical neurons to binocular disparity without depth perception. Nature 389: 280-283. Dichgans J. y Brandt T.(1978) Visual-Vestibular interaction: Effects on self motion perception and postural control. Handbook of Sensory Physiology: pp.755-804. Ferraina S., Pare M. y Wurtz R.H. (2000) Disparity sensitivity of frontal eye field neurons. J Neurophysiol 83: 625-629. Fife T.D y Baloh RW. (1993) Disequilibrium of unknown cause in older people. Ann. Neurol. 34: 694-702. Frith C. y Dolan R.J. (1997) Brain mechanisms associated with top-down processes in perception. Phil. Trans. Royal Society of Lon. B. Biol. Series 352:1221-1230. Genovesio A. y Ferraina S. (2004) Integration of Retinal Disparity and Fixation-Distance Related Signals Toward an Egocentric Coding of Distance in the Posterior Parietal Cortex of Primates. J. Neurophysiol. 91: 2670-2684. Gibson J.J.(1958) Visually controlled locomotion and visual orientation in animals.Br. J.Psychol.49:182-194. Giraldo D.(2004) Codificación Neural de la Estereopsis: Modelo teórico de la detección de Ceros como base de la visión estereoscópica. Visión Andina 6:32-38. Giraldo D.(2005) Teoría del Contraste Espectral Acromático:Codificación, decodificación, análisis y proyección como base neural del procesamiento visual humano. Franja Visual 82:10-14 y Franja Visual 83:9-13. Giraldo D.(2006) Programación de los movimientos oculares con base en el ciclo Lock-Unlock. Franja Visual 88:48-50. Goldberg J.M. y Fernandez C.(1971) Physiology of peripheral neurons innervating semicircular canals of the squirrel monkey.I. Resting discharge and response to constant angular accelerations. J. Neurophysiol. 34: 635. Howard I.P. y Rogers B.J. (1995) Binocular Vision and Stereopsis. New York:Oxford. Jensen R. J. y DeVoe R.D. (1983) Comparisons of directionally selective with other ganglion cells of the turtle retina:intracellular recording and staining. J. Comp. Neurol. 217: 271-87. Johanson G. (1971) Studies on visual perception of locomotion. Perception 6: 365-376. Klam F. y Graf W. (2003) Vestibular Signals of Posterior Parietal Cortex Neurons during Active and Passive Head Movements in Macaque Monkeys. Ann. N.Y. Acad. Sci. 1004 :271-282. Lee D.N.y Aronson E.(1974) Visual proprioceptive control of standing in human infants. Percept Psychop.15: 529-532. Lee D.N. y Lishman R.(1975) Visual proprioceptive control of stance. J. Hum. Movemt. Stud. 1:87-95. Lowenstein O. y Sand A. (1936) The activity of the horizontal semicircular canal of the dogfish. J. Exp. Biol. 13:416. Masson G.S., Busettini C. y Miles F.A. (1997) Vergence eye movements in response to binocular disparity without depth perception. Nature 389: 283-286. Nakayama K. (1985) Biological image motion processing : A review. Vis. Res. 25: 625-660. Nashner L.M., Black F.O. y Wall C.(1982) Adaptation to altered support and visual conditions during stance: Patients with vestibular deficits. J. Neurosci. 2: 536-544. Neri P., Bridge H. y Heeger D. J. (2004) Stereoscopic Processing of Absolute and Relative Disparity in Human Visual Cortex. J. Neurophysiol. 92: 1880-1891.
54
Omori M., Yamada H., Murata T et al (1999) Neuronal substrates participating in attentional set-shifting of rules for visually guided motor selection: A functional magnetic resonance imaging investigation. Neurosc. Res 33 :317-323. Ouchi Y., Okada H.,Yoshikawa E., Nobezawa S. y Futatsubashi M. (1999) Brain activation during maintenance of standing postures in humans .Brain 122: 329-338. Penn A. A., Wong R. O., Shatz C. J. (1994). Neuronal coupling in the developing mammalian retina. J.Neurosci. 14:3805-15. Schall J.D., Morel A., King D.J. y Bullier J. (1995) Topography of visual cortex connections with frontal eye field in macaque: Convergence and segregation of processing streams. J. Neurosci. 15: 4464 -4487. Simpson J.L. , Graf W. y Leonard C.(1981) The coordinate system of visual climbing fibers to the flocculus. Progress in Oculomotor Research.: pp.475-484. Von der Heydt R. , Zhou H. y Friedman H. S.(2000) Representation of stereoscopic edges in monkey visual cortex. Vis. Res. 40:1955-67. Wolfson L., Whipple M.A., Derby C.A., Amerman P., Murphy T., Tobin J.N., et al (1992) A dynamic posturography study of balance in healthy elderly. Neurology 42: 2069-75. Yang G. y Masland R.H. (1992) Direct visualization of the dendritic and receptive fields of directionally selective retinal ganglion cells. Science 258: 1949-52. Yang G. y Masland R.H. (1994) Receptive fields and dendritic structure of directionally selective retinal ganglion cells. J. Neuroscience 14: 5267-80. Zhou H., Friedman H. S., y Von der Heydt R. (2000). Coding of border ownership in monkey visual cortex. J. Neuroscience 20: 6594-6611.
56
CONECTANDO LOS BORDES CON LA PERCEPCIÓN DEL MOVIMIENTO
La percepción del movimiento es crucial para que una entidad biológica de cualquier especie
pueda sobrevivir en el entorno que habita. Los insectos la utilizan para detectar los
desplazamientos que realizan cuando sobrevuelan un campo de flores en el propósito de
encontrar su alimento, y los seres humanos para poder desplazarse a través de una avenida
congestionada, sin resultar lesionados en el intento. Tanto el cerebro simple de los insectos como
el complejo de los humanos, calculan el movimiento en función del supuesto de que los objetos
que se alejan disminuyen de tamaño y de que los que se acercan aumentan de tamaño. El
desplazamiento centrípeto (hacia la fóvea) cuando se alejan, o el centrífugo (hacia la periferia),
permite la codificación del flujo óptico, al cual es muy sensible el área M.T. o V5 (en los seres
humanos).
La sucesiva codificación de un borde cuando pasa del campo receptivo de una célula ganglionar
retinal al de otra contigua, es en esencia, la base neural de la percepción del movimiento. Los
mecanismos más complejos para conocer si los objetos contenidos en la escena que nos rodea se
mueven o no, se hallan dentro del cerebro. La constante renovación de las coordenadas
tridimensionales sobre las cuales se localizan los objetos en el objetivo de ejecutar cualquier
proceso perceptual, motor o cognitivo, sería imposible sin los sincronizados mecanismos retino-
geniculo-corticales que controlan la percepción del movimiento. Sin embargo, existen individuos
como L.M., con lesiones corticales muy específicas que impiden la normal percepción del
movimiento, haciendo de su vida cotidiana algo monótono y sobre todo, muy peligroso de
sobrellevar.
Para conocer un poco más sobre la paciente L.M, el lector puede escanear el siguiente código QR
con su Smartphone para acceder a la información disponible en la web:
Con la finalidad de ilustrar con más profundidad el tema, teniendo en cuenta la importancia
implícita que representa la codificación de bordes extraídos del procesamiento del Contraste
Espectral Acromático para la percepción del movimiento, presento un artículo ya publicado que
los conecta teóricamente:
Giraldo D.(2007) Percepción visual del movimiento con base en el procesamiento del C.E.A. Franja Visual 94: 48-50.
57
PERCEPCIÓN VISUAL DEL MOVIMIENTO CON BASE EN EL PROCESAMIENTO DEL CONTRASTE ESPECTRAL ACROMÁTICO (C.E.A)
El procesamiento del Contraste Espectral Acromático (C.E.A), siendo al parecer la base neural del sistema visual humano para el pleno desarrollo de sus funciones perceptual, motoras y cognitivas, también puede relacionarse con la percepción del movimiento. Recientes investigaciones neurofisiológicas pueden apoyar la hipótesis de que el área Medial Temporal (M.T. ó V5), que clásicamente se ha descrito como aquella encargada de la percepción del movimiento, depende para su activación del área 17 ó V1, mecanismo que posiblemente esté basado en el procesamiento del C.E.A. En el presente artículo teórico se proponen algunos modelos de cómo el procesamiento del C.E.A puede utilizarse para establecer a nivel cortical la percepción del movimiento.
INTRODUCCIÓN Las neuronas del área 17/V1 de primates, experimentalmente han sido observadas ser sensibles a las energías reflejadas de los objetos y no a su color específico (Zeki, 1993). Esta característica funcional intrínseca de las neuronas del área 17/V1, es esencial para el análisis del Contraste Espectral Acromático (C.E.A), cuyo procesamiento binocular se ha sugerido como base neural para la implementación de la percepción estereoscópica, la regulación de los movimientos oculares, el control y sostenimiento de los mecanismos de fusión, del mecanismo secundario de compensación del equilibrio corporal, como parámetro básico en la función de mapeo hemiretinotópico de otras áreas corticales sinápticamente interconectadas con el área 17/V1 haciéndolas sensibles constantemente a la disparidad, y como base del fenómeno cognitivo por aferencias visuales, entre otras posibles funciones (Giraldo, 2005). Siendo el procesamiento del C.E.A. lo que hace posible la codificación de los bordes 2D (Monocular) y 3D (Binocular) de una imagen capturada por nuestras retinas, el desplazamiento de un borde codificado desde el campo receptivo de una célula ganglionar hacia el campo receptivo de otra y así sucesivamente, es lo que establece por lo menos en sus etapas iniciales, la percepción del movimiento. Los mayores mecanismos para la implementación neural de la percepción del movimiento, se hallan a nivel cortical.
BASES NEUROFISIOLÓGICAS El movimiento es un vector definido por dos componentes: La Dirección y la Velocidad. En los sistemas visuales de primates y humanos, la percepción del movimiento está representada en una vía especializada que se inicia en el área estriada (17/V1) y se extiende hacia las áreas extraestriadas M.T (V5) y S.M.T., terminando en áreas de procesamiento de alto nivel en los lóbulos temporales y parietales de cada hemisferio. Actualmente se sabe que la mayoría de neuronas del área M.T. son selectivas para la velocidad (Maunsell y Van Essen, 1983; Lagae et al, 1993; Perrone y Thiele, 2001). Es conocido que lesiones del área M.T. y S.M.T. (Supero Medial Temporal), pueden impedir la ejecución de pruebas para valorar la discriminación visual de la velocidad de un estímulo, alterando también el correcto desarrollo de movimientos oculares que requieren una precisa computación de la misma (Newsome et al, 1985; Dursteler y Wurtz, 1988 ; Yamasaki y Wurtz, 1991 Pasternak y Merigan, 1994; Schiller y Lee, 1994; Orban et al, 1995). El área M.T. en sujetos humanos normales se presenta mucho más activa durante pruebas para la discriminación visual de velocidades, que durante otras pruebas de discriminación en
58
las que no se presenta estimulación cinética (Corbetta et al, 1991; Beaucheamp et al, 1997; Huk y Heeger, 2000). Sin embargo los científicos no saben exactamente cómo la velocidad de un objeto es codificada en la corteza visual, ni cómo la actividad de neuronas individuales se relaciona con juicios perceptuales de velocidad. ( Liu y Newsome,2003). En el área M.T existe una demostrada organización columnar para la dirección y para la disparidad binocular (Albright et al, 1984; De Angelis y Newsome, 1999 ; Liu y Newsome, 2003). De otra mano, el área M.T (de cada hemisferio) contiene la representación retinotópica del hemicampo visual contralateral (Al igual que en el área 17/V1.). Una lesión en alguna parte del área 17, deprimirá la activación de neuronas en la parte hemiretinotópicamente correspondiente del área M.T. (Maunsell et al, 1990; Collins et al, 2003). Para establecer un parámetro regulatorio para la percepción del movimiento, se puede sugerir (hipotéticamente) la proyección de las señales que representan los bordes desde el área 17/V1 hacia el área M.T. Dicha función es posible que actúe como prerrequisito para la activación de otras áreas relacionadas con la visión. Respecto a lo anterior, muchas áreas corticales relacionadas con la visión, parecen depender completamente de las señales provenientes del área 17/V1 para su activación: En estudios experimentales con primates se ha demostrado esta dependencia en las neuronas del córtex Inferotemporal (Rocha-Miranda et al, 1975), en el área V2 (Schiller y Malpeli, 1977; Girard y Bullier, 1989); en V3 y V4 (Girard et al, 1991a, 1991b). También el área M.T toma como fuente principal de activación las señales de procesamiento visual que provienen del área 17/V1, esto ha sido demostrado experimentalmente en trabajos como el de Collins y Colaboradores (Collins et al, 2003), en el cual se concluyó que el área M.T. es altamente dependiente del área 17/V1, para su activación en primates. Respecto al procesamiento del contraste, G.S. Masson y E. Castet (Masson y Castet, 2002) realizando experimentos psicofísicos en humanos, encontraron que los movimientos oculares de seguimiento en su estadío más temprano, exhiben una alta dependencia del contraste del estímulo con una sensibilidad muy alta. Similares dependencias del contraste han sido encontradas en las neuronas del área M.T. de primates ( Sclar et al,1990) , particularmente en aquellas neuronas que reciben proyecciones directas desde el área 17/V1 (Movshon y Newsome,1996). Siendo también éstas funciones de respuesta al contraste, muy parecidas a las que presentan las neuronas de las capas magnocelulares del Núcleo Geniculado Lateral (Derrington y Lennie, 1984; Sclar et al ,1990). Por lo tanto, la rápida transferencia de información de proyección hacia las áreas M.T. y S.M.T., interviene en las etapas tempranas de los movimientos de seguimiento ocular (Masson y Castet, 2002). Otro estudio que puede apoyar la propuesta de que la proyección del procesamiento del C.E.A. binocular (3D / tridimensional) o Monocular (2D / bidimensional) es necesaria para establecer procesos de activación en otras áreas corticales basándose en la sensibilidad a éstas codificaciones suministradas por las neuronas de las capas superiores del área 17/V1, es el trabajo realizado por Schmolesky y Colaboradores en macacos ( Schmolesky et al, 1998) en el cual se demostró que las respuestas a diferentes estímulos visuales ocurren en el área 17 ó V1, antes que en cualquier otra área cortical.
59
MECANISMO NEURAL BÁSICO DE LA PERCEPCIÓN DEL MOVIMIENTO.
Los bordes que se desplazan sobre la retina son codificados por las células ganglionares en coordenadas bidimensionales de posicionamiento (x , y) dentro del mapa de cada campo receptivo, dichas coordenadas de posicionamiento son conservadas durante el proceso de conducción hasta los campos receptivos de las neuronas de las capas superiores del área 17/V1, por supuesto, ya amplificados por el proceso de magnificación cortical, en el cual una imagen del tamaño de unos pocos milímetros ( imagen retiniana ), es ampliada a una escala mucho mayor ( imagen cortical ). Allí, en las capas superiores del área 17/V1, las neuronas sensibles a la disparidad analizan ,estructuran y proyectan la codificación de bordes similares enviados por cada ojo (monoculares/bidimensionales) en una señal que represente un único borde ubicado dentro de un sistema de coordenadas tridimensionales (x, y, z). Fig.No.1.
Figura No.1-Sistemas de coordenadas de codificación del C.E.A. 2D (Retinal) y 3D (Cortical).
Según recientes estudios anatómicos, se ha observado que las neuronas de la capa 4b del área 17/V1 proyectan profusamente sus axones hacia las franjas gruesas (Thick Stripes) del área 18 y hacia el área M.T., llevando información del sistema Magno, el cual como se sabe, conduce información proveniente de amplias zonas retinales delimitadas desde la perifóvea hasta las zonas más periféricas de la retina. (Información que posiblemente se utilice para activar las columnas funcionalmente organizadas en el área M.T.). Todo lo hasta ahora expuesto, lleva a suponer la existencia en nuestro sistema visual cortical de un Fenómeno de Refresco, que en electrónica se define como aquel mecanismo mediante el cual, la información anteriormente procesada se elimina para recibir nueva y así poder procesarla. Esto, es apreciable en la constante desactivación y activación de los pixeles que conforman las pantallas de los monitores de computadora o de televisión y en las áreas de memoria temporal de los microprocesadores de las computadoras (Memoria R.A.M.). Dicho
60
proceso tiene muchas aplicaciones, entre las cuales se incluye, el permitir la percepción visual del movimiento de las imágenes presentadas por estos dispositivos en sus observadores humanos. (En otras palabras una imagen es " borrada" secuencialmente con la finalidad de estructurar la siguiente.) Fig.No.2.
Figura No.2-Mecanismo de refresco en un monitor de computadora y en la corteza visual.
Esto garantizará a nivel visual cortical, la correcta percepción de los bordes de la imagen de un objeto, junto con sus demás atributos ubicados dentro de coordenadas 2D o 3D que son constantemente renovadas, cuando este se desplaza de un lugar a otro dentro de nuestro campo visual. Siendo raras las ocasiones en que el movimiento de un objeto se perciba inicialmente en las áreas centrales de la retina (ya que de otro modo se estaría fijando, foveando o siguiendo), es preciso que su detección y codificación sea lógicamente imperativa en la media y lejana periferia retinal. Con esto se pueden calcular con mayor eficiencia los movimientos oculares necesarios (sacádicos, vergencias y de seguimiento) para lograr identificar un objeto que se mueva en la zona periférica de nuestro campo visual. De esta forma, el área M.T. también puede mostrarse como pieza clave en la regulación de los movimientos oculares de seguimiento y sacádicos (Newsome et al, 1985; Dursteler y Wurtz, 1988; Yamasaki y Wurtz, 1991; Pasternak y Merigan, 1994; Schiller y Lee, 1994; Orban et al, 1995). El área M.T. colabora activamente en la emisión de señales inhibitorias por medio de vías sinápticas de retroalimentación hacia el área 17/V1, esto facilita la codificación de nuevos bordes ubicados dentro de coordenadas tridimensionales para correctamente programar y ejecutar movimientos oculares permitiendo a la vez continuidad en el ciclo Lock-Unlock ( Giraldo, 2006).
61
Registros intracelulares in vivo de las células del área 17/V1, han evidenciado que los Potenciales Postsinápticos Inhibitorios (P. P. I.) tienden a ocurrir cuando los Potenciales Postsinápticos Excitatorios (P. P. E.) ocurren (Ferster, 1986; Ferster, 1989; Douglas et al, 1991; Berman, 1992). Lo mismo sucede para las neuronas selectivas a la orientación del área 17/V1, en cuyos registros in vivo los P. P. I. y P. P. E. ocurren con mayor frecuencia como respuesta a un estímulo visual óptimamente orientado (Ferster, 1986; Ferster, 1989). Otros autores han sugerido con base en los anteriores datos, que los procesos de inhibición deben balancear el bombardeo excitatorio previniendo que las neuronas se saturen (Shadlen y Newsome, 1994). Existe también evidencia neurofisiológica de que las respuestas de las neuronas del área 17/ V1, pueden incrementarse o disminuir de acuerdo a la influencia de los estímulos que ingresan en las neuronas localizadas en sus capas inferiores y superiores (Sharma et al, 2003). Toda la evidencia hasta ahora presentada, puede reforzar la propuesta de que exista un mecanismo de refresco para la visión en lo que refiere a sus funciones perceptual y motora, ejecutado por las señales que se proyectan desde el área M.T., que a su vez están basadas en las necesarias señales codificadas que parten desde las neuronas de las capas superiores del área 17/V1. Las funciones anteriormente descritas para las conexiones de retroalimentación, están apoyadas por reciente evidencia neurofisiológica que describe que al desactivar el área M.T., se reduce el efecto supresivo de la estimulación del movimiento en V1, V2 y V3 (Hupé et al, 1998). Las señales de retroalimentación provenientes del área M.T. también han sido observadas que influyen en la parte inicial de las respuestas neuronales, sugiriendo que estas actúan sobre las neuronas del área 17/V1 al mismo tiempo que las señales que provienen del Tálamo (Núcleo Geniculado Lateral) (Hupé et al, 2001). También se ha establecido que las velocidades de conducción de las señales a través de las conexiones de retroalimentación, son tan rápidas como las que son conducidas a través de las conexiones de proyección y 10 veces más rápidas que las que se conducen en las conexiones horizontales ( Girard et al , 2001). El trabajo de Angelucci y Colaboradores (Angelucci et al, 2002), ha demostrado que las proyecciones de retroalimentación están confinadas dentro de discretas zonas del área 17/V1 que se superponen con grupos de neuronas emisoras de señales de proyección de la misma área. El preciso alineamiento de los racimos terminales de las conexiones de retroalimentación que llegan al área 17 con los racimos de proyección de las neuronas eferentes (Salin et al ,1995; Johnson y Burkhalter, 1997), se adaptaría muy bien a una rápida transferencia de información funcional específica hacia y desde el área 17/V1 (Angelucci et al, 2002). Concluyendo los mismos autores, que no obstante su trabajo propone que las conexiones de retroalimentación pueden mediar interacciones centro-periferia en el área 17/V1, un papel mucho más importante podría atribuirse para ellas en este sistema conexional, y es el papel consistente con su escala espacial: Las señales de retroalimentación deberían modular la integración de información visual de tipo Global con Local y Ascendente con Descendente. Esta integración de señales Globales con Locales puede representar un paso esencial en el procesamiento visual que ya ha sido observado ocurrir en las respuestas de las neuronas de las áreas 17/V1 y 18/V2 ante los contornos subjetivos o ilusorios ( Lee y Nguyen, 2001).
62
MODELO TEÓRICO PARA LA PERCEPCIÓN DEL MOVIMIENTO POR ESTIMULACIÓN
BIDIMENSIONAL (2D). El notable hecho de que la naturaleza haya diseñado y construido el sistema visual humano siguiendo un patrón de hemicampos simétricos y quirales (uno es el reflejo en espejo del otro), lleva a resaltar ante el lector la impresionante eficiencia que puede tener esta arquitectura neural para el procesamiento de bordes monoculares (2D o bidimensionales) o binoculares (3D o tridimensionales) con el propósito de ser utilizados en los fenómenos perceptual, motor y cognitivo. Aunque la primera codificación (2D) es necesaria para obtener la segunda (3D) a través de los cómputos hechos por las neuronas sensibles a la disparidad ubicadas en las capas superiores del área 17/V1, es suficiente para activar el área M.T., de la cual se conoce que se presenta hemiretinotópicamente organizada de igual forma que su hemiárea 17/V1 sinápticamente correspondiente en cada hemisferio cerebral. La simple razón de tipo anatómico para permitir la activación de cada hemiárea M.T. por medio de codificaciones 2D, es que cada hemiretina ya sea nasal o temporal de cada globo ocular, se encuentra representada por grupos de neuronas que se ubican en diferente hemisferio (derecho o izquierdo). Esto, hace posible la activación del hemiárea M.T. en cada uno de ellos, garantizando que la continuidad perceptual del movimiento de un objeto se sostenga cuando este pasa de la línea media (de codificarse en una hemiretina a codificarse en la otra) a través de las importantes conexiones de interacción callosal que posee cada hemiárea 17/V1 y por supuesto, a través de las de cada hemiárea M.T. que como es conocido, también tienen las suyas. Todo sucede con base en los parámetros de bordes codificados dentro de coordenadas (x , y) bidimensionales, que no siendo suficientes para emitir correctos juicios perceptuales de la profundidad a la que se ubica un objeto ( aunque puede existir algún tipo de procesamiento de la disparidad con base en claves monoculares ) , permitirán la activación de cada hemiárea M.T., favoreciendo el proceso retroalimentador con el hemiárea 17/V1 con la cual se corresponda, y con sus homólogas contralaterales, implementando de esta manera un continuo y sincronizado mecanismo de refresco en las áreas visuales de cada hemisferio. Lo anterior se presentaría como un ingenioso mecanismo de defensa o de recurso alternativo, ante la ausencia completa de señales que no pueden ser codificadas y proyectadas por un ojo amaurótico o que esté ausente. Al parecer se puede conseguir percepción de profundidad a nivel cortical partiendo de codificaciones de bordes bidimensionales. Esto se ha observado en algunos pacientes a los cuales se les ha enucleado cualquiera de sus ojos. Recién efectuado el procedimiento, ellos reportan algún grado de dificultad cuando se desplazan a través de lugares en los que existen muchos objetos, pues tropiezan constantemente. Con el tiempo, todos sin excepción reportan una total adaptación a su deficiencia, lo cual puede representar una verdadera subsistencia de codificación tridimensional (3D) en cada uno de los hemisferios cerebrales basada en codificaciones bidimensionales (2D) suministradas por el ojo remanente. Fig.No.3.
63
Figura No.3-Esquema que representa la percepción del movimiento por medio del procesamiento de información
bidimensional (2D).
MODELO TEÓRICO PARA LA PERCEPCIÓN DEL MOVIMIENTO POR ESTIMULACIÓN TRIDIMENSIONAL (3D).
Cada ojo provee al cerebro de una imagen un tanto diferente de la misma escena observada, y aunque cada imagen se proyecta sobre ambas retinas bidimensionalmente, las neuronas del área 17/V1 son capaces de fusionar estas dos imágenes que están ligeramente desplazadas una con respecto a la otra, fenómeno que se conoce como Disparidad Retinal. La Disparidad Retinal es necesaria para procesar corticalmente la profundidad a la que se ubica un objeto con respecto a su observador en cualquier coordenada del espacio tridimensional. Esta percepción de profundidad o estereoscópica, ayuda a nuestra percepción
64
visual global entre otras funciones, en el reconocimiento de la forma de los objetos, las trayectorias de éstos cuando se mueven a través del espacio y así lograr localizarlos. Ya hemos observado la importancia de la codificación bidimensional (2D) en líneas anteriores y del establecimiento de hemicampos neurales de procesamiento para permitir la mayoría de funciones perceptuales, motoras y cognitivas en los dos hemisferios cerebrales. Siendo el anterior procesamiento (2D) la excepción y no la regla, lo normal es que la percepción del movimiento se establezca mediante el procesamiento tridimensional o 3D en animales con ojos ubicados frontalmente, como es el caso (entre otros) de primates superiores y humanos. Esta, es la finalidad prevista para un entramado neural que permite el procesamiento de los bordes de un mismo objeto ubicado en lugares ligeramente distintos en el sistema de coordenadas bidimensionales de cada retina. Así, para lograr un correcto procesamiento tridimensional cortical de esta disparidad que por lógica se basa en la codificación de los bordes 2D proyectada por cada ojo, la naturaleza también dispuso de la arquitectura hemiretinal. La gran mayoría de áreas corticales relacionadas con la visión (perceptuales, motoras y cognitivas), poseen dentro de los grupos neuronales que las conforman, neuronas sensibles a la disparidad (Para una revisión ver: Giraldo, 2005). Esto sugiere que nuestros cerebros están preparados para percibir la forma de un objeto, su localización y establecer si se mueve o no, dentro de un sistema de coordenadas tridimensionales (x, y, z.). Experimentos realizados en primates, han evidenciado que las neuronas del área M.T. son con frecuencia, fuertemente sintonizadas para la disparidad binocular (Freeman, 1999). De igual manera, existe evidencia de que las neuronas del área 17/V1 responden primeramente a la disparidad absoluta que a la relativa, y que el área 18 /V2 responde igualmente a ambas disparidades. (Definiéndose la disparidad absoluta como la distancia de un objeto con respecto al plano de fijación o de proyección bifoveal, mientras que la relativa se define como la distancia existente entre dos objetos ubicados en el espacio) (Parker et al, 2000). Si tenemos en cuenta los anteriores enunciados, y que exista una normo-actividad en las columnas de dominancia ocular y de sus neuronas sensibles a la disparidad en el área 17/V1 de cada hemisferio, podemos esperar una correcta codificación 3D en el espacio visual subjetivo. Demostrándose a través de la evidencia presentada, la capacidad inherente del área M. T. para activarse por medio de las señales que llevan información 3D provenientes de las capas superiores del área 17/V1, permitiendo la existencia de un mecanismo de refresco cuando un objeto tridimensional se mueve a través de diferentes planos espaciales que pueden estar por delante o detrás del plano de fijación, en una dirección determinada. Fig.No.4.
65
Figura No.4-Esquema que representa la percepción del movimiento por medio del procesamiento de información tridimensional (3D).
DEFICIENCIAS EN LA PERCEPCIÓN DEL MOVIMIENTO
La pérdida de la capacidad de percibir visualmente el movimiento es por lo general muy rara, sin embargo existen algunos casos registrados en la literatura. Las personas que tienen grandes deficiencias en la percepción del movimiento, presentan dificultad para distinguir los objetos que se mueven de los que permanecen inmóviles, confundiendo a menudo sus direcciones de movimiento (Plant et al, 1993). Estas deficiencias en la percepción del movimiento, pueden estar limitadas a un hemicampo visual (Lo cual sucede ante un
66
traumatismo unilateral del área posterior cerebral) o afectar el campo visual completamente (ambos hemicampos) como resultado de un traumatismo bilateral. De acuerdo a lo anterior, se ha clasificado la primera como Hemiacinetopsia y la segunda como Acinetopsia, de las cuales, la última es la más severa, definiéndose como: Ceguera al movimiento. Una paciente, denominada L. M., quien sufre de Acinetopsia, relata que cuando se le presentan estímulos visuales en movimiento (objetos, personas o automóviles), ella los percibe estáticos y que “saltan” de una posición a otra en el espacio. Manifestando también los temores y dificultades que representan para ella sus salidas a la calle o cuando se desplaza a través de lugares saturados de objetos o llenos de personas. Cuando un auto se mueve, ella después de un algún tiempo puede asumir que se está moviendo, sin embargo no puede emitir juicios correctos con respecto a la dirección y velocidad con que las que el vehículo se mueve, transformando en una odisea muy peligrosa el simple hecho de cruzar una avenida. Inclusive, servir una taza de café es algo difícil para L. M., pues cuando lo hace, ella reporta ver el chorro que cae “congelado como un glaciar”. Ésta paciente también relata su dificultad al conversar con sus amigos, por lo cual se confunde a menudo, aunque la voz de sus amigos se percibe continuamente, ella percibe que sus labios aparecen cerrados o abiertos, desfasándose de las percepciones normales que se tienen de los movimientos de los labios de una persona que habla, que por lo general están sincronizadas. También los movimientos oculares y de las manos se afectan en L. M. , si el objetivo de fijación o de manipulación es un objeto que se mueve. Aunque ella ha tenido un considerable éxito adaptándose a su profundo déficit visual durante más de 20 años, L. M. aún está severamente incapacitada (Zihl et al, 1983; Heywood y Zihl, 1999). Teniendo en cuenta el caso L. M. se puede proponer que: Los daños que se presenten en las conexiones de proyección que llevan las señales de codificación 2D y 3D de los bordes de una imagen desde el área 17/V1 hacia el área M.T., daños en las mismas estructuras o grupos de procesamiento neuronal del área M.T., o daños en las conexiones de retroalimentación del área M.T. con el área 17/V1, serán causa de deficiencias en el mecanismo de refresco de la visión en referencia a lo perceptual y motor. Fig.No.5.
Figura No.5-Localización de una lesión hemilateral cortical que puede producir deficiencias en la percepción del movimiento. (Hemiárea M.T. derecha).
67
CONCLUSIÓN Al parecer, el procesamiento del C.E.A monocular (Bordes 2D) y binocular (Bordes 3D) puede también ser utilizado para establecer la percepción del movimiento en los seres humanos por medio de un ciclo retroalimentador excitatorio-inhibitorio entre el área 17/V1 y el área M.T. En el anterior capítulo, se resaltó la importancia de un diseño funcional para el sistema visual humano basado en hemicampos de procesamiento neural cuyo principal objetivo es permitir una correcta implementación de los fenómenos perceptuales, motor y cognitivo en cada hemisferio cerebral. Destacándose también, el papel que desempeñan las interconexiones callosales en el establecimiento de mecanismos que permitan sincronía y continuidad en la percepción del movimiento cuando un objeto cruza la línea media de nuestro campo visual (es decir, cuando pasa de percibirse de un hemisferio al otro). Tal vez, en un futuro no muy lejano, se pueda diseñar y construir un implante neuroprotésico que reemplace la función perdida en el área M.T. unilateral o bilateralmente, de esta forma pacientes tan incapacitados como L.M., contarán con un mecanismo artificial de refresco para su sistema visual, que les permita percibir continuamente objetos en movimiento y renovar constantemente sus coordenadas de ubicación en el espacio tridimensional.
REFERENCIAS Albright T.D., Desimone R. y Gross C.G.( 1984).Columnar organization of directionally selective cells in visual area MT of the macaque. J. Neurophysiol 51: 16-31 . Angelucci A.,Levitt J.B., Walton E., Hupé J.M., Bullier J. y Lund J.S. (2002) Circuits for local and global signal integration in Primary Visual Cortex. J.Neurosci. 22(19): 8633-8646 . Beauchamp M.S, Cox R.W. y DeYoe E.A. (1997) Graded effects of spatial and featural attention on human area MT and associated motion processing areas. J .Neurophysiol 78: 516-520. Berman N.J. , Douglas R.J. y Martin K.A.C.(1992). GABA-Mediated Inhibition in the Neural Networks of Visual Cortex. In Progress in Brain Research. Ed. Mize R.R., Marc R.E., Sillito A.M. Amsterdam: Elsevier, , 443-476. Collins C.E., Lyon D.C. y Kaas J. H.(2003) Responses of Neurons in the Middle Temporal Visual Area After Long-Standing Lesions of the Primary Visual Cortex in Adult New World Monkeys. J .Neurosci 23:2251. Corbetta M., Miezin F.M., Dobmeyer S., Shulman G.L.y Peterson S.E.(1991)Selective and divided attention during visual discriminations of shape, color, and speed: functional anatomy by positron emission tomography. J .Neurosci 11: 2383-2402. DeAngelis G.C y Newsome WT.(1999)Organization of disparity-selective neurons in macaque area MT. J .Neurosci 19: 1398-1415. Derrington A.M. y Lennie P. (1984) Spatial and temporal contrast sensitivities of neurones in lateral geniculate nucleus of macaque. J Physiol(Lond) 357:219-240. Douglas R. , Martin K. y Witteridge D. (1991). An Intracellular Analysis of the Visual Responses of Neurones in Cat Visual Cortex. J. Physiol (Lond) 440: 659-696. Dursteler M.R. y Wurtz RH. (1988) Pursuit and optokinetic deficits following chemical lesions of cortical areas MT and MST. J. Neurophysiol 60: 940-965. Ferster D.(1986).Orientation Selectivity of Synaptic Potentials in Neurons of Cat Primary Visual Cortex. J .Neurosci 6: 1284-1301. Ferster D.(1989).The Synaptic Inputs to Simple Cells of the Cat Visual Cortex. In Neural Mechanisms of Visual Perception. Proceedings of the Retina Research Foundation. Ed.Lam DM-K, Gilbert CD. The Woodlands, Texas: Portfolio Publishing Company:68-86. Freeman R.D.(1999) Stereoscopic vision: Which parts of the brain are involved?.Current Biology 9:610-613 Giraldo D. (2005).Teoría del contraste espectral acromático: Codificación, decodificación, análisis y proyección como base neural del procesamiento visual humano. Franja Visual 82 :10 -14.
68
Giraldo D.(2006) Programación de los movimientos oculares con base en el ciclo Lock-Unlock. Franja Visual 88:48-50. Girard P. y Bullier J.(1989) Visual activity in area V2 during reversible inactivation of area 17 in the macaque monkey.J.Neurophysiol 62:1287-1302. Girard P., Salin P.A. y Bullier J. (1991a) Visual activity in areas V3a and V3 during reversible inactivation of area V1 in the macaque monkey. J .Neurophysiol 66:1493-1503. Girard P., Salin P.A. y Bullier J. (1991b) Visual activity in macaque area V4 depends on area 17 input. NeuroReport 2:81-84. Girard P., Hupé J.M. y Bullier J. (2001). Feedforward and feedback connections between areas V1 and V2 of the monkey have similar rapid conduction velocities. J .Neurophysiol 85:1328-1331. Heywood C.A. y Zihl J. (1999) Motion blindness. In Case studies in the neuropsychology of vision . Ed.G Humphreys. Hove: Psychology Press.: 1-16. Huk A.C.y Heeger D.J.(2000) Task-related modulation of visual cortex. J .Neurophysiol 83: 3525-3536. Hupé J.M., James A.C., Payne B.R., Lomber S.G., Girard P.y Bullier J (1998). Cortical feedback improves discrimination between figure and background by V1, V2 and V3 neurons. Nature 394:784-787. Hupé J.M., James A.C., Girard P., Lomber S.G., Payne B.R. y Bullier J (2001). Feedback connections act on the early part of the responses in monkey visual cortex. J .Neurophysiol 85:134-145. Johnson R.R.y Burkhalter A.(1997).A polysynaptic feedback circuit in rat visual cortex. J .Neurosci 17:7129-7140. Lagae L., Raiguel S. y Orban G.A. (1993)Speed and direction selectivity of macaque middle temporal neurons. J. Neurophysiol 69: 19-39. Lee T.S. y Nguyen M. (2001). Dynamics of subjective contour formation in the early visual cortex. Proc Natl Acad Sci USA 98:1907-1911. Liu J. y Newsome W.T.(2003).Functional Organization of Speed Tuned Neurons in Visual Area MT. J. Neurophysiol. 89: 246-256. Maunsell J.H.R y Van Essen D.C.( 1983)Functional properties of neurons in middle temporal visual area of the macaque monkey. I. Selectivity for stimulus direction, speed and orientation. J Neurophysiol 49: 1127-1147. Maunsell J.H., Nealey T.A. y DePriest D.D.(1990) Magnocellular and parvocellular contributions to responses in the middle temporal visual area (MT) of the macaque monkey. J. Neurosci 10:3323-3334. Masson G. S. y Castet E.(2002)Parallel Motion Processing for the Initiation of Short-Latency Ocular Following in Humans.J.Neurosc 12:5149-5163. Movshon J.A. y Newsome W.T. (1996) Visual response properties of striate cortical neurons projecting to area MT in macaque monkeys. J Neurosci. 16:7733-7741. Newsome W.T., Wurtz R.H., Dursteler M.R.y Mikami A.(1985)Deficits in visual motion processing following ibotenic acid lesions of the middle temporal visual area of the macaque monkey. J .Neurosci 5: 825-840. Orban G.A., Saunders R.C.y Vandenbussche E.(1995) Lesions of the superior temporal cortical motion areas impair speed discrimination in the macaque monkey. Eur. J. Neurosci 7: 2261-2276. Parker A.J., Cumming B.G. y Dodd J.V.(2000) Binocular neurons and the perception of depth. In The Cognitive Neurosciences. Gazzaniga M. Cambridge, USA: MIT Press. Pasternak T.y Merigan W.H. (1994)Motion perception following lesions of the superior temporal sulcus in the monkey. Cereb. Cortex 4: 247-259. Perrone J.A.y Thiele A.(2001) Speed skills: measuring the visual speed analyzing properties of primate MT neurons. Nat. Neurosci 4: 526-532. Plant G.T., Laxer K.D., Barbaro N.M., Schiffman J.S.y Nakayama K. (1993). Impaired visual motion perception in the contralateral hemifield following unilateral posterior cerebral lesions in humans.Brain 116:1303-1335. Rocha-Miranda C.E, Bender D.B, Gross C.G y Mishkin M. (1975) Visual activation of neurons in inferotemporal cortex depends on striate cortex and forebrain commissures. J. Neurophysiol 38:475-491.
69
Salin P.A., Kennedy H. y Bullier J.(1995). Spatial reciprocity of connections between areas 17 and 18 in the cat. Can J .Physiol. Pharmacol 73:1339-1347. Schiller P. y Lee K. (1994)The effects of lateral geniculate nucleus, area V4, and middle temporal (MT) lesions on visually guided eye movements. Vis. Neurosci 11: 229-241. Schiller P.H. y Malpeli J.G. (1977) The effect of striate cortex cooling on area 18 cells in the monkey. Brain Res 126:366-369. Sclar G., Maunsell J.H y Lennie P. (1990) Coding of image contrast in central visual pathways of the macaque monkey. Vision Res 30:1-10. Shadlen M.N. y Newsome W. T.(1994).Noise, neural codes and cortical organization Current Opinion in Neurobiology 4:569-579. Schmolesky M.T., Youngchang W., Doug P. H., Kirk G. T., Leutgeb S. , Schall J. D. y Leventhal A. G. (1998).Signal timing across the macaque visual system. J. Neurophysiol. 79: 3272-3278, Yamasaki D.S y Wurtz R.H.(1991)Recovery of function after lesions in the superior temporal sulcus in the monkey. J. Neurophysiol 66: 651-673 Zeki, S. A (1993) Vision of the Brain. Oxford, Blackwell Scientific. Zihl J., Von Cramon D.y Mai N.(1983) Selective disturbance of movement vision after bilateral brain damage. Brain 106:313-340.
70
CAPÍTULO 6
NEURONAS SENSIBLES A LA DISPARIDAD Y
CONTRALATERALIZACIÓN FUNCIONAL DEL CEREBRO:
BASES DE UN CEREBRO AL REVÉS.
71
¿TENEMOS UN CEREBRO DISPUESTO AL REVÉS?
Estudiar el cerebro humano ha sido para muchos científicos un total desafío, para el cual, la gran
mayoría dedica varias décadas de sus vidas. Uno de ellos, David Hunter Hubel (quien ganó el
Premio Nobel de Medicina y Fisiología, 1981 junto con su compañero de investigación Torsten Nils
Wiesel) dejó escrito para la posteridad en el libro “Eye, Brain and Vision”, uno de sus últimos
trabajos: “Por cierto, nadie sabe por qué la mitad derecha de nuestro mundo tiende a proyectar
a la mitad izquierda de los hemisferios cerebrales.” Hubel D.H. (1995) Eye, Brain and Vision. Scientific American
Library vol. 22. Scientific American.
Este “enigma” descrito por Hubel, quedó resonando dentro de mi mente durante varios días. Sin
embargo, recordé que tenía en mis manos toda la base teórica de la investigación sobre la
codificación de bordes extraídos del procesamiento del Contraste Acromático, para intentar
plantear una “posible solución” para ese gran interrogante. Tuve la oportunidad de dialogar sobre
este tema vía e-mail con varios científicos, algunos de los cuales fueron amigos muy cercanos de
David Hubel, quien falleció a causa de una falla renal hacia finales de 2003, sin embargo ninguno
de ellos me ofreció una explicación plausible (desde mi punto de vista), al por qué de la
contralateralización funcional del cerebro en los seres humanos y en la mayoría de especies que
poseen visión binocular.
Con el tiempo, pude correlacionar todas las anteriores investigaciones sobre la codificación de
bordes estereoscópicos, con otros conceptos muy interesantes como los emitidos por Dmitri
Chklovskii sobre Economía Conexional en un extenso artículo, que por demás, trata de ofrecer una
“solución teórica” al por qué de la contralateralización funcional del cerebro.
Si el lector estudia con dedicación el presente capítulo, comprenderá mucho mejor la arquitectura
funcional invertida en 180° que posee el cerebro humano a partir del procesamiento de los bordes
estereoscópicos.
El libro “Eye, Brain and Vision” de David H. Hubel puede leerse en su sitio web original de la
Universidad de Harvard, al cual se puede acceder mediante la lectura del siguiente código QR con
un Smartphone.
Comparto también con el lector, mi teoría sobre la contralateralización funcional del cerebro
humano, que fue publicada en la revista Franja Visual en el año 2008:
Giraldo D. (2008) Neuronas sensibles a la disparidad y contralateralización funcional del cerebro: Bases de un cerebro al
revés. Franja Visual 97:44-46.
72
NEURONAS SENSIBLES A LA DISPARIDAD Y CONTRALATERALIZACIÓN FUNCIONAL DEL CEREBRO:
BASES DE UN CEREBRO AL REVÉS
INTRODUCCIÓN Si reconstruir el espacio que nos rodea dentro de un microchip es todo un reto para los especialistas en robótica en la actualidad, imaginemos la maravilla que sucede desde hace millones de años en el cerebro humano, donde existen grupos de neuronas especializadas en proporcionar la forma y correcta ubicación de los estímulos que están presentes en el espacio extrapersonal. Estamos hablando de las neuronas sensibles a la disparidad. Estos particulares grupos de células, se hacen necesarios en el establecimiento de múltiples representaciones internas tridimensionales de aquellos estímulos visuales que provienen del mundo exterior. Desde ese punto de vista y dentro del contexto en el que éste capítulo las quiere ubicar, las neuronas sensibles a la disparidad del área 17/V1 y sus homólogas que están repartidas por todo el cerebro pueden ser la base fisiológica para que el cerebro humano esté organizado topográfica y funcionalmente de la forma en que se conoce , permitiendo la ejecución de complejos procesos retroalimentadores perceptuales, motores y cognitivos dentro del entorno tridimensional que habitamos.
DEFINICIÓN DE DISPARIDAD Cada uno de nuestros ojos, provee al cerebro de una imagen un tanto diferente de la misma escena observada, y aunque cada una de ellas es proyectada sobre ambas retinas bidimensionalmente, las neuronas ubicadas en las capas superiores del área 17/V1 son capaces de fusionar esas dos imágenes que están físicamente desplazadas una con respecto a la otra, en una imagen perfecta con volumen. Dicho fenómeno se conoce generalmente como procesamiento de la disparidad. El procesamiento de la disparidad es paso obligado para establecer la profundidad a la que se ubica un objeto en cualquier coordenada del espacio tridimensional, permitiendo calcular exactamente su distancia con respecto al observador. La percepción de profundidad o estereoscópica ayuda a nuestra percepción visual global entre otras funciones: En el reconocimiento de la forma de los objetos, a establecer las trayectorias de éstos cuando se mueven a través del espacio y así lograr su localización.
UNA AMPLIA DISTRIBUCIÓN ANATÓMICA Hasta la fecha se han encontrado grupos de neuronas sensibles a la disparidad en las siguientes áreas corticales: En el área V1 ( Poggio y Fisher , 1977), V2 ( Burkhalter y Van Essen, 1986), V3 ( Felleman y Van Essen, 1987), V3a ( Poggio et al, 1988), V4 ( Hinkle y Conner, 2000) , VP ( Burkhalter y Van Essen, 1986), área Inferotemporal / IT ( Janssen et al , 2000), Medial Temporal / MT( Maunsell y Van Essen, 1983), Supero Medial Temporal / SMT ( Roy et al, 1992), Lateral Intraparietal / LIP ( Gnadt y Mays, 1995) y en el área Ocular Frontal/ FEF ( Ferraina et al, 2000). Como se puede apreciar, la generosa distribución poblacional de grupos de neuronas sensibles a la disparidad en algunas áreas que conforman los distintos lóbulos de ambos hemisferios cerebrales, debe ser muy necesaria para lograr remapear consistentemente el espacio tridimensional dentro del cual existimos y con el que cotidianamente interactuamos. Aunque los estudios que describen y ubican anatómicamente grupos de neuronas sensibles a la disparidad son en realidad muy pocos, lo más probable es que existan neuronas con funciones homólogas en muchas otras áreas corticales de ambos hemisferios aún por descubrir y tal vez subcorticalmente en estructuras como el Colículo Superior, del cual ya se conoce que contiene un mapa tridimensional para coordinar y controlar los movimientos oculares ( Chaturvedi y Van Gisbergen, 1999). Apoyando también cierto procesamiento de la disparidad a nivel subcortical, se puede encontrar en la literatura que las neuronas
73
sensibles a la disparidad del área Lateral Intraparietal ( LIP) que proyectan directamente hacia el Colículo Superior, suministran información precisa sobre la ubicación tridimensional de los estímulos (Gnadt y Beyer, 1998). De igual manera, se ha descrito la participación del Putamen en la codificación de la localización espacial de los objetos, proceso que se realiza con la finalidad de generar respuestas motoras hacia donde ellos se encuentran ( Graziano y Gross, 1993). Ver Figura No.1.
FIGURA No.1. Una amplia distribución anatómica caracteriza a las neuronas sensibles a la disparidad en el cerebro humano.
UNA CORTA HIPÓTESIS SOBRE LA CONTRALATERALIDAD FUNCIONAL DEL CEREBRO Por qué razón el cerebro humano está estructurado funcionalmente en la forma que se conoce?; Por qué razón el hemisferio cerebral derecho debe analizar y administrar la información que llega del hemiespacio izquierdo y viceversa en el hemisferio izquierdo?. Estas son preguntas que ciertamente inquietan. Respecto al tema, el premio Nobel David Hubel en uno de sus más recientes libros afirmó : "...Incidentalmente, nadie sabe por qué la mitad derecha del mundo tiende a proyectar hacia la mitad izquierda de los hemisferios cerebrales...” ( Hubel, 1995 ). Los fundamentos de la contralateralidad funcional del cerebro es uno de los enigmas más sonados en Neurociencia. Hasta ahora, lo que se tiene son algunas piezas dispersas de lo que parece ser un complicado rompecabezas. Acudiendo a la imaginación del lector se puede formular una breve hipótesis que justifique tal arquitectura funcional, teniendo en cuenta para ello el importante papel que desempeñan las neuronas sensibles a la disparidad y su multiprocesamiento de las señales que representan los bordes: “Poseemos una corteza cerebral que contiene áreas de procesamiento estructuradas de forma invertida en 180° para poder procesar las señales que representan los bordes extraídos de imágenes que de forma también invertida, provienen desde ambas retinas a causa de la óptica altamente convergente de los globos oculares. Por ello, lo más eficiente para cualquier cerebro, será establecer conexiones desde la corteza visual primaria o V1 hacia las demás áreas corticales con una disposición igualmente invertida en 180°.” Ver Figura No.2.
74
FIGURA No.2. Estructuración de una corteza funcionalmente invertida para procesar imágenes invertidas del mundo exterior.
Tal vez, ese sea el motivo por el cual se hayan mapeado experimentalmente de forma invertida la mayoría de áreas con función sensorial o sensoriomotora en la corteza cerebral y aún subcorticalmente como lo han determinado algunos recientes estudios en el Colículo Superior. La disposición invertida de la corteza cerebral en los seres humanos, puede obedecer también a los principios conocidos de “ Economía Conexional ”, que fueron enunciados por primera vez hace más de 100 años por el también premio Nobel Santiago Ramón y Cajal y reevaluados teórica y experimentalmente en el siglo XXI por científicos como Dmitri Chklovskii. El concepto de economía conexional establece que debido al tamaño reducido de nuestra cabeza, existe “ presión” por mantener el volumen de la corteza cerebral en su mínima expresión ( Ramón y Cajal, 1889; Cowey, 1979; Mitchison, 1991; Cherniak, 1992; Young, 1992; Chklovskii & Stevens, 2000 ). Esto implica que las conexiones entre neuronas (axones y dendritas) deberán ser tan cortas como sea posible, sin perder funcionalidad ( Chklovskii, 2000). Los principios que rigen la economía conexional ya fueron aplicados por algunos autores en la explicación del mapa retinotópico ( Cowey, 1979; Kass, 1997 ) , de las franjas de dominancia ocular ( Mitchison, 1991 ) y del procesamiento de la disparidad binocular en la corteza visual primaria o área V1 ( Chklovskii, 2000). Teniendo en cuenta lo hasta ahora correlacionado, se puede sugerir que los principios de economía conexional también favorecen en gran medida la aparición de grupos de neuronas ampliamente sensibles a la disparidad en diversas áreas del mismo hemisferio que generen múltiples réplicas de las señales que representan la forma de los estímulos y su localización, que inicialmente fueron procesadas y proyectadas por el área V1. Esto permitirá que los diferentes procesos realizados por cada una de ellas, se efectúen dentro de parámetros cardinales tridimensionales debido al consistente y fidedigno remapeo del espacio visual extrapersonal y de los objetos contenidos en él. Figura No.3.
75
FIGURA No.3. La inversión de las imágenes retinianas y la disparidad existente entre las mismas, exige la aplicación de los principios
de economía conexional en las conexiones proyectadas hacia el NGL y V1, razón por la cual éstas son igualmente invertidas. Por todas las razones expuestas es necesario que se establezcan conexiones que comuniquen los hemicampos de procesamiento del cerebro con sus respectivos hemicampos contralaterales corporales, de
76
ahí que exista una decusación de las fibras nerviosas descendentes a nivel del tronco cerebral y que el cuerpo humano se represente en la corteza motora de forma invertida. Figura No.4.
FIGURA No.4.(a) Decusación de las fibras descendentes de la corteza motora a nivel del tronco cerebral (Pirámide) y (b) representación del hemicuerpo derecho en la corteza motora del hemisferio izquierdo (Homúnculo ), pruebas tangibles de un procesamiento invertido para cada hemisferio.
LA EXISTENCIA DE ECONOMIA CONEXIONAL SUPONE ECONOMIA DE PROCESAMIENTO
Como se ha sugerido en líneas anteriores, la compleja e invertida arquitectura cerebral probablemente se rige por los principios de economía conexional. Los procesos sensoriales, motores y cognitivos siguen una ordenada secuencia de programación y ejecución en la corteza cerebral que se caracteriza por utilizar el mínimo de recursos. Por ejemplo y hablando de la visión, la primera información se procesa y proyecta como tal en las áreas occipitales ( V1, V2, V3, V4), sin embargo el procesamiento de la información visual vá mucho más allá. Como se sabe, la información visual puede llegar a diversas y muy lejanas regiones del cerebro ( corticales y subcorticales) , entre las que podemos nombrar: La corteza Frontal, la corteza Parietal, la corteza Temporal, el Hipocampo, el Colículo Superior, la Amígdala y tal vez hasta muchas otras regiones a las que los actuales métodos experimentales de neuroimágen no han mostrado sensibilidad. Analizando el tema desde el punto de vista computacional, es un “ gasto ” innecesario de tiempo y de recursos neuronales, codificar para todo el cerebro el contenido completo de la información que llega a nuestras retinas. Utilizar todos los atributos de la imagen de un objeto ( forma, color, textura, etc..) más allá de las áreas occipitales implicaría para las neuronas tiempos de procesamiento demasiado prolongados, sobre todo cuando se requieren desempeñar funciones de retroalimentación motora en las que unos pocos milisegundos pueden marcar la diferencia entre la vida y la muerte. Así, para cualquier persona basta con percibir el movimiento del contorno de un automóvil que se acerca ( y no sus espléndidos colores ), para realizar una rápida maniobra e impedir un accidente. Debido a lo anterior es lógico suponer que de todos los atributos inicialmente codificados por la retina, las señales que representan los bordes o contornos de los objetos sean las que más se utilicen como código básico de procesamiento en las áreas corticales. Siguiendo tan económica estrategia, se pueden simplificar al máximo las secuencias algorítmicas necesarias para construir un eficiente mecanismo de procesamiento en paralelo de imágenes que cambian varias veces por segundo, esto permite interactuar con los objetos de la escena proyectada dentro del cerebro en tiempo real. Experimentalmente se conoce que la
77
representación de la forma bidimensional ( Denys et al, 2004) y tridimensional ( Paradis et al, 2000) de los objetos está generosamente distribuida en diversas regiones de la corteza cerebral. Santiago Ramón y Cajal fue también la primera persona en postular que las neuronas deben estar estratégicamente ubicadas en los animales para reducir el “ costo” conexional ( Ramón y Cajal, 1889). De otra parte, se habla en la literatura que los principales componentes que pueden incrementar ese “ costo ” conexional de acuerdo al conocimiento científico moderno, son: El volumen ocupado por las conexiones neuronales ( Cherniak, 1992; Chklovskii, 2004) , la demora o atenuación de las señales ( Wen y Chklovskii, 2005) y el gasto metabólico asociado con la propagación y mantenimiento de las señales ( Laughlin et al, 1998). Debido a los anteriores componentes y enfatizando sobre todo en la atenuación de las señales proyectadas, se ha observado que los bordes son los atributos codificados y proyectados con mayor fuerza por las neuronas del sistema visual. Para ilustrar lo anterior, experimentalmente ya se determinó que el criterio para clasificar la selectividad de una neurona con respecto a los bordes es que la respuesta de ésta ante un borde, debe ser por lo menos 5 veces más fuerte que las respuestas evocadas por la superficies delimitadas por ellos ( Von der Heydt et al, 2000).También otros trabajos han destacado los bordes como el atributo codificado con mayor fuerza por las neuronas del sistema visual ( Macknik et al, 2000). ¿ Por qué razón debe ser la señal evocada por un borde más poderosa que la evocada por las superficies enmarcadas por ellos ? Posiblemente la respuesta se halle en la importancia intrínseca que para nuestro cerebro representan los bordes codificados tridimensionalmente como código básico de procesamiento. Razón por la cual, dichas señales que inicialmente son procesadas por las neuronas sensibles a la disparidad en las capas superiores (2 y 3) del área V1 deban ser lo suficientemente fuertes, con el fin de ser recibidas sin mayor deterioro o atenuación por sus homólogas ubicadas en las diferentes áreas que conforman las vías ventral y dorsal, permitiendo niveles de remapeo ( copias múltiples) y de procesamiento aún más complejos ( de proyección y retroalimentación). Resumiendo entonces, las señales que representan los bordes codificados estereoscópicamente parecen ser el código " más económico" ( en términos de procesamiento computacional ) y por lo tanto el más rápido para ser usado en la programación, ejecución y almacenamiento de la gran mayoría de procesos perceptuales, motores y cognitivos que se basan en aferencias visuales. Figura No.5.
FIGURA No.5. Computacionalmente, la cantidad de información que contienen las imágenes a color siempre será mayor que las que solamente están conformadas por bordes. En la gráfica se puede comprobar que la cantidad de información de la imagen a color (a) , es más grande que la de la imagen de los bordes (b).
78
NEURONAS QUE ACTÚAN COMO MONITORES TRIDIMENSIONALES DE REMAPEO Los grupos neuronales sensibles a la disparidad, pueden describirse también como una especie de “proyectores holográficos ” que reubican constantemente la proyección de las señales que representan los bordes de los objetos dentro de coordenadas tridimensionales. Dicha actividad ( que sucede en paralelo a través de la vía dorsal y ventral ) , permite establecer representaciones multiplanares de cualquier escena dentro de las cuales se pueden localizar simultáneamente los contornos de varios objetos. El proceso de remapeo continuo y en paralelo de los estímulos visuales, ya fue estudiado por Graziano y Gross. Éstos investigadores reportaron la existencia de grupos de neuronas que poseen campos receptivos visuales dentro de las áreas pertenecientes al sistema motor, los cuales presentaban la notable característica de estar estrechamente relacionados con diferentes partes del cuerpo, sugiriendo que el espacio visual debe ser reconstruido muchas veces para conectarlo con específicas partes del cuerpo y así ejecutar diversas acciones ( Graziano y Gross, 1998 ).
LOS BORDES COMO BASE NEURAL DE LA MEMORIA POR AFERENCIAS VISUALES El procesamiento de las señales que representan los bordes estereoscópicos también puede relacionarse con los actuales modelos que tratan de explicar los sistemas de memoria declarativa y procedimental. El sistema de memoria declarativa refiere a el aprendizaje, la representación y el uso del conocimiento que se tiene acerca de los fenómenos que suceden a nuestro alrededor. Recientemente se especificó que este tipo de memoria depende esencialmente de las estructuras que conforman el Lóbulo Temporal Medial ( Susuki y Eichenbaum, 2000). El sistema de memoria declarativa también ha sido cercanamente relacionado con la vía ventral de procesamiento cortical de la información visual ( Ullman, 2004 ). Complementando el importante papel que tiene la memoria declarativa encontramos la memoria procedimental ( Squire y Zola, 1996 ), ésta se ocupa tanto del aprendizaje de nuevas destrezas sensoriales, motoras y cognitivas , como del control de las que ya están establecidas y de otros procedimientos ( como conducir un automóvil o jugar al fútbol ). Se ha estimado que este sistema de memoria se halla compuesto por una red específica de estructuras cerebrales que se fundamenta en los circuitos existentes entre la corteza frontal y los ganglios basales, con probable participación de algunas áreas de la corteza parietal ( AIP, LIP), de la corteza superior temporal y del cerebelo ( Hikosaka et al, 1996; Rizzolatti et al, 2000). En los monos, las neuronas del área parietal AIP (Anterior Intraparietal) ya fueron observadas disparar potenciales de acción durante la realización de movimientos de mano, mostrando preferencia la mayoría de ellas por las maniobras de agarre. Dentro de la misma área, también se han identificado grupos de neuronas que especifican la forma de los objetos que deben asirse con la mano (Sakata y Taira, 1994). En los humanos , de igual manera el surco Anterior Intraparietal ( región homóloga al área AIP de los monos) se activa durante aquellas acciones que demandan prensión guiada por aferencias visuales (Binkofski et al, 1998), cuando se manipulan objetos ( Binkofski, 1999) , también por observar los movimientos de mano que realizan otras personas ( Iacoboni et al, 1999) o por tan sólo observar objetos que se puedan manipular como herramientas ( Chao y Martin, 2000). Como se puede apreciar, todos los anteriores trabajos apoyan la multicodificación en paralelo de la forma y de la localización tridimensional más allá de las áreas occipitales. El sistema de memoria procedimental se ha relacionado con la vía dorsal del procesamiento visual, ya que ambos se basan en la red conformada por las áreas parietales posteriores y las áreas premotoras frontales, las cuales se sabe que están fuertemente interconectadas. Esto permite la transformación de la información visual en un marco egocéntrico que facilita la ejecución de programas motores, tales como asir o manipular los objetos de muchas maneras ( Ullman, 2004). Con todo lo analizado hasta ahora, no está fuera de contexto sugerir que tal vez las llamadas " Neuronas Espejo", que han sido halladas en el área F5 del mono ( área homóloga de la denominada 44 de Brodmann en los seres humanos) y que disparan tanto al ejecutar procedimientos motores secuenciales aprendidos como cuando se observa la realización de la misma secuencia motora en otro individuo ( Kohler et al, 2002), también se beneficien de las señales que representan los bordes estereoscópicos durante los procesos perceptuales, motores y cognitivos que precisan de su intervención.
79
Pues localizar una mano, un brazo, una pierna o todo el cuerpo de un individuo que se desplace en el espacio tridimensional, obviamente requiere procesar su forma dentro de múltiples coordenadas también tridimensionales. Si éstas imágenes de nuestro cuerpo o de otro cuerpo observado llegan invertidas a la retina, lo más probable es que se codifiquen las diversas partes del hemicuerpo en cada hemisferio cerebral de forma también invertida, disposición que permitirá economía tanto en el procesamiento como en la estructura que deberán tener las conexiones intracorticales. Así , podemos concluir que las neuronas espejo funcionan como un grupo de procesamiento intermedio que se especializa en traducir las señales que representan los bordes estereoscópicos en señales que representan un código de ejecución motora que pueda ser utilizado por el sistema de memoria procedimental durante los procesos sensoriomotores inherentes a los mecanismos de aprendizaje.
DISCUSIÓN El simple hecho de que la imagen transmitida desde ambas retinas se proyecte hacia la corteza visual con una inversión de 180°, puede ser la razón de fondo para que la mayoría de funciones corticales estén contralateralizadas en los seres humanos, hablando especialmente de las sensoriomotoras. No obstante, el conocimiento Neurocientífico clásico afirma que tal disposición es el resultado de las respuestas que vienen incorporadas en nuestro genoma desde “ nuestros antepasados ” evolutivos más antiguos: Los gusanos. Diversos científicos de gran trayectoria fueron cuestionados con el tema de la contralateralización y la respuesta común de todos ellos, era que la contralateralización funcional teóricamente proviene de las respuestas motoras que presentaban los primeros gusanos. Cuando a un gusano se le toca por el lado derecho de su cuerpo, este inmediatamente se incurva hacia el lado izquierdo o viceversa como mecanismo de defensa. Sin embargo, las perspectivas de esta disertación teórica tratan de ir más allá, pues ella no comparte la visión evolutiva que sostiene la doctrina clásica. Sino que por el contrario, ve al sistema visual del ser humano como el resultado de un “ diseño muy bien pensado” que siempre se centra en procesar la información con eficiencia y sobre todo con economía. Por tal razón, que mejor que estar dotados de un sistema neural de procesamiento en paralelo dispuesto en forma invertida para imágenes del mundo exterior que son capturadas y proyectadas por las retinas de forma invertida. Ya Charles Darwin tuvo sus dudas con respecto al funcionamiento del sistema visual cuando en la página 88 de su libro “ El origen de las especies ” confesó que era de lo más absurdo creer que el ojo con todos sus mecanismos inherentes para controlar la luz y el enfoque, fuera resultado de la evolución ( Darwin, 1859). En ese tiempo Darwin no contaba con los conocimientos que tenemos en la actualidad sobre los mecanismos neurales de la visión, seguro hubiese quedado más confundido. Actualmente, se conoce que la luz tiene mucho que ver con las configuraciones asimétricas anatomofisiológicas que debe tener el cerebro de las aves desde el periodo de empollamiento ( Güntürkün et al, 2000). Sin embargo, existe también una básica participación de la genética en los procesos de lateralización cerebral, pues se ha demostrado que los seres humanos presentan comportamiento motor lateralizado durante la etapa fetal ( Hepper et al, 1998 ). De igual manera se ha observado que los neonatos humanos exhiben en los primeros seis meses de vida una marcada preferencia por girar la cabeza hacia la derecha ( Ververs et al, 1994) como también es apreciable mediante ultrasonido que la mayoría succiona el dedo pulgar de su mano derecha intrauterinamente ( Hepper et al, 1991). De acuerdo a lo anterior, se ha llegado al consenso de que los seres humanos son en su mayoría diestros y también que las áreas del lenguaje se ubican en el hemisferio izquierdo. ¿ Se debe tal disposición a que se planifica la actividad motora para escribir cualquier grafema en el hemiespacio derecho porque la imagen invertida de nuestra mano derecha, junto con sus posibles planos de acción se proyectan de la misma forma hacia el hemisferio izquierdo ?... Será que la programación de los movimientos sacádicos necesarios para leer de izquierda a derecha ( la cual es una actividad propia del hemisferio izquierdo) es el posterior resultado de la codificación realizada por las neuronas sensibles a la disparidad de aquellas señales que representan los bordes de esas imágenes invertidas que se proyectan desde textos que se despliegan hacia el hemiespacio derecho ?. Dentro del contexto de las ideas planteadas en la presente teoría se puede pensar que sí. Tal vez ésta sea una de las
80
posibles razones para que el hemisferio izquierdo se describa en la literatura como aquel que contiene áreas especializadas para procesar el lenguaje. Bueno, esto es cierto para lenguas como el Español, el Inglés y el Francés , los cuales se leen y escriben de izquierda a derecha. Entonces que sucede en los cerebros de las personas que hablan lenguas como el Mandarín (Chino) que se escribe y se lee de derecha a izquierda? Existen estudios por medio de Imágenes por Resonancia Magnética Funcional (IRMf) como el de Tan y colaboradores (Tan et al, 2001), en el cual se observaron más áreas activas en el hemisferio derecho durante la lectura de escritos en lenguaje Mandarín (Chino) con respecto a las que se activan durante la lectura de escritos en Inglés. Los autores señalaban que la mayor activación del hemisferio derecho se debía a un procesamiento visuoespacial más riguroso para los logografemas Chinos que para los grafemas Ingleses. Sin embargo, cabe la posibilidad de que dichas activaciones se deban a mecanismos de programación sacádica basados en las señales procesadas de aquellos logografemas localizados en el hemiespacio izquierdo de los escritos Chinos, pues los autores también describieron una mayor activación de la corteza occipital derecha con respecto a la izquierda, situación que también se presenta durante los periodos de retroalimentación atencional preliminares a la ejecución de un movimiento sacádico hacia objetivos localizados en el hemiespacio izquierdo. Respecto al tema de la lateralización aún falta mucho por experimentar y analizar, el autor no obstante ,espera que con esta teoría se aporte un grano de arena a la complicada tarea de entender el funcionamiento de un órgano tan importante como el cerebro, que por diversas causas todos los seres humanos tenemos al revés.
REFERENCIAS Poggio G. F ., Fisher B.( 1977). Binocular interaction and depth sensitivity instriate and prestriate cortex of behaving rhesus monkey. J. Neurophysiol. 40:1392-1405. Burkhalter A. , Van Essen D.C. ( 1986). Processing of color, form and disparity information in visual areas VP and V2 of ventral extrastriate cortex in the macaque monkey. J. Neurosci. 6: 2327-51. Felleman D.J., Van Essen D.C.( 1987). Receptive field properties of neurons in area V3 of macaque monkey extrastriate cortex. J. Neurophysiol. 57: 889-920. Poggio G.F, Gonzalez F., Krause F.( 1988). Stereoscopic mechanisms in monkey visual cortex: binocular correlation and disparity selectivity. J. Neurosci. 8: 4531-50. Hinkle D., Connor C. ( 2000). Disparity tuning in macaque area V4. Neuroreport 12: 365–369. Burkhalter A. , Van Essen D.C. ( 1986). Processing of color, form and disparity information in visual areas VP and V2 of ventral extrastriate cortex in the macaque monkey. J . Neurosci. 6: 2327-51. Janssen P., Vogels R., Orban G.A. ( 2000).Selectivity for 3D shape that reveals distinct areas within macaque inferior temporal cortex. Science 288: 2054-56. Maunsell H., Van Essen D.C.( 1983). Functional properties of neurons in middle temporal visual area of the macaque monkey. II. Binocular interactions and sensitivity to binocular disparity. J. Neurophysiol. 49: 1148-67. Roy J.P, Komatsu H. , Wurtz R.H.( 1992). Disparity sensitivity of neurons in monkey extrastriate area MST. J. Neurosci. 12: 2478-92. Gnadt J.W., Mays L.E. ( 1995).Neurons in monkey parietal LIP are tuned for eye-movement parameters in three-dimensional space. J. Neurophysiol. 73:280-297. Ferraina S., Paré M. , Wurtz R.H. ( 2000) Disparity sensitivity of frontal eye field neurons. J . Neurophysiol. 83: 625-629. Chaturvedi V., Van Gisbergen J.A.M. ( 1999) Perturbation of combined saccade-vergence movements by microstimulation in monkey superior colliculus.J. Neurophysiol. 81: 2279–96, . Gnadt J.W. , Beyer J.( 1998).Eye movements in depth: What does the monkey's parietal cortex tell the superior colliculus?. Neuroreport 9:233-298.
81
Graziano M.S.A., Gross C.G.(1993). A bimodal map of space: somatosensory receptive fields in the macaque putamen with corresponding visual receptive fields. Exp. Brain Res. 97: 96–109. Hubel D.H.( 1995) Eye, Brain and Vision. Scientific American Library vol. 22. Scientific American Press, New York. Ramón y Cajal S. ( 1899) Textura del Sistema Nervioso del Hombre y de los Vertebrados. Nicolás Moya , Madrid. Cowey A. ( 1979). Cortical maps and visual perception:the Grindley Memorial Lecture. Q.J. Exp. Psychol. 31:1–17. Mitchison G.( 1991). Neuronal branching patterns and the economy of cortical wiring. Proc. of the Royal Society of London Biol. Sci. 245: 151–158. Cherniak C.( 1992). Local optimization of neuron arbors. Biol. Cybernetics 66: 503–510. Young M.P.( 1992). Objective analysis of the topological organization of the primate cortical visual system. Nature 358: 152–155. Chklovskii D.B., Stevens C.F. ( 2000). Wiring optimization in the brain. In S.A. Solla, T.K. Leen, K.R. Müller, Advances in Neural Information Processing Systems. Chklovskii D.B.( 2000). Binocular disparity can explain the orientation of ocular dominance stripes in primate primary visual area (V1).Vision Res. 40:1765–73. Kaas J. H. ( 1997).Topographic maps are fundamental to sensory processing. Brain Res. Bull. 44: 107–112. Denys K.,Vanduffel W., Fize D., Nelissen K., Peuskens H., Van Essen D., Orban G.A. ( 2004) The Processing of Visual Shape in the Cerebral Cortex of Human and Nonhuman Primates: A Functional Magnetic Resonance Imaging Study. J. Neurosci. 24:2551–65. Paradis A. L. , Cornilleau-Pérès V. , Droulez J. , Van de Moortele P.F. , Lobel E. , Berthoz A. , Le Bihan D. , Poline J.B. ( 2000).Visual Perception of Motion and 3-D Structure from Motion: an fMRI Study. Cerebral Cortex 10(8): 772-783. Chklovskii D.B. ( 2004). Synaptic Connectivity and Neuronal Morphology:Two Sides of the Same Coin. Neuron Vol. 43: 609–617 Wen Q., Chklovskii D.B. (2005). Segregation of the brain into gray and white matter: A design minimizing conduction delays. PLoS Comput. Biol. 1(7): e78. Laughlin S. B., de Ruyter Van Steveninck R. R., Anderson J. C. (1998).The metabolic cost of neural information. Nat. Neurosci. 1: 36–41. Von der Heydt R. , Zhou H. , Friedman H. S. (2000). Representation of stereoscopic edges in monkey visual cortex. Vision Res. 40 :1955-67. Macknik S.L. , Martinez-Conde S., Haglund M.M.(2000). The role of spatiotemporal edges in visibility and visual masking.P.N.A.S. 97 :7556–560. Graziano M.S.A., Gross, C.G. (1998). Spatial maps for the control of movement. Curr. Opin. Neurobiol. 8: 195–201. Suzuki W. A. , Eichenbaum H. ( 2000). The neurophysiology of memory. Ann. New York Acad. Sci. 911: 175-191. Ullman M.T. ( 2004) Contributions of memory circuits to language: The declarative/procedural model. Cognition 92 :231-270. Squire L.R. , Zola S.M. ( 1996).Structure and function of declarative and nondeclarative memory systems.P.N.A.S 93: 13515-522. Hikosaka O., Sakai K., Miyauchi S., Takino R., Sasaki Y., Putz B. ( 1996). Activation of human presupplementary motor area in learning of sequential procedures: a functional MRI study. J. Neurophysiol. 76: 617-621 Rizzolatti G., Fogassi L. , Gallese V. ( 2000). Cortical mechanisms subserving object grasping and action recognition: a new view on the cortical motor functions. The New Cognitive Neurosciences. (p.p. 539-552). Cambridge, MA: MIT Press. Sakata H., Taira M. (1994). Parietal control of hand action. Curr. Op. in Neurobiology 4: 847-856 Binkofski F., Dohle C., Posse S., Stephan K., Hefter H., Seitz R., Freund H. (1998). Human anterior intraparietal area subserves prehension: a combined lesion and functional MRI activation study. Neurology 50: 1253-59. Binkofski F., Buccino G., Stephan K., Rizzolatti G., Seitz R., Freund H. (1999). A parieto-premotor network for object manipulation:
evidence from neuroimaging. Exp. Brain Res. 128: 210-213.
82
Iacoboni M., Woods R. P., Brass M., Bekkering H., Mazziotta J. C.,Rizzolatti G. ( 1999). Cortical mechanisms of human imitation. Science 286: 2526-28. Chao L. , Martin A. ( 2000). Representation of manipulable man-made objects in the dorsal stream. Neuroimage 12: 478-484. Kohler E., Keysers C., Umilta M. A., Fogassi L., Gallese V. , Rizzolatti G. ( 2002). Hearing sounds, understanding actions: action representation in mirror neurons. Science 297: 846-848. Darwin C.( 1859). On the origin of species by means of natural selection. 6th Edition, London. Güntürkün O., Diekamp B., Manns M., Nottelmann F., Prior H., Schwarz A., Skiba M. (2000). Asymmetry pays: visual lateralization improves discrimination success in pigeons. Current Biol. 10:1079–81. Hepper P.G., McCartney G.R., Shannon E.A. ( 1998). Lateralised behaviour in first trimester human foetuses. Neuropsychologia 36:531-534. Ververs I.A., de Vries J.I., Van Geijn H.P. et al. (1994). Prenatal head position from 12-38 weeks. I. Developmental aspects. Early Hum. Dev. 39:83-91. Hepper P.G., Shahidullah S., White R. (1991). Handedness in the human fetus. Neuropsychologia 29:1107-11. Tan L.H., Liu H-L., Perfetti C.A., Spinks J.A., Fox P.T., Gao J-H. (2001)The Neural System Underlying Chinese Logograph Reading. NeuroImage 13: 836–846.
84
PROYECTANDO LAS ESCENAS VISUALES EN EL CEREBRO
Tal vez, en estos momentos puede ser aún muy difícil para el lector transformar sus paradigmas
mentales sobre la forma como el cerebro humano reconstruye las escenas tridimensionales
dentro de sí mismo. Sin embargo, podemos imaginar nuestro cerebro como una máquina de
realidad virtual muy sofisticada, en la cual, existen varios monitores holográficos (conformados
por las neuronas sensibles a la disparidad) que se activan en paralelo (al mismo tiempo) por todo
el cerebro, proyectando múltiples copias de las señales que representan los bordes
estereoscópicos dentro de coordenadas tridimensionales que concuerdan de manera exacta con
las coordenadas del espacio extrapersonal.
Ya tuve la oportunidad de esbozar en el capítulo anterior una posible respuesta (que por cierto fue
algo extensa), al enigma planteado por el Dr. David Hubel sobre el por qué las escenas y los
objetos incluidos en ellas que se ubican en el hemiespacio derecho, proyectan y se representan en
el hemisferio cerebral izquierdo, y viceversa en el otro hemisferio. No existe duda, de que si las
hipótesis planteadas en los capítulos anteriores son ciertas, las señales que representan los bordes
resaltarán como las más firmes candidatas a utilizarse más allá de las áreas visuales, en toda
actividad perceptual, motora y cognitiva que precise la intervención de la visión para su eficiente
ejecución. Una de esas hipótesis, plantea que el cerebro establece sus mapas neuronales de tipo
perceptual, motor y cognitivo, de manera invertida de acuerdo a las escenas que se proyectan
desde ambas retinas hacia el área 17/V1, para desde allí, multiproyectarse en paralelo hacia las
áreas que conforman la vía ventral y dorsal.
Para que el lector conozca algo más sobre la estructura y topografía de los mapas visuales dentro
del cerebro humano, comparto el texto y los gráficos de un artículo publicado en la revista Franja
Visual en el año 2008. (Giraldo D. (2008) Representación de la escena en la corteza visual. Franja Visual 102:64-65).
Con la comprensión de los mapas corticales, muy pronto lograremos decodificar en directo a
través de neuroimágen (RMNf), las escenas visuales que se proyectan dentro de nuestros cerebros,
ya sean consecuencia de la actividad directa del sistema visual o de la retroalimentación que
producen nuestras memorias sobre la corteza visual cuando soñamos. En el siguiente video-link, el
Neurocientífico Jack Gallant de la Universidad de Berkeley, nos ilustra acerca de los últimos
avances al respecto:
Para acceder al video-link, el lector debe escanear el código QR con un Smartphone.
85
REPRESENTACIÓN DE LA ESCENA EN LA CORTEZA VISUAL
INTRODUCCIÓN Conocer la forma como se reconstruyen las escenas en la corteza visual, se ha facilitado en los últimos años debido al vertiginoso avance en los sistemas de neuroimagen. Algunas investigaciones recientes y de antaño, han permitido observar mediante neuroimagen que la representación del espacio visual subjetivo en la corteza visual primaria se establece de forma invertida ( Tootell et al, 1996; Dumoulin et al, 2003). En el capítulo anterior, se sugirió que tal disposición puede deberse al simple hecho de que las imágenes provenientes desde las retinas sean invertidas y que estructurando las neuronas y sus redes sinápticas de tal forma , es también el medio más “económico” para lograr procesarlas eficientemente. También, se sugirió que los principios de economía conexional ( Chklovskii , 2000 ) posiblemente se conservan en los mapas estructurados a lo largo y ancho del cerebro. Participando activamente en la replicación de la imagen invertida de la escena dentro de cada mapa, apartir de las señales que representan los bordes ( Giraldo, 2008 ). De ahí que la antigua explicación que se tenía de que el cerebro es el encargado de “ enderezar” la imagen que proviene invertida de la retina para que nuestra percepción final del mundo sea derecha, quede de acuerdo a esas razones, relegada a un segundo plano. Estableciendo un nuevo concepto que se base en los hallazgos de la actual neurociencia, se puede decir que la corteza cerebral contiene múltiples mapas que representan el mundo exterior estructurados de forma invertida, para que sea más sencillo ( para las neuronas ) interactuar con él. En otras palabras, el cerebro está fisiológicamente dispuesto “al revés” para procesar eficiente y económicamente, imágenes que recibe tambien “al revés” a través de los ojos. Así, ese “Yo” interior que radica en el cerebro no está obligado a realizar sofisticados procesamientos que conlleven un gran esfuerzo neuronal para “ enderezar ” las imágenes invertidas provenientes de la retina, sino que construye estrategias conexionales eficientes, para establecer comunicación con un cuerpo que constantemente interactúa con el mundo externo y que se mueve dentro de un sistema de coordenadas invertido en 180 grados con respecto al sistema de coordenadas que él mismo maneja. De ahí la contralateralización funcional del cerebro y que existan conexiones que cruzan desde un hemisferio cerebral hacia el lado contralateral del cuerpo para poder gobernarlo.
MAPAS VISUALES Teniendo en cuenta todo lo expuesto hasta el momento, se hace más fácil entender la manera como funcionalmente se representa el hemiespacio visual subjetivo en la corteza visual contralateral del cerebro humano. En este artículo, para simplificar un poco más las explicaciones, se decidió exponer la representación del hemicampo visual izquierdo en las áreas visuales del hemisferio derecho, asumiendo que lo mismo sucede para el hemicampo visual derecho en el hemisferio izquierdo.
86
-Mapa No.1
En este mapa, se puede apreciar la representación del hemicampo visual izquierdo en el área V1
del hemisferio cerebral derecho teniendo en cuenta los mecanismos de magnificación cortical y la
excentricidad de cada zona de la retina. Nótese que la zona fóveo-macular es la mayormente
representada en V1, ocupando casi un 50 % de la misma. En la medida que nos desplazamos hacia
la periferia retinal, se puede encontrar que para estas zonas la representación en las áreas
visuales es menor. Esa situación se debe posiblemente a las imágenes en alta resolución que se
manejan en la zona macular, por lo cual se necesita una mayor población/extensión neuronal para
asegurar en la corteza un procesamiento de igual calidad.
87
-Mapa No.2
Aquí podemos observar, la distribución angular del hemicampo visual izquierdo en el área V1 del hemisferio derecho. Como se aprecia , la inversión de la escena continúa presente y la linea media que divide en partes iguales los dos hemicampos visuales, separa la sección superior del área V1 , también llamada área V1 dorsal (V1d) del área V2 dorsal (V2d). La sección inferior de V1 , V1 ventral (V1v) es separada del área V2 ventral (V2v) por la porción superior de la linea media. El meridiano horizontal que divide los cuadrantes superior e inferior del hemicampo visual izquierdo, coincide con la Cisura Calcarina.
MECANISMO CONEXIONAL DE DUPLICACIÓN ESPECULAR EN LAS ÁREAS VISUALES El establecimiento de conexiones en espejo dentro del cerebro humano, se presenta como una estrategia de las neuronas para ser más económicas en la comunicación y procesamiento de la información dentro de una muy delgada placa ( de sólo 2mm) como la corteza cerebral. En las conexiones en espejo, las neuronas de un área proyectan sus axones hacia las neuronas del área subsecuente siguiendo un característico patrón en “U”.
88
-Mapa No.3
En el mapa No.3 , se puede apreciar el esquema conexional de patrón en “U” en las áreas visuales de la vía dorsal y ventral, que se interconectan con sus respectivos cuadrantes del área V1 del hemisferio derecho. Nótese la duplicación en espejo de cada cuadrante desde V1 hasta el área V4. Por ejemplo: Las conexiones en “U” existentes entre V1d y V2d , hacen que ésta última sea una fiel imagen en espejo de la primera, que como se ha dicho , representa el cuadrante inferior del hemicampo visual izquierdo. V3d es imagen en espejo de V2d y V4d es imagen especular de V3d. Las siguientes áreas de procesamiento (V5, V7 de la vía dorsal y LOC, IT de la vía ventral) ,contienen la representación completa del hemicampo visual contralateral, en este caso del hemicampo visual izquierdo. Funcionando como estaciones de procesamiento preliminar para el planeamiento y programación de procesos motores y cognitivos complejos como la percepción del movimiento, la lectura ,los movimientos sacádicos o las maniobras guiadas por aferencias visuales. Tal característica se logra, porque dichas áreas cuentan con neuronas que tienen campos receptivos más amplios que los de sus áreas predecesoras (V4,V3,V2,V1). Es decir, cubren un espacio mayor del campo visual, por lo cual obtienen una mejor integración de los estímulos y procesan la información de manera contextual , permitiendo la ejecución de respuestas motoras eficientes hacia los mismos.
89
-Mapa No. 4 (recuadros A,B,C,D)
En este mapa se aprecia como el hemicampo visual izquierdo ilustrado en el recuadro B, se representa en las áreas visuales del hemisferio derecho, situación que se ilustra en el recuadro A. Debe observarse detenidamente, que el cuadrante superior izquierdo de B se representa en la porción inferior de V1 (V1v) de forma invertida y que el cuadrante inferior izquierdo , se representa de forma igualmente invertida en V1d . Las neuronas de V1d realizan sinapsis especulares con neuronas de V2d siguiendo la forma de “U” concéntricas, haciendo centro en las zonas limítrofes entre ellas. Apartir de V2d, se continúa con el mismo esquema conexional en espejo para V3d y V4d. Lo mismo sucede para las neuronas de las áreas visuales que representan el cuadrante superior izquierdo en la vía ventral (V2v, V3v, V4v). Las flechas de colores azul y fucsia que demarcan el cuadrante superior e inferior en B respectivamente, son una guía para conocer el sentido de cada representación en las áreas visuales. En el recuadro A , se observa la disposición en espejo de cada una de las flechas y como las conexiones en “U” se centran en los límites existentes entre un área y otra. En el recuadro C, se exponen las áreas visuales como un todo dedicado a brindar al observador de la escena una visión completa de lo que sucede en frente de él. Cuando se pliegan las áreas visuales sobre sus ejes conexionales (centros ubicados en los límites entre un área y otra), compactándolas, se puede observar que conforman una sumatoria perceptual como se describe gráficamente en el recuadro D. Tal estructura, es comparable con varios monitores translúcidos superpuestos, de los cuales uno procesa todos los atributos de la imagen a través de diferentes canales , otro las formas en profundidad, otro los atributos de forma y color en profundidad y otro atributos de alta complejidad cromática tridimensional como texturas, gradientes, brillos y sombras, que al
90
funcionar juntos al unísono (en paralelo), facilitan la percepción de una imágen tridimensional que es réplica virtual exacta de la escena del mundo exterior que se observa en el momento.
CONCLUSIÓN
La manera invertida como están dispuestas las estructuras neuronales de las áreas visuales, facilita enormemente las diversas etapas de procesamiento de las imágenes que provienen también invertidas desde las retinas. De igual manera , las conexiones en espejo se manifiestan como una económica estrategia para conseguir la duplicación de las coordenadas retinotópicas más allá de la corteza visual primaria (V1). Con lo referido en el anterior artículo, se puede sugerir que el cerebro crea para sí mismo, un entorno virtual con coordenadas invertidas en 180°, que es fiel representación tridimensional del entorno real dentro del cual existe.
REFERENCIAS
Tootell R.B.H., Dale A. M., Sereno M. I., Malach R. New images from human visual cortex. Trends Neurosci. 19 (1996):481–489. Dumoulin S.O. , Hoge R.D., Baker C.L. Jr., Hess R.F.,. Achtman R. L, Evans A.C.. Automatic volumetric segmentation of human visual retinotopic cortex .NeuroImage 18 (2003):576–587.
91
Chklovskii D.B., Stevens C.F. . Wiring optimization in the brain. In S.A. Solla, T.K. Leen, K.R. Müller, Advances in Neural Information Processing Systems ( 2000). Giraldo D. Neuronas sensibles a la disparidad y contralateralización funcional del cerebro, bases de un cerebro al revés. Franja Visual 97 (2008) : 44-46.
93
EL CÓDIGO DE LAS NEURONAS VISUALES La manera como las neuronas del sistema visual se comunican entre sí, es un tema que aún tiene con dolor de cabeza a varios investigadores alrededor del planeta. Sin embargo, en el transcurso de los últimos 60 años, son de gran extensión y profundidad los conocimientos que se han obtenido sobre el código que las neuronas del sistema visual utilizan en sus procesos. Nada más pensar sobre cómo hacer que funcione sincronizadamente un entramado neural conformado por múltiples elementos biológicos interconectados como son los fotorreceptores, las células horizontales, bipolares, amacrinas y ganglionares, en el propósito de generar un tren de potenciales de acción que represente fielmente la imagen de cualquier escena, puede quitarnos el sueño durante muchos días. Este pensamiento asaltó mi mente hace 8 años, una vez logré concluir el estudio sobre la conformación de los mapas visuales que describí detalladamente en el capítulo anterior. Analicé en ese entonces, cómo las células ganglionares retinales eran capaces de capturar, secuenciar y comprimir la información visual (ya transducida en potenciales de acción) en un código “empaquetado” que viaje a través de un axón, hasta neuronas de segundo orden localizadas en el Núcleo Geniculado Lateral , para desde allí , retransmitirlas (de ser necesario compensadas) hacia el área 17/V1. Algo verdaderamente fascinante, pero al mismo tiempo muy enigmático. Dicen los científicos conocedores del tema, que el código que parte desde las células ganglionares de la retina hacia el cerebro, es la moderna “Piedra Rosetta” de la Neurociencia. En el momento que se descifre completamente la estructura de este código neural, se entenderá gran parte del “lenguaje básico” que utilizan la gran mayoría de neuronas del cerebro humano. Al mismo tiempo, los modernos implantes neuroprotésicos visuales que proveen de visión artificial a personas invidentes, gozarán de mejor calidad en la información de la escena que capturan y proyectan estos dispositivos sobre la retina o la corteza occipital. Pues lamentablemente y por el momento, los implantes neuroprotésicos visuales sólo producen la percepción de bordes conformados por patrones de fosfenos. Para tener una idea sobre cómo le cambia la vida a un paciente con la implantación de un dispositivo neuroprotésico visual, el lector puede escanear cualquiera de los siguientes códigos QR con un Smartphone, para poder acceder a los video-Links.
En las siguientes líneas, el lector encontrará el texto de una teoría diseñada con mucha imaginación, pero también pertinentemente soportada en la evidencia científica, sobre la codificación, proyección y decodificación de la información visual. Espero disfrute con su lectura, y sobre todo con su estudio. Giraldo D. (2008) Teoría sobre el procesamiento de la información visual. Franja Visual 99:60-62.
94
TEORÍA SOBRE EL PROCESAMIENTO DE LA INFORMACIÓN VISUAL
INTRODUCCIÓN La manera como se procesa la información en el sistema visual, es un tema que ha inspirado diversas teorías con la esperanza de vencer algún día el reto de otorgar visión por medios artificiales a un ser humano privado de ella, ya sea por medio de bioingeniería o de neurobiónica. La siguiente teoría sobre el procesamiento de la información visual, estructura en un modelo sistemático los posibles mecanismos sobre cómo fragmentar y codificar una imagen en la retina para luego ser decodificada y reestructurada en la corteza visual primaria, enunciando también algunas hipótesis sobre la forma en que esta información puede ser distribuida y representada en otras áreas corticales.
CARACTERÍSTICAS GENÉTICAS Y FOTÓNICAS Es preciso enunciar algunas características que son tanto de tipo genético como físico, las cuales preparan al sistema visual para recibir una imagen y así poder procesarla adecuadamente para su posterior composición en la corteza visual. -Genéticas (Primarias): Al parecer existe un subprograma en nuestro código genético que especifica la forma en que cada neurona del sistema visual se ha de conectar tanto con sus representantes espaciales a nivel retinal como con sus representantes a nivel cortical, construyendo de esta forma patrones retinotópicos primarios en las áreas V1, V2, V3, V3a, VP, V4 de la corteza occipital y probablemente en áreas de la vía dorsal como M.T., S.M.T., L.I.P. y F.E.F./Ocular frontal. Los hallazgos de Greiner y Weidman (Greiner y Weidman, 1981) y los más recientes de Karne y Colaboradores (Karne et al, 1997), demostraron que los primeros circuitos sinápticamente conectados aparecen durante el desarrollo de la capa plexiforme interna, cuando se establecen sinapsis entre las células amacrinas y ganglionares. De igual manera Penn y Colaboradores (Penn et al, 1998), afirmaron que antes de la maduración de los fotorreceptores y de la apertura ocular, las células ganglionares periódicamente realizan disparos de potenciales de acción. En este estudio que se realizó en fetos de rata, se observó que los potenciales se transmitían de una célula a la siguiente de la misma forma hacia la retina como hacia la corteza occipital. Suponiendo que en los humanos sean similares estos comportamientos, se puede formular la hipótesis de que las neuronas del área 17/V1 estarían en capacidad de " reconocer " los patrones de pulsación (potenciales de acción) emitidos por cada célula ganglionar espacialmente representada. Dichos patrones de pulsación se denominarán dentro del contexto de la presente disertación como Pulso de Identidad Primario (P.I.P.). Dentro de las funciones del Pulso de Identidad Primario (P.I.P), está la de facilitar el establecimiento de redes sinápticas estructuradas dentro de coordenadas retinotópicas gruesas entre las neuronas retinales, las del núcleo geniculado lateral y las de la corteza visual en los meses anteriores al nacimiento. Estas conexiones, preparan al sistema para ejecutar procesamientos más refinados una vez los ojos sean abiertos y la retina inicie la transformación de los primeros estímulos fotónicos en potenciales de acción codificados.
95
- Fotónicas (Secundarias): Es característico del sistema visual, procesar imágenes nítidas en las áreas centrales de la retina e imágenes gradualmente faltas de nitidez hacia la periferia. Esto se debe a los fenómenos ópticos refractivos y difractivos propios de los globos oculares, en los cuales, las áreas centrales del sistema dióptrico focalizan con mayor precisión las diferentes longitudes de onda del espectro visible sobre la retina central que sobre las áreas periféricas, en donde el segundo fenómeno (difracción), es más evidente. Causando de esta forma, mayor dispersión del estímulo luminoso y por ende menor cantidad de fotones por milimicra cuadrada, de ahí que sea mayor la agrupación de conos hacia las áreas centrales de la retina, disminuyendo progresivamente en cantidad hacia las áreas periféricas. Según Osterberg (Osterberg, 1935), la cantidad total de conos en la retina es de 6.400.000, de los cuales, aproximadamente 200.000 están ubicados en la fóvea. Existen también, según el mismo autor de 110.000.000 a 125.000.000 de bastones, con una densidad máxima a los 18° o 5mm del centro foveal, formando un anillo alrededor de él, en el cual hay una densidad promedio de 160.000 bastones por milímetro cuadrado en las áreas de mayor concentración. Las anteriores cifras hablan por sí solas y responden el por qué es necesario que exista una mayor densidad de células fotorreceptoras en las áreas centrales de la retina que en las periféricas, haciendo posible la existencia de dos sectores de procesamiento: Uno de alta resolución central, para estímulos fotónicos de alta intensidad (Luz día) y otro de mediana resolución paracentral para captar estímulos fotónicos de baja intensidad (Penumbra). Así, se puede sugerir que los humanos poseemos tanto una fóvea central para la recepción de estímulos cromáticos de alta intensidad en alta resolución, como una macrofóvea de mediana resolución para la recepción de estímulos acromáticos de baja intensidad, ubicada periféricamente y alrededor de la primera. En condiciones exclusivamente fotópicas o escotópicas, ambos sistemas (conos vs bastones) se suprimen mutuamente para llevar a cabo un mejor proceso de convección, codificación, decodificación y proyección de la imagen capturada dentro de su correspondiente área retinal. Existiendo una situación intermedia (mesópica) en la cual se ha observado que ambos sistemas cooperan.
TOPOGRAFIA Y JERARQUIZACIÓN DE LOS PROCESOS (CAPTURA, CONVECCIÓN, CODIFICACIÓN, CONDUCCIÓN, DECODIFICACIÓN Y PROYECCIÓN).
-A NIVEL RETINAL: Es posible, que las áreas retinales de captura de una imagen se distribuyan en patrones concéntricos que parten desde el centro de la fóvea hasta la lejana periferia retinal. Formando diferentes zonas, con parámetros de resolución también diferentes (Parámetros de alta, media y baja resolución). Es conocido que el área foveal es la de máxima resolución, y que dicha resolución decrece progresivamente hacia la periferia retinal. Esto produce diferentes niveles de procesamiento a los cuales ya se han adaptado las células ganglionares de la retina, las cuales en el área foveal reciben señales de cada cono en una estrecha relación de dos células ganglionares para recibir las señales procedentes de un cono (2:1). Esta relación se encuentra hasta los 2.2° a partir del centro foveal (Schein, 1988). Investigaciones más recientes han encontrado que la densidad de células ganglionares por milímetro cuadrado de retina es inversamente proporcional a la distancia con respecto al centro foveolar (Wässle y Boycott, 1991). Teniendo en cuenta lo anterior y lo referente a las características primarias y secundarias se puede
96
encontrar una fuerte conexión entre las distintas clases morfofisiológicas de células ganglionares y la extensión de sus campos receptivos. Las cuales, en el ser humano han sido clasificadas de acuerdo al tamaño de sus cuerpos celulares y a la extensión de sus campos receptivos en 18 tipos, ambos parámetros se incrementan de manera directamente proporcional a la distancia del centro retinal, es decir desde la fóvea (Wässle y Boycott, 1991). Así ,cuanto más lejos de la fóvea nos referimos, los cuerpos celulares de las células ganglionares y sus campos receptivos se hacen más grandes por lo cual pueden recibir información de áreas retinales cada vez más extensas ( fenómeno que es de esperarse si se quiere integrar información de una imagen periférica ligeramente desenfocada) (Figura No.1).
Figura No.1. El tamaño de las células ganglionares aumenta asombrosamente a partir de la fóvea.
Para tener un mejor concepto de los procesos, la retina de cada ojo se puede delimitar topográficamente en por lo menos tres zonas principales para la captura, convección y codificación de una imagen, de la siguiente forma: (1) Zona central de alta resolución. (2) Zona intermedia de mediana resolución. (3) Zona periférica de baja resolución. A la vez, cada una de esas zonas se puede dividir en lo que denominaremos: Áreas Concéntricas de Captura. Las áreas concéntricas de captura, representan sectores que están densamente agrupados hacia el centro retinal aumentando la distancia entre ellos hacia la periferia. También se pueden trazar líneas imaginarias de eje en los 360° que sectorizarán cada una de las zonas y áreas concéntricas en lo que se llamarán Sectores de Npixeles; denominando por último Npixel (abreviatura de pixel neuronal): Al área de imagen producto de la sumatoria de las respuestas espectrales de tres conos (rojo, verde y azul) ya percibida en la corteza visual. Cada sector de npixeles estaría conformado por una cantidad creciente de ellos, hablando del centro hacia la periferia retinal. Así, a nivel foveal (que es donde se encuentran las áreas concéntricas de captura
97
en alta resolución) cada célula ganglionar ya sea de centro de encendido o de apagado, analizará sectores de un sólo npixel mientras que en la periferia, cada vez serán más la cantidad de npixeles que deberán ser analizados y codificados por cada una de ellas ,con la finalidad de obtener información fiable que se pueda correlacionar con la obtenida en el sector de npixeles codificado por otras células ganglionares en las áreas concéntricas de captura inmediatamente anterior y posterior. Dicho proceso es muy importante para la ejecución a nivel cortical de los mecanismos de unión perceptual (Binding) de los atributos segmentados de una imagen. (Figura No.2).
Figura No.2. Esquema representativo de las zonas de captura de una imagen en la retina.
PROCESAMIENTO DESDE LA RETINA HASTA LA CORTEZA OCCIPITAL
-EN LA RETINA: El procesamiento de la información visual es posible que se codifique en la retina de acuerdo a las siguientes etapas: 1-CAPTURA Y CONVECCIÓN: La información resultante de los análisis espectrales de cada npixel efectuado por las células horizontales se compila en un orden específico, posiblemente conformando matrices de información, lo cual facilita el proceso de escaneo de cada npixel, la separación y direccionamiento de aquellos sectores de npixeles en los cuales existen cambios específicos de contraste, matíz, saturación y luminosidad. De esta forma se segmenta en una matriz de área, la información resultante de la interacción de varias células horizontales, inmediatamente esas matrices son “ comprimidas “ por las células bipolares formando una nueva matriz , cada una de éstas matrices del nivel bipolar son escaneadas de nuevo para formar una última matriz de matrices a nivel de las células amacrinas; información que es finalmente recibida, organizada y secuenciada en un patrón específico por la célula ganglionar directora, antes de enviarse al núcleo geniculado lateral y de éste al área visual primaria 17/V1. Claramente, los anteriores mecanismos demuestran un sistema especializado de convergencia de la información. (Figura No.3)
98
Figura No.3. La información visual converge de una célula nerviosa en otra, para su codificación.
El proceso de escaneo, refiere a la recuperación secuencial de un área de información, en el cual, se recibe información a medida que se transmiten, se desechan y renuevan todos los valores secuenciados unos milisegundos antes. Tal mecanismo, permite el registro de un nuevo estímulo en cada npixel, detectando también cambios en la posición de una imagen (proceso necesario para percibir el movimiento de un objeto). El proceso de escaneo, posiblemente se realiza en los 360° que conforman los campos receptivos circulares de las células ganglionares , produciéndose incluso desde los campos receptivos más pequeños que son los de las células horizontales, pasando por los de las células bipolares y amacrinas . Éste fenómeno que en electrónica se conoce como mecanismo de refresco o "refresh", es un proceso que en la retina tal vez se ejecute de centro a periferia y que por motivos de sincronización perceptual, motora y cognitiva se efectúe del mismo modo en la corteza cerebral por medio de las ya conocidas interacciones excitatorias-inhibitorias del área 17/V1 con el área Medial Temporal (MT/ V5). Teniendo en cuenta lo referido hasta el momento, se puede estructurar un modelo de codificación de la siguiente forma: (Ver Figura No.4 A)
99
Figura No.4 A. Modelo hipotético de compresión de la información visual en forma de TPMS.
Sí analizamos la anterior Figura, se puede suponer que cada célula ganglionar contiene su propio mapa para el direccionamiento y proyección de las matrices correspondientes y que tal vez, el sentido de escaneo y el de secuenciación, sea el mismo para toda célula colectora de información a nivel retinal. Así, la interacción de señales en cada matriz es analizada para nuevamente direccionarse en nuevas matrices contenedoras (desde el subnivel mínimo de procesamiento que se estructura en la capa de células horizontales hasta el nivel máximo de procesamiento que se efectúa en la capa de células ganglionares). Todas las matrices de señales direccionadas a nivel de las amacrinas son re-analizadas por cada célula ganglionar para compactarlas en un código único de acuerdo al número de matrices analizadas y fusionadas. Es de anotar, que siempre que una matriz se direcciona, la célula que ejecuta la recolección de la información es posible que emita un Pulso de Identidad Local (P.I.L.) , el cual puede definirse, como aquel pulso que "etiqueta espacialmente" la matriz codificada por la célula colectora respectiva y que también facilita el orden de codificación a nivel de la ganglionar coordinadora y de decodificación a nivel de las neuronas receptoras geniculadas y corticales, permitiendo su eficiente proyección y direccionamiento hacia otras neuronas ubicadas en otras capas de las áreas V1, V2, V3 y en áreas sucesivas para ejecutar procesamientos de alto nivel.
100
La velocidad de codificación se incrementa de forma constante desde el centro retinal hacia la periferia. Esto se debe a una evidente causa: Mientras más matrices de npixeles deba compilar y secuenciar una célula ganglionar, mayor deberá ser su volumen celular, su velocidad de computación y su velocidad de transmisión para formar parte del siempre sincronizado mosaico cortical. Se ha comprobado experimentalmente que las hemiretinas nasal y temporal de cada ojo están perfectamente sincronizadas con el fin de evocar respuestas también sincrónicas a nivel del núcleo geniculado lateral (Neuenschwander y Singer, 1996). 2-CODIFICACIÓN: Una vez la información se organiza en una matriz principal contenedora de matrices de señales, las células ganglionares se ocuparán de compilar una señal integradora final que posiblemente tenga una estructura similar a la siguiente:( Figura No.4 B).
Figura No.4 B. Tren de Pulsos Matriciales Secuenciados (T.P.M.S) procedente de la célula ganglionar ilustrada en la
Figura No.4A.
-Pulso de Identidad Primario (P.I.P): Es la señal permanente con la cual se ha establecido una comunicación estable desde la etapa prenatal entre las células ganglionares y las neuronas de la corteza visual. Dicha señal, garantiza la previa preparación de las células corticales directoras (del área 17/V1), para la recepción de nuevos trenes de datos. Tal vez, este pulso es al que se refieren algunos autores, cuando relatan que en total oscuridad, las células ganglionares exhiben una tasa sostenida de pulsos espontáneos que son mantenidos como "ruido de fondo" hasta que el estímulo luminoso es detectado nuevamente. Probablemente estos pulsos sean réplicas del Pulso de Identidad Primario (P.I.P.) sucedido por Pulsos de Identidad Local (P.I.L.) de contenido matricial vacío. Así mismo, es posible que el Pulso de Identidad Primario (P.I.P.) sea uno de los factores que genere fenómenos de refresco a nivel de los sectores de proyección cortical.
101
-Tren de Pulsos Matriciales Secuenciados (T.P.M.S.): Inmediatamente a la generación de un P.I.P, las células ganglionares es posible que disparen una secuencia de P.I.L. que a su vez contengan diferentes secuencias de otros P.I.L., de acuerdo al sentido de escaneo y a la secuencia de las matrices incluidas. En este momento se puede sugerir que las células ganglionares actúan prácticamente como secuenciadores de matrices que contienen submatrices de señales fácilmente reconocibles por otras neuronas (corticales) que redireccionan estas señales en áreas corticales sensibles a los atributos de cada segmento de señal. Así, para cada célula ganglionar retinal, existen neuronas del área 17/V1 que actúan como organismos homólogos de decodificación y redireccionamiento de las distintas pero ordenadas secuencias matriciales de señales, distribuyendo los diferentes sectores analizados de una imagen en las áreas de procesamiento de la corteza visual y de las áreas visuales de asociación repartidas por todo el cerebro. El TPMS generado por una célula ganglionar es posible que sea más simple a medida que nos aproximemos a la fóvea (teóricamente más corto, debido a la poca cantidad de información a codificar y conducir, de ahí que no se requieran de altas velocidades de cómputo, conducción y de refresco, así como también se necesita una menor circuitería entre las diferentes células recolectoras de información). Por el contrario, el TPMS generado por una célula ganglionar a medida que se aleja de la fóvea, tiende a ser progresivamente más complejo (teóricamente más largo, debido a la amplia cantidad de información a codificar, conducir y refrescar. Por tal razón se encuentra que en la vía Magnocelular el procesamiento, la conducción y la velocidad de proyección de la información hacia V1 y las demás áreas corticales, sean más rápidas. Estamos hablando, tal vez, de cientos a miles de npixeles que deben ser procesados matricialmente para compactar un gran sector de información visual que pueda ser sincronizado a nivel cortical con el sector de npixeles inmediatamente anterior (el más cercano en dirección a la fóvea) y con la totalidad de la imagen percibida. El Pulso de Identidad Primario (P.I.P.) de células ganglionares cercanas a nivel retinal deberá ser aunque no igual, sí muy parecido para efectos de direccionamiento sináptico a nivel del Núcleo Geniculado Lateral y de las áreas corticales. Respecto a lo anterior, se ha encontrado experimentalmente que existe una alta correlación de los patrones de pulsación de células ganglionares vecinas (Ej.: Como si varias personas que están muy próximas entre sí, hablasen del mismo tema.) (Meister, 1996). También se ha encontrado que dichos patrones de pulsación correlacionados pueden ser significativamente centralizados de forma que varias señales similares convergen en neuronas comunes en la corteza cerebral. Así, varias sinapsis que son simultáneamente activadas tienden a ser mutuamente fortalecidas con el tiempo, fenómeno que puede vincularse con la gran cantidad de información que es manejada por cada célula ganglionar a medida que se ubica más lejos de la fóvea. De esta forma, a nivel de la periferia retinal, las señales procedentes de varias células ganglionares vecinas se "unirán" para compactar los atributos dispersos de un sector de imagen compuesto por miles de npixeles, los cuales después de ser decodificados se percibirán como un grande y difuso sector de imagen con burdos pero reconocibles atributos.
102
3-CONDUCCIÓN: Debido a los inflexibles conceptos instaurados por algunos investigadores, actualmente es difícil saber qué tipo de información regula y conduce el sistema fásico o magno (sistema de transmisión que ha sido delimitado desde la perifóvea hasta las áreas más periféricas de la retina). Se ha sugerido que este sistema es responsable de la luminancia (Lee et al, 1990). Otros investigadores sugieren que detecta y regula la percepción del movimiento. Argumentación algo restrictiva, pues es notorio que todas las áreas de la retina perciben el movimiento, las centrales más lentamente que las periféricas. Con lo anterior, se deduce que el sistema fásico o magno, es la estructura neuronal resultante de las disposiciones expuestas, y que su velocidad de conducción de señales es producto de la adaptación de las células ganglionares al procesamiento de áreas de información cada vez mayores, en el objetivo de compactar un sector de imagen que pueda ser anexado sincrónicamente a otros sectores durante la composición perceptual de la escena observada en la corteza visual. De igual manera, el sistema tónico o parvo es resultado del procesamiento de las señales provenientes de los receptores foveales. Este sistema no es necesario que sea rápido, pues como se relató, es posible que los TMPS emitidos por cada célula ganglionar del área foveal sean cortos por la poca cantidad de información que debe compilarse. -Velocidad de Conducción: Investigaciones recientes y de antaño, han hecho consenso al clasificar las vías de transmisión de señales en dos vías principales: la vía tónica (Parvocelular) y la vía fásica (Magnocelular). Peter Gouras (Gouras, 1968), clasificó las células ganglionares de la retina del primate en dos grandes categorías de acuerdo a su velocidad de conducción: Células ganglionares pertenecientes a la vía tónica y células ganglionares pertenecientes a la vía fásica. Las células tónicas, responden a los estímulos luminosos de una manera firme y constante. La extensión de sus campos receptivos es extremadamente pequeña, cerca de 15 milimicras de superficie retinal. Estos campos receptivos concuerdan en forma muy exacta con el tamaño de dichas células. La velocidad de conducción de las fibras tónicas es lento, aproximadamente 2 m/s (Gouras, 1969). Este mismo grupo de células son denominadas con frecuencia por otros investigadores como células "P”, porque las fibras tónicas terminan su recorrido y hacen sinapsis en la capa Parvocelular del núcleo geniculado lateral. Las señales fásicas se originan en el tipo morfológicamente más grande de células ganglionares, las cuales poseen una velocidad de conducción mucho más rápida, aproximadamente 4 m/s (Gouras, 1969). Las células fásicas, son también denominadas células "M”, debido a que su recorrido termina en la capa Magnocelular del núcleo geniculado lateral. Cerca de la fóvea, los campos receptivos de las células fásicas son de 2 a 3 veces más extensos que los de las tónicas, siendo aún 10 veces más grandes en la periferia retinal. Las células tónicas de la vía Parvocelular responden bien a estímulos con alto contraste y fino detalle, mientras que las células fásicas lo hacen con estímulos de burdos detalles y débil contraste que cubren amplias áreas ( Kaplan y Shapley, 1986). La Vía Parvocelular (sistema tónico), gestiona principalmente la información concerniente a los colores y los detalles de los objetos. Así, las neuronas pertenecientes a esta vía serían las directas continuadoras de la transmisión de TPMS provenientes de las células ganglionares del área foveal, hacia sus directas representantes del área 17/V1.
103
La vía Magnocelular (sistema fásico), cuyas neuronas son morfológicamente más grandes que las del sistema Parvocelular, se ha relacionado de forma exclusiva con la percepción del movimiento y del contraste. Características con las que puede estarse parcialmente de acuerdo pues éste sistema capta mejor el movimiento debido a que sus áreas de detección en la retina son más grandes y porque sus velocidades de detección y procesamiento son igualmente mayores. Las respuestas cromáticas también se dan para este sistema aunque con un menor número de matices (Por la conocida disminución en la población de receptores cromáticos hacia la retina periférica), a diferencia de la vía Parvocelular en donde es posible combinar diferentes respuestas espectrales haciendo la percepción de colores más detallada. Podríamos concluir de acuerdo a los anteriores postulados, que la diferente organización anatomofisiológica del núcleo geniculado lateral en los humanos es el producto de las diversas velocidades de conducción que provienen desde cada una de las áreas concéntricas de procesamiento de la retina a través del nervio óptico, y que los atributos de la imagen que son conducidos por cada axón en forma de TPMS, pueden ser en teoría muy parecidos en su estructura general, lo único que los diferencia es el contenido de matrices de npixeles codificadas, el cual como se ha dicho es más extenso hacia la periferia retinal, simplificando su contenido hacia el centro. Esta singular estructura de la información llevada por cada axón, facilita las interconexiones sinápticas de compensación entre puntos retinales que emitan TPMS de estructura similar desde los dos ojos en condiciones de pérdida del paralelismo ocular. -A NIVEL CORTICAL: MACROTOPOGRAFIA DEL CÓRTEX VISUAL PRIMARIO (ÁREA V1) Se sabe que la posición espacial de las células ganglionares en la retina humana es preservada en la organización topográfica de las neuronas de las diversas capas del núcleo geniculado lateral. En el cual, sus capas posteriores contienen neuronas que conducen las señales provenientes de los campos receptivos foveales y perifoveales. De esta forma, recorriendo de posterior (polo occipital) a anterior (en dirección frontal), se conducen las señales provenientes de células ganglionares que son cada vez más periféricas en la retina (Erwin et al., 1999). Esta distribución, que ampliamente se conoce como organización retinotópica también se conserva en el área 17/V1. En experimentos electrofisiológicos con monos, se ha observado que cuando se penetra tangencialmente un electrodo a través de la capa 4C y de las columnas de dominancia ocular, Los campos receptivos de las neuronas de esta capa corresponden sistemáticamente a ubicaciones de estímulos capturados desde la fóvea hasta la periferia retinal. Esta tendencia es interrumpida localmente por abruptos cambios en los límites de las columnas de dominancia ocular. Las columnas de dominancia contienen neuronas que reciben los TPMS que provienen de áreas retinales correspondientes, intercalando grupos de neuronas decodificadoras de los pulsos provenientes de la hemiretina nasal derecha con grupos de neuronas decodificadoras de los pulsos provenientes de la hemiretina temporal izquierda o viceversa en el hemisferio cerebral contralateral. La anterior disposición es muy práctica y totalmente funcional para la conformación de circuitos binoculares (estereoscópicos), debido a que la distancia entre la columna de un ojo y otro tiene lugar aproximadamente cada 50 micras (a nivel de la capa 4C), así se facilita en gran medida, la interconexión sináptica de dichas neuronas en capas superiores, convergiendo en neuronas especializadas en analizar la información para cada columna. De esta manera se conforman los circuitos necesarios para el proceso de magnificación cortical, posterior procesamiento de la percepción estereoscópica y para el direccionamiento de sectores de npixeles con diferentes atributos en las áreas 18/V2 y 19/V4. Actualmente, se describe que el área 17/V1 tiene la forma de una pera, en el cual, las regiones foveales y perifoveales obtienen gran representación y las periféricas una mínima. Esta
104
representación científicamente se ha designado como " Magnificación Cortical". El proceso de magnificación cortical es muy necesario, pues es la única forma de ampliar escalarmente una imagen formada en la retina que es de unos pocos milímetros de diámetro, en una cortical de algunos centímetros que produzca proporcionalmente la constancia perceptual de la escena observada. Según recientes investigaciones sobre el proceso de magnificación, la gruesa organización retinotópica del área 17/V1 puede ser explicada por un gran número de neuronas representando cada célula ganglionar retinal ,que por ejemplo y solamente en la capa 4C , esta relación es de por lo menos cien (100) neuronas de dicha capa representado los TPMS emitidos por una (1) sola célula ganglionar, de esta forma, un sólo TPMS se transmite " copiado" a varias neuronas para ser decodificado, direccionado y procesado en las capas superiores del área 17/V1 y así continuar su proyección y redireccionamiento (Ya magnificado) hacia las áreas 18/V2 y 19/V4. Una sección del área 17 desplegada se puede delimitar topográficamente de la siguiente forma: (Figura No.5)
Figura No.5. Las regiones centrales de la retina obtienen gran magnificación y representación en V1.
En esta gráfica, se puede observar la gran cantidad de espacio en V1 dedicado al procesamiento de las señales foveales y perifoveales con respecto al necesario para las áreas retinales periféricas.
105
-MICROTOPOGRAFIA Y POSIBLES NIVELES DE PROCESAMIENTO DE LOS TPMS PARA LA FORMACIÓN DE LA IMAGEN EN LA CORTEZA VISUAL (Figura No.6)
Figura No.6. Flujo retroalimentador de la información visual en el NGL, V1, V2, V4 y V5.
En esta Figura, podemos apreciar los niveles de procesamiento en el área 17 de los TPMS provenientes del núcleo geniculado lateral. El flujo de información está representado por flechas de colores, en las cuales, la punta de cada flecha representa las proyecciones de una capa hacia otra, ya sea para el envío de TPMS procesados o para la retroalimentación de pulsos procesados que sean contenedores de nueva información proveniente de otras capas de la misma área 17 u otras áreas corticales. -DECODIFICACIÓN: -PROCESO DE DECODIFICACIÓN PARA SEÑALES FOVEALES, PERIFOVEALES Y PERIFÉRICAS: Los TPMS llegan provenientes de las neuronas de la vía Parvocelular del Núcleo Geniculado Lateral a la capa 4Cα, allí se inicia el proceso de magnificación cortical por medio de la copia de cada una de las señales que provienen de cada célula ganglionar perteneciente a las áreas retinales de captura foveales y perifoveales en grupos de varias neuronas que representan un punto determinado del espacio visual. Es conocido que los axones de las neuronas de la capa 4Cα se proyectan en gran cantidad hacia la capa 3B. Los npixeles que representan atributos cromáticos de alto y bajo contraste, así como los que representan luminancia, son direccionados en grupos de neuronas de los llamados" Blobs" y los npixeles que representan zonas con atributos acromáticos de alto contraste (basados en diferencias energéticas) es decir, los bordes extraídos de una imagen, son direccionados en los grupos de neuronas de los "interblobs", y a partir de estos " Blobs" e "Interblobs" del área 17/V1 se redireccionan las matrices de npixeles en capas homólogas de procesamiento y direccionamiento en las áreas 18/V2 y 19/V4. De esta forma, el autor comparte el concepto que sobre el tema tenía el desaparecido científico Bela Julesz. Julesz afirmaba que el área 17/V1
106
funciona como una “nueva retina” para el cerebro, proyectando a la inversa sobre las áreas adyacentes la imagen tridimensional de una escena transmitida desde la retina (Julesz, 1971). Los TPMS que provienen de las neuronas pertenecientes a la vía Magnocelular del núcleo geniculado lateral cuya estructura es teóricamente más compleja debido a su alto contenido de matrices de npixeles codificadas, llegan a la capa 4Cβ del área 17/V1, donde son magnificados en la misma proporción escalar de su contenido matricial y con la misma velocidad de transmisión del TPMS emitido por cada célula ganglionar representada. (Velocidades que pueden ser leve y secuencialmente diferentes, aumentando desde el centro hacia la periferia retinal como ya se ha descrito). También se conoce, que existe al igual que en la vía Parvocelular, una fuerte proyección axonal hacia la capa 3B. Según recientes estudios anatómicos se ha observado que la capa 4B , proyecta profusamente sus axones hacia las franjas gruesas (Thick stripes) del área 18/V2 y hacia el área MT/V5 (Medial Temporal), otorgándole a esta última un papel muy importante en la percepción psicofísica del movimiento y en la regulación de los movimientos oculares de seguimiento y sacádicos (Newsome et al. 1985 ; Dursteler y Wurtz.1988; Yamasaki y Wurtz.1991; Pasternak y Merigan. 1994; Schiller y Lee. 1994; Orban et al. 1995). Además, estudios imagenológicos realizados en humanos, proveen fuerte evidencia de que la información relacionada con la percepción de movimiento es procesada principalmente en el área M.T. (Beauchamp et al.1997; Corbetta et al. 1990, 1991; Huk y Heeger. 2000; Sunaert et al. 2000). Dicho en palabras más acordes a los planteamientos sugeridos en líneas anteriores, las neuronas del área MT (las cuales están hemiretinotópicamente organizadas) son las directas responsables de coordinar y regular las diferentes velocidades de procesamiento perceptual de una imagen en las áreas 17/V1, 18/V2 y 19/V4 ( Proceso de Refresco), facilitando la percepción del movimiento de un objeto y los cálculos retroalimentadores para sostener dicha percepción a través de movimientos oculares compensatorios , los cuales, pueden ser de seguimiento ,sacada o de vergencia. De ésta manera, una imagen que se desplace sobre las retinas, a medida que mantiene su velocidad , la aumenta o disminuye, produce cambios en la velocidad de procesamiento de las neuronas del área MT , así, un objeto que se mueve rápido producirá un movimiento sacádico que ubicará las fóveas sobre un sector del mismo (generalmente un borde), una vez se realicen los cálculos asociativos para igualar la velocidad de los movimientos oculares con la del objeto, se establece una nueva velocidad de procesamiento en el área MT que producirá un movimiento suave de seguimiento hasta que el objeto desaparezca del campo visual, tal como sucede en los fenómenos optocinéticos. Por último, estos cambios en la velocidad de procesamiento del área MT, también serán necesarios para el posible reconocimiento de ese objeto mediante cálculos asociativos con las áreas de memoria visual. Tomando como base fisiológica para todas estas funciones, el mismo pulso generado que representa los bordes. Así, se perciben a nivel cortical nuevos cambios en la posición de una misma imagen que se desplaza sobre ambas retinas. Los sectores de npixeles acromáticos de alto contraste (basados en diferencias energéticas) que fueron proyectados en la capa 3B del área 17/V1, para la formación de la imagen base que concierne al procesamiento de los bordes, se siguen proyectando desde la capa 2 de dicha área hacia las áreas 18/V2, 19/V4 y hacia otras áreas de asociación visual, debido a la conocida fuerza con que son codificados, respetando las mismas coordenadas retinotópicas. Es decir, se produce una especie de " sombra de procesamiento de bordes “, lo que no es más, que múltiples copias de la señal inicial, desplegadas hacia otras neuronas que directamente las representan en las áreas 18/V2, 19/V4, para propósitos de percepción visual y en otras neuronas similares que generalmente son sensibles a la disparidad en distantes áreas de asociación del cerebro para propósitos de regulación de los movimientos oculares, de los procesos de memoria y de otros más de tipo cognitivo, que precisen de las aferencias visuales para su ejecución.
107
- PROYECCIÓN DE LA IMAGEN EN V2 Y V4 Los sectores de npixeles que representan los bordes, son redireccionados en las neuronas que conforman las interfranjas del área 18/V2 (Interstripes), produciendo un segundo mapeo de los sectores de procesamiento de bordes pero ya a manera de "sombra", lo cual sirve como guía o marco de reposicionamiento en coordenadas tridimensionales específicas de los sectores de npixeles de alto contraste cromático y de luminancia en las áreas 18/V2 y 19/V4. Así, las matrices de npixeles provenientes de los Blobs de la capa 3B del área 17/V1 , que representan codificación cromática y de luminancia, se redireccionan en las capas de neuronas que conforman las franjas delgadas del área 18/V2 ( Thin stripes ), para hacer parte de una segunda proyección, que se caracteriza por presentar sectores de npixeles cromáticos de alto contraste direccionados alrededor de los sectores de " Sombra" de aquellos npixeles que representan los bordes proyectados desde el área 17/V1. Los TPMS compuestos por matrices de npixeles de gran tamaño provenientes del sistema Magnocelular y proyectados desde el área 17/V1, son redireccionados hacia las franjas gruesas del área 18/V2 ( Thick stripes ) si ellos representan atributos cromáticos o de luminancia y hacia las interfranjas ( Interstripes) si están conformados por npixeles que representen " sombras de procesamiento de bordes" , donde son direccionados para hacer parte de la segunda imagen, posiblemente conservando la misma velocidad de procesamiento con la que se han venido transmitiendo desde la retina. Una vez se proyecta la segunda imagen en el área 18/V2, se efectúa un último procesamiento para la producción de la imagen final de la escena observada , que es direccionar las matrices de npixeles que representen atributos cromáticos y/o de luminancia en las neuronas del área 19/V4, cuya función posiblemente sea la de realizar las últimas combinaciones cromáticas entre npixeles, proceso que tal vez sea análogo al de las células horizontales de la retina, pero en un nivel más sofisticado, porque ya estas neuronas, tienen el reto de reproducir la imagen a color dentro de múltiples planos tridimensionales, facilitando la percepción de millones de colores, con muchas características de saturación y niveles de luminancia.(Figura No.7)
Figura. No.7.
Percepción
de la escena
observada
desde V1
hasta V4.
108
CONCLUSIÓN A través de esta teoría, se espera que el lector construya en su mente un nuevo concepto sobre el procesamiento de la información visual, y sobre cómo dicha información puede segmentarse en varios elementos para ser distribuida a lo largo y ancho de la corteza cerebral. El día en que los investigadores logren obtener los patrones exactos de codificación que conforman los TPMS será muy especial, pues los modernos sistemas neuroprotésicos visuales (prótesis epiretinal, prótesis visual cortical, etc.,), podrían ser mejorados hasta el punto de emular la visión natural con todos sus elegantes atributos.
REFERENCIAS Beauchamp M.S., Cox R.W., DeYoe E.A. Graded effects of spatial and featural attention on human area MT and associated motion processing areas. J. Neurophysiol. 1997; 78: 516-520. Corbetta M., Miezin F.M., Dobmeyer S., Shulman G.L, Peterson S.E. Attentional modulation of neural processing of shape, color, and velocity in humans. Science 1990; 248: 1556-1559. Corbetta M., Miezin F.M., Dobmeyer S., Shulman G.L., Peterson S.E. Selective and divided attention during visual discriminations of shape, color, and speed: functional anatomy by positron emission tomography. J. Neurosci. 1991; 11: 2383-2402. Dursteler M.R., Wurtz R.H. Pursuit and optokinetic deficits following chemical lesions of cortical areas MT and MST. J. Neurophysiol. 1988;60: 940-965. Erwin E., Baker F.H., Busen W.F., Malpeli J.G. Relationship between laminar topology and retinotopy in the rhesus lateral geniculate nucleus: results from a functional atlas. J Comp Neurol. 1999;407: 92-102. Gouras P. Identification of cone mechanisms in monkey ganglion cells. J. Physiol.1968 ;199: 533-547. Gouras P. Antidromic responses of orthodromically identified ganglion cells in monkey retina. J. Physiol. 1969; 204:407-419. Greine J.V., Weidman TA. Histogenesis of the ferret retina. Exp.Eye.Res.1981;33:315-332. Huk A.C., Heeger D.J. Task-related modulation of visual cortex. J. Neurophysiol. 2000; 83: 3525-3536. Julesz B. Foundations of cyclopean perception. Chicago: University of Chicago Press. 1971. Kaplan E. , Shapley R. M. The primate retina contains two groups of ganglion cells, with high and low contrast sensitivity. Proc. Natl. Acad. Sci. 1986 ; 83: 2755-2757. Karne A., Oakley D. M., Wong G. K., Wong R. O. Immunocytochemical localization of GABA, GABAA receptors, and synapse- associated proteins in the developing and adult ferret retina. Vis. Neurosci. 1997;14:1097-108. Lee B. B., Pokorny J., Smith V. C., Martin P. R., Valberg A. Luminance and chromatic modulation sensitivity of macaque ganglion cells and human observers. J. Opt. Soc. Am. 1990 ;7: 2223-2236. Meister M. Multineuronal codes in retinal signaling. Proc. Natl. Acad. Sci. 1996 ;93:609–614. Newsome W.T., Wurtz R.H., Dursteler M.R., Mikami A. Deficits in visual motion processing following ibotenic acid lesions of the middle temporal visual area of the macaque monkey. J. Neurosci. 1985; 5: 825-840. Neuenschwander S., Singer W. Long-range synchronization of oscillatory light responses in the cat retina and lateral geniculate nucleus. Nature. 1996;379:728-732
109
Orban G.A., Saunders R.C., Vandenbussche E. Lesions of the superior temporal cortical motion areas impair speed discrimination in the macaque monkey. Eur. J. Neurosci. 1995 ;7: 2261-2276. Osterberg G.Topography of the layer of rods and cones in the human retina. Acta Ophthal.1935; suppl. 6: 1-103. Pasternak T., Merigan W.H. Motion perception following lesions of the superior temporal sulcus in the monkey. Cereb. Cortex 1994; 4: 247-259. Penn A. A., Wong R. O., Shatz C. J. Neuronal coupling in the developing mammalian retina. J. Neurosci. 1994 ;14:3805-15. Schein S. J. Anatomy of macaque fovea and spatial densities of neurons in foveal representation. J. Comp. Neurol. 1988;269: 479-505. Schiller P.H., Lee K. The effects of lateral geniculate nucleus, area V4, and middle temporal (MT) lesions on visually guided eye movements. Vis. Neurosci. 1994 ;11: 229-241. Sunaert S., Van Hecke P., Marchal G., Orban G.A. Attention to speed of motion, speed discrimination, and task difficulty: an fMRI study. NeuroImage 2000 ;11: 612-623. Wässle H.,Boycott B.B. Functional architecture of the mammalian retina. Physiol.Rev. 1991; 71: 447-480. Yamasaki D.S., Wurtz R.H. Recovery of function after lesions in the superior temporal sulcus in the monkey. J. Neurophysiol. 1991;66: 651-673.
111
LA IMPORTANCIA DEL PROCESAMIENTO DE LAS CARAS
“…Estos incidentes se multiplicaron, provocando situaciones embarazosas, perplejidad, miedo...y, a
veces, situaciones cómicas. Porque el Doctor P. no sólo fracasaba cada vez más en la tarea de
identificar caras, sino que veía caras donde no las había: podía ponerse, afablemente, al estilo de
Mr. Magoo, a dar palmaditas en la cabeza de los hidrantes y a los parquímetros, creyéndolos
cabezas de niños; podía dirigirse cordialmente a las prominencias talladas del mobiliario y
quedarse asombrado de que no contestasen…”.
“…El Doctor P. actuaba, en realidad, exactamente igual que actúa una máquina. No se trataba sólo
de que mostrase la misma indiferencia que un ordenador hacia el mundo visual sino que (aún más
sorprendente) construía el mundo como lo construye un ordenador, mediante rasgos distintivos y
relaciones esquemáticas. Podía identificar el esquema (a la manera de un «equipo de
identificación») sin captar en absoluto la realidad…”
Los anteriores, son fragmentos del libro del Dr. Oliver Sacks: “El hombre que confundió a su mujer
con un sombrero”, que describen con algo de “jocosidad científica”, la profunda agnosia visual que
pueden presentar algunos pacientes después de sufrir lesiones traumáticas, vasculares o
tumorales. La dificultad en la identificación de los rostros y de otras características de los objetos
que están presentes en una escena, puede presentarse con mucha variabilidad de acuerdo a su
etiopatogenia.
Aunque exquisita, divertida y muy profunda, fue la descripción del Dr. Sacks de los innumerables
problemas perceptuales del “Dr.P”, resultó muy dramático para los que tuvimos la oportunidad de
leer su libro, enterarnos recientemente que fuese el mismo Dr. Sacks el que padecía este tipo de
Agnosia desde su infancia. Una entrevista con el Dr. Sacks refiriéndose al tema, puede ser
visualizada a través del escaneo del siguiente código QR que permite acceder al video-link:
En las siguientes líneas, el lector encontrará un corto documento que describe la Prosopagnosia
como una deficiencia funcional en el normal procesamiento, proyección o retroalimentación de
los bordes codificados de una cara.
112
Nos conocemos ?...Una breve mirada a la Prosopagnosia.
INTRODUCCIÓN
La Prosopagnosia denominada también “ceguera a las caras”, se refiere al déficit en el
reconocimiento de los rostros de personas que han sido previamente almacenados en las áreas de
memoria de corto o de largo plazo del cerebro. Esta situación con frecuencia lleva a las personas
que la padecen, a tener que enfrentar situaciones muy incómodas cuando no logran reconocer a
sus propios familiares o amigos por medio de la visión.
CLASIFICACIÓN
Al igual que en todos los tipos de Agnosias, la Prosopagnosia puede clasificarse en:
1-Prosopagnosia Aperceptiva: El paciente no distingue una cara de cualquier otro objeto del
campo visual (la mejor descripción que existe de este escaso tipo de pacientes, la realizó el Dr.
Oliver Sacks en su best seller “El hombre que confundió a su mujer con un sombrero”) (1).
2-Prosopagnosia Asociativa: El paciente no reconoce la cara de personas u animales previamente
almacenados en las áreas de memoria. Sin embargo, estos pacientes pueden discriminar la raza, la
edad aproximada y el género de la cara que observan durante las pruebas. La mayoría de casos de
Prosopagnósicos descritos por la literatura científica padece este tipo de déficit.
ANTECEDENTES EXPERIMENTALES
De Renzi y colaboradores en 1991, sometieron a 3 sujetos Prosopagnósicos a diferentes tests y
encontraron de acuerdo a la variedad de respuestas suministradas por cada uno de ellos, que el
principal problema de los Prosopagnósicos radica en los mecanismos de recuperación de la
información existente sobre una cara que ha sido percibida adecuadamente con anterioridad(2).
James Haxby y Colaboradores, reportaron que el procesamiento facial esta mediado por un
sistema neural complejo que consta de un subsistema central y un subsistema periférico: El
subsistema central incluye el Giro Occipital Inferior, el Giro Fusiforme Lateral y el Surco Temporal
Superior. El Giro Fusiforme Lateral se propuso dentro del trabajo de Haxby y Col., como el centro
cortical en donde se procesan aspectos invariantes de las caras mientras que al Surco Temporal
Superior se le adjudicó la función de procesar características cambiantes como los movimientos de
los ojos y de la boca de la cara que se observa.
El subsistema periférico comprende varias regiones cerebrales que incluye áreas del Lóbulo
Frontal, parietal y temporal, cuya activación depende de la información extraída de la cara
observada, facilitando su reconocimiento de acuerdo al contexto. Ejemplo: Cuando analizamos las
expresiones faciales relacionadas con las emociones (dolor, alegría, tristeza, etc.) (3).
113
LOCALIZACIÓN DE LAS ZONAS DE PROCESAMIENTO FACIAL
Si se correlacionan los resultados de las investigaciones realizadas en los años 90 por Sergent y
Col. (1992) (4), Haxby y Col. (1994) (5), Clark y Col. (1996) (6) y Haxby y Col. (1999) (7), se puede
apreciar una fuerte y constante activación en todos los mapeos imagenológicos de las regiones
correspondientes al Giro Fusiforme Lateral, al Giro Occipital Inferior y al Surco Temporal Superior
cuando los sujetos de experimentación observan una cara. Es de resaltar, que de acuerdo al
contexto en el que se percibe la cara, las activaciones pueden presentarse de manera bilateral
simétrica o asimétricamente. Cuando las activaciones son bilaterales asimétricas, las zonas
correspondientes al hemisferio derecho generalmente son las más activas (Ver Figura No.1 a y b).
Figura No. 1 A y B.
Localización de las regiones
corticales que procesan las
caras según las
investigaciones publicadas
por algunos autores.
114
ETIOLOGÍA DE LA PROSOPAGNOSIA: UNA CORTA HIPÓTESIS
Tal vez, el procesamiento de las caras se realiza principalmente en la vía ventral debido a la
prontitud requerida en la respuesta de reconocimiento (vía más corta) y a que también, se
necesita de cierto tiempo de foveación para establecer una relación directa y simultánea entre el
patrón de bordes que se construye y proyecta desde las áreas visuales y el patrón de bordes
almacenado en las áreas de memoria visual del Lóbulo Temporal. La activación ocasional de otras
áreas del cerebro como la Amígdala y la Corteza Cingulada, sugiere que algunos gestos de la cara o
la misma cara que se analiza, evoca en el observador emociones como el miedo, dolor, tensión,
alegría o tristeza.
Para exponer un ejemplo sobre como los bordes pueden suministrar información de la cara que se
observa, el lector puede apreciar la Figura No.2 y la Figura No.3. A las fotografías de estos dos
famosos personajes se les han extraído los bordes, el lector puede notar que la identificación del
personaje de la Figura No.2 es más fácil que la del personaje de Figura No.3, ya que nuestro
cerebro no está preparado para analizar caras dispuestas en forma invertida. Así, que para lograr
reconocer la cara del personaje de la Figura No.3, el lector deberá rotar la página 180°.
La dificultad para reconocer una cara invertida, radica según algunos investigadores en una
disminución en la respuesta de las neuronas que responden a las caras en el Giro Fusiforme
Lateral y en el Surco Temporal Superior, incrementándose en el Giro Occipital Inferior (7). Sin
embargo, de acuerdo a todos los conceptos estudiados hasta el momento en los capítulos
anteriores, este conflicto en el procesamiento de las caras invertidas, puede deberse a que las
caras que están almacenadas dentro de nuestra memoria, se codifican normalmente de forma
invertida, razón por la cual, no existe emparejamiento del código de bordes de la cara percibida
con el que está almacenado, porque ambos difieren el uno del otro, en 180o (11).
Algunos autores, observaron que la región correspondiente al Surco Temporal Superior presenta
más actividad cuando existen aspectos dinámicos en una cara como el movimiento de los labios al
Figura No.2.
Procesamiento
de los bordes
de un rostro
fácilmente
reconocible.
Figura No.3.Procesamiento de los bordes de
un rostro que no se puede reconocer a priori.
115
hablar, la gesticulación, los movimientos oculares o la rotación del rostro en cualquier plano. Esta
característica, tal vez se deba a la intervención de áreas como V5 (MT) cuando se hace necesario el
procesamiento del movimiento de los objetos dentro de una escena visual. Los trabajos realizados
por Malach y Col. en 1997, apoyan una conexión directa entre el área V5/MT y el área MTc (8). El
área MTc fue descrita por Kass y Morel en 1993, como densamente interconectada con el área FSTv
y con algunas áreas del Lóbulo Temporal (9). Un estudio más reciente, mediante resonancia
magnética tractográfica realizado por Marco Catani y Colaboradores, concluyó que existe una
conexión directa que se proyecta desde las áreas extraestriadas occipitales hacia las estructuras del
Lóbulo Temporal anterior, a través del Fascículo Longitudinal Inferior con tractos de fibras que
interconectan de forma rápida y efectiva las áreas V2 y V4 con las áreas del Lóbulo Temporal
anterior, con la corteza temporal lateral , el giro parahipocampal y la Amígdala. Esto facilita el
eficiente acceso de la información visual hacia las estructuras del Lóbulo Temporal y desde allí, de
forma recíproca hacia las áreas visuales occipitales (10). La anterior investigación, describe
claramente un sincronizado circuito retroalimentador esencial para el almacenamiento de nuevas
memorias, su contextualización con otros aspectos del estímulo visual que se perciben en el
momento y su correlación con los atributos ya almacenados del mismo (Figura No.4).
Las lesiones que afectan directamente las áreas de procesamiento neural adyacentes al Giro
Fusiforme Lateral, al Giro Occipital Inferior o al Surco Temporal Superior, pueden causar
Prosopagnosia de múltiples características. Lo mismo puede afirmarse sobre las lesiones en las
fibras de proyección o de retroalimentación que afecten el Fascículo Longitudinal Inferior. En la
literatura se ha descrito que las lesiones que comprometen significativamente las áreas
correspondientes al procesamiento facial del hemisferio derecho, son las causantes de los casos
más profundos de Prosopagnosia. Esto tal vez se deba a que en algunas áreas de memoria facial
del Lóbulo Temporal derecho se almacenan las representaciones globales de las caras ( caras
completas y no hemirepresentaciones) , ya que el hemisferio derecho contiene también varias
Figura No.4. Proyección
postero-anterior del
Fascículo Longitudinal
Inferior.
116
representaciones completas del campo visual en áreas de la vía ventral y dorsal que son necesarias
durante algunos tipos de procesamiento.
CONCLUSIÓN
Definitivamente, los casos más comunes de Prosopagnosia son del tipo asociativo, y su etiología radica principalmente en aquellas lesiones que afectan de manera directa las áreas de procesamiento facial del Giro Fusiforme Lateral, del Giro Occipital Inferior o del Surco Temporal Superior, especialmente del hemisferio derecho. También, las lesiones que afectan el Fascículo Longitudinal Inferior pueden producirla, ya sea en el proceso de almacenamiento del código de bordes de una cara cuando se lesionan las fibras de proyección, o en el proceso de recuperación del código de una cara almacenada con anterioridad, cuando se afectan las fibras de retroalimentación que interconectan las áreas visuales de asociación con las áreas de memoria localizadas en el Lóbulo Temporal.
REFERENCIAS
1. Sacks O. El hombre que confundió a su mujer con un sombrero. Muchnik Editores S.A. 1987: ISBN 84-7669-044-4.
2. De Renzi E., Faglioni P., Grossi D., Nichelli P. Apperceptive and associative forms of prosopagnosia. Cortex
1991; 27: 213-221.
3. Haxby J. V., Hoffman E. A. , Gobbini M. I. The distributed human neural system for face perception.T r ends in C o g n i t i v e S c i e n c e s 2000: 223-233.
4. Sergent, J. et al. Functional neuroanatomy of face and object processing. Brain 1992; 115: 15–36.
5. Haxby J. V. et al. The functional organization of human extrastriate cortex: a PET–rCBF study of selective
attention to faces and locations. J. Neurosci. 1994; 14: 6336–53.
6. Clark V. et al. Functional magnetic resonance imaging of human visual cortex during face matching: a comparison with positron emission tomography. Neuroimage 1996, 4: 1–15.
7. Haxby J.V. et al. The effect of face inversion on activity in human neural systems for face and object perception. Neuron 1999; 22:189–199.
8. Malach R., Schirman T. D., Harel M., Tootell R. B. H., Malonek D. Organization of Intrinsic Connections in Owl Monkey Area MT. Cerebral Cortex 1997 ; 7:386–393.
9. Kaas J.H., Morel A . Connections of visual areas of the upper temporal lobe of owl monkeys: the MT crescent and dorsal and ventral subdivisions of FST. J. Neurosci. 1993; 13 : 534–546.
10. Catani M., Jones D. K., Donato R. ,Ffytche D. H. Occipito-temporal connections in the human brain. Brain 2003 ; 126: 2093-107.
11. Giraldo D. (2008) Neuronas sensibles a la disparidad y contralateralización funcional del cerebro: Bases de un
cerebro al revés. Franja Visual 97:44-46
118
LAS NEURONAS ESPEJO Y SU CÓDIGO
Si todos los tipos de Neuronas del cerebro humano fueran sometidas a un juicio, las Neuronas Espejo serían las primeras en pasar al estrado para presentar su defensa. Se les acusa de ser las directas responsables en facilitar las respuestas motoras aprendidas por medio de la visión en cualquier individuo. Entre sus delitos, se encuentran: La participación en actividades imitativas negativas que van desde el asir con la mano cosas que no pertenecen al individuo, hasta la repulsiva situación de quitar la vida a un ser vivo de su misma especie o de otras con diversos instrumentos. Sin embargo, tienen para su defensa, que son también responsables de actividades imitativas positivas que permiten en el mismo individuo, el aprendizaje de numerosas conductas que garantizan la supervivencia de la especie como: El trabajo, el deporte, el estudio y las relaciones interpersonales. Después de mucha deliberación, se sentenció que Las Neuronas Espejo son inocentes. Las Neuronas Espejo, funcionan como simples traductoras automáticas de aquellas señales codificadas que representan los bordes tridimensionales desde el área 17/V1, en señales de actividad motora hacia las coordenadas tridimensionales donde esos bordes se representan dentro de sus campos receptivos.
El lector puede observar en el gráfico, el flujo de información que representa la codificación de bordes 3D desde V1 hasta S1 y M1, en el objetivo de producir las respuestas motoras necesarias para activar las neuronas del núcleo del Hipogloso (XII par craneal) que permiten sacar la lengua en el primate neonato, dentro de un contexto plenamente imitativo. Fuente: Gross L. (2006). Evolution of Neonatal Imitation. PLoS
Biology Vol. 4: 9. En las siguientes líneas, establezco la posible relación que existe entre la codificación de bordes estereoscópicos ejecutado por la neuronas sensibles a la disparidad, con la actividad visuomotora detectada por varios investigadores en las denominadas “Neuronas Espejo” dentro del cerebro humano.
119
NEURONAS ESPEJO Y VISIÓN: Una relación inseparable
INTRODUCCIÓN
Desde hace 18 años, se conoce de la existencia de un tipo de neuronas que tiene la capacidad de activarse cuando un individuo observa a otro ejecutar una acción o cuando el individuo ejecuta la misma acción por su propia cuenta, estamos hablando de las Neuronas Espejo. Las Neuronas Espejo, fueron descubiertas por 5 investigadores en Italia hacia el año 1992 por pura y simple coincidencia (como han sido algunos de los hallazgos más importantes en la historia de la ciencia), cuando realizaban estudios neurofisiológicos de las neuronas de la corteza motora en primates. Los investigadores, se percataron de la presencia de este grupo de neuronas polimodales, al verificar que se activaban cuando el mono inmovilizado observaba las acciones que ellos realizaron durante el experimento. De ahí en adelante, una cascada de trabajos sobre el tema se ha publicado, cautivando el pensamiento de destacados científicos que calificaron el descubrimiento de las Neuronas Espejo como uno de los más relevantes de las últimas décadas para la neurociencia.
DISTRIBUCIÓN EN LA CORTEZA CEREBRAL Las Neuronas Espejo fueron localizadas inicialmente en el área F5 del macaco, en estudios posteriores, se han ubicado en otras áreas del Lóbulo Frontal y del Lóbulo Parietal, de este último, se ha observado que sus neuronas poseen funciones homólogas a las que están ubicadas en las áreas premotoras de la corteza Frontal. En otras palabras, las Neuronas Espejo de la corteza Parietal tienen la capacidad de codificar los objetivos de una actividad motriz y no la de ejecutar los movimientos necesarios para alcanzar dichos objetivos (1), (2). También se han encontrado neuronas con la característica de disparar señales cuando se observa actividad en otro individuo en el surco temporal superior que podrían catalogarse dentro del grupo de Neuronas Espejo, pero carecen de la cualidad de ejecutar planes motores. Por tal razón, Rizzolatti y colaboradores no incluyeron este grupo de neuronas de la corteza temporal en su más reciente trabajo sobre el sistema de Neuronas Espejo (mirror system) (3) (Figura No.1).
Figura No.1. Grupos
de Neuronas que
conforman el Sistema
Espejo repartidos por
todo el cerebro
humano.
120
El sistema de Neuronas Espejo incluye tanto las áreas premotoras de la corteza Frontal como las áreas Parietales, y todas ellas cuentan con la característica de presentar una organización somatotópica (4). Esto quiere decir, que las acciones motoras están representadas de acuerdo a la parte del cuerpo que activan, es así, como los movimientos que afectan la cara, los ojos y la boca están representados rostralmente, los que controlan los brazos y la mano caudalmente, y los que controlan las piernas y pies dorsalmente (Figura No.2).
Figura No.2. Hemirepresentación Somatotópica del Hemicuerpo Derecho en el Hemisferio Izquierdo del cerebro humano.
También se han encontrado mediante Resonancia Magnética Funcional, grupos de neuronas que pueden hacer parte del sistema, en áreas corticales que regulan el comportamiento visceromotor relacionado con las emociones (5), (6). De esta manera, cuando un individuo siente en sí mismo, u observa emociones en otro causadas por un estímulo desagradable o que represente dolor, se presenta activación de dos zonas especialmente: La Corteza Cingulada y la Ínsula. Respecto al anterior experimento, para los científicos fue sorprendente que dichas regiones se activaran indistintamente, tanto cuando el sujeto de experimentación recibía los estímulos directamente sobre su propio cuerpo, como cuando observaba las respuestas emocionales que producían los estímulos en otro individuo. Cuando se estimula eléctricamente la región de la Ínsula en el mono, se producen movimientos en varias partes del cuerpo acompañados de diversas respuestas visceromotoras (7). En los humanos dichas respuestas también se han encontrado (8). También se encontró, que el sistema conformado por las Neuronas Espejo cuenta en el área de Broca con un subgrupo especializado en traducir los fonemas procesados por las áreas auditivas que implican actividades en los programas motores necesarios para ejecutarlas (9).
121
VISIÓN Y NEURONAS ESPEJO
La relación existente entre las Neuronas Espejo y la visión es muy estrecha, tanto es así, que sin las aferencias visuales el funcionamiento del sistema espejo se vería comprometido para el aprendizaje motor y el cognitivo social, siendo este último el que facilita las interacciones con individuos de nuestra misma especie y aún con los de especies inferiores. Desde hace algunos años se conoce la importancia de la visión en la programación de la motricidad (10) y en el desempeño social del individuo, pues la utilización de las señales procesadas por las neuronas visuales en el aprendizaje de numerosas conductas siempre se hace imprescindible. Por ello, se habla actualmente de que el Autismo se debe básicamente a fallas en el sistema conformado por las Neuronas Espejo, llevando a que las personas autistas casi siempre presenten un déficit en la representación cortical de las acciones dirigidas hacia una meta específica, tanto cuando las acciones tratan de ejecutarlas por su propia cuenta, como cuando observan que otra persona las realiza. En los últimos años se ha llegado al consenso de que los estímulos visuales, dominan sobre los somatosensitivos en las funciones del cerebro humano por las siguientes razones: 1- Los estímulos retroalimentadores visuales pueden incrementar la excitabilidad motora cortical
y espinal, cuando un individuo ve a otro moverse (11). 2- La experiencia visual por sí sola, evoca experiencias somatosensoriales e incrementa la
sensibilidad táctil (12).
LOS BORDES: CÓDIGO BÁSICO DEL SISTEMA ESPEJO ? En anteriores capítulos, se ha descrito la generosa distribución de grupos de neuronas sensibles a la disparidad tanto en áreas de la vía dorsal (red occipital-parietal-frontal), como en áreas de la vía ventral (red occipital-temporal), también se expuso la idea de que ellas tal vez funcionen como “proyectores holográficos” que remapean constantemente el campo visual tridimensional y los objetos incluidos en él. Igualmente, se hipotetizó acerca de que las señales que representan los bordes sean la base de todas las multirepresentaciones tridimensionales del espacio visual (13). Existe la posibilidad de que muchos de los grupos neuronales con propiedades especulares descritos por Giacomo Rizzolatti y colaboradores, sean los mismos grupos clasificados en trabajos anteriores como neuronas sensibles a la disparidad. El anterior enunciado puede sustentarse en algunos experimentos que describen el campo receptivo de estas neuronas con respuestas bimodales (visuales y motoras), como campos que funcionan centrados en diversas partes del cuerpo, favoreciendo las interacciones de miembros del cuerpo tales como las manos, los brazos y la boca con objetos que se encuentren dentro del rango de alcance del individuo en el entorno tridimensional en el que se mueve. Para el sistema espejo, se habla de un nuevo tipo de remapeo del espacio tridimensional que no se hace centrado en la fóvea como en las etapas iniciales del procesamiento visual (V1-V2-V3-V4-V5), sino que se centra en una parte específica del cuerpo, y al parecer, comienza a estructurarse desde las áreas parietales con el fin de proyectar información directamente hacia las áreas frontales para ejecutar secuencias motoras específicas. Si se correlacionan los resultados de los trabajos experimentales de Gulyás y Roland (14) sobre las áreas corticales y cerebelares que procesan la disparidad, con el de Buccino y Colaboradores (15) sobre las áreas corticales y cerebelares implicados en el sistema espejo, se puede encontrar que las siguientes regiones
122
anatómicas se activan tanto para la representación tridimensional del entorno observado, como durante la observación de acciones motoras imitativas: 1- Surco Intraparietal. 2- Lóbulo Parietal Superior. 3- Circunvolución Frontal Medial. 4- Cerebelo. La implicación de las mismas poblaciones celulares en actividades distintas, indica la múltiple función que desempeñan los grupos de neuronas que las conforman. De una parte, las neuronas tienen la capacidad de representar el espacio tridimensional del campo visual y los objetos incluidos en él, y de otra, facilitan la planeación y ejecución de programas motores que permitan interactuar con los mismos. En pocas palabras, podemos resumir que algunos grupos neuronales que conforman el sistema espejo, pueden ser los mismos que procesan la disparidad más allá de las áreas visuales occipitales. Esta idea se puede apoyar en una reciente publicación de Olivier Joly. En este estudio experimental se encontró que muchas neuronas del área F5a del macaco tienen la capacidad de reconstruir estructuras volumétricas a partir de la disparidad. Lo cual sugiere que el área F5a procesa formas tridimensionales completas y hace parte de una red funcional, junto con las áreas Inferotemporal (IT) y el área Anterior Intraparietal (AIP), que analiza la información de la forma tridimensional estereoscópica y establece su potencial uso en el control visual de las maniobras de prensión (16) .
CONCLUSIÓN Al parecer, algunos grupos neuronales que procesan la disparidad en el cerebro humano, también pueden procesar los programas motores y cognitivos que regulan los mecanismos de imitación. La superposición de ambos sistemas (estereoscópico y espejo) comprobado por la similitud en la localización anatómica de las poblaciones neuronales que se activan, supone la utilización de un código único de procesamiento que muy probablemente sean las señales que representan los bordes codificados tridimensionalmente desde V1, como se puede concluir del trabajo de Olivier Joly y su grupo (16). Así, un nuevo trabajo apoya la hipótesis presentada desde hace algunos años de que las señales que representan los bordes tridimensionales sean la base de los procesos perceptuales, motores y cognitivos por aferencias visuales en el cerebro humano (13). Respecto al sistema espejo, quedan muchas situaciones experimentales por describir como las interacciones con las áreas de memoria del Lóbulo Temporal, en el cual, también existen grupos neuronales con algunas características espejo. También, se espera un mayor estudio de las etapas preprocesales de las señales que parten desde las áreas Occipitales hacia las Parietales y Temporales, que apoyen la codificación de las señales que representan los bordes estereoscópicos como código básico del sistema de Neuronas Espejo.
BIBLIOGRAFIA 1- Rizzolatti G. , Craighero L. The mirror-neuron system. Annu Rev Neurosci . 2004; 27: 169–192. 2- Fabbri-Destro M., Rizzolatti G. The mirror system in monkeys and humans. Physiology. 2008; 23:171–179. 3-Rizzolatti G., Fabbri-Destro M. , Cattaneo L. Mirror neurons and their clinical relevance . Nature Clin Pract . 2009 ; 5:24-34. 4-Buccino G. et al. Action observation activates premotor and parietal areas in a somatotopic manner: an fMRI study. Eur J Neurosci 2001 ;13: 400–404. 5- Gallese V. et al. A unifying view of the basis of social cognition. Trends Cogn Sci 2004; 8: 396–403.
123
6- Singer T. The neuronal basis and ontogeny of empathy and mind reading: review of literature and implications for future research. Neurosci Biobehav Rev. 2006 ;30: 855–863. 7- Frontera J.G. Some results obtained by electrical stimulation of the cortex of the island of Reil in the brain of the monkey (Macaca mulatta). J Comp Neurol 1956 ; 105:65–394. 8- Penfield W. , Faulk M.E. The insula; further observations on its function. Brain 1955 ; 78: 445–470. 9- Fadiga L. et al . Speech listening specifically modulates the excitability of tongue muscles: a TMS study. Eur J Neurosci. 2002 ;15: 399–402. 10- Graziano M.S.A. Where is my arm? The relative role of vision and proprioception in the neuronal representation of limb position. Proc Natl Acad Sci USA 1999; 96:10418–21. 11- Funase K., Tabira T., Higashi T., Liang N., Kasai T. Increased corticospinal excitability during direct observation of self-movement and indirect observation with a mirror box. Neurosci Lett. 2007; 419:108–12. 12- Ro T., Wallace R., Hagedorn J., Farne A., Pienkos E. Visual enhancing of tactile perception in the posterior parietal cortex. J Cog Neurosci. 2004 ; 16:24–30. 13- Giraldo D. Teoría del contraste espectral acromático: Codificación, decodificación , análisis y proyección como base neural del procesamiento visual humano. Franja Visual 2005; 83:9-13. 14- B. Gulyás, P.E. Roland. Binocular disparity discrimination in human cerebral cortex:Functional anatomy by positron emission tomography Proc. Nati. Acad. Sci. USA 1994 ; 91: 1239-1243. 15- Buccino G., Vogt S., Ritzl A., Fink G., Zilles K., Freund H.J., Rizzolatti G. Neural Circuits Underlying Imitation Learning of Hand Actions: An Event-Related fMRI Study. Neuron 2004 ;42: 323–334. 16- Joly O., Vanduffel W., Orban G.A . The monkey ventral premotor cortex processes 3D shape from disparity. Neuroimage 2009 ;47:262-72.
125
LOS BORDES: SEÑALES REHABILITADORAS
Las señales que representan los bordes estereoscópicos, también pueden relacionarse con la rehabilitación
motora. Como se explicó en el capítulo anterior, su indispensable participación en la activación de todas las
áreas cerebrales que contienen Neuronas Espejo para el aprendizaje de secuencias motoras, facilita también
su utilización en el objetivo de “despertar” conexiones que no son utilizadas con frecuencia, durante los
procesos de rehabilitación de una extremidad afectada por una parálisis, o que haya sido amputada y esté
causando el “síndrome del miembro fantasma”.
Si a estas alturas, el lector ha leído y establecido dentro de su mente un mapa conceptual sobre la gran
importancia que posee la codificación de señales que representen los bordes dentro del cerebro humano, a
futuro podrá diseñar y construir ayudas tan sencillas pero con tanta profundidad neurofisiológica, como la
terapia de la caja con espejo creada por el Dr. Ramachandran.
Este procedimiento terapéutico se debe realizar de forma intensiva. El tiempo de trabajo en cada sesión
deberá ser de 15 - 45 minutos al día (dependiendo del grado de alteración o parálisis), 4 a 7 veces por
semana y durante 5 a 8 semanas, para facilitar la recuperación de habilidades motoras, alteraciones
sensotáctiles y para disminuir el dolor de la extremidad. Los ejercicios que se ejecutan, deben ser
movimientos sencillos y repetitivos de la mano, del brazo o de la pierna. Al paciente se le solicita que intente
realizarlos con ambas extremidades, mientras observa únicamente la imagen reflejada en el espejo. Como
requisitos para trabajar con el espejo, los pacientes deberán estar en capacidad de comprender
instrucciones simples, sostener la atención sobre el ejercicio en un ambiente muy tranquilo y sobre todo,
colaborar activamente.
Todavía recuerdo una tierna anécdota, en la que el padre de un niño de 9 años que padecía retraso en su
motricidad a causa de un trauma cerebral a muy temprana edad, me comentó sobre los inconvenientes que
tenía el niño sobre todo en su locomoción y equilibrio. Sin estar dentro de mi campo de acción profesional,
pero como conocedor de este sistema de retroalimentación motora por aferencias visuales (que por cierto
ningún otro profesional le había sugerido hasta el momento), sentí la responsabilidad de exponerle a este
padre, la metodología del tratamiento con el espejo tanto para rehabilitar su extremidad superior como
para la inferior y algunas secuencias motoras para practicar durante las sesiones. Pasó el tiempo, y a los seis
meses, el padre apareció en mi consultorio con una gran sonrisa en su rostro, unos pastelillos en su mano
derecha y un refresco en la izquierda, manifestándome su agradecimiento porque su hijo había mejorado
sus habilidades motoras en gran manera con la terapia de retroalimentación por aferencias visuales con
espejos.
El mismo Dr. Ramachandran, explica en un corto video las conclusiones de sus investigaciones. Para acceder
al video, el lector debe escanear el siguiente código con un Smartphone:
Asimismo, comparto con el lector un documento que relaciona la codificación de bordes con la
neurorehabilitación por imágenes motoras a través del sistema de Neuronas Espejo.
126
IMÁGENES MOTORAS: BASE DE LA NEUROREHABILITACIÓN POR
AFERENCIAS VISUALES.
INTRODUCCIÓN
La asombrosa recursividad del cerebro humano para utilizar las aferencias visuales como
coadyuvantes en la rehabilitación de la motricidad perdida por un ser humano después de una
afección, está más que demostrada. La influencia de la visión en la programación y
reprogramación de los movimientos corporales, es uno de los temas más estudiados por la
Neurociencia en la actualidad. En el presente capítulo, se hará una breve revisión sobre el
relevante papel que tiene el sistema visual sobre la programación del sistema motor. Este tema se
expone con la finalidad de que los Profesionales de la Salud Visual se apropien de él y adquieran
un nivel de conocimientos avanzados, que les permita aconsejar sobre estas nuevas medidas
terapéuticas, que en buena medida servirán para la recuperación funcional de aquellos pacientes
afectados en su motricidad, que muchas veces llegan a nuestra consulta sin ninguna orientación al
respecto.
IMÁGENES MOTORAS
Según la literatura científica moderna, las imágenes motoras pueden definirse como un estado
dinámico durante el cual, la representación de una actividad motora específica se procesa
internamente dentro de las áreas de memoria de trabajo sin la manifestación abierta de actividad
eferente, con la característica adicional, de que son gobernadas por los mecanismos de control
motor central 1.
En palabras más sencillas, las imágenes motoras son procesos cognitivos, en los cuales, un sujeto
imagina que ejecuta un movimiento sin llegar a contraer alguno de los músculos de su cuerpo 2.
Para procesar una imagen motora, indiscutiblemente se requiere de la intervención del grupo de
neuronas que conforman el sistema espejo, pues cuesta trabajo imaginar la ejecución de un
movimiento si no se tiene previo conocimiento visual y/o motor del mismo. Lo anterior sugiere,
que para la construcción de un proceso motor imaginario es necesario que se haya internalizado
por medio de la visión como primera medida, para que su posterior codificación dentro de un
modelo interno sea posible. Sin embargo, los procesos motores también pueden programarse en
modelos imaginarios con el uso de sólo aferencias somatosensitivas, como sucede en el caso de
aquellos invidentes a los que se les enseña a manipular un objeto. Por ello, Theo Mulder ha divido
las imágenes motoras en dos tipos: Imágenes motoras kinestésicas o propioceptivas e imágenes
motoras visuales. Durante la construcción de las imágenes motoras kinestésicas o propioceptivas,
el sujeto “siente” que él está ejecutando un movimiento con todas sus consecuencias a nivel
sensorial. Durante la construcción de las imágenes motoras visuales, el sujeto se autovisualiza
desarrollando el movimiento requerido 2.
Desde los trabajos realizados por Clark en los años 60, se sabe que el aprendizaje de nuevas
destrezas motoras es más efectivo si se combina la programación de imágenes motoras
127
kinestésicas y visuales con la práctica física de las mismas 3. Investigaciones más recientes,
concluyeron que la activación sistemática de grupos de Neuronas Espejo en las cortezas parietal y
premotora por medio de procesos de observación - ejecución, puede utilizarse en la consecución
de cambios funcionales en la corteza cerebral que permitan el restablecimiento de las destrezas
manuales perdidas tras un accidente cerebrovascular 4.
En el capítulo anterior, se describió al sistema espejo como un grupo de neuronas
estratégicamente distribuidas a lo largo y ancho de la corteza cerebral que posee función
polimodal, es decir, que son capaces de procesar información que proviene del sistema visual
(señales que representan bordes estereoscópicos) y de traducirla en programas motores
instantáneamente ejecutables para la corteza somatosensorial primaria (S1) y la motora primaria
(M1) 5.
Esta red de neuronas polimodales que conforman el sistema espejo, puede utilizarse en la
rehabilitación funcional de personas que hayan sufrido alteraciones en su capacidad motora
debido a cualquier etiología. La gran capacidad que posee cada una de las neuronas de conectarse
con otras localizadas en regiones cercanas y lejanas del cerebro, favorece la reprogramación con la
ayuda de la visión de las destrezas motrices en nuevas regiones corticales que puedan ejercer los
mecanismos de reemplazo de las funciones perdidas. Esta capacidad ya fue explorada por el
Neurólogo y Científico Vilayanur S. Ramachandran en sus estudios sobre los mecanismos de
rehabilitación por medio de retroalimentación visual , en aquellos casos en los cuales los pacientes
acusan de dolor del miembro fantasma , utilizando un artefacto de fácil manufactura llamado “la
caja con espejo” (the mirror box). Aunque la caja con espejo se utilizó en un comienzo con fines
terapéuticos para aliviar los episodios de dolor que sufren los amputados, en los últimos años se
está utilizando en la rehabilitación de personas con hemiparálisis causadas por accidentes
cerebrovasculares o post-traumáticos 6,7.
LA CAJA CON ESPEJO
La caja con espejo es un dispositivo muy sencillo que consta de una caja rectangular con las
dimensiones suficientes para introducir la extremidad paralizada y la funcional, separadas entre sí
por un septum que es el espejo, éste último debe estar ubicado de forma que en él se refleje la
extremidad funcional, ocupando aquel reflejo el mismo espacio visual de la extremidad parética.
La idea es que el paciente ubique su cabeza levemente desplazada hacia el lado de la extremidad
funcional y desde allí, debe fijar su atención en el reflejo de la extremidad funcional, con la cual
deberá realizar una secuencia de ejercicios de estiramiento, flexión y prensión. Con esta actividad
retroalimentadora combinada de la visión y de la motricidad, se busca que el paciente logre
reprogramar por medio de su sistema de Neuronas Espejo los procesos motores perdidos en las
zonas corticales y/o subcorticales que resultaron afectadas por la patología. Para efectos prácticos,
puede bastar un simple espejo lo suficientemente largo para cubrir la extremidad parética y lo
suficientemente ancho para permitir la observación del reflejo de los ejercicios que se realizan con
la extremidad funcional. Ver Figura No. 1.
128
FIGURA No.1. Imagen especular de la extremidad funcional y de su movimiento en el espejo.
POSIBLE ACTIVIDAD NEURAL GENERADA
CON EL USO DE LA CAJA CON ESPEJO
Al utilizar la caja con espejo, se puede esperar en el cerebro de los pacientes la generación de la
siguiente actividad neuronal:
Las aferencias visuales (señales que representan bordes estereoscópicos) que provienen de la
imagen virtual de la extremidad funcional reflejada en el espejo, se procesan en su mayoría en el
hemisferio afectado. Así, recorriendo de posterior a anterior, las señales viajan desde las áreas
visuales (V1, V2, V3, V4) hasta la corteza parietal posterior para la contextualización del plan
motor en el entorno tridimensional. De forma paralela, las aferencias somatosensitivas
provenientes de la extremidad funcional son conducidas a través de las conexiones callosales
desde el hemisferio sano hasta los campos receptivos de las Neuronas Espejo polimodales de la
corteza parietal posterior del hemisferio afectado, en ellas convergen tanto la información visual
como la somatosensitiva. En este momento, se estructura un nuevo programa que puede
estimular grupos intactos de neuronas motoras que tienen la capacidad de procesarlo y ejecutarlo
en las áreas motoras frontales.
129
De esta manera, se cumple con dos de los prerrequisitos esenciales que permiten la programación
de un acto motor:
Que existan señales que representen el acto motor visualmente y permitan codificarlo
en nuevas coordenadas tridimensionales centradas en la cabeza del sujeto o en alguna
extremidad.
Que existan señales propioceptivas sincronizadas con las visuales que procedan de la
piel, músculos y tendones de las extremidades implicadas en el acto motor, las cuales
con el tiempo permitirán continuos ajustes en las ejecuciones del mismo.
Con los procedimientos que se realizan en la caja con espejo, se pretende “engañar” al cerebro
con la observación de un movimiento aparente de la extremidad paralizada, que provea la
suficiente retroalimentación para despertar conexiones neuronales alternativas en pro de la
rehabilitación funcional completa. Ver figura No.2 a y b.
Figura No. 2 a y b. Secuencia retroalimentadora de las señales que representan los bordes que viajan desde V1
hasta S1 y M1, con la finalidad de rehabilitar la función motriz de la extremidad afectada.
130
CONCLUSIÓN
La utilización de imágenes motoras en la rehabilitación de un paciente, es imprescindible en el
proceso de reprogramación de las secuencias motrices perdidas. Es sugerible, de acuerdo a la
buena cantidad de pacientes que acuden a consulta con patología cerebral antigua o reciente, que
los especialistas de la salud visual conozcan sobre el tema, para que a futuro, sean promotores de
estos nuevos procedimientos terapéuticos, que no obstante su baja tecnología, aprovechan al
máximo la capacidad que poseen las neuronas polimodales del cerebro humano para restablecer
las funciones perdidas tras un accidente cerebrovascular , usando para tal fin, la armoniosa
convergencia de señales somatosensitivas y visuales en las áreas motoras frontales a través del
sistema de Neuronas Espejo.
REFERENCIAS
1- Jeannerod M. Mental imagery in the motor context. Neuropsychologia. 1995; 33:1419–32.
2- Mulder Th. Motor imagery and action observation: cognitive tools for rehabilitation J. Neural Transm. ; 2007 114:
1265–78.
3- Clark L.V. Effect of mental practice on the development of a certain motor skill. Res Quart. 1960; 31: 560–569.
4- Buccino G., Solodkin A., Small S.L. Functions of the mirror neuron system: implications for neurorehabilitation. Cognit
Behav Neurol. 2006 ; 19:55–63.
5- Giraldo D. Neuronas Espejo y visión: Una relación inseparable. Franja Visual. 2009; 107:24-26.
6- Ramachandran VS, Rogers-Ramachandran D, Cobb S. Touching the phantom limb. Nature 1995; 377:489–490.
7- Ramachandran VS, Rogers-Ramachandran D. Synaesthesia in phantom limbs induced with mirrors.Proceedings of the
Royal Society of London, B: Biological Sciences 1996; 263: 377–386.
132
SEÑALES QUE PERMITEN MULTIPROGRAMACIÓN MOTORA
El caso de A.I. es muy interesante, porque permite concluir que existe un código único de
programación tanto para los movimientos oculares como para los movimientos de la cabeza,
cuando se sigue, se fija o se busca un objeto dentro del espacio tridimensional. Esto supone
también, la codificación de los objetos presentes en el campo visual dentro de un marco de
coordenadas tridimensionales principalmente centrado en la fóvea, es decir retinocéntricas.
En el siguiente cuadro, se resumen las funciones análogas a las de los músculos extraoculares que
cumplen algunos músculos del cuello en el caso de la paciente A.I.:
MÚSCULOS DEL CUELLO
FUNCIÓN
MÚSCULOS
EXTRAOCULARES
FUNCIÓN
ESPLENIOS
Elevación de la cabeza.
RECTOS SUPERIORES
Rotan el ojo hacia
arriba.
ESTERNOCLEIDEOMASTOIDEOS , OBLICUOS Y COMPLEXOS
Rotación de la cabeza hacia el lado opuesto
RECTOS MEDIOS Y RECTOS LATERALES
Rotan el ojo
horizontalmente.
RECTOS ANTERIORES, RECTOS LATERALES, RECTOS LARGOS.
Flexión de la cabeza
RECTOS INFERIORES
Rotan el ojo hacia abajo.
Nuevamente, las señales que representan los bordes estereoscópicos se hacen presentes como el
mismo código que utiliza el cerebro tanto para programar los movimientos oculares, como para
programar los movimientos de la cabeza, en el objetivo de sostener la fijación y la percepción de la
forma tridimensional de objetos estáticos o que se mueven.
Las muy conocidas “Posiciones compensatorias de la cabeza”, que tanto se describen en Ortóptica,
no son más que una reprogramación causada por la percepción estereoscópica global de toda la
planta Oculomotora y Cefalomotora, unificándolas, con el fin de sostener una correcta percepción
tridimensional de los objetos. Para lograr todo lo anterior, el Cerebro busca alinear las fóveas de
ambos ojos con la representación foveal en V1, convirtiendo coordenadas retinocéntricas
tridimensionales en cefalocéntricas tridimensionales.
Expongo en las siguientes líneas el excepcional caso de A.I., así mismo, correlaciono mediante una
breve explicación, la codificación de bordes estereoscópicos con los movimientos de cabeza que
emulan de manera casi perfecta, los movimientos oculares de un individuo normal.
133
EL REEMPLAZO PERFECTO !
El fascinante caso de una mujer Inglesa llamada A.I., revela la gran capacidad del cerebro
humano para suplir una deficiencia motriz.
INTRODUCCIÓN
Los seres humanos poseen la capacidad de realizar movimientos oculares a voluntad durante la
exploración visual de cualquier escena. Sin embargo, existen personas que no pueden hacerlo de
la manera convencional, A.I. es una de ellas. Esta mujer residente en Inglaterra y con 45 años de
edad en la actualidad, sufre de una oftalmoplegía total causada por una fibrosis congénita de la
musculatura extraocular. Esta situación, hace de A.I. una persona incapaz de ejecutar movimientos
oculares normales, sin embargo, ella puede compensar esta deficiencia moviendo su cabeza y lo
mejor de todo, es que A.I. realiza esta sustitución con una precisión asombrosa. En las siguientes
líneas, se estudiará brevemente la brillante estrategia del cerebro para reemplazar la función de
los músculos extraoculares durante la ejecución de movimientos sacádicos y de seguimiento.
ANTECEDENTES EXPERIMENTALES
La destreza de A.I. para emular la actividad oculomotora con la musculatura del cuello, ha sido
estudiada por varios investigadores. Entre ellos, se han destacado los trabajos de Iain D. Gilchrist y
Colaboradores 1. Gilchrist y su grupo, encontraron que no obstante la total deficiencia de A.I. para
mover sus globos oculares, su desempeño visual para la ejecución de movimientos sacádicos era
muy eficiente, pues comparándola con los sujetos de control, A.I. era capaz de reducir el número
de foveaciones durante una actividad visuomotora, mediante el complejo reemplazo de las
funciones oculomotoras por una estrategia cefalomotora que permite el desplazamiento de la
mirada en los dos ejes principales de rotación de la cabeza. Aunque los investigadores observaron
que los movimientos sacádicos que efectuaba A.I. con la cabeza demoraban casi el doble de
tiempo de ejecución que los de los controles, se llegó a la conclusión que la eficacia de A.I. para
conseguir las metas sacádicas del experimento era similar a la de los controles 1,2.
REEMPLAZO MOTOR
Que el cerebro tenga la capacidad de echar mano de la musculatura que controla la cabeza para
hacer que la percepción visual funcione y por ende los actos motores se puedan programar y
ejecutar, no es un secreto para los profesionales de la salud visual. Es conocido, que el encéfalo
utiliza los músculos del cuello para inclinar o rotar la cabeza en casos de nistagmus, cuando busca
la posición de bloqueo de las oscilaciones, o cuando busca conseguir Estereopsis fina en los casos
de estrabismo. En el caso de A.I., el cerebro sustituye sin problema las funciones de la
musculatura extraocular, pues la forma semiesférica de la cabeza permite los movimientos de
rotación en el plano horizontal y vertical, de manera eficiente. Los movimientos torsionales, tal vez
representen un problema porque pueden causar diplopia, pero en la literatura no se detalla el
estudio de tal circunstancia en sujetos como A.I. Ver figura No.1.
134
Figura No.1. Reconstrucción por medio de RMN 3D de aquellos músculos del cuello que pueden emular la función de
los músculos extraoculares.
El posible mecanismo de programación de los movimientos cefalomotores para el desplazamiento
de la mirada en A.I., para varios autores es el mismo que para la programación de los movimientos
oculares sacádicos y de seguimiento en personas normales:
Como primera medida, el objetivo es detectado y procesado por las áreas visuales, la
contextualización del mismo dentro de coordenadas tridimensionales se programa y procesa
simultáneamente en las áreas parietales, permitiendo en paralelo el envío de señales al Colículo
Superior y hacia los Ganglios Basales, para iniciar la planeación del vector oculomotor ( en el caso
de A.I del vector cefalomotor ), que de forma también paralela, se mapea en las áreas oculares
frontales para desde allí, dar la señal de ejecutar o no, el movimiento cefálico hacia el objetivo ya
discriminado y resaltado por los mecanismos atencionales. Si la repuesta es positiva, el proceso de
desenganche (Unlock) de la fijación se manifiesta por medio de señales que producen a la vez dos
eventos: Uno en el cual, se inicia el fenómeno del campo vacío y se ejecuta la rotación de la cabeza
hacia el objetivo de la sacada mediante la activación de los músculos apropiados del cuello.
Respecto a este tema, Gilchrist y su grupo observaron en un estudio, que el efecto del campo
vacío o “gap effect” en A.I. era normal 1. De otro lado, si la respuesta volutiva es negativa, el
proceso de enganche (Lock) prosigue y la fijación se mantiene. Todo lo anterior, sugiere que los
mecanismos neurales de programación y ejecución de los movimientos oculares en A.I. son los
135
mismos de una persona sana, aunque con una leve diferencia: La planta motriz que se activa no es
la oculomotora, sino la cefalomotora, indicando también, una transformación eficiente de las
coordenadas retinocéntricas (centradas en la retina) en cefalocéntricas (centradas en V1) como si
todo el cráneo funcionara como un nuevo globo ocular. Los experimentos de Freedman y Sparks 3
concluyeron que es muy factible que la señal que se codifica en el Colículo Superior para los
movimientos oculares, sea la misma que se utiliza para rotar la cabeza durante el proceso de la
mirada conjugada en A.I. Esta observación es muy acertada, pues el lector puede apreciar que
cuando la cabeza está fija y se realiza un movimiento de seguimiento o de sacada que exceda la
máxima contracción de los músculos oculares agonistas en lateroversión, inmediatamente los
músculos del cuello asumen el resto de la excursión de forma involuntaria, y si es necesario, el
cerebro acude a los músculos del tronco, como si se tratara de un sistema de engranajes que se
activan uno tras otro, cuando cada uno de ellos llega a su respectivo tope de giro. Ver Figura No.2.
Figura No.2. Los receptores tendinosos ubicados en los músculos extraoculares, del cuello y del tronco, registran la
contracción máxima en cada uno de ellos, con la finalidad de activar un músculo agonista homolateral que permita
continuar los movimientos oculares de seguimiento o sacada que excedan en amplitud el campo visual binocular.
Sin embargo, parece que las señales visuales (bordes estereoscópicos) no son las únicas que
intervienen en los movimientos cefalomotores, pues cuando se le solicita a una persona con los
ojos cerrados que ejecute una amplia excursión de sus ojos hacia cualquier lado, el mecanismo
que complementa el giro por parte de los músculos del cuello se activa. Esto indica que los
receptores denominados órganos tendinosos de Golgi que están distribuidos entre las fibras de
colágeno que forman los tendones de los músculos extraoculares, generan información
retroalimentadora sobre el momento de máxima contracción de los músculos agonistas para
generar la subsecuente contracción de los agonistas del cuello.
136
CONCLUSIÓN
Con la investigación de casos como el de A.I., se manifiestan en parte los complejos mecanismos
que posee el cerebro humano para reemplazar eficientemente la función motora de los músculos
extraoculares con algunos de los músculos del cuello. También se concluye con todos estos
estudios, que los procesos intrínsecos de los movimientos oculares como el desenganche (Unlock),
el enganche (Lock) y el fenómeno del campo vacío, están presentes tanto en los movimientos de
origen oculomotor como cefalomotor, lo cual implica un código único para su programación, que
por supuesto está basado en las señales que representan los bordes estereoscópicos 4.
REFERENCIAS
1- Gilchrist I.D., Brown V., Findlay J. M., Clarke M.P. Using the eye-movement system to control the head .Proc. R. Soc. Lond. B (1998) 265: 1831-1836.
2- Land M. F., Furneaux S. M., Gilchrist.I.D. The Organization of Visually Mediated Actions in a Subject without Eye Movements. Neurocase (2002) 8: 80–87.
3- Freedman, E. G., Sparks, D. L. Activity of cells in the deeper layers of the superior colliculus of the rhesus monkey: evidence for a gaze displacement command. J. Neurophysiol. (1997) 78: 1669-1690.
4- Giraldo D. Programación de los movimientos oculares con base en el ciclo Lock-Unlock. Franja Visual (2006) 88: 48-50.
138
CÓDIGOS COMUNES EN EL CEREBRO
Para concluir, resumiré para el lector mediante un diagrama, la importancia intrínseca que posee
la codificación de señales que representan los bordes dentro del Cerebro humano, en el objetivo
de efectuar todo proceso perceptual, motor y cognitivo por aferencias visuales:
CONTRASTE ESPECTRAL
ACROMÁTICO
SEÑALES QUE REPRESENTAN LOS
BORDES
FENÓMENOS PERCEPTUALES
FORMA 2D Y 3D- MAPEOS
HEMIRETINOTÓPICOS
MOVIMIENTO 2D Y 3D
ESTEREOPSIS
(DISPARIDAD)
FENÓMENOS COGNITIVOS
ATENCIÓN VISUAL
RECONOCIMIENTO FACIAL Y GEOESPACIAL
MEMORIA DE TRABAJO
MEMORIA POR AFERENCIAS VISUALES
DECLARATIVA Y PROCEDIMENTAL
FENÓMENOS MOTORES
PROGRAMACIÓN OCULOMOTORA Y CEFALOMOTORA
FOVEACIÓN FIJACIÓN
ACOMODACIÓN SEGUIMIENTO
SACÁDICOS
CONSERVACIÓN DEL EQUILIBRIO CORPORAL
SISTEMA DE NEURONAS ESPEJO
NEUROREHABILITACIÓN POR AFERENCIAS
VISUALES
139
La idea de que existen señales que facilitan una codificación universal no es nueva, ya en el siglo
pasado, el Psicólogo William James y el Neurofisiólogo Roger Sperry, ganador del premio Nobel,
argumentaban que el ciclo existente entre la percepción y la acción, es el fundamento lógico del
sistema nervioso 1. A principios del siglo XXI, el Científico Alemán Wolfgang Prinz y sus colegas del
Instituto Max Planck, afirmaron que la percepción y la acción están directamente vinculadas por
un código computacional común2. Esta teoría, propuesta por Prinz y Colaboradores, afirma que la
percepción de una acción debe activar las representaciones de las respuestas motoras de igual
manera, cuando se perciben y cuando se ejecutan 3.Tal afirmación sugiere, que representamos las
acciones de la misma forma dentro de nuestros cerebros, de manera acorde a como las
observamos, ejecutamos e imaginamos. Así, se puede suponer que las representaciones de las
acciones observadas y ejecutadas deben subyacer en un sustrato neuronal compartido, que por
supuesto, interactúa desde lo perceptual a lo motor y cognitivo, y viceversa, utilizando como base
las mismas señales codificadas.
Aunque la mayoría de los enfoques tradicionales tienden a enfatizar la relativa independencia
entre la percepción y la acción, algunas teorías (más modernas) han abogado por una relación más
estrecha. Actualmente, la teoría de la codificación común está estrechamente relacionada con la
investigación y teoría de un campo muy especial de la Neurociencia: El sistema de Neuronas
Espejo. En cuanto al sistema de Neuronas Espejo, los investigadores han descrito que su lógica
funcional parece construirse sobre la base de un código común4.
Tomando en cuenta el legado científico de David Marr, y después de investigar varios años sobre
el tema, puedo atreverme a concluir que las señales que representan los bordes 2D y 3D hacen
parte del selecto grupo de señales que conforman ese “lenguaje” o “código común” que utilizan
las neuronas de las distintas áreas cerebrales para construir multirepresentaciones del campo
visual tridimensional y de los objetos contenidos en él, permitiendo de esta forma la codificación
de señales de actividad motora dentro de coordenadas también tridimensionales, que le faciliten
al individuo interactuar con ellos de diversas maneras. De todos los códigos comunes que maneja
el cerebro, pienso que las señales que representan los bordes es la más importante.
En realidad, es muy amplio el abanico de funciones cerebrales que pueden tomar como código
único de procesamiento las señales que representan los bordes. En el diagrama que ilustra el inicio
de este capítulo, sólo expuse las que para mi criterio son más evidentes, sin embargo, dichas
señales podrían participar en muchas más funciones a nivel cortical y subcortical. Cabe destacar
ante el lector, que la gran mayoría de las hipótesis que se han presentado en los capítulos
anteriores no han sido experimentalmente corroboradas, sin embargo, las he sustentado con
suficiente evidencia Psicofísica y Neurofisiológica que podría respaldar su posible desarrollo
dentro del cerebro humano y porque no, en el de otras especies.
140
REFERENCIAS
1- Sperry, R.W. (1952). Neurology and the mind-body problem. American Scientist, 40:291-312.
2- Prinz W. (1984). Modes of linkage between perception and action. In W. Prinz & A.-F. Sanders (Eds.), Cognition and
motor processes Berlin, Springer: 185-193.
3- Prinz W. (1997). Perception and action planning. European Journal of Cognitive Psychology, 9: 129-154.
4- Rizzolatti G., Craighero L. (2004). The mirror neuron system. Annual Review of Neuroscience, 27, 169-192.