DIVISIÓN DE CIENCIAS BIOLÓGICAS Y DE LA SALUD148.206.53.84/tesiuami/UAMI13568.pdf · El sistema...
Transcript of DIVISIÓN DE CIENCIAS BIOLÓGICAS Y DE LA SALUD148.206.53.84/tesiuami/UAMI13568.pdf · El sistema...
DIVISIÓN DE CIENCIAS BIOLÓGICAS Y DE LA SALUD
PROYECTO DE SERVICIO SOCIAL Nombre: Barrita Nuñez Juana Claudia Matrícula: 98335570 Teléfono: 51-15-66-51 Licenciatura: Biología División: Ciencias Biológicas y de la Salud Unidad: Iztapalapa Trimestre lectivo 05-O TITULO DEL PROYECTO: Efecto del coumestrol sobre glándulas accesorias en ratas macho Wistar TITULO DEL TRABAJO: Efecto del coumestrol en la diferenciación del núcleo dimórfico sexual en ratas macho wistar. Nombre del asesor interno: MARIO GARCIA LORENZANA Lugar de realización: Universidad Autónoma Metropolitana- Iztapalapa Edificio S Laboratorio de Neurociencias cubículo 336 tercer piso. Av. San Rafael Atlixco No. 186, Col Vicentina C.P. 09340, Iztapalapa, México D.F. Tel. 01(55) 58044600 Ext. 2729.
Nombre del proyecto de servicio social:
Efecto del coumestrol en la diferenciación del núcleo dimórfico sexual en ratas macho wistar. Lugar de realización: Universidad Autónoma Metropolitana- Iztapalapa Edificio S Laboratorio de Neurociencias cubículo 336 tercer piso. Av. San Rafael Atlixco No. 186, Col Vicentina C.P. 09340, Iztapalapa, México D.F. Tel. 01(55) 58044600 Ext. 2729. Periodo de realización: 24 de noviembre del 2005 – 24 de mayo del 2006 Nombre del asesor interno: MARIO GARCIA LORENZANA INTRODUCCIÓN
Los fitoestrógenos (FE), son un grupo de sustancias procedentes de varias especies vegetales, que se caracterizan por tener cierta actividad estrogénica. Se encuentran especialmente en cereales, legumbres y hortalizas, siendo sin embargo los granos de soya una de las fuentes con más abundante contenido de FE. Dentro de los fitoestrógenos existen diversas familias de moléculas que se incluyen de manera general dentro de los denominados isoflavonoides y corresponden en realidad a tres grupos: las isoflavonas, los pterocarpenos y los coumestanos (Tarrago, et. al, 2001).
Estos pueden llegar a tener, bajo determinadas circunstancias, efectos no deseados a nivel reproductivo. Sin embargo, por sus claros efectos estrogénicos, se han realizado estudios en los que se menciona una serie de resultados benéficos a nivel de salud humana, como puede ser el papel protector ante diferentes tipos de cáncer (próstata, colon, estómago, mama) o como una excelente terapia alternativa en mujeres menopaúsicas (Branca, 2005).
Ya que presentan los efectos benéficos de los estrógenos mas no los efectos secundarios. Lo anterior ha provocado que el consumo de alimentos que contienen fitoestrógenos o medicamentos a base de éstos se haya incrementado notablemente. Dados los efectos que pueden tener en el ganado o en el humano es necesario realizar estudios en diferentes etapas del desarrollo de la vida reproductiva, para poder determinar el efecto que este tipo de compuestos puedan llegar a tener.
La mayoría de los estudios relacionados con el efecto de los fitoestrógenos se han realizado en hembras (Kurzer y Xu, 1997). Sin embargo, se tiene información de que los machos, también, presentan receptores a estrógenos. Estos receptores se encuentran presentes en diferentes tejidos y permiten que los fitoestrógenos, así como el estradiol, tengan efecto sobre la actividad de diversos órganos del aparato genital masculino (Tarragó et al., 2001). Estudios realizados en animales domésticos, indican que tanto en ovinos, como en bovinos es frecuente encontrar alteraciones reproductivas en animales macho, que han sido expuestos en la dieta a fitoestrógenos, (genisteina y/o coumestrol) tales como: baja fertilidad, ginecomastia e hipospermia (Romero et al., 1997).
Diversos estudios realizados en roedores, muestran que la genisteina a nivel prostático es capaz de actuar como agonista de estrógenos, al inducir metaplasia escamosa epitelial (Santti et al., 1998); se sugiere de manera general una acción quimiopreventiva de estos compuestos (Mäkela et al., 1995).
En otros estudios se sugiere que la estrogenización temprana de machos, da por resultado un decremento persistente de la actividad enzimática de 5αreductasa y del crecimiento prostático. Lo anterior indica que existe un periodo crítico de la actividad enzimática. Por otro lado, se ha visto que este tipo de compuestos no produce efecto similar a la castración, cuando se administra en machos adultos normales (Mäkela et al., 1990).
Se ha encontrado que la administración de coumestrol es capaz de inducir cambios en
glándulas accesorias del aparato reproductor masculino, siendo los más dramáticos los observados en las glándulas coagulantes (Tarragó et al., 2000).
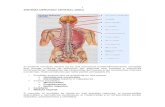
Desconocemos si estos efectos son debidos a una acción local de los FE, o bien si estos se dan como efecto de alteraciones gonadales o encefálicas. SISTEMA NERVIOSO CENTRAL (SNC)
El sistema nervioso central es una estructura extraordinariamente compleja que recoge millones de estímulos por segundo que procesa y memoriza continuamente, adaptando las respuestas del cuerpo a las condiciones internas o externas. Está constituido por siete partes principales
Encéfalo anterior que se subdivide en dos partes: Hemisferios cerebrales Diencéfalo (tálamo e hipotálamo) Tronco encefálico Mesencéfalo Protuberancia Bulbo raquídeo Cerebelo Médula espinal
A menudo, el encéfalo se divide en tres grandes regiones: el prosencéfalo (diencéfalo y
hemisferios cerebrales), el meséncefalo y el rombencéfalo (bulbo raquídeo, protuberancia y cerebelo).Todo el neuroeje está protegido por estructuras óseas (cráneo y columna vertebral) y por tres membranas denominadas meninges. Las meninges envuelven por completo el neuroeje, interponiéndose entre este y las paredes óseas y se dividen en encefálicas y espinales. De afuera hacia adentro, las meninges se denominan duramadre, aracnoides y piamadre. (Fawcett, 1988) Anatomía del encéfalo Desde el exterior, el encéfalo aparece dividido en tres partes distintas pero conectadas:
Cerebro: la mayor parte del encéfalo Cerebelo Tronco del encéfalo
El término tronco, o tallo del encéfalo, se refiere a todas las estructuras que hay entre el cerebro y la médula espinal, esto es, el mesencéfalo o cerebro medio, el puente o protuberancia y el bulbo raquídeo o médula oblongada. El encéfalo está protegido por el cráneo y, además, cubierto por las meninges. Cerebro
Constituye la masa principal del encéfalo y es lugar donde llegan las señales procedentes de los órganos de los sentidos, de las terminaciones nerviosas. Se desarrolla a partir del telencéfalo. El cerebro procesa toda la información procedente del exterior y del interior del cuerpo y las almacena como recuerdos. Se divide en dos hemisferios cerebrales, separados por una profunda fisura, pero unidos por su parte inferior por un haz de fibras nerviosas de unos 10 cm. llamado cuerpo calloso, que permite la comunicación entre ambos.
Los ventrículos son dos espacios bien definidos y llenos de líquido que se encuentran en cada uno de los dos hemisferios. Los ventrículos laterales se conectan con un tercer ventrículo localizado entre ambos hemisferios, a través de pequeños orificios que constituyen los agujeros de Monro o forámenes interventriculares. El tercer ventrículo desemboca en el cuarto ventrículo, a través de un canal fino llamado acueducto de Silvio. El líquido cefalorraquídeo que circula en el interior de estos ventrículos y además rodea al sistema nervioso central sirve para proteger la parte interna del cerebro de cambios bruscos de presión y para transportar sustancias químicas.
Este líquido cefalorraquídeo se forma en los ventrículos laterales, en unos entramados vasculares que constituyen los plexos coroideos
En cada hemisferio se distinguen: La corteza cerebral o sustancia gris, de unos 2 ó 3 mm de espesor, formada por capas de células amielínicas (sin vaina de mielina que las recubra). Debido a los numerosos pliegues que presenta, la superficie cerebral es unas 30 veces mayor que la superficie del cráneo. Estos pliegues forman las circunvoluciones cerebrales, surcos y fisuras y delimitan áreas con funciones determinadas, divididas en cinco lóbulos. Cuatro de los lóbulos se denominan frontal, parietal, temporal y occipital. El quinto lóbulo, la ínsula, no es visible desde fuera del cerebro y está localizado en el fondo de la cisura de Silvio.
La sustancia blanca, más interna constituida sobre todo por fibras nerviosas amielínicas que llegan a la corteza. Desde del cuerpo calloso, miles de fibras se ramifican por dentro de la sustancia blanca. Si se interrumpen los hemisferios se vuelven funcionalmente independientes. El diencéfalo origina el tálamo y el hipotálamo: Tálamo:
Esta parte del diencéfalo consiste en dos masas esféricas de tejido gris, situadas dentro de la zona media del cerebro, entre los dos hemisferios cerebrales. Es un centro de integración de gran importancia que recibe las señales sensoriales y donde las señales motoras de salida pasan hacia y desde la corteza cerebral. Todas las entradas sensoriales al cerebro, excepto las olfativas, se asocian con núcleos individuales (grupos de células nerviosas) del tálamo.
Hipotálamo: El hipotálamo está situado debajo del tálamo en la línea media en la base del cerebro. Está
formado por distintas regiones y núcleos hipotalámicos encargados de la regulación de los impulsos fundamentales y de las condiciones del estado interno de organismo (homeostasis, nivel de nutrientes, temperatura). El hipotálamo también está implicado en la elaboración de las emociones y en las sensaciones de dolor y placer. En la mujer, controla el ciclo menstrual.
El hipotálamo actúa también como enlace entre el sistema nervioso central y el sistema endocrino. En efecto, tanto el núcleo supraóptico como el núcleo paraventricular y la eminencia mediana están constituidos por células neurosecretoras que producen hormonas que son transportadas hasta la neurohipófisis a lo largo de los axones del tracto hipotálamo-hipofisiario. Allí se acumulan para ser excretadas en la sangre o para estimular células endocrinas de la hipófisis (Bar, 1975).
El área preoptica media (MPA) esta totalmente implicada en muchos aspectos de la fisiología reproductiva y conductual. Las neuronas de esta región tienen receptores a andrógenos y estrógenos y concentran los esteroides gonadales. El MPA se localiza entre la porción caudal del quiasma óptico y la comisura anterior, tiene como borde rostral y caudal a la lámina Terminal y la división media del núcleo de la cama de la estría Terminal respectivamente. El MPA forma conexiones con varias regiones cerebrales. Recibe entradas del sistema vomeronasal, (VNO), a través de la estría Terminal hacia la amígdala media (Me) y al núcleo de la cama de la estría Terminal (BST) anterior y medial posterior (BSTMA y BSTMP, respectivamente) (Morales et al., 2001).
TESTICULO El testículo es una glándula tubular compuesta, rodeada por una gruesa capsula fibrosa, la túnica albugínea. En la cara posterior del órgano; un engrosamiento de tejido conjuntivo penetra en la glándula y forma el mediastino del testículo. Unos delgados tabiques fibrosos llamados los septula testis, se extienden radialmente a partir del mediastino hasta la túnica albugínea, y dividen al órgano en unos 200 compartimentos piramidales, los lobulillos testiculares. (Fawcett, 1988) Hacia la periferia los septula pueden ser incompletos de tal manera que en ella se intercomunican los lobulillos están separados completamente. Cada lobulillo esta constituido por uno o cuatro tubos seminíferos sumamente retorcidos mide de 150 a 250 µm de diámetro y 30 a 70 cm. de largo y son extremadamente tortuosos. Los tubulos seminíferos constituyen la porción exocrina del testículo que es una glándula citogena cuyo producto de secreción es holocrina están formados por células completas, los espermios o espermatozoides. (Fawcett, 1988)
El ciclo espermatogénico de la rata se han descrito seis generaciones sucesivas de espermatogonias con diferencias morfológicas bastantes sutiles, son los tipos A1, A2, A3, A4, In y B. Las espermatogonias tipo A1 son el producto de la división mitótica de las células precursoras. Las divisiones mitóticas dan origen a las células de la siguiente generación. Las espermatogonias B se dividen para dar espermatocitos primarios que pronto entran en el periodo de preleptonema de la meiosis. A medida que continúan con la profase de la primera división meiótica, las células espermatogénicas atraviesan una serie de etapas morfológicamente diferenciadas, a saber preleptonema, leptonema cigonema, paquinema, diplonema y diacinesis. Los espermatocitos secundarios producidos por la primera división meiótica o división reduccional ingresan de inmediato
a la segunda división meiótica o división ecuatorial, y dan origen a espermatides haploides. (Ross, et. al. 1998)
Las diversas generaciones de las células espermatogénicas no se distribuyen al azar en el epitelio seminífero sino que se organizan en asociaciones celulares bien definidas. Las asociaciones celulares se denominan estadios, si la asociación celular presente en una porción de un túbulo seminífero de rata fuese observada en forma continuada, se vería que las células pasan sucesivamente por todos los 14 estadios y luego se repite la asociación inicial. Esta serie de cambios entre los aspectos de la misma asociación celular se denomina ciclo del epitelio seminífero. En un corte de un túbulo seminífero de la rata las células espermatogénicas serian las de solo una de las 14 asociaciones celulares. (Ross, et. al. 1998)
En el caso particular del presente trabajo el interés se basa en el análisis a nivel del núcleo dimórfico sexual en el área preóptica media del encéfalo y en el testículo para observar los cambios producidos por la administración de coumestrol en etapa neonatal. OBJETIVOS: Objetivo general: Determinar la estructura del núcleo dimórfico sexual en machos después de la administración de Coumestrol, en etapa neonatal. Objetivos específicos:
Describir la organización histológica del NDS en machos adultos, previamente tratados con aceite en etapa neonatal.
Describir la organización histológica del NDS en machos adultos, previamente tratados con coumestrol en etapa neonatal.
Analizar en forma comparada la organización histológica del NDS en los machos adultos tratados con aceite y coumestrol
METODOLOGÍA
Se escogieron 30 hembras y se seleccionaron 9 hembras receptivas las cuales se pusieron en unidades reproductivas para fecundarlas.
Se espero el nacimiento de las crías de 8 hembras gestantes y las camadas resultantes se dividieron de la siguiente manera: 4 camadas (Grupo experimental), 2 camadas (Grupo control), 2 camadas (Grupo sin tratamiento)
Se preparo coumestrol (anexo) Se administró a los neonatos, por vía subcutánea en la región cráneo-dorsal (a nivel de las
primeras vértebras cervicales) (Svendsen y Hau, 1994) coumestrol y aceite durante los primeros 5 días de vida de la forma siguiente: Grupo experimental ( 100 µl de coumestrol), Grupo control (100 µl de aceite) Grupo sin tratamiento
Se sexaron a los neonatos a los 15 días de nacimiento para conocer cuantas hembras y machos se obtuvieron.
Hasta los 2 meses se realizaron 4 pruebas de peso, como referente para determinar madurez .
Una vez alcanzado el peso reportado (Svendsen y Hau, 1994) se realizaron pruebas de conducta a fin de determinar la aptitud sexual a partir de los siguientes parámetros: monta, intromisión y eyaculación. Esto con un tiempo de duración de 30 minutos por rata
A los 4 meses de edad se eutanaziaron las ratas macho para extracción de encéfalo y testículo. Los testículos se midieron y pesaron. Posteriormente se fijaron con formalina neutra estabilizada
Se procesaron cerebro y testículo después de ensayar diferentes tiempos a fin de optimizar la técnica histológica (anexo)
Se obtuvieron cortes sagitales de testículo 7µm y se tiñeron con la técnica de Hematoxilina y eosina ( anexo)
Se obtuvieron cortes coronales seriados de encéfalo de 7 µm y se tiñeron con la técnica de Kluber-Barrera para análisis. (procedimiento anexo)
se observaron los cortes en un sistema óptico de análisis a fin de evaluar la morfología típica de cada grupo de animales
ACTIVIDADES REALIZADAS ETAPAS 1er mes 2do mes 3er mes 4to mes 5to mes 6to mes OBTENCION DEL MATERIAL
X X X
PROCESAMIENTO DEL MATERIAL
X X
CORTE Y TINCION DEL MATERIAL PROCESADO
X X
ANÁLISIS DE DATOS
X X
REPORTE FINAL X
OBJETIVOS Y METAS ALCANZADAS
Se describió y analizó la organización histológica del NDS en machos adultos, previamente tratados con aceite y coumestrol en etapa neonatal.
Se midieron parámetros de conducta solo con el fin de determinar aptitud sexual de los individuos
Se analizó la estructura testicular en las ratas tratadas previamente con aceite y coumestrol RESULTADOS
1. Peso Somático
PROMEDIO Y DESVEST DE PRUEBAS DE PESO
0
50
100
150
200
250
300
350
400
450
Número de pesaje
g
ACEITE ST COUMESTROL
Fig. 1 Pesos totales obtenidos del pesaje de los animales de los diferentes grupos. Se realizaron un total de 4 pesajes.
2. Pruebas de Conducta Con respecto a los resultados de las pruebas de conducta encontramos que los individuos tratados con coumestrol presentaban aptitud sexual con respecto a los animales control. presentaron una conducta sexual normal en cuanto a los parámetros de monta e intromisión. Un dato importante es que no eyacularon. 3. Indice Gonadosomático
INDICE GONADOSOMÁTICO (Testículo Derecho)
0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1
Tratamientos
g
ACEITE COUMESTROL SIN TRATAMIENTO
INDICE GONADOSOMÁTICO (Testículo Izquierdo)
0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1
1
Trataminetos
g
ACEITE COUMESTROL SIN TRTATAMIENTO 4. Histología del Encéfalo
Fig. 3 Fotomicrografías de encéfalo de rata en el plano 17.5 (Paxinos, Watson, 1986). A. (coumestrol), B. (aceite). Putamen caudal (CPu), Quiasma óptico (qo), Comisura anterior (aca), ventrículos laterales (LV). El quiasma óptico se encuentra en la región ventral. El núcleo núcleo dimórfico sexual se localiza en la región preóptica media ( ) (Kluver_Barrera, Barra 1000 µm).
5. Histología del Testículo
Fig. 4 Fotomicrografias de testículo de rata (tratamiento coumestrol) VS vaso sanguíneo, EI espacio intersticial, TS Túbulo seminífero (H-E, barra 500 µm). En el recuadro se aprecia un espermatogénesis completa pero el epitelio seminífero espacios acelulares atípicos ( ), L luz del túbulo seminífero, t espermátidas, c espermatocitos, g espermatogonias, b lámina basal (H-E, barra 100 µm) Conclusiones
Svendsen y Hau (1994) reportan que el peso promedio en el que las ratas macho alcanzan la pubertad es de 250.0 g y que se evidencia por la posición escrotada de los testículos. En nuestro trabajo el escrotamiento se presentó a un peso ligeramente mayor en el grupo de aceite y sin tratamiento. Los ejemplares que alcanzaron mayor peso en el periodo de valoración somática fueron los del grupo tratado con Coumestrol. Lo cual podría explicarse por un aumento de la grasa corporal. Resultado que parece deberse a un efecto estrogénico del coumestrol a nivel de tejido adiposo.
Existen datos de que la administración de ciertos fármacos suprimen la conducta sexual, sin embargo, es escasa la información en cuanto a fármacos que inhiban de manera selectiva a alguno de los componentes del comportamiento sexual. En este trabajo se observó la inhibición de la eyaculación lo que requiere de estudios posteriores, ya que este estudio no se planteó como objetivo de este trabajo de servicio social
Se ha reportado que la administración de estradiol en rata macho en etapa neonatal y adulta provoca la disminución del peso de los testículos (Kalla et al., 1980). La administración de coumestrol en etapa neonatal provoca la disminución de peso del testículo izquierdo con respecto a los grupos de aceite y sin tratamiento. Sin embargo en el caso del testículo derecho no se observan cambios significativos en los tres grupos. Esta es una observación que tendrá que evaluarse en estudios posteriores.
Los experimentos realizados por Phoenix y cols. En 1959, propusieron que los esteroides
sexuales podían actuar de dos modos: organizando y activando. Los esteroides sexuales actuarían tempranamente durante el desarrollo organizando las estructuras y vías neuronales implicadas en la conducta reproductora, siendo los efectos de carácter irreversible y permanente.
En cuanto al análisis histológico se observa una tinción diferencial del área preóptica media entre el grupo tratado con aceite y el tratado con coumestrol (Barrita et al., 2004). Esto sugiere que el núcleo dimórfico sexual se ve afectado por la administración neonatal de coumestrol. En este sentido el trabajo de Gorski et al. (1965) menciona que el desarrollo del núcleo del área preóptica media empieza después de la vida fetal y depende principalmente del medio hormonal que priva durante su periodo crítico. A este grupo de células se le llamo núcleo dimorfico sexual del área preoptica media (SDN-POA) y presenta los siguientes parámetros de diferenciación: 1) el volumen celular es tres veces mayor en los machos que en las hembras, 2) los machos presentan neuronas mas grandes que las hembras y 3) la proporción de neuronas aferentes y eferentes o densidad neuronal, es mayor que los machos que en las hembras, principalmente en un núcleo que corresponde a la parte central del núcleo preoptico medial.
Por tanto, los resultados de este trabajo insinuan una acción masculinizante del coumestrol, ya que la tinción observada (en el area preóptica media) de los animales tratados con coumestrol es más intensa (mayor apetencia de las vías mielinizadas por el azul luxol) que en los animales de los grupos tratados con aceite y sin tratamiento. Resultado que lo explicamos a partir de un mayor desarrollo de las vías aferentes y eferentes, debido éste al incremento de las neuronas del núcleo dimórfico sexual. Por lo que proponemos que el coumestrol en etapa neonatal tiene un efecto estrogénico (Barrita et al., 2005 ).
En cuanto al analisis histológico del testículo, la presencia de espacios acelulares atípicos en algunos túbulos seminiferos denotan una alteración en la espermatogénesis. Lo que pensamos se debe a que el efecto del coumestrol administrado actuó no solo en el núcleo dimórfico sexual, sino en componentes del eje hipotálamo hipófisis gónada. Eje que es fundamental en la regulación de la espermatogénesis.
Estos resultados en conjunto sugieren un efecto central sin que podamos descartar por completo un efecto suplementario, a nivel periférico.
RECOMENDACIONES
Al fijar los tejidos por riego sanguíneo es necesario que la aguja penetre exactamente el ventrículo derecho del corazón para lograr una buena fijación.
Al procesar el encéfalo y testículo tendrán que ser de forma manual ya que son órganos muy delicados.
Al procesar el encéfalo hacer un pequeño corte a la altura de los nervios ópticos y mantenerlos en formalina, es necesario que antes de procesarlos, hacer tres cambio de solución salina de 1hrs c/u.
Para procesar al testículo se debe separar el epidídimo y hacer un corte sagital del testículo, en una acción postifijación, pero previa al lavado.
Al teñir las muestras de cerebro dejarlas solo 12 horas exactas en azul- luxol, al sacarlas de la estufa dejarlas enfriar durante 30 minutos. Al diferenciarlas en carbonato de litio son 4 veces cada laminilla con duración de 15 segundos cada diferenciación.
Los colorantes de la técnica de Klüver–Barrera deben ser preparados el mismo día que se van utilizar, ya que si duran por mas tiempo pierden sus propiedades tintóreas.
BIBLIOGRAFIA
Bar, M. L. 1975 El sistema nervioso humano. 2a. ed. Ed. HARLA, México. 373 pp. Barrita Núñez, Claudia; Estevez Heredia, Irlanda; Santiago Antonio, Yolanda; Tejeda Valdivia,
Verónica; García Lorenzana, Mario; Tarragó Castellanos, Ma. del Rosario; Morales Otal , Adriana; Ferreira Nuño, Armando; Velázquez Moctezuma, Javier. 2004. Efecto del coumestrol en el nucleo dimorfico sexual en ratas macho en etapa neonatal. Memorias del XXVIII Congreso Nacional de Histología. México, D.F..
Barriitta Núñez,, Cllaudiia;; Esttevez Herediia,, Irllanda;; Santtiiago Anttoniio Yollanda,, Tarragó Casttellllanos M.. R..;; Garcíía Lorenzana Mariio y Vellázquez Mocttezuma Javiier. 2005. Efecto de la administración del coumestrol en el núcleo dimorfico sexual en etapa neonatal en rata macho wistar. Memorias del XXIX Congreso Nacional de Histología. Tlaxcala, Tlax.
Cllaudiia;; Esttevez Herediia,, Irllanda;; Santtiiago Anttoniio Yollanda,, Tarragó Casttellllanos M.. R..;; Garcíía Lorenzana Mariio y Vellázquez Mocttezuma Javier 2005 Efecto del tratamiento neonatal de coumestrol en el testículo de ratas wistar.. Memorias del XXIX Congreso Nacional de Histología. Tlaxcala, Tlax.
Branca F, Lorenzetti S. Health effects of phytoestrogens. Diet Diversification and Health Promotion. Forum Nutr. Basel, Karger, 2005, vol 57, pp 100-111
Fawcett DW, Tratado de Histologia. 1988. Décimoprimera edición. Interamericana McGraw-Hill Gorski RA, Harlan RE, Jacobson CD, Shryne JE, Southam AM. Evidence for the existence of a
sexually dimorphic nucleus in the preoptic area of the rat. Comp Neurol. 1980 Sep 15; 193(2):529 Gorski, R. A. Arthur, P. A. Gonadal steroid induction of structural sex ddifferences in the central
nervous system. Ann. Rev. Neurosci. 1984. 7: 413-42 Kalla N.R., Insula B.C., Menard R. And Loriaux D.L. 1980. The effect of estradiol on testicular
testosterone biosynthesis. Endocrinology 106:35-39. Kurser MS, Xu X. (1997) Dietry phytoestrogens Annu. Rev. Nutr. 17:353-381 Mäkela S, Santti R, Salo L, McLachlan JA. (1995) Phytoestrogens are partial estogens in the adult
male Mouse. Environ Health Perpert 103:123-127. Morales Otal, A.; Armando F. N.; Javier V.M. Diferenciación sexual del sistema nervioso central en
mamiferos. Ed. Javier Velásquez Moctezuma. UAM-PUIS. 2002. Pp. 251-265 Oko E. and Hrudka F. 1984. Comparison of the effect of gosypol, estradiol 17 β and testosterone
compenation on male rat reproductive organs. Biol Rep 30:1198-1207. Paxinos G, Watson C. The rat brain in stereotaxic cooordinates. Second Edition, 1986. Academic
Press Ramirez, T. O. ¿Es la biología el destino? Diferenciación sexual del sistema nervioso. Ciencia y
desarrollo. Julio-Agosto 1993. Pp. 110-113 Romero RC, Tarrago CR, Muñoz MR, Arisla RR y Rosado GA. (1997). Síndrome estrogenito en
vacas lecheras por consumo de alfalfas con grandes cantidades de coumestrol. Ross MH, Romrell LJ, Kaye GI. Histologia texto y atlas color. Tercera edicion. 1998. editorial medica
panamericana. Santti R. Mäkela S, Stauss L, KorkmanJ, Hostian MC. (1998) Phytoestrogens: potencial endocrine
disruptors in males. Toxicol Indust Health 14:223-237. Svendsen, P. and Hau, J. (Eds.) 1994 Handbook of laboratory animal sciences. Vol. I CRC press,
London 435 pp. Tarrago, M. R; Mario, G. L. Javier, V. M. Fitoestrógenos y reproducción. Biología de la reproducción.
Ed. Javier Velásquez Moctezuma. UAM-PUIS. 2002. Pp. 251-265 Vazquez Inn G, Echeverria O. introducción a la microscopia electronica aplicada a las ciencias
biologicas. Fondo de cultura economica. Facultad de Ciencias. UNAM. 2000.
ANEXO
TECNICAS HISTOLOGICAS METODO DEL AZUL LUXOL RESISTENTE (KLÜBER-BARRERA) FIJACION: Formalina SECCIONES: 15 A 20 µm SOLUCIONES AZUL-LUXOL
Azul luxol resistente MBS 0.1 g Etanol al 96 % G.L 100 ml.
PROCEDIMIENTO Disuelva el colorante en el alcohol, añada 0.5 ml de ácido acético al 10% por cada 100 ml. Estable por varios meses. VIOLETA DE CRESILO
Violeta 0.1 g Agua destilada 100 ml
PROCEDIMIENTO Se disuelve el colorante en el agua, antes de usar añada 15 gotas de ácido acético glacial por cada 100 ml, filtre CARBONATO DE LITIO
Carbonato de litio 0.005 g Agua destilada 100 ml
PROCEDIMIENTO DE LA TECNICA
1) Desparafine e hidrate hasta llegar a etanol al 96 ° G.L a) Neo-clear I …........5 minutos b) Neo-clear II...........5 minutos c) OH-100% I............3 minutos d) OH-100% II...........2 minutos e) Oh-96°..................2 minutos
2) solucion azul luxol resitente a 56°C toda la noche (12 horas aproximadamente) 3) enjuagar el exceso de colorante con etanol al 96° G.L 4) enjuagar exceso con agua destilada 5) diferenciar las laminillas una por una por 30 seg. en carbonato de litio (repetir 3 veces) 6) continué la diferenciación en el etanol al 70% G.L hasta que la sustancia gris este clara y la sustancia blanca
este bien definida
7) revisar al microscopio, repita la diferenciación si es necesario comenzando en el paso 5 8) al terminar la diferenciación, coloque en agua destilada 9) al acumular todas las laminillas en agua destilada haga un paso de agua destilada fresca 10) contraste en la solución de violeta “echt” de cresilo por 6 minutos. 11) Después se coloca en agua destilada y se observa al microscopio 12) Se siguen los siguientes pasos:
a) OH-96% I………lavado b) OH-96% II……..lavado c) OH-100% I…….lavado d) OH-100% II……lavado e) Neo-clear I…….lavado f) Neo-clear II……lavado g) Montaje con entellan
METODO HEMATOXILINA-EOSINA PREPARACION DE HEMATOXILINA
• 100 ml. De solución madre e hematoxilina de Harris • Acido acetico 1 a 3 ml. (2ml.) • Se filtra y se usa
PREPARACION DE SOLUCION MADRE DE EOSINA AMARILLENTA
• una parte se solución madre de eosina amarillenta (25ml) • tres partes de alcohol etílico de 80° G.L (75 ml.) • agregar 0.6 ml. De ácido acético por cada 100 ml.
PROCEDIMIENTO
• NEO-CLEAR I…........................... 5 minutos • Neoclear II...................................... 5 minutos • OH- 100.......................................... 3 minutos • OH-100........................................... 2 minutos • OH-eter............................................2 minutos • OH-96..............................................2 minutos • OH- 80………………………………..2 minutos • OH-60…………………………………2 minutos • Agua destilada……………………….lavados • Hematoxilina………………………….7 minutos • Agua de la llave………………………lavado • OH-ácido………………………………lavado • Agua destilada………………………..lavado • Solución de scout…………………….8 minutos • EOSINA……………………………… 5 MIN 30 SEG • Agua destilada……………………….lavado • OH-96…………………………………lavado • OH-96 II……………………………….lavado • OG- 100 I ........................................ lavado • OH-100 II .........................................lavado
• Neo-clear I ......................................lavado • Neo-clear II.......................................lavado
PREPARACION DE FORMALINA NEUTRA ESTABILIZADA AL 10%
• fosfato de sodio monobasico cristal 4.0 grs • fosfato de sodio dibasioc anhidro 6.5 grs • formaldehído en solución 100ml • agua destilada 900ml
PROCEDIMIENTO Los reactivos se mezclan por separado en 200 ml de agua destilada se mezclan en una probeta de 1000 ml, se le agrega el formaldehído y se afora hasta llegar a 1000 ml. Se refrigera para conservarse por más tiempo.
PREPARACION DE SOLUCION SALINA
agua destilada 100 m cloruro de sodio 0.9 grs. Se mezclan los reactivos colocando una mosca de agitación en el vaso de precipitado
PREPARACION DE COUMESTROL
1) pesaje: 8.25 mg de coumestrol en un vial con una mosca de agitaron 2) disolver en etanol. Agregar alcohol de 100 ° G.L (varios mls) varía lo que se debe cuidar en que se disuelve.
Empezar con gotas y ha velocidad de agitación 1 (la menor) 3) agregar aceite: ya disuelto en el etanol agregar 550 µl de aceite 4) dejar que se evapore el alcohol
nota: se utilizo alcohol del 86° G.L para disolver el coumestrol, para evitar que el coumestrol tuviera una consistencia chiclosa
TECNICA HISTOLOGIA PARA PROCESAR TEJIDO (ENCEFALO Y TESTICULO)
Estos fueron los tiempos utilizados para el procesamiento de los tejidos después de varias pruebas realizadas. Reactivo Tiempo Solución salina 1 hora Solución salina 1 hora Solución salina 1 hora Alcohol 40º 1 hora Alcohol 50º 1 hora Alcohol 60º 1 hora Alcohol 70º 1 hora Alcohol 80º 1 hora
Alcohol 96º I 1 hora Alcohol 96 II 1 hora Alcohol 100º I 1 hora Alcohol 100ºII 1 hora OH-Xileno 1 hora Xileno I 1 hora Xileno II 1 hora Paraplast I 2 horas Paraplast II Toda la noche (aprox. 12 hrs.) Por ultimo se incluyen los tejidos, colocándolos en escuadras y poniendo un poco de paraplast; después se coloca el tejido y se rellena nuevamente con paraplast, dejándolo secar hasta el otro día, para proceder a cortar.
FIJACION POR PERFUSION La fijación del sistema nervioso central de vertebrados adulto o fetal después de la diferenciación de las glías requiere un cuidado procedimiento de perfusión, para que el fijador llegue a la intimidad del tejido rápidamente. No deben de pasar de tres minutos entre el momento de detención de la circulación o de la respiración, lo que ocurra primero, y la fijación. La perfusión debe ser de caída libre, nunca se emplearan bombas de perfusión o de algún sistema de flujo constante. El aparato puede estar constituido por dos frascos con los que se emplean para perfusiones de sueros. Se pueden emplear los tubos que se usan para venoclisis en hospitales. Debe utilizarse un tubo en forma de Y para unir los conductos que salen de cada uno de los frascos; se cuidara que no quede ninguna burbuja en los tubos ni en la aguja. PREPARACION DEL ANIMAL. Se le anestesia con cualquier procedimiento que no produzca anoxia. Se emplea éter etílico, se pone al animal en una cámara con una pequeña entrada de aire, en la que se ha colocado previamente el algodón empapado con dicho liquido. Cuando el animal se ha dormido, se le retira de la cámara, se le ata sobre una plancha de madera con clavo y otros aditamentos que sirven para atar a sus miembros. Se mantiene la acción del éter colocando el algodón mojado en el anestésico cerca de la nariz del animal, de manera que reciba de vapores de éter y también aire. Se humedece y se corta el pelo de la región torácica. Se corta la piel con una larga incisión media sobre el esternón y se separa dos colgajos laterales que descubren ampliamente el plano costo muscular. Se hace incisión de este plano por el esternón, cortándolo como todo, y sostiene abierto por separadores. Se abre el pericardio y e introduce una aguja gruesa o un trocar en la cavidad del ventrículo izquierdo y se comienza a prefundir el liquido lavado. Se corta la aurícula derecha y se deja salir la sangre, que se absorbe con un algodón o gasas. Se corrobora que la perfusión se lleve a cabo a goteo muy rápido o a chorro delgado. El animal muere en el momento en que se abre el tórax, se colapsan pulmones y deja d respirar, de manera que desde ese momento se empiece a contar el tiempo de anoxia.
LAVADO Se debe lavar el árbol vascular con un liquido isotónico y de preferencia isoionico, que no este frió, frecuentemente a 37° C. se puede emplear Ringer ajustado a pH 7.2-7.3 produce muy buenos resultados agregar un anticoagulante y un vasodilatador al liquido de perfusión. Para ello se puede agregar cada 1000 ml de líquido lavador 500 unidades de heparina de 1000 unidades por mililitro, y 3 ml de xilocaina al 2%. Esta última sustancia tiene propiedades vasodilatadoras inyectadas en el árbol vascular. Se usa a menudo la siguiente solución de Ringer que queda a 310-320 mOsm/Kg.: Cloruro de sodio………9.00 gr. Cloruro de potasio…….0.42 gr. Cloruro de calcio………0.24 gr. Bicarbonato de sodio….0.3 gr. Se prefunde a flujo rápido, como se menciono, hasta que la sangre que se sale por la aurícula derecha se diluya con el liquido de lavado, pero nunca durante mas de un minuto a minuto y medio, aunque salga sangre de la aurícula
ANEXOS
TABLAS DE RESULTADOS PRUEBAS DE PESO (PESO ESTIMADO AL QUE DEBIAN LLEGAR 250 GRS) Primera prueba de peso Aceite Sin tratamiento Coumestrol 184.9 208.5 171.5 153.0 152.5 189.0 154.7 174.4 181.0 168.5 165.4 217.9 173.9 159.0 167.2 150.9 164.1 169.2 150.9 118.5 192.9 153.0 192.4 178.2 105.0 Segunda prueba de peso Aceite Sin tratamiento Coumestrol 214.3 230.0 258.0 218.9 170.0 223.6 230.6 16.0 267.6 234.9 243.2 246.8 221.0 286.2 317.1 228.5 224.1 252.4 244.6 226.9 231.8 221.5 270.0 241.2 Tercera prueba de peso Aceite Sin tratamiento Coumestrol 260.0 251.0 287.0 259.5 195.1 300.0 283.1 297.2 263.6 256.6 244.3 286.0 240.6 257.3 259.5 269.7 262.3 394.0 254.0 264.8 285.0 251.5 315.8 185.0 CUARTA PRUEBA DE PESO Aceite Sin tratamiento coumestrol 327.2 287.0 318.4 399.5 299.5 320.3 275.9 281.1 326.5 291.2 343.3 290. 29.2 296.1 317.1 297.1 288.0 291.4 286.8 324.7 393.0 306.1 225.0 209.0
PRUEBAS DE CONDUCTA (TIEMPO DE PRUEBA 30 MINUTOS A CADA RATA) PRUEBA DE CONDUCTA A LAS RATAS TRATADAS CON COUMESTROL
MONTA INTROMISION RATA TIEMPO DE LA 1er MONTA
NO. DE MONTAS
TIEMPO DE LA 1era INTROMISION
NO DE INTROMISIONES
EYACULACION
1 4´45´´ 6 3´00´´ 2 0 2 1´ 33´´ 6 0´ 45´´ 21 0 3 4´ 32´´ 5´ 00´´ 3 0 4 2´ 31´´ 7 6´ 52´´ 17 0 5 2´ 01´´ 24 0´24´´ 31 0 6 3´ 43´´ 4 1´ 51´´ 7 0 7 12´05´´ 3 4´ 46´´ 21 0 PRUEBA DE CONDUCTA A LAS RATAS TRATADAS CON ACEITE
MONTA INTROMISION RATA TIEMPO DE LA 1er MONTA
NO. DE MONTAS
TIEMPO DE LA 1era INTROMISION
NO DE INTROMISIONES
TIEMPO DE LA EYACULACION
1 0 0 0 0 0 2 1´ 20 ´´ 13 1´ 51´´ 7 0 3 15´ 39´´ 4 1´ 08´´ 6 0 4 0 0 7´ 34´´ 1 0 5 0 0 0 0 0 6 0 14 1´ 00´´ 25 26´ 13´´ PRUEBA DE CONDUCTA A LAS RATAS SIN TRATAMIENTO
MONTA INTROMISION RATA TIEMPO DE LA 1er MONTA
NO. DE MONTAS
TIEMPO DE LA 1era INTROMISION
NO DE INTROMISIONES
TIEMPO DE LA EYACULACION
1 1´ 54´´ 4 4´ 00´´ 16 29´45´´ 2 1´ 03´´ 5 1´ 06´´ 15 12´ 16´´ 3 0´ 33´´ 9 0´ 20´´ 17 17´ 48´´ 4 11´ 02´´ 3 1´ 00´´ 12 28´ 10 ´´
EXTRACCION DEL APARATO REPRODUCTOR TRATAMIENTO PESO
RATA TESTICULO DERECHO
TESTICULO IZQUIERDO
PROSTATA VESICULAS SEMINALES Y GLANDULA COAGULNTE
ACEITE 495.5 3.0168 3.1293 1.6519 2.2810 ACEITE 365.3 2.2815 2.3357 1.0363 1.6480 ACEITE 610.2 3.1911 3.2683 2.4464 2.4562 ACEITE 511.7 3.7432 4.1582 1.2810 2.88540 ACEITE 420.3 2.6306 3.7796 1.8676 2.5620 ACEITE 409.7 3.0870 3.1760 2.0661 1.8953 ACEITE 468 3.2422 3.6102 1.8847 2.0608 ACEITE 457.3 2.7149 3.2718 2.1695 2.5680 COUMESTROL 554.1 2.3610 2.9119 1.2000 2.47 COUMESTROL 434 3.0363 3.005 1.9196 2.2489 COUMESTROL 460 3.5780 2.9223 1.6231 2.2703 COUMESTROL 424.3 2.9652 2.7030 1.4845 2.2931 COUMESTROL 438 3.2098 3.1537 2.0860 2.0199 COUMESTROL 459.4 3.124 2.8640 1.8245 1.7659 COUMESTROL 475.5 3.0346 3.6883 1.7054 2.0561 SIN TRATAMIENTO 324.3 2.4131 2.137 1.5802 1.1965 SIN TRATAMIENTO 470.8 3.4997 3.9053 2.5111 2.036 MEDICION DEL TESTICULO TRATAMIENTO TESTICULO CRANEO CAUDAL ANTERO-
POSTERIOR MEDIO LATERAL
Aceite Derecho 1.9 1.6 1.5 Aceite Derecho 3.0 1.7 1.5 Aceite Derecho 2.6 1.7 1.4 Aceite Derecho 2.4 1.6 1.5 Aceite Derecho 2.6 1.7 1.1 Aceite Derecho 2.6 1.4 1.0 Aceite Derecho 2.4 1.4 1.0 Aceite Izquierdo 2.5 1.4 1.5 Aceite Izquierdo 2.4 1.1 1.0 Aceite Izquierdo 2.5 1.6 1.4 Aceite Izquierdo 2.0 1.5 1.1 Aceite Izquierdo 2.5 1.3 1.0 Coumestrol Derecho 2.4 1.4 1.3 Coumestrol Derecho 2.5 1.7 1.3 Coumestrol Derecho 2.4 1.2 1.1 Coumestrol Derecho 2.7 1.5 1.0 Coumestrol Derecho 2.4 1.3 1.1 Coumestrol Izquierdo 2.2 1.6 1.6 Coumestrol Izquierdo 2.5 1.6 1.0 Coumestrol Izquierdo 2.5 1.7 0.9 Coumestrol Izquierdo 2.5 1.5 0.9 Coumestrol Izquierdo 2.5 1.6 0.9 Coumestrol Izquierdo 2.6 1.5 1.3 Sin Tratamiento Derecho 1.8 1.2 0.9 SinTratamiento Derecho 1.8 1.1 0.9 Sin Tratamiento Izquierdo 2.3 1.3 1.1 Sin tratamiento Izquierdo 2.7 1.5 1.3