Capitolo 18 - Doctor33 · Esame RM eseguito a distanza di 5 settimane dalla nascita. Si dimostrano...
Transcript of Capitolo 18 - Doctor33 · Esame RM eseguito a distanza di 5 settimane dalla nascita. Si dimostrano...

371
Capitolo | 18 |
Patologia ipossico-ischemica neonatale e cerebrovascolare pediatricaGiovanni Morana, Andrea Rossi
InTRoDUzIonE
Il danno cerebrale conseguente a patologia ipossico-ischemica neo-natale e cerebrovascolare pediatrica costituisce una delle principali cause di grave disabilità neurologica a lungo termine; comprende un eterogeneo gruppo di lesioni clastiche le cui caratteristiche dipen-dono da una serie di fattori, tra cui principalmente l’epoca in cui si instaura il danno vascolare, la gravità di quest’ultimo e le condizioni predisponenti tipiche dell’età pediatrica. In particolare, per quanto riguarda la patologia ipossico-ischemica pre-perinatale, i diversi qua-dri anatomopatologici e conseguentemente neuroradiologici dipen-dono essenzialmente dalla selettiva vulnerabilità al danno ipossico di specifiche regioni dell’encefalo, in funzione dell’età gestazionale e del grado di maturazione cerebrale raggiunto. Tradizionalmente, pertanto, si è soliti distinguere i pattern lesionali del nato pretermine (24-36 settimane) da quelli del nato a termine (37-41 settimane). Per quanto riguarda invece la patologia cerebrovascolare in epoca pediatrica, cioè al di fuori del periodo neonatale, i quadri anatomo-patologici, pur sostenuti da eziologie differenti rispetto al paziente adulto, presentano distribuzione e caratteristiche non dissimili da quest’ultimo. Anche le manifestazioni cliniche dipenderanno dalla gravità e dall’epoca dell’insulto, con quadri clinici peculiari in caso di danno cerebrale conseguente a fenomeni ipossico-ischemici neonatali (paralisi cerebrale infantile) e manifestazioni più eterogenee (deficit focali, epilessia) per quanto riguarda la patologia cerebrovascolare pediatrica.
PAToLoGIA IPoSSICo-ISCHEMICA DEL nATo PRETERMInE
La persistenza di strutture tipiche del periodo fetale, estremamente sensibili agli stress dell’ambiente extrauterino, e la fisiologica incom-pleta maturazione cerebrale rendono l’encefalo del neonato pretermine estremamente vulnerabile agli insulti di tipo ipossico-ischemico. In particolare, la capacità di autoregolazione è scarsamente efficiente, con conseguente maggior rischio di ipoperfusione in caso di ipotensione; a questo si aggiunge la particolare fragilità della matrice germinativa.
Nei prematuri, le lesioni su base ipossico-ischemica di più frequente ri-scontro sono rappresentate dalla leucomalacia periventricolare (LMPV) e dalle emorragie della matrice germinativa.
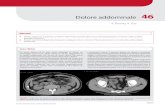
Leucomalacia periventricolareCon il termine leucomalacia periventricolare (LMPV) si indica un quadro neuropatologico caratterizzato da un danno clastico della sostanza bianca periventricolare. Nonostante esistano teorie differenti per quanto riguarda i meccanismi eziopatogenetici, attualmente si ritiene che le lesioni che caratterizzano la LMPV siano correlate preva-lentemente alla selettiva vulnerabilità degli oligodendrociti immaturi della sostanza bianca periventricolare a stress ossidativi ed eccitotossici (danno mediato da citochine e da radicali liberi) su base ipossica. Tuttavia, si deve tenere presente che spesso non è possibile identificare in anamnesi un evento ipossico scatenante e, pertanto, alcuni autori ritengono che fattori addizionali, per esempio le infezioni prenatali, o comunque differenti rispetto a una forma ischemica pura, possano determinare l’attivazione della suddetta cascata proinfiammatoria responsabile del danno finale. In fase acuta, la LMPV è generalmente valutata con un esame ecografico che può evidenziare focali lesioni iperecogene periventricolari. L’esame RM è di norma eseguito solo nella fase subacuta o stabilizzata del danno, in ragione della vulnerabilità e instabilità dei neonati prematuri che possono rendere rischioso l’esame RM. Nei rari casi in cui si ricorre all’esame RM in fase molto precoce (1-2 giorni), spesso grazie all’ausilio di incubatori RM dedicati, può essere dimostrata la presenza di piccole focali aree di restrizione della diffusione (ipersegnale in DWI e iposegnale in ADC) in corrispondenza della sostanza bianca periventricolare prevalentemente posteriore; le sequenze convenzionali T1- e T2 non consentono un’adeguata valu-tazione del danno in fase iperacuta-acuta. Le aree di restrizione della diffusione persistono durante la prima settimana, epoca in cui (general-mente a partire da 3-4 giorni dall’evento) compaiono nella medesima sede piccole aree spontaneamente iperintense in T1 e iso-ipointense in T2, che possono persistere anche per alcune settimane (Fig. 18.1). La spontanea iperintensità T1 non si correla a un’ipointensità nel-le sequenze in eco di gradiente (T2*-dipendenti) e, pertanto, non è espressione di lesioni emorragiche petecchiali, ma di danno ischemico. Le ipotesi più accreditate sostengono che possa essere dovu-ta all’accumulo di macrofagi o ad aree di focale mineralizzazione.

372
Patologia pediatricaSezione | 3 |
Successivamente, la RM può dimostrare la presenza di concomitanti alterazioni cistiche periventricolari riferibili a piccole cavità malaciche che tendono a confluire nel sistema ventricolare. Nella fase cronica o degli esiti stabilizzati, si dimostra inoltre un variabile grado di ridu-zione di volume/spessore della sostanza bianca profonda di entrambi gli emisferi cerebrali, prevalentemente posteriore, cui si associano alterazioni di segnale iperintense in T2 e FLAIR, di significato gliotico, nella sostanza bianca periventricolare residua. Al depauperamento della sostanza bianca e, conseguentemente, delle fibre commessurali telencefaliche, consegue un assottigliamento del corpo calloso, pre-valente a livello delle regioni posteriori, su base atrofica. Il sistema ventricolare presenta una peculiare irregolarità dei margini delle celle medie dei ventricoli laterali (in rapporto alla confluenza di piccole aree malaciche) con aspetto “squadrato” dei trigoni; generalmente si associa un variabile grado di dilatazione ex vacuo dei ventricoli laterali. Gli spazi subaracnoidei possono essere normalmente rappresentati o anch’essi ampliati ex vacuo (Figg. 18.2 e 18.3). Inoltre, va ricordato che il classico quadro di LMPV sinora descritto è considerato l’espressione di un danno ipossico-ischemico di grado lieve-moderato. In caso di grave danno ipossico, alle alterazioni suddette possono associarsi le-sioni dei talami, del tronco dell’encefalo e degli emisferi cerebellari.
Forme minime di LMPV, caratterizzate da settoriale ipersegnale T2/FLAIR nella sostanza bianca peritrigonale, possono creare problemi di diagnosi differenziale con le cosiddette aree terminali di mielinizza-zione (vedi Capitolo 16). La storia clinica del paziente e la presenza di ulteriori segni RM sono elementi fondamentali per dirimere il dubbio diagnostico; l’interposizione di una sottile banda di sostanza bianca normale tra il margine ventricolare e le alterazioni di segnale è, secondo
alcuni autori, un segno RM indicativo della presenza di aree terminali. Le alterazioni di segnale della LMPV sono inoltre caratterizzate da una maggiore iperintensità FLAIR/T2 rispetto alle cosiddette aree terminali. La LMPV è tipica del pretermine, ma può riscontrarsi anche nel nato a termine, seppure più raramente.
Emorragie della matrice germinativaLe emorragie della matrice germinativa sono lesioni tipiche del pre-termine, la cui incidenza è inversamente proporzionale all’età gesta-zionale e al peso alla nascita. Nella maggioranza dei casi rappresen-tano eventi di entità modesta, tali da non determinare conseguenze significative nella vita del bambino. La patogenesi dell’emorragia si correla alle peculiari caratteristiche vascolari della matrice germinativa; quest’ultima è una struttura subependimale altamente vascolarizzata e con elevato metabolismo, in cui sono generati i precursori dei neuroni destinati a raggiungere la corteccia cerebrale. È una struttura transitoria, che va incontro a involuzione spontanea durante la vita fetale; intor-no alla 32-34ª settimana di gestazione è pressoché completamente scomparsa. I capillari che la compongono possiedono un endotelio sottile e scarso tessuto collagene di sostegno; per tale motivo risultano particolarmente vulnerabili in caso di variazioni del flusso ematico cerebrale o di ossigenazione dei tessuti cerebrali. Da un punto di vista fisiopatologico, si ritiene che l’ipossia possa danneggiare le cellule endoteliali dei capillari della matrice germinativa, con conseguente alterazione della permeabilità capillare cui fa seguito, al momento della riperfusione, la rottura dei capillari stessi con stravaso ematico. La regione anatomica prevalentemente coinvolta è rappresentata dal solco talamo-caudato o solco terminale (linea di confine tra il talamo e il nucleo caudato situata sotto l’ependima, in cui decorre la stria terminale). L’evoluzione dell’emorragia è determinata sostanzialmente dalla sua estensione. Classicamente si distinguono quattro gradi, con gravità crescente a seconda che l’emorragia sia limitata alla regione su-bependimale (grado I), coinvolga i ventricoli laterali senza dilatazione del sistema ventricolare (grado II) (Figg. 18.4 e 18.5) o li coinvolga con dilatazione del sistema ventricolare (grado III), o che si estenda al parenchima cerebrale (grado IV) (Fig. 18.6). Le emorragie di grado IV, caratterizzate pertanto dalla presenza di ematomi intraparenchimali, non sono considerate delle vere emorragie della matrice germinativa, ma piuttosto infarti venosi dovuti alla stasi/congestione delle vene afferenti alla matrice e al conseguente stravaso parenchimale ed en-doventricolare. In circa il 25-35% dei casi, la presenza di sangue nel sistema ventricolare determina l’insorgenza di idrocefalo che necessita di trattamento chirurgico tramite posizionamento di un catetere di derivazione. Le emorragie della matrice vengono generalmente dia-gnosticate e studiate evolutivamente mediante esame ecografico, che rappresenta l’indagine di prima istanza. A differenza della LMPV in cui la TC è scarsamente informativa in fase precoce, nell’emorragia della matrice la TC è in grado di evidenziare con precisione la sede e l’entità del sanguinamento, e le dimensioni ventricolari. La RM è comunque preferibile a scopo radioprotezionistico. Tuttavia, trattandosi di neona-ti prematuri ad alto rischio, il ricorso alla RM avviene solitamente solo in fase subacuta o in presenza di quadri complessi con interessamento parenchimale.
PAToLoGIA IPoSSICo-ISCHEMICA DEL nATo A TERMInE
A differenza del neonato pretermine, in cui è prevalentemente coin-volta la sostanza bianca, nel neonato a termine il pattern lesionale più frequente è rappresentato dal coinvolgimento dei nuclei della base, del talamo e di alcune regioni corticali (corteccia uditiva, sensitivo-motoria e corteccia limbica); queste strutture sono maggiormente
Figura 18.1 Leucomalacia periventricolare in fase subacuta. A,B. Immagini assiali T1. C,D. Immagini assiali T2. Nato alla 33a settimana di gestazione. Esame RM eseguito a distanza di 5 settimane dalla nascita. Si dimostrano multiple piccole aree di alterato segnale, iperintense in T1 e ipointense in T2, in corrispondenza della sostanza bianca periventricolare, bilateralmente, più estese a sinistra (frecce), riferibili a lesioni su base ipossica.

373
CapitoloPatologia ipossico-ischemica neonatale e cerebrovascolare pediatrica | 18 |
esposte agli insulti ipossici poiché presentano un più elevato fabbi-sogno energetico, in relazione alla loro intensa attività metabolica (elevate attività neuronale e ricchezza di recettori del glutammato). La suddetta distribuzione di alterazioni è descritta nella letteratura anato-mopatologica come necrosi neuronale selettiva. Ulteriori pattern lesionali che è possibile riscontrare nel neonato a termine sono rappresentati dalle cosiddette ischemie parasagittali (prevalente coinvolgimento della sostanza bianca e della sostanza grigia dei territori vascolari di confine della convessità) o dall’encefalomalacia multicistica (presenza di mul-tiple aree gliotico-malaciche cortico-sottocorticali bi-emisferiche con aspetto confluente). Il meccanismo eziopatogenetico alla base delle ischemie parasagittali sembra essere rappresentato primariamente, se non esclusivamente, dall’ipotensione arteriosa. L’encefalomalacia multicistica è invece il risultato finale di un esteso danno clastico delle strutture cortico-sottocorticali di entrambi gli emisferi cerebrali. Tut-tavia, l’encefalomalacia multicistica può essere riscontrata anche nei
casi di grave sofferenza ipossica-ischemica del pretermine e, inoltre, può riconoscere eziologie differenti, tra cui la patologia infettiva o la trasfusione feto-fetale, in cui tipicamente colpisce il feto donatore. In linea generale, le ischemie parasagittali sono considerate l’espressione di una sofferenza ipossico-ischemica di grado lieve-moderato, la necrosi neuronale selettiva di grado moderato-grave e l’encefalomalacia multi-cistica di grado estremamente grave. Questo tipo di schematizzazione presenta tuttavia alcune limitazioni, in quanto i quadri suddetti possono sovrapporsi in vario modo.
La RM è la metodica più accurata nella valutazione dell’encefalopatia ipossico-ischemica neonatale. L’imaging convenzionale nelle fasi preco-ci del danno è poco informativo e i quadri morfologici possono essere assai aspecifici. L’avvento delle sequenze in diffusione (DWI) ha tuttavia contribuito in maniera significativa a migliorare l’accuratezza della RM nelle primissime fasi successive all’evento ipossico: già nelle prime 24 ore dall’insulto, ma in maniera più cospicua tra la seconda e la quarta
Figura 18.2 Esiti di leucomalacia periventricolare. A-C. Immagini FLAIR assiali. D. Immagine coronale T2. E. Immagine sagittale T1. Nato alla 29a settimana di gestazione. RM eseguita all’età di 4 anni. Diffuse alterazioni di segnale, iperintense in FLAIR (frecce vuote, A-C) e T2 (frecce vuote, D), di significato gliotico, che coinvolgono la sostanza bianca periventricolare. Si associa un settoriale assottigliamento del corpo calloso (freccia sottile, E). Lieve ampliamento ex vacuo del sistema ventricolare.
Figura 18.3 Esiti di leucomalacia periventricolare. A,B. Immagini assiali T2. C. Immagine sagittale T1. Nato alla 28a settimana di gestazione. RM eseguita all’età di 7 anni. Tipica morfologia del sistema ventricolare con aspetto “squadrato” dei trigoni (frecce vuote, A) e irregolarità dei margini delle celle medie (frecce grosse, B). Diffusa riduzione quantitativa della sostanza bianca prevalentemente posteriore di entrambi gli emisferi cerebrali (asterischi, B) e assottigliamento del corpo calloso (frecce sottili, C).

374
Patologia pediatricaSezione | 3 |
giornata, si possono apprezzare aree di restrizione della diffusione nelle sedi in cui – più tardivamente – con le sequenze convenzionali si tro-veranno lesioni focali. Anche la spettroscopia è estremamente sensibile nelle prime 24 ore, dimostrando la patologica presenza di lattato e la riduzione dell’N-acetilaspartato (NAA). Tuttavia, la notevole sensibilità della spettroscopia non si accompagna ad analoga specificità, in quanto possono riscontrarsi reperti spettroscopici sovrapponibili in molteplici condizioni patologiche. Inoltre, si deve prestare particolare attenzione nell’interpretazione dei dati spettroscopici, in quanto nel neonato a termine sano, tipicamente, il NAA è ridotto rispetto all’adulto e in alcuni casi possono anche essere presenti minime quantità di lattato (entro la 40a settimana). La presenza di lattato è inoltre un reperto fisiologico nei prematuri. L’interpretazione dei dati di spettroscopia va pertanto sempre correlata all’imaging di diffusione, convenzionale e al grado di maturazione cerebrale in funzione dell’età.
A distanza di circa 1 settimana dal danno ipossico le alterazioni della diffusione tendono a scomparire (pseudonormalizzazione), mentre do-po 3-5 giorni dall’evento compaiono alterazioni di segnale iperintense in T1 e iso-ipointense in T2. Nella necrosi neuronale selettiva, tipicamente queste alterazioni coinvolgono i talami (nuclei ventro-postero-laterali), i nuclei lentiformi (generalmente le porzioni posteriori) e in maniera variabile la corteccia uditiva e perirolandica (Figg. 18.7 e 18.8). Poiché può risultare estremamente difficile distinguere il fisiologico ipersegnale T1 riferibile a normale mielinizzazione rispetto alle lesioni ipossico-ischemiche, la mancata visualizzazione dell’iperintensità T1 del braccio posteriore della capsula interna rappresenta un segno neuroradiologico estremamente affidabile per l’identificazione del danno. Così come nella LMPV, anche nella sofferenza ipossico-ischemica del nato a ter-mine si ritiene che l’iperintensità T1 sia conseguente ad aree di focale mineralizzazione, accumulo di macrofagi o aumentata densità cellulare. Con il passare del tempo le alterazioni tendono a stabilizzarsi e gli esiti a distanza si configurano in quadri caratterizzati da perdita di sostanza e gliosi in sede talamica e lenticolare posteriore, spesso associate ad analoghe lesioni cortico-sottocorticali, soprattutto perirolandiche. Nelle ischemie parasagittali, le lesioni presentano caratteristiche di segnale e aspetti evolutivi simili, ma coinvolgono in maniera più selettiva le regioni cortico-sottocorticali dei lobi frontali, parietali e occipitali in territori di confine tra le arterie cerebrali anteriori, medie e posteriori (Fig. 18.9). In fase cronica, in corrispondenza delle regioni anatomiche coinvolte può determinarsi un settoriale raggrinzimento di alcune cir-convoluzioni, che assumono una morfologia “a fungo”, configurando
Figura 18.5 Esiti di emorragia della matrice germinativa. A. Immagine assiale T2. B. Immagine assiale SWI (Susceptibility Weighted Imaging). Stesso paziente della Figura 18.4. Esame RM di controllo eseguito a distanza di 1 anno. Piccola area ipointensa in T2 in corrispondenza del solco talamo-caudato di destra (freccia bianca, A), più evidente nella corrispondente immagine SWI (freccia nera, B), riferibile a piccolo deposito emosiderinico, esito di pregressa emorragia della matrice.
Figura 18.4 Emorragia della matrice germinativa di grado II. A. Immagine assiale T1. B. Immagine assiale T2. C. Immagine assiale Gradient Echo T2*. D. Immagine assiale SWI (Susceptibility Weighted Imaging). Nato alla 29a settimana di gestazione. RM eseguita a 4 settimane dalla nascita. Piccola emorragia subependimale destra con spandimento ematico endoventricolare (frecce, A-D). Il sistema ventricolare non è ampliato. La quota ematica presenta un segnale disomogeneo in T1 e T2 in rapporto a differenti prodotti di degradazione emoglobinica, con prevalenza di metaemoglobina. Si noti la maggiore sensibilità ai prodotti ematici delle sequenze SWI (frecce, D) rispetto alle sequenze T2* GRE (frecce, C).
Figura 18.6 Emorragia della matrice germinativa di grado IV. Immagini assiali TC. Nato alla 30a settimana di gestazione. Esame TC eseguito nella prima giornata di vita. Si apprezza un’estesa quota ematica subependimale a destra (frecce) con inondazione e dilatazione ventricolare. Inoltre, è presente un esteso infarcimento emorragico parenchimale della sostanza bianca frontale (asterischi).

375
CapitoloPatologia ipossico-ischemica neonatale e cerebrovascolare pediatrica | 18 |
Figura 18.7 Necrosi neuronale selettiva in fase subacuta. Immagini assiali T1. Differenti quadri con gravità crescente (più lieve in A, più grave in C) di coinvolgimento dei nuclei lentiformi e dei talami (frecce) in tre neonati a termine con sofferenza ipossico-ischemica. Si noti, in tutti i casi, l’assenza del fisiologico ipersegnale T1 del braccio posteriore della capsula interna.
Figura 18.8 Moderata-grave sofferenza ipossico-ischemica in fase acuta-subacuta. A-C. Immagini assiali T1. D-F. Immagini assiali DWI. G-I. Immagini assiali ADC. Nato a termine. Esame eseguito in 5a giornata di vita. Patologico ipersegnale T1 (frecce, A-C) in corrispondenza dei talami, dei nuclei lentiformi e della corteccia rolandica. Non è apprezzabile il fisiologico segnale dei bracci posteriori delle capsule interne in T1. Le immagini in diffusione evidenziano ipersegnale in DWI (D-F) e iposegnale nelle corrispondenti mappe ADC (G-I).

376
Patologia pediatricaSezione | 3 |
un quadro neuropatologico e radiologico noto come ulegiria. Nei casi più gravi, oltre alle alterazioni suddette possono riscontrarsi, in fase precoce, diffuse aree di restrizione della diffusione che coinvolgono estesamente le regioni cortico-sottocorticali di entrambi gli emisferi ce-rebrali (Fig. 18.10) con successiva diffusa iperintensità T1 della corteccia ed edema della sostanza bianca che evolve più tardivamente in multiple lesioni cavitarie (encefalomalacia multicistica) (Fig. 18.11). Generalmente le regioni infratentoriali sono relativamente risparmiate.
QUADRI PAToLoGICI CoMUnI: CoInVoLGIMEnTo DELLE VEnE MIDoLLARI PRoFonDE
Oltre ai quadri classici finora descritti, alcuni autori hanno recentemente riportato in letteratura un pattern emergente di danno cerebrale neonata-le, su verosimile base ipossico-ischemica, che accomuna sia il prematuro sia il nato a termine. Si tratta delle lesioni da coinvolgimento delle vene midollari profonde. Le vene midollari profonde sono strutture vascolari che, dalla sostanza bianca sottocorticale, decorrono sino alla superficie ventricolare; drenano la sostanza bianca periventricolare e presentano una caratteristica distribuzione anatomica con aspetto a ventaglio. La congestione-trombosi di tali vasi può determinare lesioni clastiche della sostanza bianca, anche in assenza di trombosi dei seni venosi maggio-ri. L’aspetto RM tipico, evidenziabile in particolare grazie all’utilizzo di sequenze sensibili alla suscettibilità magnetica (eco di gradiente T2* o SWI), è quello di lesioni lineari, con aspetto raggiato, marcata-mente ipointense, nel contesto della sostanza bianca periventricolare (Fig. 18.12). Le aree suddette possono inoltre apparire iperintense in T1 e ipointense in T2, con possibile successivo sviluppo di concomitanti alte-razioni cistiche lineari. Possono costituire un reperto isolato o associarsi a ematomi parenchimali e/o emorragie della matrice germinativa. In fase tardiva, a distanza di circa un anno dall’evento, possono configurarsi quadri simili a quelli della LMPV. La principale differenza rispetto a quest’ultima è tuttavia rappresentata da un più frequente coinvolgimento della sostanza bianca adiacente i corni frontali. Secondo un recente stu-dio, la gravità del pattern di prominenza delle vene midollari profonde si correla all’outcome neurologico a distanza di 6 mesi; in particolare, sono state riscontrate sequele neurologiche più gravi nei neonati con maggior grado di prominenza delle vene midollari profonde. La significatività dei risultati che stanno emergendo dalla letteratura sottolinea l’importanza dell’utilizzo di sequenze sensibili alla suscettibilità magnetica (SWI) nello studio del neonato con sofferenza ipossico-ischemica. A nostro avviso, qualora disponibili, tali sequenze dovrebbero entrare a far parte del protocollo standard di studio del neonato ipossico unitamente alle sequenze in diffusione, e alle sequenze convenzionali T1 e T2. Anche in questa condizione il ruolo della spettroscopia è significativo soprattutto nelle prime 24 ore dall’evento lesivo.
PAToLoGIA CEREBRoVASCoLARE In ETà PEDIATRICA
Patologia ischemicaLa patologia ischemica in età pediatrica presenta eziologie significativa-mente differenti rispetto all’adulto; l’aterosclerosi delle grandi arterie e la patologia dei piccoli vasi rappresentano, nel complesso, solo una piccola percentuale dei casi nel bambino. La prognosi può essere sfavorevole, con incompleto recupero neurologico nel 60% dei bambini colpiti, mentre il rischio di ricorrenza per ictus ischemico varia dal 5 al 20%. Gli studi neuroradiologici forniscono risultati sostanzialmente simili a quanto tipicamente riscontrato nell’ictus dell’adulto; generalmente
Figura 18.9 Esiti di pregresse ischemie parasagittali. A. Immagine assiale FLAIR. B. Immagine assiale T2. Esame eseguito all’età di 7 anni. Si dimostrano alterazioni di segnale, iperintense in FLAIR e T2 (frecce vuote), di significato gliotico, in sede cortico-sottocorticale frontale e parietale, con distribuzione parasagittale. Si associa una settoriale “perdita di sostanza” delle regioni coinvolte.
Figura 18.10 Anossia grave e prolungata. A. Immagine assiale T2. B. Immagine assiale T1. C. Immagine assiale DWI. D. Immagine assiale ADC. Nato a termine. Esame eseguito in terza giornata di vita. Le immagini T2 e T1 (A,B) evidenziano una diffusa alterazione del normale segnale della corteccia di entrambi gli emisferi cerebrali, con perdita della differenza di intensità all’interfaccia tra sostanza bianca e grigia. Si notino l’assenza del fisiologico ipersegnale T1 dei bracci posteriori delle capsule interne (frecce, B) e l’estesa restrizione della diffusione (frecce, C,D) nelle regioni cortico-sottocorticali di entrambi gli emisferi cerebrali.

377
CapitoloPatologia ipossico-ischemica neonatale e cerebrovascolare pediatrica | 18 |
si osserva una più rapida evoluzione delle lesioni infartuali verso la malacia. Di seguito sono riportate alcune delle principali condizioni predisponenti allo sviluppo di ictus ischemico in epoca pediatrica.
Anemia falciformeL’anemia falciforme è una delle principali cause di ictus ischemico nei bambini di tutto il mondo, anche se esiste una netta prevalenza in soggetti di discendenza africana. Circa il 10% dei bambini con anemia
falciforme va incontro a ictus sintomatico entro il ventesimo anno di vita, mentre il 20% circa sviluppa lesioni ischemiche clinicamente silenti, responsabili di deficit cognitivo e problemi nell’apprendimento a lungo termine. Inoltre, il rischio di recidiva è estremamente alto, con percentuali di circa il 50% a 3 anni. Gli infarti ischemici sono sostenuti principalmente da lesioni steno-occlusive che interessano prevalente-mente il tratto prossimale dell’arteria cerebrale media e il tratto distale della carotide interna.
Cardiopatie congeniteLe cardiopatie congenite rappresentano la principale causa cardia-ca responsabile dello sviluppo di ictus ischemico in epoca pedia-trica. In particolare, la pervietà del forame ovale e difetti del setto interatriale si correlano a un elevato rischio di ictus sostenuto da un’ostruzione emboligena di rami arteriosi intracranici da parte di coaguli generati in sede cardiaca e che raggiungono il circolo cere-brale. Tipicamente, all’esame RM possono ricontrarsi lesioni infar-tuali isolate o multiple con differente distribuzione (più frequente-mente sono coinvolte le regioni nucleo-basali e la giunzione cortico- sottocorticale).
Stati protromboticiDiversi disordini emocoagulativi in grado di alterare l’equilibrio tra fattori protrombotici e antitrombotici, definibili nel loro complesso come “stati protrombotici o di trombofilia”, possono giocare un ruo-lo importante nell’eziologia dell’ictus ischemico pediatrico. Queste condizioni, che determinano uno stato di ipercoagulabilità, includo-no il deficit di antitrombina III, la proteina S, la proteina C e alcune mutazioni puntiformi a carico di proteine della coagulazione come il fattore V Leiden o, infine, altre anomalie come l’iperomocisteinemia o la presenza di anticorpi antifosfolipidi. I reperti neuroradiologici negli infarti ischemici dovuti a condizioni di ipercoagulabilità sono del tutto
Figura 18.11 Encefalomalacia multicistica. A-C. Immagini assiali T1. D. Immagine coronale T2. E. Immagine sagittale T1. Esame eseguito all’età di 3 anni. Diffusa perdita di sostanza cerebrale con presenza di multiple aree malacico-cavitarie in entrambi gli emisferi cerebrali. Si associa ampliamento ex vacuo del sistema ventricolare e degli spazi subaracnoidei. Atrofia del corpo calloso (freccia, E). Si noti il relativo risparmio delle strutture infratentoriali.
Figura 18.12 Lesioni da coinvolgimento delle vene midollari profonde in nato a termine. A. L’esame TC eseguito in prima giornata di vita documenta la presenza di un’area emorragica in sede periventricolare sinistra (freccia). B. L’immagine RM corrispondente con sequenza T2* GRE, eseguita in seconda giornata di vita, dimostra inoltre multiple alterazioni lineari, con aspetto raggiato, marcatamente ipointense, nel contesto della sostanza bianca periventricolare, compatibili con stasi ematica a livello delle vene midollari profonde (frecce grosse).

378
Patologia pediatricaSezione | 3 |
aspecifici e non consentono di orientare un’ipotesi eziologica. Pertanto, uno screening dei fattori protrombotici deve essere necessariamente incluso nell’iter diagnostico dei pazienti pediatrici con stroke in assenza di evidenti cause eziologiche.
Sindrome di moyamoyaLa sindrome di moyamoya è una vasculopatia arteriosa occlusiva, frequentemente idiopatica, responsabile di circa il 30% degli stroke ischemici in età pediatrica. Può associarsi ad alcune patologie tra cui la neurofibromatosi di tipo 1, la sindrome di Down e l’anemia a cellule falciformi. Si caratterizza per la presenza di una stenosi progressiva della carotide terminale e dei segmenti prossimali delle principali arterie in-tracraniche, con predilezione per il circolo anteriore. Con il progredire della stenosi, il flusso arterioso diverge attraverso vasi collaterali, in particolare le arterie lenticolo-striate e talamo-perforanti, dando luogo a una tipica immagine angiografica/angio-RM simile a una nuvola di fumo (moyamoya in giapponese). Nelle sequenze RM convenzionali sono evidenziabili multiple immagini serpiginose con segnale di tipo vascolare (“vuoto da flusso”) in sede nucleo-capsulare e nelle cisterne della base (Fig. 18.13). Si riscontrano, inoltre, diffusa iperintensità FLAIR lungo i solchi di entrambi gli emisferi cerebrali ed enhance-ment leptomeningeo, espressione di congestione di strutture vascolari piali (ivy sign). Gli studi di RM perfusionale possono essere utili per valutare situazioni di ischemia critica o per selezionare l’emisfero ce-rebrale da rivascolarizzare. L’intervento neurochirurgico consiste nella creazione di un bypass tra circolo carotideo esterno e interno, ottenuto indirettamente, mediante la mobilizzazione di parte del muscolo tem-porale contenente l’arteria temporale superficiale e il suo posiziona-mento sulla superficie piale del cervello (“encefalo-mio-sinangiosi”), o in alternativa mediante diretta anastomosi termino-laterale tra un ramo della temporale superficiale e un ramo distale della cerebrale media. In caso di successo operatorio, l’angio-RM dimostra un incremento di flusso attraverso la temporale superficiale e i rami distali della cerebrale media, mentre gli studi RM di perfusione dimostrano un aumento del volume e del flusso ematico cerebrale dell’emisfero rivascolarizzato.
Arteriopatia cerebrale transitoria (o focale)Si tratta di un’arteriopatia unilaterale a carattere non progressivo che tipicamente coinvolge la porzione sopraclinoidea della carotide interna e le sue diramazioni prossimali. Costituisce la causa più frequente di infarti del territorio lenticolo-striatale. Da un punto di vista angiogra-fico, si osserva stenosi o irregolarità di calibro delle arterie del circolo anteriore (carotide distale, segmento prossimale della cerebrale ante-riore e media). Il meccanismo eziopatogenetico è di tipo infiammato-rio, frequentemente postinfettivo; nel 40-50% dei casi è sostenuto da un’infezione da virus varicella-zoster, avvenuta nel corso dei 12 mesi precedenti (Fig. 18.14). Nella maggior parte dei casi, l’angio-RM mo-stra segni di stabilizzazione o di rimodellamento e miglioramento del calibro vasale a 6 mesi di follow-up.
Dissezione arteriosaPiù della metà dei casi di dissezione delle arterie craniocervicali in epoca pediatrica è dovuta a eventi traumatici, a volte di minima entità. Ulteriori possibili condizioni predisponenti sono rappresentate dalle alterazioni del connettivo: sindrome di Marfan, sindrome di Ehlers-Danlos tipo IV, osteogenesi imperfetta tipo I, policistosi renale autosomica dominante, displasia fibromuscolare e malattia di Menkes. A differenza degli adulti, è stata riscontrata una maggiore incidenza di dissezioni che coinvolgono il circolo arterioso intracranico. La dissezione dell’arteria vertebrale extracranica avviene più frequentemente all’uscita del forame trasver-sario di C2 (imbocco dell’ansa di Tillaux); i segni ischemici possono riguardare bulbo, tronco, cervelletto e lobo occipitale, e sono multi-formi. La dissezione della carotide interna extracranica si localizza tipicamente subito oltre la biforcazione e si manifesta più frequente-mente con infarti ischemici di tipo embolico nel territorio anteriore. Lo studio neuroradiologico deve comprendere l’angio-RM non solo del distretto endocranico, ma anche dei vasi sopra-aortici; la visua-lizzazione del flap intimale o di un doppio lume arterioso si giova in particolare di metodiche angio-RM contrastografiche, ma anche dell’angio-TC. L’assottigliamento “a coda di topo” del lume arterioso
Figura 18.13 Sindrome di moyamoya. A. Immagine assiale DWI. B. Immagine assiale ADC. C. Immagine assiale FLAIR. D. Immagine assiale T2. E. Angio-RM arteriosa (tecnica 3D-TOF). Improvviso deficit focale all’arto inferiore di destra in un bambino di 2 anni. È evidente una lesione infartuale ischemica in fase acuta a sede corticale fronto-rolando-parietale mesiale sinistra (frecce vuote, A,B). Si riscontrano inoltre multiple immagini lineari iperintense in FLAIR (C) lungo i solchi di entrambi gli emisferi cerebrali, in rapporto a congestione vascolare piale (ivy sign). In sede talamo-capsulare e nei nuclei lentiformi sono presenti plurime immagini serpiginose ipointense in T2 (frecce sottili, D) di natura vascolare (segnale di vuoto da flusso). L’angio-RM dimostra la tipica immagine a nuvola di fumo (freccia grossa, E) dovuta a esteso circolo arterioso collaterale (arterie lenticolo-striate e talamo-perforanti).

379
CapitoloPatologia ipossico-ischemica neonatale e cerebrovascolare pediatrica | 18 |
è un segno particolarmente importante, come pure l’identificazione, in RM, dell’iperintensità a semiluna dovuta al contenuto metaemoglo-binico del trombo intramurale, che deve essere attentamente ricercata a livello del basicranio mediante sequenze T1, meglio se con soppres-sione del grasso.
Sindrome MELASLa sindrome MELAS (Mitochondrial Encephalomyopathy, Lactic Aci-dosis, Stroke-like Episodes) è una malattia mitocondriale caratterizzata dalla presenza di un quadro di encefalopatia e miopatia, acidosi lattica ed episodi simil-infartuali. L’età di insorgenza può variare dai primi anni di vita alla tarda età adulta, ma nella maggior parte dei casi i primi segni fanno il loro esordio tra i 4 e i 15 anni. Le manifestazioni
cliniche sono estremamente variabili (cefalea, vomito, convulsio-ni, debolezza muscolare ecc.); il reperto più tipico è rappresentato dall’insorgenza di episodi acuti simil-infartuali, a carattere ricorrente, a volte precipitati da stati febbrili. Gli episodi ictali possono dare luogo a deficit neurologici transitori o permanenti. Il quadro neuro-radiologico è caratterizzato da lesioni simil-infartuali che coinvolgono prevalentemente le regioni emisferiche cortico-sottocorticali posteriori. In particolare, più comunemente sono interessati i lobi parietali e occipitali e meno frequentemente le regioni temporali e frontali; la distribuzione delle lesioni non si correla a precisi territori vascolari e questo dato rappresenta un indizio estremamente importante per porre il sospetto diagnostico. Per quanto concerne l’imaging in dif-fusione, in letteratura sono presenti dati discordanti ed eterogenei. Alcuni autori, soprattutto nei lavori meno recenti, hanno riportato
Figura 18.14 Infarto cerebrale arterioso in un bambino con pregressa infezione da varicella. A-D. Esame RM eseguito in fase iperacuta (8 ore dall’evento ictale) in cui, nella sequenza FLAIR (A), parzialmente viziata da artefatti, è visibile una lieve iperintensità di segnale corticale e striatale a sinistra, mentre l’imaging in diffusione (B,C) mette chiaramente in evidenza aree di restrizione (riferibili a edema citotossico) in corrispondenza del corpo striato di sinistra, della corteccia fronto-opercolare e in sede cortico-sottocorticale parieto-occipitale. Mancata visualizzazione dell’arteria cerebrale media sinistra all’esame angio-RM (D), per occlusione. E-H. Esame RM eseguito a distanza di 6 giorni: evoluzione della lesione infartuale la cui entità è ben documentata sia dalle sequenze FLAIR (E) sia dall’imaging in diffusione (F,G). L’angio-RM arteriosa evidenzia, peraltro, una parziale rivascolarizzazione del circolo dell’arteria cerebrale media sinistra (H). I-N. Esame RM eseguito a distanza di 1 anno: le immagini FLAIR dimostrano esiti ischemici cronicizzati con aree gliotico-malaciche e ampliamento ex vacuo della cella media del ventricolo laterale sinistro e degli spazi subaracnoidei della regione fronto-insulo-parietale omolaterale.

380
Patologia pediatricaSezione | 3 |
la presenza di aree di aumentata diffusività in fase acuta, espressione di edema vasogenico; le descrizioni più recenti riportano invece, in maniera crescente, la presenza di lesioni caratterizzate da restrizione della diffusione. L’esame di spettroscopia può essere utile in quanto in grado di documentare la presenza di lattato anche in aree cerebrali apparentemente indenni o nel liquor contenuto nel sistema ventrico-lare. L’imaging convenzionale dimostra alterazioni con caratteristiche sovrapponibili a lesioni ischemiche che, tuttavia, in alcuni casi pos-sono regredire completamente (Fig. 18.15). Inoltre, possono essere presenti iperintensità T2 che coinvolgono i gangli della base, i talami e la sostanza grigia periacqueduttale. In fase cronica si osservano esiti atrofici e gliotici nelle sedi coinvolte. Anche l’atrofia cerebellare è di comune riscontro. L’esame TC può documentare, inoltre, calcificazioni a evoluzione progressiva nei gangli della base. Nel complesso, il qua-dro neuroradiologico consente di porre il sospetto diagnostico, la cui conferma necessita di un esame bioptico muscolare.
Malformazione aneurismatica della vena di GalenoLa malformazione aneurismatica della vena di Galeno (MAVG) è una ra-ra causa di ictus pediatrico e rappresenta circa il 30% delle malformazio-ni vascolari nei bambini. Il suo riconoscimento è importante in quanto vi è una crescente evidenza che un adeguato trattamento endovascolare, eseguito in un contesto multidisciplinare con la collaborazione di neo-natologi, anestesisti e neurologi, è associato a un significativo migliora-mento della prognosi. La MAVG è una malformazione congenita della circolazione intracranica caratterizzata da un’ampolla venosa mediana (persistenza della vena prosencefalica mediana) con molteplici comu-nicazioni arterovenose ad alto flusso, provenienti da arterie coroidee e pericallose. I neonati affetti possono presentare grave insufficienza car-diaca, sviluppare idrocefalo e, successivamente, atrofia cerebrale. Dopo la prima infanzia possono comparire cefalea e convulsioni, e si accresce la probabilità di sviluppare emorragia intracerebrale o subaracnoidea. La RM dimostra la sacca venosa dilatata, la posizione delle connessioni fistolose e le arterie coinvolte, il drenaggio venoso e l’eventuale presen-za di trombosi endoluminale. La RM mette inoltre in evidenza l’entità del danno parenchimale, con possibili infarti focali e atrofia cerebrale generalizzata, mentre la TC è più sensibile nei confronti di calcificazioni parenchimali (che possono conseguire all’ipertensione venosa cronica). L’angiografia è il gold standard diagnostico e idealmente dovrebbe essere eseguita come primo passo del trattamento endovascolare.
Patologia ipossicaIn età pediatrica, cioè al di fuori del periodo perinatale, il danno cerebrale ipossico riconosce prevalentemente cause traumatiche (per esempio arresto respiratorio durante incidenti automobilistici), annegamento o maltrattamento. In caso di grave sofferenza ipossica, nei bambini di età compresa tra 1 e 2 anni, le lesioni ischemiche coinvolgono preva-lentemente la sostanza grigia dei nuclei della base e la corteccia fron-tale anteriore e parieto-occipitale, spesso con relativo risparmio della corteccia perirolandica e dei talami. Nei bambini di età inferiore a 1 anno (immediatamente dopo il periodo perinatale) il pattern lesio-nale può presentare caratteristiche intermedie tra le lesioni tipiche del neonato e del bambino, con coinvolgimento dei gangli della base, dei talami laterali, delle regioni dorsali del mesencefalo e della corteccia di entrambi gli emisferi cerebrali, comprese le regioni perirolandiche. Nel bambino più grande e nell’adolescente sono primariamente coin-volti i gangli della base, i talami e diffusamente la corteccia cerebrale (in particolare la corteccia sensitivo-motoria e calcarina) (Fig. 18.16). Le sofferenze ipossiche di entità meno severa determinano generalmente lesioni ischemiche cortico-sottocorticali in territori vascolari “di confine”, sia nei bambini più piccoli sia negli adolescenti. In fase iperacuta-acuta (prime 12 ore), l’imaging in diffusione è più sensibile per dimostrare le lesioni che successivamente (a distanza di 24-48 ore) si manifestano anche nelle sequenze convenzionali. In casi di grave sofferenza ipossica, l’esame TC eseguito dopo 12-24 ore dall’evento può documentare diffusa ipodensità cortico-sottocorticale con perdita del normale contrasto tra so-stanza bianca e grigia, associata a un diffuso appianamento dei solchi della convessità, in rapporto a edema cerebrale diffuso (Fig. 18.17). Inoltre, il cervelletto può apparire relativamente iperdenso rispetto alle strutture nervose sovratentoriali (white cerebellum sign) in rapporto a relativa preser-vazione dei tessuti nervosi della fossa cranica posteriore. In fase cronica, gli esami RM e TC evidenziano esiti atrofici, con ampliamento ex vacuo del sistema ventricolare e degli spazi subaracnoidei della convessità.
Patologia emorragicaLa patologia cerebrovascolare di tipo emorragico (emorragia suba-racnoidea, intraparenchimale e/o intraventricolare) è relativamente frequente anche in epoca pediatrica. L’eziologia è multifattoriale, ma tra le varie cause, le malformazioni vascolari e diatesi emorragiche
Figura 18.15 Sindrome MELAS. A,B. Le immagini FLAIR dimostrano diffuse alterazioni di segnale con caratteristiche simil-infartuali che coinvolgono le regioni cortico-sottocorticali del lobo frontale e parietale di destra, senza una distribuzione territoriale arteriosa. C,D. Esame RM eseguito a distanza di 1 anno: le immagini FLAIR dimostrano sostanziale risoluzione delle alterazioni di segnale precedentemente documentate; residua minima atrofia delle regioni cerebrali coinvolte. E. Spettroscopia dell’idrogeno con tecnica PRESS Single Voxel (TE 144 ms). L’esame di spettroscopia della regione nucleo-basale di sinistra (sede in cui non si osservano alterazioni di segnale), eseguito durante il primo esame RM, documenta la patologica presenza di lattato (freccia, E).

381
CapitoloPatologia ipossico-ischemica neonatale e cerebrovascolare pediatrica | 18 |
rappresentano le condizioni predisponenti più comuni. I pazienti con emorragia intracranica presentano un esordio acuto e, in emergenza, l’esame TC senza mezzo di contrasto è la metodica più indicata per identificare la presenza di sangue, la sua sede, l’entità dell’effetto massa e l’eventuale concomitanza di idrocefalo. Successivamente si rende ne-cessaria la RM (comprendente sequenze angio, arteriose e venose) e, a seconda del sospetto diagnostico, anche l’arteriografia convenzionale, che rappresenta il gold standard per la pianificazione del trattamento di aneurismi e malformazioni arterovenose. Di seguito sono descritte le principali cause responsabili di eventi emorragici non traumatici in età pediatrica. Si accenna brevemente, infine, agli infarti emorragici.
Figura 18.16 Sofferenza ipossica in un bambino di 4 anni. Arresto respiratorio a seguito di un incidente automobilistico. Aree ischemiche in fase acuta caratterizzate da restrizione della diffusione (A,B,D,E) e iperintensità FLAIR (C,F) in sede cortico-sottocorticale frontale e parieto-occipitale con coinvolgimento dei nuclei caudati.
Figura 18.17 Grave sofferenza ipossica a seguito di arresto cardiaco in un bambino di 2 anni. A,B. Esame TC eseguito a 20 ore dall’evento. Diffusa ipodensità cortico-sottocorticale con perdita del normale contrasto tra sostanza bianca e grigia, associata a diffuso appianamento dei solchi della convessità, in rapporto a edema cerebrale diffuso. Si noti, inoltre, la diffusa ipodensità dei gangli della base e dei talami (frecce).
Malformazioni arterovenoseLe malformazioni arterovenose (MAV) sono malformazioni caratteriz-zate da anastomosi diretta tra strutture arteriose e venose senza interpo-sizione di un circolo capillare. In genere le connessioni, che hanno sede piale, sono molteplici e danno luogo alla formazione di un groviglio di strutture vascolari (nidus). La presentazione con emorragia riguarda l’80% dei casi pediatrici e si manifesta con cefalea intensa, segni neurolo-gici focali e coma; nel restante 20%, i pazienti si presentano con convul-sioni o sintomatologia neurologica progressiva. In caso di emorragia, la TC dimostra uno stravaso ematico intraparenchimale e/o subaracnoideo, talvolta con spandimento intraventricolare. La RM mostra, alla periferia del focolaio emorragico, strutture vascolari anomale che spesso risultano più evidenti nelle sequenze T2 rispetto a quelle angio-RM, soprattutto nelle fasi iniziali, in cui lo spasmo può rendere difficoltosa la loro individuazione (Fig. 18.18). In tutti i casi di MAV deve essere presa in considerazione l’ipotesi di una teleangiectasia emorragica ereditaria, o sindrome di Rendu-Osler-Weber, patologia autosomica dominante in cui coesistono MAV cerebrali spesso multiple, epistassi, teleangiectasie linguali e fistole arterovenose polmonari. La terapia delle MAV si giova molto spesso di un approccio endovascolare, che può – a seconda dei casi – essere combinato con la chirurgia o la radiochirurgia.
Malformazioni cavernose cerebraliLe malformazioni cavernose cerebrali (MCC), altrimenti note come cavernomi cerebrali, sono anomalie vascolari del versante venoso ca-ratterizzate da multiple concamerazioni a basso flusso, tipicamente occulte all’esame angiografico. Il riscontro di queste anomalie è talora incidentale e avviene durante esami RM eseguiti per altre indicazioni; inoltre è frequente in pazienti sottoposti a radioterapia encefalica. In età pediatrica la presentazione più comune è con emorragia (30% dei casi) o con convulsioni (25% dei casi). Il microsanguinamento costituisce un evento caratteristico nella storia naturale delle MCC e determina

382
Patologia pediatricaSezione | 3 |
l’accumulo di emosiderina alla periferia della malformazione e la de-posizione di calcificazioni distrofiche. A ciò consegue il tipico aspetto neuroradiologico, caratterizzato da iperdensità e fini calcificazioni alla TC e ipointensità in T2, soprattutto evidente nelle sequenze T2*, sensibili alla suscettibilità magnetica (GE e SWI) in cui l’alone ipoin-tenso è più evidente ed esteso (blooming). Le lesioni possono presentare inoltre componenti spontaneamente iperintense in T1 in rapporto a contenuto metaemoglobinico. Le dimensioni possono essere variabili, da millimetriche a svariati centimetri (cavernomi giganti, tipici della popolazione pediatrica) (Fig. 18.19). Il riscontro di una MCC deve indurre alla ricerca di altri cavernomi nell’intero nevrasse (includendo
il midollo spinale), per la possibilità di cavernomatosi familiare su base genetica; inoltre, è frequente l’associazione con anomalie di sviluppo venoso, caratterizzate dalla tipica architettura vascolare a caput medusae, chiaramente identificabile nelle sequenze post-contrasto o SWI.
Aneurismi cerebraliGli aneurismi cerebrali sono rari nei bambini (5% del numero totale degli aneurismi nella popolazione generale). In questa fascia di età vi è una distinta predominanza maschile, una maggiore inci-denza di aneurismi di grandi dimensioni e una minore incidenza di aneurismi multipli. Nella maggioranza dei casi, coinvolgono la porzione distale e la biforcazione della carotide interna. Gli aneuri-smi possono essere riscontrati anche in pazienti con MAV, sindrome di moyamoya e anemia falciforme. In età pediatrica devono, inoltre, essere attentamente ricercate possibili condizioni predisponenti, quali coartazione aortica, malattia del rene policistico, displasia fibromuscolare, sindrome di Marfan e di Ehlers-Danlos tipo IV. La semeiotica neuroradiologica degli aneurismi in età pediatrica e delle eventuali complicanze emorragiche è del tutto sovrapponibile a quella dell’adulto.
CoagulopatieLe condizioni di diatesi emorragica possono riscontrarsi in caso di neoplasie ematologiche, come la leucemia acuta, in cui la trombocito-penia (piastrine <20.000/mm3) è l’evento causale. L’emofilia causa una percentuale variabile tra il 2 e il 14% delle emorragie intracraniche. I farmaci anticoagulanti tra cui l’eparina e derivati, utilizzati per esempio nel corso di interventi cardiochirurgici o come terapia per disturbi di ipercoagulabilità, sono un’ulteriore importante causa di emorragia intracranica. Le caratteristiche TC e RM non orientano per un’eziologia specifica. Un pattern lesionale più tipico si configura invece in caso di coagulazione intravascolare disseminata (CID), dove si evidenziano ge-neralmente multiple lesioni emorragiche focali di entrambi gli emisferi cerebrali, prevalenti in sede sottocorticale (Fig. 18.20).
Infarti emorragici e trombosi venosaGli infarti emorragici possono determinarsi a seguito di una trasfor-mazione emorragica di un infarto arterioso embolico, sostenuta da un meccanismo di riperfusione del letto vascolare danneggiato, o in caso di patologia veno-occlusiva (trombosi venosa); in quest’ultima con-dizione, l’ostruzione del deflusso venoso determina incremento della pressione venosa a monte, stasi ematica nel letto arteriolo-capillare, ischemia e infine spandimento ematico cerebrale. La sede dell’infarto emorragico corrisponde a un territorio vascolare arterioso quando la genesi è embolica; gli infarti venosi non presentano invece una distri-buzione territoriale arteriosa, ma venosa. La trasformazione emorragica di un infarto ischemico avviene, inoltre, tipicamente in fase subacuta;
Figura 18.18 MAV emorragica in bambino di 8 anni. A. Immagine assiale TC. B. Immagine assiale T2. C. Immagine sagittale T2. D. Angiografia digitale. L’esame TC documenta una piccola lesione emorragica (freccia vuota, A) adiacente al corno frontale di sinistra con inondazione ventricolare. L’esame RM, oltre ai reperti suddetti, dimostra sottili immagini vascolari (vuoto da flusso) adiacenti all’emorragia (frecce, B,C) che pongono il sospetto per una possibile malformazione vascolare sottostante. L’angiografia digitale conferma il sospetto diagnostico mettendo chiaramente in evidenza il nidus malformativo (ovale, D) e lo scarico venoso precoce (freccia grossa, D).
Figura 18.19 Cavernoma gigante emorragico. A. Immagine coronale T2. B. Immagine assiale T2* GRE. C. Immagine sagittale T1. Voluminosa lesione con caratteristiche emorragiche nel cui contesto sono apprezzabili prodotti emoglobinici in differente fase di degradazione e anello emosiderinico ben evidente nelle sequenze in eco di gradiente (B). Si associa edema perilesionale (frecce, A,C).

383
CapitoloPatologia ipossico-ischemica neonatale e cerebrovascolare pediatrica | 18 |
gli infarti venosi possono invece presentare già all’esordio componenti emorragiche. La trombosi venosa profonda (con coinvolgimento delle vene cerebrali interne) tende a prevalere in pazienti in età neonatale o nella prima infanzia rispetto alla trombosi venosa superficiale, che prevale nel bambino più grande o in età adulta. La TC senza mezzo di contrasto è spesso il primo studio diagnostico nel paziente con trombo-si dei seni venosi e mette in evidenza un’iperdensità del seno coinvolto dovuta alla presenza del coagulo. Va tenuto presente che nel neonato i seni venosi appaiono normalmente iperdensi, il che rende difficoltosa la diagnosi, incrementando i falsi positivi. Il segno del “delta”, in cui il trombo endoluminale viene delineato come difetto di opacizzazione contornato dalla maggiore densità dell’enhancement durale circostante, è il gold standard diagnostico e richiede, per un’ottimale dimostrazione, la tecnica angio-TC. L’esame RM è comunque da preferire in età pedia-trica, almeno in prima istanza. All’esame RM, il segnale del trombo varia in funzione dello stato di degradazione emoglobinica all’interno del coagulo. Se nelle fasi subacute l’iperintensità T1 e T2 ne rendono
piuttosto semplice il riconoscimento, nelle fasi acute l’analisi delle sequenze convenzionali può generare una falsa impressione di pervietà del seno, in quanto il trombo è isointenso in T1 e ipointenso in T2. Nei neonati, anche l’esame RM può generare falsi positivi, in quanto la fisiologica ridotta velocità di flusso, unitamente alle piccole dimensioni del lume vasale, può contribuire a determinare settoriali aree di assenza del tipico segnale di vuoto da flusso. A sua volta, l’angio-RM risente di aspetti tecnici (nelle sequenze TOF, l’iperintensità T1 della metae-moglobina può simulare la pervietà del seno) e anche della situazione anatomica; in particolare esiste in genere una fisiologica asimmetria dei collettori trasverso-sigmoidei e delle vene giugulari interne, con ten-denza alla prevalenza del lato destro; in situazioni estreme, un’ipopla-sia anatomica può essere confusa con un’assenza di flusso dovuta a trombosi. In genere, la diagnosi di trombosi dei seni venosi può essere difficile alla RM, soprattutto in fase acuta e nei neonati, e richiede un elevato indice di sospetto e una valutazione combinata dei reperti RM e angio-RM in correlazione al quadro clinico (vedi Capitolo 16).
Figura 18.20 Coagulazione intravascolare disseminata in un bambino di 4 anni affetto da leucemia in fase terminale. A-C. Immagini assiali TC. In quadro di edema cerebrale diffuso sono presenti multiple lesioni emorragiche focali in entrambi gli emisferi cerebrali in corrispondenza della giunzione cortico-sottocorticale.
LETTURE ConSIGLIATE
Acciarri N, Galassi E, Giulioni M, et al. Cavernous malformations of the central nervous system in the pediatric age group. Pediatr Neurosurg 2009;45:81–104.
Argyropoulou MI. Brain lesions in preterm infants: initial diagnosis and follow-up. Pediatr Radiol 2010;40:811–8.
Arrigoni F, Parazzini C, Righini A, et al. Deep medullary veins involvement in neonates with brain damage: an MR imaging study. Am J Neuroradiol 2011 Sep 29 [Epub ahead of print].
Back SA, Luo NL, Borenstein NS, et al. Late oligodendrocyte progenitors coincide with the developmental window of vulnerability for human perinatal white matter injury. J Neurosci 2001;21:1302–12.
Barkovich A, Sargent S. Profound asphyxia in the premature infant: imaging findings. Am J Neuroradiol 1995;16:1837–46.
Barkovich A, Truwit C. Brain damage from perinatal asphyxia: correlation of MR findings with gestational age. Am J Neuroradiol 1989;11:1087–96.
Barron TF, Gusnard DA, Zimmerman RA, Clancy RR. Cerebral venous thrombosis in neonates and children. Pediatr Neurol 1992;8:112–6.
Chabrier S, Rodesch G, Lasjaunias P, et al. Transient cerebral arteriopathy: a disorder recognized by serial angiograms in children with stroke. J Child Neurol 1998;13:27–32.
Chao CP, Zaleski CG, Patton AC. Neonatal hypoxic-ischemic encephalopathy: multimodality imaging findings. Radiographics 2006;26:159–72.
Choux M, Lena G, Genitori L. Intracranial aneurysms in children. In: Raimondi A, Choux M, Di Rocco C, editors. Cerebrovascular disease in children. Vienna: Springer; 1992. p. 123–31.
Cornette LG, Tanner SF, Ramenghi LA, et al. Magnetic resonance imaging of the infant brain: anatomical characteristics and clinical significance of punctate lesions. Arch Dis Child Fetal Neonatal Ed 2002;86:171–7.
Counsell S, Allsop J, Harrison M, et al. Diffusion weighted imaging of the brain in preterm infants with focal and diffuse white matter abnormality. Pediatrics 2003;112:1–7.
Counsell SJ, Tranter SL, Rutherford MA. Magnetic resonance imaging of brain injury in the high-risk term infant. Semin Perinatol 2010;34:67–78.
de Vries LS, Groenendaal F, Meiners L. Ischemic lesions in the preterm babies. In: Rutherford M, editor. MRI of the neonatal brain. London: Saunders; 2002.
Doneda C, Righini A, Parazzini C, et al. Prenatal MR imaging detection of deep medullary vein involvement in fetal brain damage. Am J Neuroradiol 2011;32:146–9.
Faraci M, Morana G, Bagnasco F, et al. Magnetic resonance imaging in childhood leukemia survivors treated with cranial radiotherapy: a cross sectional, single center study. Pediatr Blood Cancer 2011;57:240–6.
Ganesan V, Prengler M, McShane MA, et al. Investigation of risk factors in children with arterial ischemic stroke. Ann Neurol 2003;53:167–73.
Garcia-Monaco R, Taylor W, Rodesch G, et al. Pial arteriovenous fistula in children as presenting manifestation of Rendu- Osler-Weber disease. Neuroradiology 1995; 37:60–4.
Ghazi-Birry HS, Brown WR, Moody DM, et al. Human germinal matrix: venous origin of hemorrhage and vascular characteristics. Am J Neuroradiol 1997;18:219–29.

384
Patologia pediatricaSezione | 3 |
Graus F, Rogers LR, Posner JB. Cerebrovascular complications in patients with cancer. Medicine 1985;64:16–35.
Hladky JP, Lejeune JP, Blond S, et al. Cerebral arteriovenous malformations in children: report of 62 cases. Childs Nerv Syst 1994;10:328–33.
Huang BY, Castillo M. Hypoxic-Ischemic brain injury: imaging findings from birth to adulthood. RadioGraphics 2008;28:417–39.
Ito H, Mori K, Kagami S. Neuroimaging of stroke-like episodes in MELAS. Brain Dev 2011;33:283–8.
Kadhim H, Tabarki B, Verellen G, et al. Inflammatory cytokines in the pathogenesis of periventricular leukomalacia. Neurology 2001;56:1278–84.
Kirkham FJ, Prengler M, Hewes DK, et al. Risk factors for arterial ischemic stroke in children. J Child Neurol 2000;15:299–307.
Kitamura G, Kido D, Wycliffe N, et al. Hypoxic-ischemic injury: utility of susceptibility-weighted imaging. Pediatr Neurol 2011;45:220–4.
Lasjaunias P. Intracranial aneurysms in children. In: Lasjaunias P, editor. Vascular diseases in neonates, infants and children: interventional neuroradiology management. Berlin: Springer; 1997.
Lasjaunias PL, Chng SM, Sachet M, et al. The management of vein of Galen aneurysmal malformations. Neurosurgery 2006;59: S184–94.
Leach JL, Fortuna RB, Jones BV, et al. Imaging of cerebral venous thrombosis:
current techniques, spectrum of findings, and diagnostic pitfalls. Radiographics 2006;26(Suppl.1):S19–41.
Lechat PH, Pas JL, Lascault G, et al. Prevalence of patent foramen ovale in patients with stroke. N Engl J Med 1988;318:1148–52.
Liauwa L, van der Grond J, Slooff V, et al. Differentiation between peritrigonal terminal zones and hypoxic-ischemic white matter injury on MRI. Eur J Radiol 2008;65:395–401.
Lodigiani C, Ferrazzi P, Librè L. Ipercoagulabilità e trombofilia nello stroke giovanile. Riv It Neurobiologia 2008;54:53–63.
Patay Z. Metabolic disorders. In: Tortori-Donati P, editor. Pediatric neuroradiology. Berlin: Springer; 2005.
Rafay MF, Armstrong D, Deveber G, et al. Craniocervical arterial dissection in children: clinical and radiographic presentation and outcome. J Child Neurol 2006;21:8–16.
Ramenghi L, Mosca F, Counsell S, et al. Magnetic resonance imaging of the brain in preterm infants. In: Tortori-Donati P, editor. Pediatric neuroradiology. Berlin: Springer; 2005.
Recinos PF, Rahmathulla G, Pearl M, et al. Vein of galen malformations: epidemiology, clinical presentations, management. Neurosurg Clin N Am 2012;23:165–77.
Rooney CM, Kaye EM, Scott M, et al. Modified encephaloduroarteriosynangiosis as a surgical treatment of childhood moyamoya disease: Report of five cases. J Child Neurol 1991; 6:24–31.
Rutherford M, Malamateniou C, McGuinness A, et al. Magnetic resonance imaging in hypoxic-
ischaemic encephalopathy. Early Human Development 2010;86:351–60.
Sébire G. Transient cerebral arteriopathy in childhood. Lancet 2006;368:8–10.
Smith ER, Scott RM. Cavernous malformations. Neurosurg Clin N Am 2010;21:483–90.
Takashima S, Mito T, Ando Y. Pathogenesis of periventricular white matter hemorrhages in preterm infants. Brain Dev 1986;8:25–30.
Taylor SB, Quencer RM, Holzman BH, et al. Central nervous system anoxic-ischemic insult in children due to near-drowning. Radiology 1985;156:641–6.
Triulzi F, Baldoli C, Righini A. Neonatal hypoxic-ischemic encephalopathy. In: Tortori-Donati P, editor. Pediatric neuroradiology. Berlin: Springer; 2005.
Triulzi F, Parazzini C, Righini A. Patterns of damage in the mature neonatal brain. Pediatr Radiol 2006;36:608–20.
Whitlock JA, Janco RL, Phillips JA. Inherited hypercoagulable states in children. Am J Pediatr Hematol Oncol 1989;11:170–3.
Yoon HK, Shin HJ, Chang YW. “Ivy sign” in childhood moyamoya disease: depiction on FLAIR and contrast-enhanced T1-weighted MR images. Radiology 2002;223:384–9.
Zimmerman RA, Bilaniuk LT. Cerebrovascular disease in infants and children. In: Tortori-Donati P, editor. Pediatric neuroradiology. Berlin: Springer; 2005.
Zimmerman RA. Vascular injuries of the head and neck. Neuroimaging Clin N Am 1991;1:443–59.