BAB II (Dina Fitria) (Repaired)
-
Upload
mgs-a-rifqi-murtadho -
Category
Documents
-
view
100 -
download
1
description
Transcript of BAB II (Dina Fitria) (Repaired)
BAB II
34
BAB II
TINJAUAN PUSTAKA
2.1 Lerek (Phyrinium pubinerve Blume)2.1.1Klasifikasi Lerek
Gambar 1. Tanaman Lerek (Phyrinium pubinerve Blume)Sumber: India BiodiversityKingdom
: PlantaeFilum
: MagnoliophytaKelas
: LiliopsidaOrdo
: ZingiberalesFamili
:MarantaceaeGenus
:PhryniumSpesies
:Phyrinium pubinerve
(Global Biodiversity Information Facility, 2011)
Secara luas spesies ini dapat ditemukan di sepanjang Asia Tenggara. Tanaman ini dapat diidentifikasi dari bentuk morfologinya yang merupakan kombinasi dari buah berwarna merah, bunga yang berbentuk menyerupai kepala dengan keseluruhan daun, dan bunga-bunganya yang memiliki dua buah benag sari steril di bagian luar.2.1.2 Morfologi dan Habitat Lerek Tanaman lerek (Phyrinium pubinerve Blume) merupakan tanaman herbal yang berbentuk melingkar (rosulate/rosette), dengan tinggi 0,7-3,5 m. Daun-daunnya tumbuh 2-3 helai dari masing-masing tunas, tepian daun (lamina) 23-82 x 9-30 cm, daunnya hanya berambut pada bagian tengah. Perbungaan ini berkembang pada tunasnya, berdiri tegak, biasanya muncul dari tangkai daun dari daun yang menyertainya, berbentuk bundar menyerupai kepala dengan diameter 4-8 cm, lapisan tipis (bract) menyelubungi perbungaan tersebut dengan cepat, bunganya berpasangan 2-4. Bunga tanaman ini berwarna merah muda-putih, dengan panjang 1,8 cm dan bagian sepal 10 mm. Buahnya berwarna merah terang, berbentuk lonjong hingga menyerupai segitiga dengan luas permukaan 15 x 10 mm.Tanaman ini secara luas terdistribusi di wilayah Asia Tenggara, dari India hingga Myanmar, Thailand, Laos, Vietnam, Kamboja, Semenanjung Malaysia, Sumatera, Jawa, Kalimantan, Filipina, dan Papua New Guinea/ Tanaman ini dikenal dengan nama Onese dalam bahasa Suku Tolaki, Sulawesi (Kramadibrata, 2011)
Spesies ini dapat tumbuh secara liar di lahan basah, sekitar rawa/sungai, di tepian jalan, atau bahkan di sekitar perkebunan karet tua (Wakur, 2013).2.1.4Tinjauan Zat Antioksidan dan Antibakteri Lerek
Menurut penelitian yang telah dilakukan oleh Ren Li et al, kandungan senyawa kimia utama yang ada pada tanaman lerek dengan metode analisis Gas Chromatography/Mass Spectrometry adalah (Z)-3-hexen-1-ol (17,31%), (E)-2-hexenal (9,01%) dan 1-hexanol (8,61%). Tanaman ini telah sering digunakan oleh warga pribumi sebagai tanaman pembungkus makanan yang memiliki efek antioksidan tinggi serta antibakteri. Wilayah dengan temperatur yang tinggi menyebabkan makanan cepat mengalami reaksi oksidasi, namun dengan teori berbasis empiris masyarakat pribumi Asia Tenggara maupun Semenanjung Malaysia menggunakan daun lerek (Phyrinium pubinerve Blume) sebagai pembungkus makanan yang menurut penelitian mengandung Phytol, 2-Methoxy-4-vinylphenol dan Eugenol sebagai antioksidan. Eugenol merupakan senyawa kimia yang bersifat bakteriostatik terhadap fungi dan bakteri (Cowan, 1999). Eugenol biasanya digunakan pada parfum, minyak esensial, dan bahan medis. Eugenol dan isoeugenol merupakan turunan dari prekursor lignin; asam ferulat atau alkohol koniferil (Rhodes, 2008). Selain itu, kandungan fenol pada tanaman ini juga merupakan senyawa yang bersifat toksik terhadap bakteri.
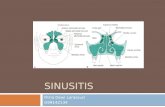
2.2Bakteri Staphylococcus aureus
Gambar 2. S. aureus(Sumber: Jawetz, Melnick, & Adelbergs Medical Microbiology, 24th Edition)
Klasifikasi S. aureusKingdom: Protozoa
Divisi: Schyzomycetes
Kelas: Schyzomycetes
Ordo: Eubacterialos
Famili: Micrococcaceae
Genus: Staphylococcus
Spesies: Staphylococcus aureus (Salle, 1961)
2.2.1Morfologi dan Karakteristik Staphylococcus aureus
Staphylococcus aureus merupakan bakteri Gram positif berbentuk bulat (sferis) berdiameter 0,7-1,2 m, termasuk famili Micrococcaceae, memiliki genom kromosom sirkuler sekitar 2800 kb (kilobasa), memiliki plasmid dan transposon, tersusun dalam kelompok-kelompok yang tidak teratur seperti buah anggur, fakultatif anaerob, tidak membentuk spora, tidak bergerak, dan telah dikenal sejak abad ke-19 (Yuwono, 2010). Kokus muda berwarna gram positif kuat dan pada proses penuaan bakteri ini banyak sel menjadi gram negatif. Organisme ini mudah tumbuh pada banyak jenis medium dan aktif secara metabolis, memfermentasi karbohidrat dan menghasilkan pigmen yang bervariasi dari putih sampai kuning tua. Bakteri ini tumbuh pada suhu optimum 37 C, tetapi membentuk pigmen paling baik pada suhu kamar (20-25 C). Koloni pada perbenihan padat berwarna abu-abu sampai kuning keemasan, berbentuk bundar, halus, menonjol, dan berkilau. Lebih dari 90% isolat klinik menghasilkan S. aureus yang mempunyai kapsul polisakarida atau selaput tipis yang berperan dalam virulensi bakteri (Jawetz et al., 1995 ; Novick et al., 2000).
Beberapa anggota dari genus Staphylococcus merupakan flora normal kulit dan membran mukosa lainnya menyebabkan supurasi, pembentukan abses, berbagai infeksi piogenik dan bahkan sepsis yang fatal. Stafilokok patogen sering kali menghemolisis darah, menyebabkan koagulasi plasma, dan menghasilkan berbagai toksin serta enzim ekstraseluler. Keracunan makanan yang paling umum disebabkan secara global disebabkan oleh enterotoksin stafilokok yang stabil terhadap suhu panas. Stafilokok dengan cepat menjadi resisten terhadap banyak agen antimikroba dan menimbulkan persoalan terapi yang sulit.
Genus Stayphylococcus mempunyai paling sedikit empat puluh spesies. Tiga spesies yang paling sering dijumpai yang mempunyai kepentingan klinis adalah Staphylococcus aureus, Staphylococcus epidermidis, dan Staphylococcus saprophyticus. S. aureus bersifat koagulase positif yang merupakan enzim penghancur jaringan dan yang membedakannya dari spesies yang lain. Enzim koagulase yang dimiliki oleh bakteri patogen S. aureus bekerja sama dengan faktor pembekuan darah menyebabkan koagulasi plasma. Koagulase berperan dalam pembentukan dinding fibrin di sekeliling lesi stafilokokus yang membantu bakteri ini tetap berada di dalam jaringan. Koagulase juga menyebabkan penumpukan fibrin pada permukaan tiap stafilokok yang dapat membantu melindungi bakteri dari fagositosis atau dari penghancuran di dalam sel fagosit. Oleh karena itu, S. aureus seringkali disebut-sebut sebagai patogen utama manusia. (Brooks dkk, 2013).
Stafilokok koagulase negatif merupakan flora normal manusia dan kadang-kadang menyebabkan infeksi, sering berkaitan dengan alat implan seperti protesis sendi, shunt, dan kateter intravaskular, terutama pasien-pasien yang terlalu muda, tua, maupun immunocompromised.
Stafilokok tumbuh dengan mudah pada sebagian besar media bakteriologis dengan kondisi aerob atau mikroaerofilik. Tumbuh paling cepat pada 37 C, tetapi membentuk pigmen paling baik pada temperatur ruang (20-25 C). Koloni pada media solid berbentuk bulat, halus, timbul dan mengilat. S. aureus biasanya membentuk koloni berwarna abu-abu hingga putih pada isolasi primer; banyak koloni menghasilkan pigmen hanya pada inkubasi yang berkepanjangan. Berbagai tingkat hemolisis ditimbulkan oleh S. aureus dan kadang-kadang oleh spesies lainnya, Peptostreptococcus dan Peptoniphilus sp., yang merupakan kokus anaerob, secara morfologi sering menyerupai stafilokok. .2.2.2 Patogenesis dan patologi Staphylococcus aureus
Sebagian bakteri Stafilokokus merupakan flora normal pada kulit, saluran pernafasan, dan saluran pencernaan makanan pada manusia. Bakteri ini juga ditemukan di udara dan lingkungan sekitar. S. aureus yang patogen bersifat invasif, menyebabkan hemolisis, membentuk koagulase, dan mampu meragikan manitol (Warsa, 1994).
Infeksi oleh S. aureus ditandai dengan kerusakan jaringan yang disertai abses bernanah. Beberapa penyakit infeksi yang disebabkan oleh S. aureus adalah bisul, jerawat, impetigo, dan infeksi luka. Infeksi yang lebih berat diantaranya pneumonia, mastitis, plebitis, meningitis, infeksi saluran kemih, osteomielitis, dan endokarditis. S. aureus juga merupakan penyebab utama infeksi nosokomial, keracunan makanan, dan sindroma syok toksik (Ryan, et al., 1994; Warsa, 1994).
Staphylococcus aureus mampu menginvasi jaringan tubuh manusia dengan menggunakan toksin dan enzim ekstraseluler yang dihasilkannya dan rendahnya daya tahan tubuh menyebabkan infeksi mudah terjadi (Brooks dkk, 2013). Patogenesis Staphylococcus aureus disebabkan oleh ekspresi dari faktor-faktor virulensi yang dapat mengakibatkan lesi superfisial kulit, misalnya furunkel, paronychia, dan styes, atau infeksi yang lebih serius, seperti pneumonia, mastitis, infeksi saluran kemih, osteomielitis, endokarditis, meningitis dan sepsis. Infeksi terjadi akibat inokulasi pada luka yang terbuka. Terkadang infeksi melalui saluran pernapasan atas yang menyebabkan kerusakan mukosa dan menjadi predisposisi infeksi pneumonia, biasanya terjadi satu minggu setelah onset infeksi influenza (Liu, 2010).
Lesi oleh Staphylococcus sp menyebabkan nekrosis jaringan setempat akibat perkembangbiakan kuman. Selanjutnya terjadi koagulasi fibrin di sekitar lesi dan pembuluh getah bening sehingga terbentuk dinding yang membatasi proses nekrosis. Kemudian disusul dengan serbukan sel radang, di pusat lesi akan terjadi pencairan jaringan nekrotik, cairan abses ini akan mencari jalan keluar di tempat yang paling kurang tahanannya. Pengeluaran cairan abses diikuti dengan pembentukan jaringan granulasi. Sifat khas dari infeksi Staphylococcus sp. adalah terjadinya peradangan setempat. Dari fokus ini kuman akan menyebar ke bagian tubuh lain lewat pembuluh getah bening dan pembuluh darah, sehingga peradangan dari vena dan thrombosis pun merupakan hal yang biasa (Brooks dkk, 2013).2.2.3 Faktor Virulensi S. aureusBerbagai zat yang berperan sebagai faktor virulensi dapat berupa protein, termasuk enzim dan toksin, contohnya: Katalase
Katalase adalah enzim yang berperan pada daya tahan bakteri terhadap proses fagositosis. Tes adanya aktivtias katalase menjadi pembeda genus Staphylococcus dari Streptococcus. Stafilokok menghasilkan katalase yang mengubah hidrogen peroksida menjadi air dan oksigen (Ryan dkk, 1994; Brooks dkk, 2013). Koagulase
Enzim ini dapat menggumpalkan plasma oksalat atau plasma sitrat, karena adanya faktor koagulase reaktif dalam serum yang bereaksi dengan enzim tersebut. Esterase yang dihaslkan dapat meningkatkan aktivitas penggumpalan, sehingga terbentuk deposit fibrin pada permukaan sel bakteri yang dapat menghambat fagositosis (Warsa, 1994).
Hemolisin
Hemolisin merupakan toksin yang dapat membentuk suatu zona hemolisis di sekitar koloni bakteri. Hemolisin pada S. aureus terdiri dari alfa hemolisin, beta hemolisisn, dan delta hemolisin. Alfa hemolisin adalah toksin yang bertanggung jawab terhadap pembentukan zona hemolisis di sekitar koloni S. aureus pada medium agar darah. Toksin ini dapat menyebabkan nekrosis pada kulit hewan dan manusia. Beta hemolisin adalah toksin yang terutama dihasilkan Stafilokok yang diisolasi dari hewan, yang menyebabkan lisis pada sel darah merah domba dan sapi. Sedangkan delta hemolisin adalah toksin yang dapat melisiskan sel darah merah manusia dan kelinci, tetapi efek lisisnya kurang terhadap sel darah merah domba (Warsa, 1994).
Eksotoksin
Toksin- adalah protein heterogen yang bekerja pada spektrum luas membran sel eukariot. Toksin- merupakan hemolisis poten. Toksin-( mendegradasi sfingomielin dan karena itu bersifat toksik untuk banyak jenis sel, termasuk sel darah merah manusia. Toksin-( bersifat heterogen dan mengalami disosiasi menjadi subunit-subunit di dalam detergen nonionik. Toksin ini merusak membran biologi dan mungkin mempunyai peran pada penyakit diare S. aureus. Hemolisin ( yang berinteraksi dengan dua protein leukosidin panton-valentine mampu secara efisien melisis sel darah putih dengan menimbulkan pembentukan pori pada membran sel, yang meningkatkan permeabilitas kation. Hal ini menyebabkan pelepasan masif mediator inflamasi seperti IL-8, leukotrien, dan histamin yang bertanggung jawab atas inflmasi berat dan nekrosis (Brooks dkk, 2013). Leukosidin panton-valentine
Toksin S. aureus ini mempunyai dua komponen. Toksin ini dapat membunuh sel darah putih manusia dan kelinci. Dua komponen yang dapat disebut sebagai S dan F bekerja secara sinergis pada membran sel darah putih. Toksin ini merupakan faktor virulensi penting dalam infeksi S. aureus yang resisten terhadap metisilin yang berhubungan dengan komunitas (Brooks dkk, 2013). Toksin eksfoliatif
Toksin ini mempunyai aktivitas proteolitik dan dapat melarutkan matriks mukopolisakarida epidermis, sehingga menyebabkan pemisahan intraepitelial pada ikatan sel di stratum granulosum. Toksin eksfoliatif merupakan penyebab Staphylococcal Scalded Skin Syndrome, yang ditandai dengan melepuhnya kulit (Warsa, 1994).
Toksin Sindrom Syok Toksik
Sebagian besar galur S. aureus yang diisolasi dari penderita sindrom syok toksik menghasilkan eksotoksin pirogenik. Pada manusia, toks in ini menyebabkan demam, syok, ruam kulit, dan gangguan multisistem organ dalam tubuh (Ryan dkk, 1994; Brooks dkk, 2013). Enterotoksin
Enterotoksin adalah enzim yang tahan panas dan tahan terhadap suasana basa di dalam usus. Enzim ini merupakan penyebab utama dalam keracunan makanan, terutama pada makanan yang mengandung karbohidrat dan protein (Brooks dkk, 2013).2.2.4 Pengobatan Staphylococcus aureus
Abses dan lesi supuratif diterapi dengan drainase yang merupakan tindakan penting, dan terapi antimikroba. Banyak obat antimikroba mempunyai beberapa efek terhadap stafilok in vitro. Namun. Stafilokok patogen sulit dieradikasi dari orang yang terinfeksi, karena organisme ini secara cepat menjadi resisten terhadap banyak obat antimikroba dan obat-obat tersebut tidak dapat bekerja pada bagian nekrotik sentral lesi supuratif. Keadaan karier S. aureus juga sulit dieradikasi. Agen alternatif untuk pengobatan bakteremia MRSA dan endokarditis meliputi antimikroba yang lebih baru, seperti daptomisin, linezolid, dan kuinupristin-dalfopristin. Jika infeksi didapati berkaitan dengan S. aureus yang tidak memproduksi laktamase-(, penisilin G adalah obat terpilih, tetapi galur S. aureus seperti ini jarang dijumpai (Brooks dkk, 2013).
Untuk kasus di luar rumah sakit diberikan penisilin G. Pada infeksi yang berat atau jika diduga resisten terhadap penisilin, dapat diberikan metisilin atau derivat penisilin lain yang resisten penicilinase. Jika hasil tes telah ada, sebaiknya diberikan obat yang sesuai dengan hasil tes kepekaan tersebut. Pada penderita yang alergi penisilin, dapat diberikan sefalosporin, eritromisin, linkomisin atau klindamisin. Pada infeksi oleh suatu jenis yang tahan terhadap metisilin, dapat diberikan vankomisin; rimfapisin atau fusidic acid juga dapat diberikan, asal dalam bentuk kombinasi dengan antibiotik lainnya. Kalau diberikan tersendiri cepat terjadi resistensi. Jenis resisten metisilin biasanya juga resisten terhadap oksasilin, kloksasilin dan sefalosporin (Jawetz, 2005).
Hingga kini belum ada terapi yang benar-benar efektif untuk strain resisten seperti MRSA. Glikopeptida vankomisin yang merupakan drug of choice untuk infeksi MRSA ternyata memiliki efek bakterisidal yang lambat dan sering menimbulkan kegagalan terapi. Masalah menjadi semakin rumit dengan ditemukannya galur MRSA yang menurun kepekaannya terhadap vankomisin dan MRSA yang resisten vankomisin. Antimikroba lain seperti asam fusidat, rifampisin, fosfomisin, quinolon dan trimetoprim-sulfametoksazol memiliki kemanjuran yang lebih rendah dibandingkan dengan vankomisin. Juga telah terbukti adanya galur MRSA yang resisten terhadap antimikroba tersebut. Antimikroba baru sebagai alternatif terapi infeksi MRSA adalah streptogramin, oksazolidinon, daptomisin, glisilsiklin, oritavansin dan peptida. Selain itu direkomendasikan pula terapi infeksi MRSA dengan antimikroba kombinasi. Glikopeptida vankomisin dan teikoplanin masih merupakan obat pilihan (drug of choice) untuk terapi infeksi MRSA (Yuwono, 2010).
Glikopeptida vankomisin dan teikoplanin masih merupakan obat pilihan (drug of choice) untuk terapi infeksi MRSA. Glikopptida adalah molekul berukuran besar yang bekerja menghambat tahap akhir sintesa peptidoglikan dan anyamannya (cross linked). Galur MRSA yang menurun kepekaannya terhadap glikopeptida pertama kali dilaporkan di Jepang pada tahun 1996 dan kemudian juga di negara-negara lain termasuk adanya galur MRSA resisten glikopeptida. Secara umum diketahui bahwa glikopeptida mencegah reaksi transglikosilasi dan transpeptidasi sehingga terjadi kegagalan sintesa dinding sel. Terdapat dua macam target pengikatan pada dinding sel S. aureus yaitu residu D-alanil-D-alanin pada lapisan peptidoglikan dan monomer murein pada membran sitoplasma yang menjadi substrat untuk reaksi glikosiltransferase. Ikatan glikopeptida pada D-alanil-D-alanin tidak menghambat sintesa peptidoglikan tetapi hanya mengganggu formasi cross bridge yang dimediasi PBP. Ikatan glikopeptida pada murein menyebabkan hambatan total sintesa peptidoglikan sehingga sel menjadi ruptur dan mati. Untuk dapat mencapai target murein tersebut, molekul glikopeptida harus mampu menembus sekitar 20 lapis petidoglikan, jika terjebak pada target pertama yaitu D-alanil-D-alanin maka obat ini tidak akan efektif (Yuwono, 2010).
Vankomisin adalah prototipe glikopeptida yang disisolasi pertama kali pada tahun 1956 dari jamur golongan Actinoycetes yaitu Streptomyces orientalis dari sampel tanah di Kalimantan. Zat ini mulai dipakai sebagai antimikroba pada tahun 1958 dan terus meningkat penggunaannya setelah menyebarnya MRSA. Secara in vitro, vankomisin aktif terhadap bakteri Gram positif aerob dan bakteri anaerob seperti Staphylococcus, streptokokus, enterokokus, Clostridium spp dan Corynebacterium spp. Menurut NCCLS, vankomisin dikatakan peka/aktif terhadap Staphylococcus bila mampu mematikan pada konsentrasi 4g/mL, intermediat antara 8-16 g/mL dan resisten pada konsentrasi 32 g/mL. Vankomisin bersifat slow bactericidal terhadap S. aureus dan S. epidermidis. Secara in vitro juga dilaporkan adanya efek sinergi pada campuran vankomisin dengan aminoglikosida terhadap S. aureus. Sedangkan campuran vankomisin dengan rifampin masih diragukan efektivitasnya karena beberapa studi memperlihatkan hasil antagonistik. Vankomisin merupakan obat pilihan infeksi MRSA seperti bakteriemia, endokarditis, pneumonia dan komplikasi pascabedah.
2.2.5Resistensi Staphylococcus aureus
Staphylococcus aureus sudah lama dikenal sejak abad ke-19 sebagai penyebab infeksi lokal maupun sistemik. Pada era tahun 1940-an, masalah infeksi yang ditimbulkan oleh bakteri ini berhasil diatasi dengan pemberian antimikroba golongan betalaktam yaitu penisilin. Antimikroba betalaktam mengikat Penicillin Binding Protein (PBP) yaitu suatu enzim peptidase membran yang mengkatalisis reaksi transpeptidasi pada proses sintesis dinding sel bakteri. Ikatan betalaktam pada situs aktif sering mengakibatkan PBP tidak aktif, sintesis dinding sel gagal dan bakteri mengalami lisis. Staphylococcus aureus memiliki 4 macam PBP yaitu PBP 1 seberat 85 kDa, PBP 2 seberat 81 kDa, PBP 3 seberat 75 kDa dan PBP 4 seberat 45 kDa. PBP 1, 2 dan 3 memiliki aktivitas transpeptidase dan memiliki afinitas sangat tinggi terhadap betalaktam, sehingga pemberian antimikroba betalaktam akan menyebabkan letal Staphylococcus aureus (Yuwono, 2010).
Resistensi MRSA terhadap metisilin dan terhadap semua antimikroba golongan betalaktam disebabkan perubahan pada protein binding penicillin (PBP) yang normal yaitu PBP 2 menjadi PBP 2a. PBP 2a memiliki afinitas yang sangat rendah terhadap beta laktam sehingga sekalipun bakteri ini dibiakan pada medium mengandung konsentrasi tinggi beta laktam, MRSA tetap dapat hidup dan mensintesa dinding sel (tumbuh). Eksplorasi pada struktur PBP 2a menunjukkan adanya perubahan pada situs pengikatan (binding site) yang mengakibatkan rendahnya afinitas. PBP 2a disandi oleh gen mecA yang merupakan bagian staphylococcal cassette chromosome mec (SCCmec). SCCmec adalah sisipan suatu elemen DNA berukuran besar antara 20-100 kb yang terintegrasi ke dalam kromosom S. aureus pada regio di dekat origin of replication (ori) kromosom (Yuwono, 2010).
Protein binding penicillin adalah sekelompok protein yang terlibat dalam biosintesa peptidoglikan yaitu mengkatalisa reaksi transpeptidasi (pembentukan anyaman peptida). Peptidoglikan Staphylococcus memiliki ciri khas berukuran panjang, berupa struktur anyaman (cross linkage) dengan rantai samping pentaglisin yang fleksibel. Peptidoglikan ini menjadi target antimikroba betalaktam. Resistensi terjadi karena produksi enzim betalaktamase seperti pada galur S. aureus producing betalactamases dan perubahan pada struktur PBP seperti yang terjadi pada MRSA. PBP 1, 2 dan 3 memiliki aktifitas transpeptidase primer sedangkan PBP 4 memiliki aktifitas transpeptidase sekunder. Reaksi lain dalam pembentukan peptidoglikan adalah transglikosilasi yang tidak berhubungan dengan penicillin binding activity (tidak berhubungan dengan reseptor penisilin). PBP 2 memiliki aktifitas unik yaitu selain sebagai enzim transpeptidase ternyata juga memiliki aktifitas transglikosilase. Afinitas PBP 2a yang sangat rendah terhadap beta laktam mengakibatkan antimikroba ini tidak dapat mempengaruhi reaksi transpeptidasi. Selain itu karena aktifitas transglikosilasi PBP 2a sama sekali tidak terpengaruh oleh beta laktam maka diduga resistensi MRSA juga ditentukan oleh keutuhan fungsi transglikosilasi dari PBP 2a ini (Yuwono, 2010).
Lebih dari 80% Staphylococcus aureus menghasilkan penicilinase (salah satu bentuk betalaktamase), suatu enzim yang menyebabkan cincin beta-laktam hancur sehingga antibiotik tidak akan lagi memiliki kemampuan untuk mengikat PBP (Penisilin-mengikat protein) (Brown et al., 2005).
Metisilin mulai diperkenalkan untuk menanggulangi Staphylococcus aureus yang resisten terhadap penisilin pada tahun tahun 1959. Cara kerjanya sama dengan antibiotik betalaktam pada umumnya, hanya saja metisilin ini resisten terhadap penicilinase dan mampu menghambat pembentukkan akhir sintesis dinding sel bakteri peptidoglikan yang difasilitasi PBP. Antibiotik ini akan berikatan dengan PBP2 sehingga menghambat peptidoglikan dan akhirnya lisis. Satu tahun setelahnya, Methicillin Resistant Staphylococcus aureus (MRSA), galur Staphylococcus aureus yang resisten terhadap antibiotik betalaktam, termasuk penisilin dan turunannya (Metisilin, Oxacilin, dicloxacilin, Nafcilin dan Sephalosporin) ditemukan di Inggris untuk pertama kalinya. MRSA terjadi karena adanya perubahan PBP2 menjadi PBP2a yang dikode oleh gen mecA sehingga afinitas Metisilin ini rendah yang menyebabkan bakteri tidak dapat berikatan dengan PBP2a hingga pembentukkan tahap akhir peptidoglikan tidak terganggu dan bakteri menjadi resisten (Fuda et al., 2005).
Sejak tahun 1990-an, vankomisin yang merupakan golongan glikopeptide dipilih sebagai pengganti metisilin (Goodman and Gilman, 2004). Peningkatan penggunaan vankomisin menyebabkan terjadi kecenderungan penurunan sensitivitas vankomisin terhadap Staphylococcus aureus. Tahun 1996 untuk pertama kalinya dilaporkan bahwa telah terjadi penurunan sensitifitas vankomisin terhadap Staphylococcus aureus di Jepang. Tahun 2002, seorang klinisi dari USA untuk pertama kalinya mengisolasi Vancomycin Resistant Staphylococcus aureus (VRSA), dan tidak lama kemudian di Brazil dilaporkan hal yang sama (Tiwari dan Sen, 2006). Mekanisme resistensi terhadap vankomisin belum sepenuhnya diketahui. Resistensi terhadap vankomisin diperantarai oleh gen van yang akan mengakibatkan perubahan pada terminal dinding sel Staphylococcus aureus. Pilihan antibiotika semakin terbatas dikarenakan terjadinya resistensi Staphylococcus aureus terhadap beberapa antimikroba (Hiramatsu, 2001). Tabel 1. Kronologi Infeksi Staphylococcus aureus dan Resistensinya
Tahun Keterangan
1940Penicilin diperkenalkan
1942Muncul Staphylococcus aureus resisten terhadap penisilin
1959Metisilin diperkenalkan; sebagian besar strain
Staphylococcus aureus di rumah sakit dan masyarakat resisten penisilin
1961Muncul MRSA (Methicillin-resistantS aureus)
1963Wabah pertama MRSA di rumah sakit
1968Ditemukan strain MRSA pertama di rumah sakit Amerika
1970-anPenyebaran MRSA secara global, ditemukan kejadian MRSA yang sangat tinggi di Eropa
1980-an & awal 1990-anPenurunan MRSA yang dramatis dengan adanya program search & destroy di Eropa utara
1996VRSA (Vancomycin-resistantS aureus) pertama kali dilaporkan di Jepang
1997Kejadian MRSA di rumah sakit di Amerika hampir 25
%; penggunaan vancomycin meningkat; muncul VISA;
dilaporkan adanya infeksi CA-MRSA yang serius
2002Terjadi VRSA yang pertama di Amerika
2003Kejadian MRSA kembali meningkat; hampir 60 %
terjadi di ICU; wabah CA-MRSA dilaporkan terjadi di
banyak tempat dan berimplikasi pada wabah di rumah
sakit
2006>50 % infeksi kulit Staphylococcal muncul di bagian
gawat darurat yang disebabkan CA-MRSA; HA-MRSA
terus meningkat; CA-MRSA secara epedemiologi
menjadi sangat sulit
2007The Year of MRSA
Sumber : Sampathkumar, 2007
2.3
Antibiotik Vankomisin2.3.1Tinjauan Umum Vankomisin
Antibiotik adalah suatu antibakteri yang diperoleh dari mikroorganisme. Antimikroba adalah antibakteri yang diperoleh dari sintesis atau yang berasal dari senyawa non organik (Priyanto, 2008). Beberapa mekanisme aksi dari antibiotik yaitu :a. Antibiotik yang menghambat sintesis dinding selb. Antibiotik yang merusak membrane plasmac. Antibiotik yang menghambat sintesis proteind. Antibiotik yang menghambat sintesis asam nukleat (DNA/RNA)e. Antibiotik yang menghambat sintesis metabolit esensial (Pratiwi, 2008).
Vankomisin adalah suatu glikopeptida yang dihasilkan oleh Streptomyces orientalis. Zat ini sukar diserap oleh usus. Vankomisin bersifat bakterisidal terhadap stafilokokus, beberapa klostridia, dan beberapa basil. Vankomisin menghambat tahap awal sintesis peptidoglikan dinding sel. Strain bakteri yang resisten terhadap vankomisin tidak muncul dengan cepat. Dosis 0,5 gram tiap 6- 12 jam yang diberikan secara intravena digunakan untuk infeksi stafilokokus sistemik yang gawat, termasuk endokarditis, terutama bila resisten terhadap nafsilin. Efek samping dari vankomisin adalah tromboflebitis, ruam kulit, dan tuli saraf. Vankomisin yang digunakan secara gabungan dengan aminoglikosida dapat menyebabkan kerusakan ginjal (Brooks et al., 2001).Vankomisin merupakan alternatif pilihan pada pasien yang alergi terhadap penisilin (Vermeluen, 2000). Vankomisin yang digunakan peroral dianggap kurang efektif karena absorbsi di saluran GI jelek dan efek toksiknya besar (Priyanto, 2008). Vankomisin adalah prototipe glikopeptida yang disisolasi pertama kali pada tahun 1956 dari jamur golongan Actinoycetes yaitu Streptomyces orientalis dari sampel tanah di Kalimantan. Zat ini mulai dipakai sebagai antimikroba pada tahun 1958 dan terus meningkat penggunaannya setelah menyebarnya MRSA. Secara in vitro, vankomisin aktif terhadap bakteri Gram positif aerob dan bakteri anaerob seperti Staphylococcus, streptokokus, enterokokus, Clostridium spp dan Corynebacterium spp. Menurut NCCLS, vankomisin dikatakan peka/aktif terhadap Staphylococcus bila mampu mematikan pada konsentrasi 4g/mL, intermediat antara 8-16 g/mL dan resisten pada konsentrasi 32 g/mL. Vankomisin bersifat slow bactericidal terhadap S. aureus dan S. epidermidis. Secara in vitro juga dilaporkan adanya efek sinergi pada campuran vankomisin dengan aminoglikosida terhadap S. aureus. Sedangkan campuran vankomisin dengan rifampin masih diragukan efektivitasnya karena beberapa studi memperlihatkan hasil antagonistik. Vankomisin merupakan obat pilihan infeksi MRSA seperti bakteriemia, endokarditis, pneumonia dan komplikasi pascabedah (Yuwono, 2010).
2.3.2 Farmakokinetik Vankomisin
Vankomisin hanya dapat diberikan secara intravena, tidak dapat diberikan secara intramuskuler (IM) karena akan menimbulkan nyeri dan absorbsi yang buruk, juga tidak dapat digunakan per oral karena sangat buruk absorbsinya pada saluran pencernaan. Satu-satunya penggunaan oral adalah untuk terapi clostridial enterocolitis. Vankomisin tidak mengalami modifikasi pada metabolisme hati dan dikeluarkan melalui ginjal dalam bentuk aktif. Waktu paruhnya antara 6-8 jam pada pasien dengan fungsi ginjal normal. Vankomisin berada dalam konsentrasi tinggi dan mencapai level terapi di darah, pleura, perikardial, sinovial dan cairan asites tetapi tidak dapat mencapai kadar terapi di cairan serebrospinal dan di vitreous serta aquous humor di mata. Sebagaimana beta laktam, aktivitas antibakteri vankomisin bersifat time dependent oleh karena itu harus dipertahankan konsentrasi di atas nilai MIC. Aktivitas vankomisin masih berlangsung selama 2 jam setelah konsentrasi di bawah nilai MIC karena pengaruh post antibiotic effect (Yuwono, 2010).2.3.3Farmakodinamik VankomisinGlikopeptida vankomisin dan teikoplanin masih merupakan obat pilihan (drug of choice) untuk terapi infeksi MRSA. Glikopeptida adalah molekul berukuran besar yang bekerja menghambat tahap akhir sintesa peptidoglikan dan anyamannya (cross linked). Galur MRSA yang menurun kepekaannya terhadap glikopeptida pertama kali dilaporkan di Jepang pada tahun 1996 dan kemudian juga di negara- negara lain termasuk adanya galur MRSA resisten glikopeptida. Secara umum diketahui bahwa glikopeptida mencegah reaksi transglikosilasi dan transpeptidasi sehingga terjadi kegagalan sintesa dinding sel. Terdapat dua macam target pengikatan pada dinding sel S. aureus yaitu residu D-alanil-D-alanin pada lapisan peptidoglikan dan monomer murein pada membran sitoplasma yang menjadi substrat untuk reaksi glikosiltransferase. Ikatan glikopeptida pada D-alanil-D-alanin tidak menghambat sintesa peptidoglikan tetapi hanya mengganggu formasi cross bridge yang dimediasi PBP. Ikatan glikopeptida pada murein menyebabkan hambatan total sintesa peptidoglikan sehingga sel menjadi ruptur dan mati. Untuk dapat mencapai target murein tersebut, molekul glikopeptida harus mampu menembus sekitar 20 lapis petidoglikan, jika terjebak pada target pertama yaitu D-alanil-D-alanin maka obat ini tidak akan efektif (Yuwono, 2010)2.3.4Dosis
Dosis vankomisin pada pasien dengan fungsi ginjal yang normal adalah 15 mg/kg berat badan (BB) selama 12 jam atau 8 mg/ kgBB selama 6-8 jam. Pada fungsi ginjal yang tidak normal, pada luka bakar, kelebihan cairan atau obesitas penambahan/pengurangan dosis dapat dilakukan. Kadar puncak dan konsentrasi dalam serum harus terus dipantau untuk mencapai dosis efektif dan untuk menghindari ototoksisitas dan nefrotoksisitas. Umumnya kadar puncak sekitar 20-40 g/mL dicapai 1 jam setelah infus selesai, kadar efektif di serum sekitar 5-10 g/mL. Untuk mengurangi toksisitas dilakukan pembuatan sediaan vankomisin dengan high pressure liquid chromatograpy tetapi tetap tidak mengurangi efek alergeniknya. Efek samping yang paling sering timbul adalah demam, menggigil, dan plebitis pada tempat tempat infus yang sering dikenal dengan sebutan red man karena lepasnya histamin. Efek ini berkurang bila infus diperlambat dengan volume lebih besar. Obat yang digunakan pada tahun 1960-an sebelum dimurnikan dengan kromatografi sering menimbulkan nefrotoksisitas dan ototoksisitas tetapi saat ini dengan sedian baru kedua efek tersebut sangat jarang terjadi. Kombinasi dengan aminoglikosida dapat meningkatkan toksisitas vankomisin (Yuwono, 2010).2.4 Ekstraksi
2.4.1Definisi
Ekstraksi adalah proses penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan menggunakan pelarut cair. Diketahuinya senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid dan lain-lain (Ditjen POM, 2000). Tujuan dilakukannya ekstraksi ialah untuk mendapatkan atau memisahkan sebanyak mungkin zat yang memiliki khasiat pengobatan dari zat yang tidak berkhasiat agar lebih mudah dipergunakan dan disimpan (Syamsuni, 2006).
Hasil dari proses ekstraksi disebut sebagai ekstrak, berupa sediaan kental yang diperoleh dengan mengekstraksi senyawa aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian sehingga memenuhi baku yang telah ditentukan (Nurussakinah, 2010).2.4.2Prinsip Ekstraksi
Pada prinsipnya, ekstraksi adalah melarutkan dan menarik senyawa dengan menggunakan pelarut yang tepat. Ada tiga tahapan proses pada waktu ekstraksi yaitu:
1. Penetrasi pelarut ke dalam sel tanaman dan pengembangan sel
2. Disolusi pelarut ke dalam sel tanaman dan pengembangan sel
3. Difusi bahan yang terekstraksi ke luar sel
Pada proses di atas diharapkan terjadi kesetimbangan antara zat larut dan pelarut. Kecepatan untuk mencapai kesetimbangan umumnya tergantung pada suhu, pH, ukuran, dan gerakan partikel. Prinsip yang utama adalah yang berkaitan dengan kelarutan, yaitu senyawa polar lebih mudah larut dalam pelarut polar dan senyawa nonpolar akan mudah larut dalam pelarut nonpolar (Emilan, 2011).2.4.3 Metode Ekstraksi
Menurut Mc Cabe (1999) dalam Muhiedin (2008), ekstraksi dapat dibedakan menjadi dua cara berdasarkan wujud bahannya yaitu:
1. Ekstraksi padat-cair, digunakan untuk melarutkan zat yang dapat larut dari campurannya dengan zat padat yang tidak dapat larut.
2. Ekstraksi cair-cair, digunakan untuk memisahkan dua zat cair yang saling bercampur, dengan menggunakan pelarut dapat melarutkan salah satu zat.Ekstraksi padat cair secara umum terdiri dari maserasi, refluktasi, sokhletasi, dan perkolasi. Metode yang digunakan tergantung dengan jenis senyawa yang digunakan. Jika senyawa yang akan diekstraksi rentan terhadap pemanasan maka metode maserasi dan perkolasi yang sebaiknya dilakukan. Namun jika tahan terhadap pemanasan maka metode refluktasi dan sokletasi yang digunakan (Hidayat, 2015).
Pada ekstraksi cair-cair, bahan yang menjadi analit berbentuk cair dengan pemisahannya menggunakan dua pelarut yang tidak saling bercampur sehingga terjadi distribusi sampel di antara kedua pelarut tersebut. Pendistribusian sampel dalam kedua pelarut tersebut dapat ditentukan dengan perhitungan KD/koefisien distribusi (Hidayat, 2015).
1. Ekstraksi Padat-Cair
a. Cara Dingin
Dengan metode ini tidak ada proses pemanasan selama ekstraksi berlangsung. Tujuannya untuk menghindari rusaknya senyawa karena pemanasan. Jenis ekstraksi dengan cara dingin adalah:1) MaserasiMaserasi berasal dari kata macerare (bahasa Latin, artinya merendam) merupakan salah satu cara ekstraksi, dimana sediaan cair yang dibuat dari mengekstraksi bahan nabati direndam menggunakan pelarut bukan air (pelarut nonpolar) atau setengah air, misalnya etanol encer, selama periode waktu tertentu sesuai dengan aturan dalam buku resmi kefarmasian. Prinsip maserasi adalah mengikat/melarutkan zat aktif berdasarkan sifat kelarutannya dalam suatu pelarut (like dissolved like). Teorinya, ketika simplisia yang akan dimaserasi direndam dalam pelarut yang dipilih, maka cairan penyari akan menembus dinding sel dan masuk ke dalam sel yang penuh dengan zat aktif sehingga terjadi proses pelarutan. Akibat adanya perbedaan konsentrasi zat aktif di dalam dan di luar sel ini akan muncul gaya difusi, larutan yang terpekat akan didesak menuju keluar untuk berusaha mencapai keseimbangan konsentrasi (Hidayat, 2015).
Kelebihan cara ekstraksi dengan maserasi adalah peralatan dan pengerjaannya sederhana, biaya operasional relatif rendah, dan prosesnya relatif hemat penyari dan tanpa pemanasan. Adapun kelemahannya adalah penyariannya tidak sempurna karena zat aktif hanya mampu terekstraksi sebesar 50% saja dan prosesnya pengerjaan yang cukup lama (Hidayat, 2015).Menurut Hidayat (2015), maserasi dapat dilakukan modifikasi seperti:a) DigestiDigesti adalah cara maserasi dengan menggunakan pemanasan lemah, yaitu pada suhu 4050C. Cara maserasi ini hanya dapat dilakukan untuk simplisia yang zat aktifnya tahan terhadap pemanasan. Dengan pemanasan diperoleh keuntungan antara lain: kekentalan pelarut berkurang, daya melarutkan cairan penyari meningkat, kecepatan difusi meningkat, dan jika cairan penyari mudah menguap pada suhu yang digunakan maka bisa dilengkapi dengan pendingin balik, sehingga cairan akan menguap kembali ke dalam bejana.b) Maserasi dengan Mesin PengadukPenggunaan mesin pengaduk yang berputar terus-menerus, waktu proses maserasi dapat dipersingkat menjadi 6 sampai 24 jam.c) RemaserasiCairan penyari dibagi menjadi dua. Seluruh serbuk simplisia dimaserasi dengan cairan penyari pertama. Selanjutnya diendapkan, dituangkan dan diperas, ampas dimaserasi lagi dengan cairan penyari yang kedua.d) Maserasi MelingkarMaserasi dapat diperbaiki dengan mengusahakan agar cairan penyari selalu bergerak dan menyebar. Dengan cara ini penyari selalu mengalir kembali secara berkesinambungan melalui sebuk simplisia dan melarutkan zat aktifnya.e) Maserasi Melingkar BertingkatPada maserasi melingkar, penyarian tidak dapat dilaksanakan secara sempurna karena pemindahan massa akan berhenti bila keseimbangan telah terjadi. Masalah ini dapat diatasi dengan maserasi melingkar bertingkat (M.M.B) sehingga bisa memberikan hasil penyarian yang maksimal.
2) Perkolasi
Perkolasi merupakan suatu metode estraksi dengan mengalirkan penyari melalui bahan yang telah dibasahi sehingga pelarut yang digunakan selalu baru. Perkolasi banyak digunakan untuk mengekstraksi komponen dari bahan tumbuhan. Pada proses perkolasi, terjadi partisi komponen yang diekstraksi antara bahan dan pelarut. Kekuatan yang berperan pada perkolasi antara lain: gaya berat, kekentalan, daya larut, tegangan permukaan, difusi, osmosa, adesi, daya kapiler dan daya geseran (friksi).Cara perkolasi lebih baik dibandingkan cara maserasi karena aliran cairan penyari menyebabkan adanya pergantian larutan dengan larutan yang konsentrasinya lebih rendah sehingga meningkatkan derajat perbedaan konsentrasi. Ruangan diantara butir-butir serbuk simplisia membentuk saluran tempat mengalir cairan penyari. Karena kecilnya saluran kapiler tersebut, maka kecepatan pelarut cukup untuk mengurangi lapisan batas sehingga dapat meningkatkan perbedaan konsentrasi.
Kelebihan dari metode perkolasi ini adalah tidak terjadi kejenuhan dan difusinya meningkat karena pengaliran. Sedangkan kekurangannya adalah cairan penyari jadi lebih banyak dan risiko cemaran mikroba untuk penyari air karena dilakukan secara terbuka.b. Cara Panas
Metode ini melibatkan panas dalam prosesnya dengan tujuan untuk mempercepat proses penyarian. Jenis ekstraksi dengan cara panas adalah:
1) RefluksRefluks merupakan ekstraksi dengan pelarut yang dilakukan pada titik didih pelarut tersebut selama waktu tertentu, sejumlah pelarut tertentu, dan dengan adanya pendinginan balik (kondensor). Umumnya dilakukan tiga sampai lima kali pengulangan proses pada residu pertama agar proses ekstraksinya sempurna.Keuntungannya adalah metode ini bisa digunakan untuk mengekstraksi sampel-sampel yang memiliki tekstur kasar. Sedangkan kerugiannya adalah metode ini membutuhkan volume total pelarut yang besar dan sejumlah manipulasi operator.
2) SoxhletasiSoxhletasi adalah suatu metode pemisahan suatu komponen yang terdapat dalam sampel padat dengan cara penyarian berulangulang dengan pelarut yang sama sehingga semua komponen yang diinginkan dalam sampel tersebut dapat terisolasi dengan sempurna. Pelarut yang digunakan ada dua jenis, yaitu heksana (C6H14) untuk sampel kering dan metanol (CH3OH) untuk sampel basah. Jadi, pelarut yang digunakan tergantung dari sampel alam yang akan diekstraksi.Kelebihan dari metode ini adalah dapat digunakan untuk sampel dengan tekstur yang lunak dan tidak tahan terhadap pemanasan secara langsung, pelarut yang digunakan lebih sedikit, dan pemanasannya dapat diatur. Sedangkan kekurangannya adalah dapat menyebabkan reaksi peruraian oleh panas, bisa mengendap dalam wadah dan membutuhkan volume pelarut yang lebih banyak untuk melarutkannya.2. Ekstraksi Cair-Cair (Ekstraksi Pelarut)
Ekstraksi pelarut atau disebut juga ekstraksi air adalah metode pemisahan yang paling baik dan populer karena dapat dilakukan baik dalam tingkat makro ataupun mikro. Prinsip metode ini didasarkan pada distribusi zat pelarut dengan perbandingan tertentu antara dua pelarut yang tidak saling bercampur, seperti benzena, karbon tetraklorida atau kloroform. Batasannya adalah zat terlarut dapat ditransfer pada jumlah yang berbeda dalam kedua fase pelarut (Hidayat, 2015).Ekstraksi pelarut terutama digunakan bila pemisahan campuran dengan cara destilasi tidak mungkin dilakukan (misalnya karena pembentukan aseotrop atau karena kepekaannya terhadap panas) atau tidak ekonomis. Seperti ekstraksi padat-cair, ekstraksi cair-cair selalu terdiri atas sedikitnya dua tahap, yaitu pencampuran secara intensif bahan ekstraksi dengan pelarut, dan pemisahan kedua fasa cair itu sesempurna mungkin (Hidayat, 2015).2.4.4 Faktor-Faktor yang Harus Diperhatikan dalam Ekstraksi
Dalam proses ekstraksi, ada beberapa hal yang harus diperhatikan antara lain (Hidayat, 2015):
1. Ukuran partikel Ukuran partikel mempengaruhi laju ekstraksi dalam beberapa hal. Semakin kecil ukurannya, semakin besar luas permukaan antara padat dan cair sehingga laju perpindahannya menjadi semakin besar.
2. Zat pelarut Zat pelarut seharusnya merupakan pelarut pilihan terbaik dan viskositasnya harus cukup rendah agar dapat bersikulasi dengan mudah. Biasanya, zat pelarut murni akan digunakan pada awal proses ekstraksi dan selanjutnya konsentrasi zat terlarut akan naik dan laju ekstraksinya turun karena gradiennya berkurang dan zat terlarutnya menjadi lebih kental.Jenis pelarut berkaitan dengan polaritas dari pelarut tersebut. Hal yang perlu diperhatikan dalam proses ekstraksi adalah senyawa yang memiliki kepolaran yang sama akan lebih mudah tertarik/terlarut dengan pelarut yang memiliki tingkat kepolaran yang sama. Berkaitan dengan polaritas dari pelarut, terdapat tiga golongan pelarut yaitu: Pelarut polar
Memiliki tingkat kepolaran yang tinggi sehingga bisa mengekstrak senyawa-senyawa yang polar dari tanaman. Pelarut polar cenderung universal digunakan karena biasanya walaupun polar, tetap dapat menyari senyawa-senyawa dengan tingkat kepolaran lebih rendah. Salah satu contoh pelarut polar adalah: air, metanol, etanol, asam asetat.
Pelarut semipolar
Pelarut semipolar memiliki tingkat kepolaran yang lebih rendah dibandingkan dengan pelarut polar. Pelarut ini baik untuk mendapatkan senyawa-senyawa semipolar dari tumbuhan. Contoh pelarut ini adalah: aseton, etil asetat, kloroform. Pelarut nonpolar
Pelarut nonpolar, hampir sama sekali tidak polar. Pelarut ini baik untuk mengekstrak senyawa-senyawa yang sama sekali tidak larut dalam pelarut polar. Senyawa ini baik untuk mengekstrak berbagai jenis minyak. Contoh: heksana, eter.3. Temperatur Dalam banyak hal, kelarutan zat terlarut (pada partikel yang diekstraksi) di dalam pelarut akan naik bersamaan dengan kenaikan temperatur untuk memberikan laju ekstraksi yang lebih tinggi.
4. Pengadukan fluida Pengadukan zat pelarut penting untuk dilakukan karena akan meningkatkan proses difusi sehingga menaikkan perpindahan material dari permukaan partikel ke zat pelarut.
Menurut Hidayat (2015), pemilihan pelarut pada umumnya dipengaruhi oleh faktor-faktor berikut ini :
1. Selektivitas
Pelarut hanya boleh melarutkan ekstrak yang diinginkan, bukan komponen-komponen lain dari bahan ekstraksi. Dalam praktek, terutama pada ekstraksi bahan-bahan alami, sering juga bahan lain (misalnya lemak, resin) ikut dibebaskan bersama-sama dengan ekstrak yang diinginkan. Dalam hal itu larutan ekstrak tercemar yang diperoleh harus dibersihkan, salah satu caranya adalah melakukan ekstraksi lagi dengan menggunakan pelarut kedua.
2. Kelarutan
Pelarut sedapat mungkin memiliki kemampuan melarutkan ekstrak yang besar sehingga pelatur yang dibutuhkan tidak terlalu banyak..
3. Kemampuan tidak saling bercampur
Pada ekstraksi cair-cair pelarut tidak boleh (atau hanya secara terbatas) larut dalam bahan ekstraksi.
4. Kerapatan
Terutama pada ekstraksi cair-cair, sedapat mungkin terdapat perbedaaan kerapatan yaitu besar antara pelarut dan bahan ekstraksi. Hal ini dimaksudkan agar kedua fasa dapat dengan mudah dipisahkan kembali setelah pencampuran (pemisahan dengan gaya berat). Bila beda kerapatannya kecil, seringkali pemisahan harus dilakukan dengan menggunakan gaya sentrifugal (misalnya dalam ekstraktor sentrifugal).
5. Reaktifitas
Pada umumnya pelarut tidak boleh menyebabkan perubahan secara kimia pada komponen-komponen bahan ekstraksi. Sebaliknya dalam hal-hal tertentu diperlukan adanya reaksi kimia (misalnya pembentukan garam) untuk mendapatkan selektivitas yang tinggi. Seringkali ekstraksi juga disertai dengan reaksi kimia. Dalam hal ini bahan yang akan dipisahkan mutlak harus berada dalam bentuk larutan.
6. Titik didih
Ekstrak dan pelarut biasanya harus dipisahkan dengan cara penguapan, destilasi atau rektifikasi, maka titik didih kedua bahan itu tidak boleh terlalu dekat, dan keduanya tidak membentuk aseotrop.
7. Kriteria yang lain
Pelarut sedapat mungkin harus murah, tersedia dalam jumlah besar, tidak beracun, tidak dapat terbakar, tidak eksplosif bila bercampur dengan udara, tidak korosif, tidak menyebabkan terbentuknya emulsi, memilliki viskositas yang rendah, stabil secara kimia dan termis.
Karena hampir tidak ada pelarut yang memenuhi syarat di atas, maka untuk setiap proses ekstraksi harus dicari pelarut yang paling sesuai. Beberapa pelarut yang terpenting adalah: air, asam-asam organik dan anorganik, hidrokarbon jenuh, toluen, karbon disulfit, eter, aseton, hidrokarbon yang mengandung khlor, isopropanol, etanol.2.5 Uji Aktivitas Antimikroba
Uji kepekaan terhadap obat antimikroba secara umum dapat dilakukan melalui dua cara, yaitu:
1. Metode Difusia. Metode disc diffusion (Metode Kirby Bauer) untuk menuntukan aktivitas agen antimikroba. Piringan yang berisi agen antimikroba diletakkan pada media agar yang telah ditanami mikroorganisme yang akan berdifusi pada media agar tersebut. Area jernih mengindikasikan adanya hambatan pertumbuhan mikroorganisme oleh agen antimikroba pada permukaan media agar (Pratiwi, 2008).
b. Metode E-test digunakan untuk mengestimasi MIC (Minimum Inhibitory Concentration) atau KHM (Kadar Hambat Minimum), yaitu konsentrasi minimal suatu agen antimikroba untuk dapat menghambat pertumbuhan mikroorganisme. Pada metode ini digunakan strip plastik yang mengandung agen antimikroba dari kadar terendah hingga tertinggi dan diletakkan pada permukaan media agar yang telah ditanami mikroorganisme. Pengamatan dilakukan pada area jernih yang ditimbulkannya yang menunjukkan kadar agen antimikroba yang menghambat pertumbuhan mikroorganisme pada media agar (Pratiwi, 2008).c. Ditch plate technique. Pada metode ini sampel uji berupa agen antimikroba yang diletakkan pada parit yang dibuat dengan cara memotong media agar dalam cawan petri pada bagian tengah secara membujur dan mikroba uji (maksimum 6 macam) digoreskan ke arah parit yang berisi agen antimikroba (Pratiwi, 2008).
d. Cup-plate technique. Metode ini serupa dengan metode disc diffusion, yaitu dibuat sumur pada media agar yang telah ditanami dengan mikroorganisme dan pada sumur tersebut diberi agen antimikroba yang diuji (Pratiwi, 2008).
e. Gradient-plate technique. Pada metode ini konsentrasi agen antimikroba pada media agar secara teoritis bervariasi dari 0 hingga maksimal. Media agar dicairkan dan larutan uji ditambahkan. Campuran kemudian dituang ke dalam cawan petri dan diletakkan dalam posisi miring. Nutrisi kedua selanjutnya dituang di atasnya dan diinkubasi selama 24 jam untuk memungkinkan agen antimikroba berdifusi dan permukaan media mengering. Mikroba uji (maksimal 6 macam) digoreskan pada arah mulai dari konsentrasi tinggi ke rendah. Hasil diperhitungkan sebagai panjang total pertumbuhan mikroorganisme maksimum yang mungkin dibandingkan dengan panjang pertumbuhan hasil goresan. Bila:
X = panjang total pertumbuhan mikroorganisme yang mungkin
Y = panjang pertumbuhan aktual
C = konsentrasi final agen antimikroba pada total volume media mg/ml atau g/ml,Maka konsentrasi hambat adalah:
X.YC
Yang perlu diperhatikan adalah dari hasil perbandingan yang didapat dari lingkungan padat dan cair, faktor difusi agen antimikroba dapat mempengaruhi keseluruhan hasil pada media padat (Pratiwi, 2008).
2. Metode dilusi
Metode dilusi dibedakan menjadi dua, yaitu:
a. Metode dilusi cair/broth dilution test (serial dilution).
Metode ini mengukur MIC (Minimum Inhibitory Concentration atau Kadar Hambat Minimum) dan MBC (Minimum Bactericidal Concentration atau Kadar Bunuh Minimum). Cara yang dilakukan adalah dengan membuat seri pengeceran agen antimikroba pada medium cair yang ditambahkan dengan mikroba uji. Larutan uji agen antimikroba pada kadar terkecil yang terlihat jernih tanpa adanya pertumbuhan mikroba uji ditetapkan sebagai KHM. Larutan yang ditetapkan sebagai KHM tersebut selanjutnya dikultur ulang pada media cair tanpa penambahan mikroba uji ataupun agen antimikroba, dan diinkubasi selama 18-24 jam. Media cair yang tetap terlihat jernih setelah diinkubasi ditetapkan sebagai KBM (Pratiwi, 2008).b. Metode dilusi padat/solid dilution test.Metode ini serupa dengan metode dilusi cair namun menggunakan media padat (solid). Keuntungan metode ini adalah satu konsentrasi agen antimikroba yang diuji dapat digunakan untuk menguji beberapa mikroba uji (Pratiwi, 2008).2.6 Konsentrasi Hambat Minimum (KHM)
KHM (Konsentrasi Hambat Minimum) adalah konsentrasi minimal bahan coba yang mampu menghambat pertumbuhan bakteri setelah diinkubasi 24 jam dan tidak tumbuh koloni bakteri yang diketahui dengan cara mengamati kekeruhan pada media perbenihan dengan menggunakan metode dilusi. 2.7 Konsentrasi Bunuh Minimum (KBM)
KBM (Konsentrasi Bunuh Minimum) adalah konsentrasi minimal bahan coba yang dapat membunuh bakteri sebesar 99 % atau 100 % pada media agar. 2.8 Uji KromatografiIstilah kromatografi berasal dari kata latinchromaberarti warna dan graphien berarti menulis. Kromatografi pertama kali diperkenalkan oleh Michael Tsweet (1903) seorang ahli botani dari Rusia. Michael Tsweet dalam percobaannya ia berhasil memisahkan klorofil dan pigmen-pigmen warna lain dalam ekstrak tumbuhan dengan menggunakan serbuk kalsium karbonat yang diisikan ke dalam kolom kaca dan petroleum eter sebagai pelarut. Proses pemisahan itu diawali dengan menempatkan larutan cuplikan pada permukaan atas kalsium karbonat, kemudian dialirkan pelarut petroleum eter. Hasilnya berupa pita-pita berwarna yang terlihat sepanjang kolom sebagai hasil pemisahan komponen-komponen dalam ekstrak tumbuhan (Alimin, 2007).Ketepatan dalam memilih prosedur semuanya tergantung pada perbendaan distribusi berbagai komponen-komponen campuran di antara dua fasa, yakni fasa bergerak dan fasa diam. Fasa bergerak dapat berupa cairan atau gas, dan fasa diam dapat berupa padatan atau cairan. Melalui kombinasi komponen-komponen tersebut maka diperoleh beberapa macam teknik kromatografi seperti pada tabel berikut:
Tabel 2: Teknik Kromatografi (Firdaus. 2011).Kromatografi Lapis Tipis (KLT) merupakan cara untuk memisahkan campuran senyawa menjadi senyawa murni. Kromatografi menggunakan proses analisis yang cepat dan memerlukan bahan yang sangat sedikit, baik penyerap maupun ekstraknya. KLT dapat berguna untuk mencari eluen untuk kromatografi kolom, analisis fraksi yang diperoleh dari kromatografi kolom, identifikasi senyawa secara kromatografi, dan isolasi senyawa murni skala kecil (Arista, 2010). Pada proses pemisahan dengan kromatografi lapis tipis, terjadihubungan kesetimbangan antara fase diam dan fase gerak, dimana ada interaksi antara permukaan fase diam dengan gugus fungsi senyawa organik yang akan diidentifikasi yang telah berinteraksi dengan fasa geraknya. Kesetimbangan ini dipengaruhi oleh 3 faktor, yaitu : kepolaran fase diam, kepolaran fase gerak, serta kepolaran dan ukuran molekul (Hidayat, 2015).Data yang diperoleh dari KLT adalah nilai Rf (Retodansi factor) yang berguna untuk identifikasi senyawa. Nilai Rf untuk senyawa murni dapat dibandingkan dengan nilai Rf dari senyawa standar. Nilai Rf dapat didefinisikan sebagai jarak yang ditempuh oleh senyawa dari titik asal dibagi dengan jarak yang ditempuh oleh pelarut dari titik asal. Oleh karena itu, bilangan Rf selalu lebih kecil dari 1,0. Rumus faktor retensi adalah:
Nilai Rf sangat karakterisitik untuk senyawa tertentu pada eluen tertentu. Hal tersebut dapat digunakan untuk mengidentifikasi adanya perbedaan senyawa dalam sampel. Senyawa yang mempunyai Rf lebih besar berarti mempunyai kepolaran yang rendah, begitu juga sebaliknya. Hal tersebut dikarenakan fasa diam bersifat polar. Senyawa yang lebih polar akan tertahan kuat pada fasa diam, sehingga menghasilkan nilai Rf yang rendah.Rf KLT yang bagus berkisar antara 0,2 - 0,8. Jika Rf terlalu tinggi, yang harus dilakukan adalah mengurangi kepolaran eluen, dan sebaliknya (Hidayat, 2015).2.9 Kerangka Teori
Mengandung senyawa antibakteri
Flavonoid
Menghambat pertumbuhan bakteri Staphylococcus aureus
mendenaturasi protein yang terdapat pada dinding sel
Fraksi daun gaharu
(Aquilaria malaccensis)
Saponin
Alkaloid
Tanin
Mengganggu komponen penyususn peptidoglikan
Lapisan dinding sel tidak utuh
menghambat enzim topoisomerase sel bakteri
Mengganggu tegangan permukaan dinding sel
Menghambat sintesis asam nukleat
Menghambat fungsi membran sitoplasma
Menghambat metabolisme energi
6