Atualização na Síndrome Coronariana Aguda
Transcript of Atualização na Síndrome Coronariana Aguda

Volume 26 • Nº 2 • ABRIL/JUNHO 2016
ISSN 0103-8559
Editora Chefe: Maria Cristina de Oliveira Izar
www.socesp.org.br
Atualização na Síndrome Coronariana Aguda •fiSiopAtologiA dAS SíndromeS CoronAriAnAS AgudAS
•diAgnÓStiCo dAS SíndromeS CoronAriAnAS AgudAS e modelo SiStemAtiZAdo de Atendimento em unidAdeS de dor torÁCiCA
• importÂnCiA dA telemediCinA e dA tromBÓliSe prÉ-HoSpitAlAr
•AnÁliSe CrítiCA dA reperfuSÃo preCoCe no infArto Agudo Com SuprAdeSníVel de St: tromBÓliSe QuímiCA e interVenÇÃo perCutÂneA primÁriA
•eStrAtÉgiA inVASiVA nAS SíndromeS CoronAriAnAS AgudAS Sem SuprAdeSniVelAmento do Segmento St
•terApiA AntitromBÓtiCA nA fASe AgudA dAS SíndromeS CoronAriAnAS AgudAS
•eStrAtÉgiAS AntiplAQuetÁriAS orAiS nAS fASeS AgudA e CrÔniCA dAS SíndromeS CoronAriAnAS AgudAS.
•AnÁliSe CrítiCA do trAtAmento CirúrgiCo nAS SíndromeS CoronAriAnAS AgudAS e SuAS CompliCAÇõeS
•Síndrome CoronAriAnA AgudA em indiVíduoS Com reVASCulAriZAÇÃo CirúrgiCA ou perCutÂneA prÉViA
•pApel do Suporte CirCulAtÓrio nAS SíndromeS CoronAriAnAS AgudAS
Aumento de expressão de tltr2Aumento de neutrófilos
Aumento de netSinterações com ácido hialurônicoAumento da apoptose endotelial
Aumento de microparticulas endoteliais
Aumento de ldl-colesterolAumento de vias inflamatórias
formação de celulas espumosasredução de igm anti ldloxidada
inflamação de linfócitos e monócitospró-inflamatórios
TromboseOclusão parcial
TromboseOclusão Total
endotélio
Micropartículas endotéliais
IAMCSSTRuptura de placa
Trombose
IAMSSST/AIErosão endotelial
Trombose
*representadas em tamanho aumentado para fins didáticos.ft= fator tecidual, cofator lipoprotéico não-enzimático, que aumenta a eficiência proteolítica do fator Vii; pl= fosfolipídios; At iii= antitrombina iii.
Células endoteliais
Células musculares lisas
Fibrinogenio
Fibrinas
FT
FT FT
x
IX a
IX
X a
X
FTFT
FT
FTFT
Macrófagos
Va+PL+Ca+2
FT+Villa+PL
+Ca+2
Villa+PL+Ca +2
xIa
II (Protrombina)
IIa (trombina)
Plaquetas*
Fondaparinux (+AT III)
Heparina de baixo peso molecular (+ At iii)
Heparina não fracionada(+At iii)
Bivalirudina



Responsável TécnicoDr. Luiz Carlos V. de Andrade – CRM 48277
HCor – Hospital do Coração/Diagnóstico – Unidade Paraíso: Rua Desembargador Eliseu Guilherme, 147 – São Paulo – SPHCor – Edifício Dr. Adib Jatene: Rua Desembargador Eliseu Guilherme, 130 – São Paulo – SPHCor Onco – Clínica de Radioterapia: Rua Tomás Carvalhal, 172 – São Paulo – SPHCor Diagnóstico – Unidade Cidade Jardim: Av. Cidade Jardim, 350 – 2º andar – São Paulo – SPTels.: Geral: (11) 3053-6611 • Central de Agendamento: (11) 3889-3939 • Pronto-socorro: (11) 3889-9944 • www.hcor.com.br
Sala de cirurgia híbrida cardiovascular, para o tratamento de cardiopatias complexas com imagens tridimensionais altamente apuradas.
Nós colocamos o coração em tudo.
Todo o apoio que você precisa:uma equipe multidisciplinar e os maisavançados recursos tecnológicos.
O HCor foi o hospital pioneiro na América Latina a conquistar duas certificações pela JCI para os Programas Clínicos de Infarto Agudo de Miocárdio ( IAM) e de Insuficiência Cardíaca ( IC).
Essa mesma excelência também está presente na nova unidade do HCor, o edifício Dr. Adib Jatene. Agora, você e seus pacientes têm uma das mais completas e sofisticadas estruturas totalmente à disposição para que obtenham os melhores resultados em todos os tratamentos.
HC_0007_15_ANUNCIO_SOCESP_42x28cm_af_saida.pdf 1 1/28/15 6:10 PM

Responsável TécnicoDr. Luiz Carlos V. de Andrade – CRM 48277
HCor – Hospital do Coração/Diagnóstico – Unidade Paraíso: Rua Desembargador Eliseu Guilherme, 147 – São Paulo – SPHCor – Edifício Dr. Adib Jatene: Rua Desembargador Eliseu Guilherme, 130 – São Paulo – SPHCor Onco – Clínica de Radioterapia: Rua Tomás Carvalhal, 172 – São Paulo – SPHCor Diagnóstico – Unidade Cidade Jardim: Av. Cidade Jardim, 350 – 2º andar – São Paulo – SPTels.: Geral: (11) 3053-6611 • Central de Agendamento: (11) 3889-3939 • Pronto-socorro: (11) 3889-9944 • www.hcor.com.br
Sala de cirurgia híbrida cardiovascular, para o tratamento de cardiopatias complexas com imagens tridimensionais altamente apuradas.
Nós colocamos o coração em tudo.
Todo o apoio que você precisa:uma equipe multidisciplinar e os maisavançados recursos tecnológicos.
O HCor foi o hospital pioneiro na América Latina a conquistar duas certificações pela JCI para os Programas Clínicos de Infarto Agudo de Miocárdio ( IAM) e de Insuficiência Cardíaca ( IC).
Essa mesma excelência também está presente na nova unidade do HCor, o edifício Dr. Adib Jatene. Agora, você e seus pacientes têm uma das mais completas e sofisticadas estruturas totalmente à disposição para que obtenham os melhores resultados em todos os tratamentos.
HC_0007_15_ANUNCIO_SOCESP_42x28cm_af_saida.pdf 1 1/28/15 6:10 PM

C
M
Y
CM
MY
CY
CMY
K
anuncio_21x28_3A.pdf 1 4/14/16 11:11 AM

ISSN 0103-8559
Editora Chefe: Maria Cristina de Oliveira Izar
Conselho EditorialÁlvaro Avezum Instituto Dante Pazzanese de Cardiologia São Paulo, SP, BrasilAmanda G. M. R. SousaInstituto Dante Pazzanese de Cardiologia São Paulo, SP, BrasilAngelo Amato V. de PaolaEscola Paulista de Medicina da Universidade Federal de São Paulo - Unifesp São Paulo, SP, BrasilAntonio Augusto LopesInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP São Paulo, SP, BrasilAntonio Carlos Pereira-BarrettoInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP São Paulo, SP, BrasilAntonio de Pádua MansurInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilAri TimermanInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilBenedito Carlos MacielFaculdade de Medicina de Ribeirão Preto, Ribeirão Preto,SP,BrasilBráulio Luna FilhoEscola Paulista de Medicina da Universidade Federal de São Paulo/Hospital Brasil, ABC São Paulo, SP, BrasilBruno Caramelli Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilCaio de Brito ViannaInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilCarlos Alberto BuchpiguelFaculdade de Medicina da Universidade de São Paulo (Vinculação Acadêmica) São Paulo, SP, BrasilCarlos Costa MagalhãesCardioclin - Clinica e Emergência Cardiologica São José dos Campos, SP, Brasil.Carlos Eduardo RochitteInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP/Hospital do Coração, HCOR/Associação do Sanatório Sírio, São Paulo, SP, BrasilCarlos V. Serrano Jr.Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP São Paulo, SP, BrasilCelso AmodeoInstituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil
Dalmo Antonio R. MoreiraInstituto Dante Pazzanese de Cardiologia, São Paulo, SP, BrasilDaniel BornEscola Paulista de Medicina da Universidade Federal de São Paulo - UNIFESP São Paulo, SP, BrasilDante Marcelo Artigas GiorgiInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC FMUSP), São Paulo, SP, BrasilDirceu Rodrigues AlmeidaEscola Paulista de Medicina da Universidade Federal de São Paulo - UNIFESP, São Paulo, SP, BrasilEdson StefaniniEscola Paulista de Medicina da Universidade Federal deSão Paulo -UNIFESP, São Paulo, SP, BrasilExpedito E. RibeiroInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de-Medicina da Universidade de São Paulo-HCFMUSP São Paulo, SP, BrasilFabio B. JateneInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP São Paulo, SP, BrasilFausto FeresInstituto Dante Pazzanese de Cardiologia São Paulo, SP, BrasilFelix J. A. RamiresInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Fernanda Marciano Consolim ColomboInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilFernando BacalInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilFernando NobreHospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, Ribeirão Preto, SP, BrasilFlavio TarasoutchiInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilFrancisco A. Helfenstein FonsecaEscola Paulista de Medicina - Universidade Federal de São PauloSão Paulo, SP, BrasilFrancisco R. M. LaurindoInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de-Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilHenry AbensurBeneficência Portuguesa de São Paulo - Setor de ensino, São Paulo, SP, BrasilIbraim Masciarelli F.pintoInstituto Dante Pazzanese de Cardiologia, São Paulo, SP, BrasilIeda Biscegli JateneHospital do Coração - HCOR São Paulo, SP, BrasilJoão Fernando Monteiro FerreiraInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilJoão Manoel Rossi NetoInstituto Dante Pazzanese de Cardiologia, São Paulo, SP, BrasilJoão Nelson R. Branco Escola Paulista de Medicina da Universidade Federal de São Paulo -UNIFESP, São Paulo, SP, BrasilJorge Eduardo AssefInstituto Dante Pazzanese de Cardiologia, São Paulo, SP, BrasilJosé Carlos NicolauInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilJosé Carlos Pachón MateosInstituto Dante Pazzanese de Cardiologia, Universidade de São Paulo - USP, Hospital do Coração, Hospital Edmundo Vasconcelos, São Paulo, SP, BrasilJosé Francisco Kerr SaraivaHospital e Maternidade Celso Pierro, São Paulo, SP, BrasilJosé Henrique Andrade Vila Hospital de Beneficência Portuguesa, São Paulo, SP, BrasilJosé L. AndradeInstituto de Radiologia (InRad) - Hospital das Clínicas - Faculdade de Medicina- USP, São Paulo, SP, BrasilJosé Soares Jr.Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilKatashi OkoshiFaculdade de Medicina de Botucatu, UNESP, Botucatu, SP, BrasilKleber G. FranchiniDepartamento de Clínica Médica UNICAMP - Universidade Estadual de Campinas, Campinas, SP, BrasilLeopoldo Soares PiegasInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilLilia Nigro MaiaFaculdade de Medicina de Rio Preto (FAMERP)/Hospital de BaseSão José do Rio Preto, SP, BrasilLuiz A. Machado CésarInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilLuiz MastrocolaHospital do Coração da Associação do Sanatório Sírio (HCOR) e Insti-tuto Dante Pazzanese de Cardiologia, São Paulo, SP, BrasilLuiz Felipe P. Moreira Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP São Paulo, SP, Brasil
DIRETORIA DA SOCIEDADE DE CARDIOLOGIA DO ESTADO DE SÃO PAULO/Biênio 2016 - 2017Presidente Ibraim Masciarelli Francisco PintoVice-Presidente João Fernando Monteiro Ferreira1° Secretário Ieda Biscegli Jatene2° Secretário Roberto Kalil Filho 1° Tesoureiro José Luiz Aziz 2° Tesoureiro Juan Carlos Yugar Toledo
Diretor Científico Álvaro Avezum Junior Diretora de Publicações Maria Cristina de Oliveira IzarDiretora de Regionais Lilia Nigro Maia Diretor de Qualidade Assistencial Múcio Tavares de Oliveira Junior Diretor de Tecnologia da Informação Ricardo PavanelloDiretor de Relações Institucionais Luciano Ferreira Drager
Diretor de Promoção e Pesquisa Pedro Alves Lemos Neto Diretor do Centro de Emergências Agnaldo PispicoCoordenador de Pesquisa Otavio BerwangerCoordenador de Educação Virtual Pedro Silvio Farsky Coordenadores de Políticas de Saúde Edson Stefanini Jose Francisco Kerr SaraivaCoordenador de Memórias Alberto Francisco Piccolotto Naccarato
Marcelo JateneInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilMarcelo Chiara BertolamiInstituto Dante Pazzanese de Cardiologia, São Paulo, SP, BrasilMarcelo Luiz Campos VieiraInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilMarcus Vinicius SimõesFaculdade de Medicina de Ribeirão Preto - Universidade de São Paulo, Ribeirão Preto, SP - BrasilMaria Cristina Oliveira IzarEscola Paulista de Medicina da Universidade Federal de São Paulo -UNIFESP, São Paulo, SP, BrasilMaria Teresa Nogueira BombigEscola Paulista de Medicina da Universidade Federal de São Paulo -UNIFESP, São Paulo, SP, BrasilDra. Maria Virgínia Tavares Santana Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, BrasilMauricio Ibrahim ScanavaccaInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilMax GrinbergInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilMiguel Antonio MorettiInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilNelson Kasinsky Escola Paulista de Medicina da Universidade Federal de São Paulo -UNIFESP, São Paulo, SP, BrasilOrlando Campos FilhoEscola Paulista de Medicina da Universidade Federal de São Paulo -UNIFESP, São Paulo, SP, BrasilOtavio Rizzi CoelhoDisciplina de Cardiologia do Departamento de Clinica Médica da FCM UNICAMP, São Paulo, SP, BrasilPaola Emanuela Poggio SmanioInstituto Dante Pazzanese de Cardiologia São Paulo, SP, BrasilPaulo Andrade LotufoFaculdade de Medicina e Centro de Pesquisa Clínica Epidemiológica da USP, São Paulo, SP, BrasilPaulo J. F. TucciEscola Paulista de Medicina da Universidade Federal de São Paulo -UNIFESP, São Paulo, SP, BrasilPaulo M. Pêgo FernandesInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, BrasilPedro Silvio FarskyInstituto Dante Pazzanese de Cardiologia, São Paulo, SP, BrasilRaul Dias Dos Santos FilhoFaculdade de Medicina da Universidade de São Paulo, São Paulo, SP, BrasilRenato Azevedo JrHospital Samaritano São Paulo, São Paulo, SP, BrasilRomeu Sérgio MenegheloInstituto Dante Pazzanese de Cardiologia/Hospital Israelita Albert Einstein, São Paulo, SP, BrasilRui PóvoaUniversidade Federal de São Paulo, São Paulo, SP, BrasilUlisses Alexandre Croti Hospital da Criança e Maternidade de São José do Rio Preto (FUN-FARME)/Faculdade de Medicina de São José do Rio Preto (FAMERP), São José do Rio Preto, SP, BrasilValdir Ambrosio MoisesEscola Paulista de Medicina da Universidade Federal de São Paulo - UNIFESP/Fleury Medicina e Saúde, São Paulo, SP, BrasilValter C. LimaEscola Paulista de Medicina da Universidade Federal de São Paulo - UNIFESP, São Paulo, SP, BrasilWilliam Azem ChalelaInstituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Indexada em:LILACS – Literatura Latino-Americana e do Caribe em Ciências da Saúde (www.bireme.br)Latindex – Sistema Regional de Información em Línea para Revistas Científicas de América Latina, El Caribe, España y Portugal (www.latindex.unam.mx)
C
M
Y
CM
MY
CY
CMY
K
anuncio_21x28_3A.pdf 1 4/14/16 11:11 AM

Revista da Sociedade de Cardiologia do Estado de São PauloSão Paulo – SP, Brasil. V. 1 – 1991 –Substitui Atualização Cardiológica, 1981 – 91
1991, : 1 (supl A), 2 (supl A), 3 (supl A)1992, 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A), 5 (supl A), 6 (supl A)1993, : 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A), 5 (supl A), 6 (supl A)1994, : 1 (supl A), 2 (supl A), 3 (supl A), 3 (supl B), 4 (supl A), 5 (supl A), 6 (supl A)1995, : 1 (supl A), 2 (supl A), 3 (supl B), 4 (supl A), 5 (supl A), 6 (supl A)1996, : 1 (supl A), 2 (supl A), 3 (supl A), 3 (supl B), 4 (supl A), 5 (supl A), 6 (supl A)1997, : 1 (supl A), 2 (supl A), 3 (supl A), 3 (supl B), 4 (supl A), 5 (supl A), 6 (supl A)1998, : 1 (supl A), 2 (supl A), 3 (supl A), 4 (supl A), 4 (supl B), 5 (supl A), 6 (supl A)1999, : 1 (supl A), 2 (supl A), 3 (supl A), 3 (supl B), 4 (supl A), 5 (supl A), 6 (supl A)2000, : 1 (supl A), 2 (supl A), 3 (supl A), 3 (supl B), 4 (supl A), 5 (supl A), 6 (supl A)2001, : 1 (supl A), 2 (supl A), 3 (supl A), 3 (supl B), 4 (supl A), 5 (supl A), 6 (supl A)2002, : 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A), 5 (supl A), 6 (supl A)2003, : 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A), 5 (supl A), 6 (supl A)2004, : 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A), 5 (supl A), 6 (supl A)2005, : 1 (supl A), 2 (supl A), 3 (supl A), 4 (supl A), 5 (supl A), 5 (supl B), 6 (supl A)2006, : 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)2007, : 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)2008, : 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)2009, : 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)2010, : 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)2011, : 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)2012, : 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)2013, : 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)2014, : 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)2015, : 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)2016, : 1 (supl A)
ISSN 0103-8559 CDD16616.105RSCESP 72594 NLM W1 WG100 CDU 616.1(05)
A Revista da Sociedade de Cardiologia do Estado de São Paulo (INSS 0103-8559) é Órgão Oficial da Sociedade de Cardiologia do Estado de São Paulo, editada trimestralmente pela Diretoria de Publicações da SOCESP.
Avenida Paulista, 2073 – Horsa I, 15° andar Conjunto 1512 - Cerqueira Cesar – São Paulo, SP CEP 01311-940/Tel: (11) 3179-0045/E-mail: [email protected]
Website: www.socesp.org.brAs mudanças de endereço, a solicitação de números atrasados e as cartas ao Editor
deverão ser dirigidas à sede da SOCESP.É proibida a reprodução total ou parcial de quaisquer textos constantes desta edição
sem autorização formal e expressa de seus editores.Para pedidos de reprints, por favor contate: SOCESP – Sociedade de Cardiologia do Estado de São Paulo/
Diretoria de PublicaçõesTel: (11) 3179-0045/E-mail: [email protected]
Impressão: DuografTiragem: 6.190 exemplares
Coordenação editorial, criação, diagramação, revisão e tradução
Atha Comunicação e EditoraTel.: 11 5087 9502 - [email protected]

DIRETORIA DAS REGIONAIS DA SOCIEDADE DE CARDIOLOGIA DO ESTADO DE SÃO PAULOBiênio 2016 - 2017
ABCDM PresidenteRogerio Krakauer
Diretor CientíficoRoberto Andres Gomez Douglas
1° SecretáriaCarla Janice Baister Lantieri
2° SecretárioKamal Yazbek Jr.
ARAÇATUBA
Presidente Celso Biagi
Diretor Científico Carlos Roberto Bortoluci Etto
1° Secretário Paulo Francisco de Mesquita Barros
2° SecretáriaMonica Neri Shinsato
ARARAQUARA
PresidenteAntonio Carlos Braga de Moraes
Diretor CientíficoJosé Geraldo Bonfá
1° SecretárioHélio Marques Malavolta
2° SecretárioJosé Candido M. da S. Machado
ARARAS
PresidenteAntonio Carlos Assumpção
Diretor CientíficoJosé Joaquim Fernandes Raposo Filho
1° SecretárioFernando Candido Martins
2° SecretárioAgnaldo Pispico
BAURU
PresidenteAlexandre Volney VillaDiretor CientíficoPlinio de Almeida Barros Neto
1° SecretárioNilcelio Leite Melo
2° SecretárioJoão Quialheiro Abreu
BOTUCATU
PresidenteRicardo Mattos Ferreira
Diretor CientíficoDanieliso Renato Fusco
1° SecretárioMarcos Mitsuo Seki
2° SecretárioGuilherme de Castro Ribeiro
CAMPINAS
PresidenteAlessandro Franjotti Chagas
Diretor CientíficoFernando Piza de S. Cannavan
1° SecretárioFernando Mello Porto
2° SecretárioTiago Porto Di Nucci
FRANCA
PresidenteEduardo Maniglia Puccinelli
Diretor CientíficoRodrigo Tavares Silva
1° SecretárioLuiz Alfredo Husemann Patti
2° SecretárioHélio Rubens Crialezi
JUNDIAÍ
PresidenteLuiz Anibal Larco Patino
Diretor CientíficoMarco Antonio Dias
1° SecretárioJoão Paulo de Mello Medeiros
2° SecretáriaFatima Aparecida Lopes Pinto Denardi
MARILIA
PresidenteAlexandre Rodrigues
Diretor CientíficoPedro Beraldo de Andrade
1° SecretárioRonaldo de Oliveira Jr
2° SecretárioAndré dos Santos Moro
PIRACICABA
PresidenteJuliana Barbosa Previtalli
Diretora CientíficaCelise Alessandra Sobral Denardi
1° SecretárioRafael Prota
2° SecretárioDavi Bizetti Pelai
PRESIDENTE PRUDENTE
PresidenteMozart Alves Gonçalves Filho
Diretor CientíficoFernando Pierin Peres
1° SecretárioOsmar Marchiotto Junior
2° SecretárioAdriano Oliveira Cavalheiro
RIBEIRÃO PRETO
PresidenteMoyses de Oliveira Lima Filho
Diretor CientíficoMarcelo Garcia Leal
1° SecretáriaSamira Ubaid Girioli
2° SecretárioFlavio Cantarelli Hiss
SANTOS
PresidenteLuiz Fernando Muniz Pinheiro
Diretor CientíficoCarlos Alberto Cyrillo Sellera
1° SecretárioWilliam da Costa
2° SecretárioSergio Paulo Almeida B. Camargo
SÃO CARLOS
PresidenteHélio Araújo Cardoso
Diretora CientíficaAna Cândida Arruda Verzola de Castro.
1° SecretáriaMeliza Goi Roscani
2° SecretárioSergio Luis Berti
SÃO JOSÉ DO RIO PRETO
PresidenteAdriana Pinto Bellini Miola
Diretor CientíficoGilmar Valdir Greque
1° SecretáriaMaria Helena Mani Dias Sardilli
2° SecretáriaEliana Migliorini Mustafa
SOROCABA
PresidenteFernando Cortes Remisio Figuinha
Diretor CientíficoPericles Sidnei Salmazo
1° SecretáriaJuliana Buchmann Pereira
2° SecretárioMarcelo Demarchi
VALE DO PARAÍBA
Presidente Jorge Zarur Neto
Diretor Científico Pedro Henrique Duccini Mendes Trindade
1° Secretária Fabiana Goulart Marcondes Braga 2° Secretário André Zeraik Lima Chammas

A Revista da Sociedade de Cardiologia do Estado de São Paulo (Rev Soc Cardiol Estado de São Paulo) é o órgão oficial de divulgação da Sociedade de Cardiologia do Estado de São Paulo (SOCESP).
O Suplemento da Revista Sociedade de Cardiologia do Estado de São Paulo é parte integrante da Revista da Sociedade de Cardiologia do Estado de São Paulo e publica artigos nas áreas de saúde como enfermagem, fisioterapia, educação física, nutrição, odontologia, psicologia, serviço social, far-macologia, entre outras).
Trata-se de uma publicação trimestral indexada no LILACS (Literatura Latino-Americana e do Caribe em Ciências da Saúde) e no Latindex (Sistema Regional de Información en Línea para Revistas Científicas de América Latina, el Caribe, España y Portugal).
Com o objetivo de disseminar o conhecimento na área de cardiologia e de outras áreas de saúde a Revista da SOCESP e seu Suplemento passam a partir de 2015 a ter acesso aberto.
A publicação segue os requisitos de uniformização reco-mendados pelo Comitê Internacional de Editores de Revistas Médicas (www.icmje.org.br).
Os artigos, para serem aprovados, são submetidos à avalia-ção de uma comissão de revisores (peer review) que recebem o texto de forma anônima e decidem se haverá sua publicação, sugerem modificações, requisitam esclarecimentos aos autores e efetuam recomendações ao Editor Chefe.
Os conceitos e declarações contidos nos trabalhos são de total responsabilidade dos autores.
A Revista da Sociedade de Cardiologia do Estado de São Paulo segue na íntegra a tendência internacional do estilo Van-couver, disponível (www.icmje.org.br).
Categorias de artigosA Revista da Sociedade de Cardiologia do Estado de São
Paulo recebe para publicação artigos de Revisão, Revisão Sis-temática e Meta-análise.
O Suplemento da Revista da Sociedade de Cardiologia do Estado de São Paulo recebe para publicação: Artigo Original, Revisão, Revisão Sistemática, Meta-análise, Artigo de Opinião, Artigo de Atualização e Relato de Caso.
No caso de estudos clínicos e experimentais deverá haver refe-rência explícita quanto ao cumprimento das normas éticas, incluindo o nome do Comitê de Ética em Pesquisa que aprovou o estudo.
LiMites Por tiPo de PUBLiCaÇÃo (extensão): Os critérios abaixo recomendados devem ser observados
para cada tipo de publicação. A contagem eletrônica de palavras deve incluir a página inicial, resumo, texto e referências.
Os manuscritos enviados deverão estar em padrão PC com arquivos TXT ou DOC, espaço duplo, com margem larga, acom-panhados pela carta de autorização de publicação assinada pelo autor, declarando que o mesmo é inédito e que não foi, ou está sendo submetido à publicação em outro periódico.
Certifique-se de que o manuscrito se conforma inteiramente
NorMas de PUBLiCaÇÃo
às instruções.Ensaios clínicos: O periódico apoia as políticas para re-
gistro de ensaios clínicos da Organização Mundial de Saúde (OMS) e do Comitê Internacional de Editores de Diários Médicos (ICMJE), reconhecendo a importância dessas iniciativas para o registro e divulgação internacional de informação sobre estudos clínicos, em acesso aberto. Sendo assim, somente serão aceitos para publicação, os artigos de pesquisas clínicas que tenham recebido um número de identificação em um dos Registros de Ensaios Clínicos validados pelos critérios estabelecidos pela OMS e ICMJE. Os endereços para esses registros estão dis-poníveis a partir do site do ICMJE (www.icmje.org). O número de identificação deve ser declarado no final do resumo.
Conflito de interesses: Conforme exigências do Comitê Internacional de Editores de Diários Médicos (ICMJE), grupo Vancouver e resolução do Conselho Federal de Medicina nº 1595/2000 os autores têm a responsabilidade de reconhecer e declarar conflitos de interesse financeiros e outros (comercial, pessoal, político, etc.) envolvidos no desenvolvimento do tra-balho apresentado para publicação. Devem declarar e podem agradecer no manuscrito todo o apoio financeiro ao trabalho, bem como outras ligações para o seu desenvolvimento.
Correção de provas gráficas: Logo que prontas, as provas gráficas em formato eletrônico serão enviadas, por e-mail, para o autor responsável pelo artigo. Os autores deverão devolver, também por e-mail, a prova gráfica com as devidas correções em, no máximo, 48 horas após o seu recebimento. O envio e o retorno das provas gráficas por correio eletrônico visa agilizar o processo de revisão e posterior publicação das mesmas.
Direitos autorais: Todas as declarações publicadas nos artigos são de inteira responsabilidade dos autores. Entretanto, todo material publicado torna-se propriedade da Revista, que passa a reservar os direitos autorais. Portanto, nenhum material publicado na Revista da Sociedade de Cardiologia do Estado de São Paulo poderá ser reproduzido sem a permissão por es-crito. Todos os autores de artigos submetidos deverão assinar um Termo de Transferência de Direitos Autorais, que entrará em vigor a partir da data de aceite do trabalho.
Organização do arquivo eletrônico: Todas as partes do manuscrito devem ser incluídas em um único arquivo. O mesmo deverá ser organizado com a página de rosto, em primeiro lugar, o texto, referências seguido pelas figuras (com legendas) e ao final, as tabelas (com legendas).
Página de rosto: A página de rosto deve conter:a. o tipo do artigo (artigo original, de revisão ou atualização);b. o título completo em português e inglês com até 90 caracteres
deve ser conciso, porém informativo;c. o nome completo de cada autor (sem abreviações); e a
instituição a que pertence cada um deles;d. o local onde o trabalho foi desenvolvido;e. nome, endereço, telefone e e-mail do autor responsável para
correspondência.Resumo: O Resumo deve ser estruturado em caso de artigo
original e deve apresentar os objetivos do estudo com clareza, dados históricos, métodos, resultados e as principais conclusões em inglês e português, não devendo ultrapassar 250 palavras.
recomendações para Artigos submetidos à revista da SoCeSp:
tipo de Artigo resumo número de palavras referências figuras tabelas
original estruturado com até 250 palavras
2.500 - excluindo o resumo, referências, tabelas e figuras 20 10 6
Atualização/revisão
não é estruturado com até 250 palavras
4.000 - excluindo o resumo, referências, tabelas e figuras 60 3 2
editorial 0 500 0 0 0

Resumos Gráficos (graphical abstract) serão aceitos. A informação deverá ser composta de imagem concisa, pictórica e visual das principais conclusões do artigo. Pode ser tanto a figura de conclusão do artigo ou uma figura que é especialmente concebida para este fim, que capta o conteúdo do artigo para os leitores em um único olhar. As figuras incluem todas as ilus-trações, tais como fotografias, desenhos, mapas, gráficos, etc, e deve ser identificado com o nome do artigo.
O envio de resumo gráfico (graphical abstract) é opcional e deve ser encaminhado em arquivo separado e identificado. O arquivo deve ter extensão.tif e/ou jpg. Também são aceitos arquivos com extensão.xls (Excel);.eps;.psd para ilustrações em curva (gráficos, desenhos e esquemas).
Descritores: Deve conter no mínimo três palavras chaves baseadas nos Descritores de Ciências da Saúde (DeCS) -http://decs.bireme.br. No inglês, apresentar keywords baseados no Medical Subject Headings (MeSH) - http://www.nlm.nih.gov/mesh/meshhome.html, no mínimo três e no máximo seis citações.
Introdução: Deve apresentar o assunto e objetivo do estudo, oferecer citações sem fazer uma revisão externa da matéria.
Material e método: Deve descrever o experimento (quanti-dade e qualidade) e os procedimentos em detalhes suficientes que permitam a outros pesquisadores reproduzirem os resultados ou darem continuidade ao estudo.
Ao relatar experimentos sobre temas humanos e animais, indicar se os procedimentos seguiram as normas do Comitê Ético sobre Experiências Humanas da Instituição, na qual a pesquisa foi realizada ou de acordo com a declaração de Helsinki de 1995 e Animal Experimentation Ethics, respectivamente. Identificar precisamente todas as drogas e substâncias químicas usadas, incluindo os nomes genéricos, dosagens e formas de admi-nistração. Não usar nomes dos pacientes, iniciais, ou registros de hospitais. Oferecer referências para o estabelecimento de procedimentos estatísticos.
Resultados: Apresentar os resultados em sequência lógica do texto, usando tabelas e ilustrações. Não repetir no texto todos os dados constantes das tabelas e ou ilustrações. No texto, enfatizar ou resumir somente as descobertas importantes.
Discussão: Enfatizar novos e importantes aspectos do es-tudo. Os métodos publicados anteriormente devem ser compa-rados com o atual para que os resultados não sejam repetidos.
Conclusão: Deve ser clara e concisa e estabelecer uma ligação entre a conclusão e os objetivos do estudo. Evitar con-clusões não baseadas em dados.
Agradecimentos: Dirigidos a pessoas que tenham cola-borado intelectualmente, mas cuja contribuição não justifica coautoria, ou para aquelas que tenham provido apoio material.
Referências: Citar as referências, restritas à bibliografia es-sencial ao conteúdo do artigo. Numerar as referências de forma consecutiva de acordo com a ordem em que forem menciona-das pela primeira vez no texto, utilizando-se números arábicos sobrescritos. Incluir os seis primeiros autores seguidos de at al.
Os títulos de periódicos deverão ser abreviados de acordo com o Index Medicus.a. Artigos: Autor(es). Título do artigo. Título do Periódico. ano;
volume: página inicial - finalEx.: Campbell CJ. The healing of cartilage deffects. Clin
Orthop Relat Res. 1969;(64):45-63.b. Livros: Autor(es) ou editor(es). Título do livro. Edição, se não
for a primeira. Tradutor(es), se for o caso. Local de publi-cação: editora; ano. Ex.: Diener HC, Wilkinson M, editors. Drug-induced headache. 2nd ed. New York: Spriger-Verlag; 1996.
c. Capítulos de livros: Autor(es) do capítulo. Título do capítulo Editor(es) do livro e demais dados sobre este, conforme o item anterior.Ex.: Chapman MW, Olson SA. Open fractures. In: Rockwood CA, Green DP. Fractures in adults. 4th ed. Philadelphia: Lippincott-Raven; 1996. p.305-52.
d. Resumos: Autor(es). Título, seguido de [abstract]. Periódico ano; volume (suplemento e seu número, se for o caso): página(s) Ex.: Enzensberger W, Fisher PA. Metronome in
Parkinson’sdisease [abstract]. Lancet. 1996;34:1337.
e. Comunicações pessoais só devem ser mencionadas no texto entre parênteses.
f. Tese: Autor, título nível (mestrado, doutorado etc.), cidade: instituição; ano. Ex.: Kaplan SJ.Post-hospital home health care: the elderley’s access and utilization [dissertation]. St. Louis:Washington Univ.; 1995.
g. Material eletrônico: Título do documento, endereço na inter-net, data do acesso. Ex: Morse SS. Factors in the emergence of infectious diseases. Emerg Infect Dis. [online] 1995 Jan--Mar [cited 1996 Jun 5];1(1):[24 screens]. Available from: URL: http://www.cdc.gov/ncidod/EID/eid.htmTabelas: As tabelas devem ser numeradas por ordem de
aparecimento no texto com números arábicos. Cada tabela deve ter um título e, se necessário, uma legenda explicativa. As tabelas deverão ser enviadas através dos arquivos originais (p.e. Excel).
Figuras (fotografias e ilustrações): As figuras devem ser apresentadas em páginas separadas e numeradas sequencial-mente, em algarismos arábicos, conforme a ordem de apare-cimento no texto. Para evitar problemas que comprometam o padrão da revista, o envio do material deve obedecer aos seguintes parâmetros: todas as figuras, fotografias e ilustrações devem ter qualidade gráfica adequada (300 dpi de resolução) e apresentar título e legenda. Em todos os casos, os arquivos devem ter extensão.tif e/ou jpg. Também são aceitos arquivos com extensão.xls (Excel),.eps,.psd para ilustrações em curva (gráficos, desenhos e esquemas). As figuras incluem todas as ilustrações, tais como fotografias, desenhos, mapas, gráficos, etc, e devem ser numeradas consecutivamente em algarismos arábicos.
Vídeos: O envio de vídeo é opcional, e irá acompanhar a versão online do artigo. Deve ser encaminhado junto com o artigo em arquivo separado e acompanhado de legenda. Os vídeos devem ser enviados em formato digital MP4.
Legendas: Digitar as legendas usando espaço duplo, acompanhando as respectivas figuras (gráficos, fotografias e ilustrações). Cada legenda deve ser numerada em algarismos arábicos, correspondendo a cada figura, e na ordem em que foram citadas no trabalho. Abreviaturas e Siglas:Devem ser precedidas do nome completo quando citadas pela primeira vez no texto. No rodapé das figuras e tabelas deve ser discri-minado o significado das abreviaturas, símbolos, outros sinais e informada fonte: local onde a pesquisa foi realizada. Se as ilustrações já tiverem sido publicadas, deverão vir acompanhadas de autorização por escrito do autor ou editor, constando a fonte de referência onde foi publicada.
Reprodução: Somente a Revista da Sociedade de Cardiolo-gia do Estado de São Paulo poderá autorizar a reprodução dos artigos nelas contidos. Os casos omissos serão resolvidos pela Diretoria da Revista da Sociedade de Cardiologia do Estado de São Paulo. Os artigos enviados passarão a ser propriedade da Revista da Sociedade de Cardiologia do Estado de São Paulo.
Submissão de artigos: A partir de janeiro de 2015 os artigos deverão ser enviados para Submissão para o email:revista @socesp.org.br para a Atha Comunicação e Editora a/c Flávia M. S. Pires e/ou Ana Carolina de Assis.
Caso ocorra a necessidade de esclarecimentos adicionais, favor entrar em contato com a Atha Comunicação e Editora - Rua Machado Bittencourt, 190 - 4º andar - CEP: 04044-903 - São Paulo/SP, Brasil Tel: +55 11 5087-9502/Fax: +55 11 5579 5308.
Todo o conteúdo do periódico, exceto onde identifica-do, está licenciado sob uma Licença Creative CommonsAtribuição-tipo BY-NC.

72
editoriaL
Prezados leitores,
Nesta segunda edição da Revista da SOCESP, abril/junho de 2016, o tema escolhido foi Atualização na Síndrome Coronária Aguda. Este é um fascículo que procura abordar de forma bastante abrangente essa situação clínica tão dramá-tica, para que o cardiologista possa encontrar uma referência rápida e precisa do tema, desde a fisiopatologia e sistematização do diagnóstico, incluindo mo-delos de atendimento na sala de emergência aos avanços com a incorporação da telemedicina na abordagem inicial das síndromes coronárias agudas (SCA).
De grande interesse e importância, temos ainda capítulos que discutem as estratégias de reperfusão nas SCA com supradesnível de ST, comparando a intervenção coronária percutânea precoce, a trombólise química e a estratégia fármaco-invasiva, situando suas vantagens e desvantagens a depender do tempo para sua realização e da sintonia entre as equipes participantes, para garantir o sucesso de cada uma das intervenções. Naquelas sem supradesnível de ST, discute-se a forma e o momento ideal para a estratificação invasiva de risco, se precoce ou muito precoce, conforme o cenário clínico.
Com relação ao tratamento farmacológico, contamos com revisões cuidadosas sobre o uso apropriado dos antitrombóticos e antiplaquetários nas SCA, com considerações sobre a obtenção do máximo benefício clínico e o menor risco de sangramento.
Situações especiais constituem as indicações do tratamento cirúrgico nas SCA e em suas complicações, e uma condição peculiar, mas frequente, que é a abordagem naqueles que possuem revascularização cirúrgica ou percutânea prévia. Por fim, uma situação clínica de alta mortalidade na fase hospitalar, como o choque cardiogênico, é discutida nesta edição. A estratificação de risco, o momento da indicação e a escolha da modalidade de suporte circu-latório são apresentados para a apropriada tomada de decisão clínica.
Espero que os leitores tirem o melhor proveito desse verdadeiro estado da arte, onde os autores escrevem de maneira atualizada, em profundidade e numa leitura agradável tópicos da maior importância em cardiologia.
Boa leitura!
Maria Cristina IzarEditora Chefe

Atualização na Síndrome Coronariana Aguda
sUMÁrio/CoNteNts
FISIOPATOLOGIA DAS SíNDROMES CORONARIANAS AGUDAS ..................................................................................................................................................................................................... 74PATHOPHYSIOLOGY OF ACUTE CORONARY SYNDROMESFrancisco Antonio Helfenstein Fonseca, Maria Cristina de Oliveira Izar
DIAGNÓSTICO DAS SíNDROMES CORONARIANAS AGUDAS E MODELO SISTEMATIZADO DE ATENDIMENTO EM UNIDADES DE DOR TORÁCICA .............................................................................................................................................. 78DIAGNOSIS OF ACUTE CORONARY SYNDROME AND SYSTEMATIC MODEL IN CHEST PAIN SERVICESSilvio Reggi, Edson Stefanini
IMPORTÂNCIA DA TELEMEDICINA E DA TROMBÓLISE PRÉ-HOSPITALAR.......................................................................................................... 86THE IMPORTANCE OF TELEMEDICINE AND OF PRE-HOSPITAL THROMBOLYSISSilvio Reggi, Antonio Carlos Carvalho
ANÁLISE CRíTICA DA REPERFUSÃO PRECOCE NO INFARTO AGUDO COM SUPRADESNíVEL DE ST: TROMBÓLISE QUíMICA E INTERVENÇÃO PERCUTÂNEA PRIMÁRIA ...................................................................................................................... 93ANALYSIS OF EARLY PERFUSION IN MYOCARDIAL INFARCTION WITH ST ELEVATION: CHEMICAL THROMBOLYSIS AND PRIMARY PERCUTANEOUS INTERVENTIONLuiz Antonio Machado César, Miguel Antonio Moretti
ESTRATÉGIA INVASIVA NAS SíNDROMES CORONARIANAS AGUDAS SEM SUPRADESNIVELAMENTO DO SEGMENTO ST ..................................................................................................................................................... 99INVASIVE STRATEGY IN ACUTE CORONARY SYNDROMES WITHOUT ST SEGMENT ELEVATIONDimytri A. Siqueira, J. Ribamar Costa Jr., Alexandre Abizaid
TERAPIA ANTITROMBÓTICA NA FASE AGUDA DAS SíNDROMES CORONARIANAS AGUDAS .................................................................105ANTITHROMBOTIC THERAPY IN ACUTE PHASE OF ACUTE CORONARY SYNDROMESRodrigo Modolo, Otávio Rizzi Coelho
ESTRATÉGIAS ANTIPLAQUETÁRIAS ORAIS NAS FASES AGUDA E CRÔNICA DAS SíNDROMES CORONARIANAS AGUDAS. ..................................................................................................................................................................................................112ORAL ANTIPLATELET STRATEGIES IN THE ACUTE AND CHRONIC OF ACUTE CORONARY SYNDROMES. José Carlos Nicolau, Remo Holanda de Mendonça Furtado
ANÁLISE CRíTICA DO TRATAMENTO CIRúRGICO NAS SíNDROMES CORONARIANAS AGUDAS E SUAS COMPLICAÇõES ...........................................................................................................................................................................................................120CRITICAL ANALYSIS OF SURGICAL TREATMENT IN ACUTE CORONARY SYNDROMES AND ITS COMPLICATIONSAlexandre C. Hueb, Fabio B. Jatene
SíNDROME CORONARIANA AGUDA EM INDIVíDUOS COM REVASCULARIZAÇÃO CIRúRGICA OU PERCUTÂNEA PRÉVIA .....................................................................................................................................................................................................128ACUTE CORONARY SYNDROME IN INDIVIDUALS WITH PREVIOUS SURGICAL OR PERCUTANEOUS REVASCULARIzATIONCristiano Guedes Bezerra, Fábio Augusto Pinton, Pedro Alves Lemos Neto
PAPEL DO SUPORTE CIRCULATÓRIO NAS SíNDROMES CORONARIANAS AGUDAS ....................................................................................134THE ROLE OF CIRCULATORY SUPPORT IN ACUTE CORONARY SYNDROMESEduardo Gregório Chamlian, Nelson Americo Hossne Junior, Walter José Gomes

74
rev Soc Cardiol estado de São paulo 2016;26(2):74-7
revisÃo/review
resUMoAs síndromes coronarianas agudas decorrem principalmente de ruptura da placa vulnerável ou de erosão superficial do endotélio. A crescente exposição ao tratamento com estatinas tem diminuído o conteúdo lipídico e inflamatório das placas, resultando em progressiva redução dos infartos com oclusão completa do vaso e mesmo de recorrência de eventos coronarianos. Por outro lado, com a maior longevidade e crescente prevalência de obe-sidade e diabetes, a erosão endotelial tem se tornado mais presente, notadamente nas apresentações com oclusões transitórias ou parciais das coronárias, sugeridas pela maior incidência de infartos sem supradesnível de segmento ST e angina instável. O avanço da compreensão do papel do colesterol e da inflamação tem proporcionado uma nova visão terapêutica das síndromes coronarianas agudas, que incluem melhora da microcirculação, diminuição de massa infartada e melhor remodelamento ventricular.
Descritores: Síndromes coronarianas agudas; Inflamação; Colesterol.
aBstraCtAcute coronary syndromes mainly occur due to the rupture of vulnerable plaque or superficial endothelial erosion. The increasing exposure of treatment with statins has decreased the inflammatory and lipid content of the plaques, resulting in progressive reduction of myocardial infarction with complete vessel occlusion and even recurrence of coronary events. On the other hand, the increased longevity and the higher prevalence of obesity and diabetes have been associated with endothelial erosion, mainly in transient or partial coronary occlusion, suggested by higher incidence of non-ST elevation myocardial infarction or unstable angina. Advances in understanding the role of cholesterol and inflammation have provided a new therapeutic vision of acute coronary syndromes, including improvement of microcirculation, decreased infarct mass, and better ventricular remodeling.
Keywords: Acute coronary syndromes; Inflammation; Cholesterol.
Francisco Antonio Helfenstein Fonseca1
Maria Cristina de Oliveira Izar1
1. Escola Paulista de Medicina, Universidade Federal de São Paulo, Brasil
Correspondência:Setor de Lípides, Aterosclerose e Biologia VascularEscola Paulista de Medicina – Disciplina de CardiologiaRua Loefgren 1350, Vila Clementino, São Paulo – SP, CEP [email protected]
fisioPatoLogia das síNdroMes CoroNariaNas agUdas
PatHoPHYsioLogY of aCUte CoroNarY sYNdroMes
iNtrodUÇÃoA doença isquêmica do coração é a principal causa de
morte em todo o mundo,1 responsável por 7,4 milhões de óbitos anuais, correspondendo a 13,2% de todas as mor-tes. No Brasil, a doença isquêmica do coração também é a principal causa de óbito, sendo responsável por 31% das mortes cardiovasculares, ultrapassando a taxa de morte por acidente vascular cerebral, estimada em 30%.2
Análise de randomização Mendeliana tem mostrado um notável impacto da exposição a níveis mais baixos de colesterol ao longo da vida e proporcional diminuição nas taxas de eventos coronarianos na vida adulta.3 Além disso, polimorfismos genéticos afetando diferentes me-canismos para redução do colesterol, como absorção intestinal e síntese endógena, possuem similar impacto na incidência da doença coronariana na vida adulta e
sinergismo quando concomitantemente presentes.4
Entretanto, marcadores inflamatórios parecem também associados aos desfechos coronarianos, por uma diversi-dade de mecanismos, que vão desde a presença de cristais de colesterol na íntima vascular, como também a partir de isquemia, maior ativação de receptores Toll Like tipo 2 (TLR2) associados com estresse endotelial, aumento de liberação de microfilamentos (Neutrophyl extracellular Traps – NETs) por neutrófilos, em conjunto proporcionando erosão endotelial.5
Assim, ambos os mecanismos, lipídicos e inflamatórios parecem associados com complicações da placa vulnerável e erosão endotelial e a magnitude da resposta inflamatória que se segue após a oclusão vascular constituem tema de grande interesse atual devido ao seu papel na recupera-ção do miocárdio isquêmico e recorrência de desfechos, sobretudo ao longo do primeiro ano após uma síndrome coronariana aguda.

75
rev Soc Cardiol estado de São paulo 2016;26(2):74-7
aterosCLerose CoroNariaNaEstrias gordurosas e fibroateromas nas coronárias estão
presentes no adulto jovem e sua gravidade estreitamente relacionada com fatores de risco clássicos, como coles-terol e hipertensão arterial.6 A exposição a níveis altos de colesterol, como na hipercolesterolemia familiar determina maior prematuridade na idade de apresentação da doença coronariana, sendo que apropriada redução nos níveis de LDL-colesterol aproxima os pacientes com a dislipidemia de base genética com a história natural da população geral.7,8
Embora a hipercolesterolemia seja fortemente asso-ciada com o desenvolvimento das lesões ateroscleróticas coronárias e suas complicações, o acúmulo de colesterol na íntima vascular parece depender de modificações na estrutura da LDL, principalmente pela exposição a espécies reativas de oxigênio, determinando oxidação de conteúdo protéico (apolipoproteína B) e de fosfolípides. Entretanto, nos últimos anos, notável avanço no conhecimento do papel de subtipos de linfócitos na modulação da placa vulnerável foi reconhecido. Linfócitos que produzem interferon – gama impedem respostas reparativas, como a migração e mu-dança fenotípica de células musculares lisas da camada média, reduzindo a síntese de matriz e promovendo maior proximidade de macrófagos repletos de colesterol junto à luz vascular. Além disso, certos linfócitos de marcante atividade inflamatória, induzem nos macrófagos maior liberação de metaloproteases de matriz, substâncias que degradam o tecido matricial, facilitando a interação do núcleo lipídico com a circulação e, consequentemente, trombose do vaso.9
Nos últimos anos, maior atenção tem sido dada ao papel imune dos linfócitos. As células B1 produzem anticorpo natural (IgM) que neutraliza a LDL oxidada, enquanto outros tipos de linfócitos como as células B2 parecem relacionadas com maior
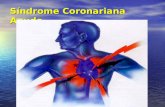
figura 1. mecanismos das síndromes coronarianas agudas. oclusões parciais dos vasos coronarianos estão associadas com infarto sem supradesnível do segmento St e angina instável e tem como base a erosão endotelial. A erosão endotelial parece associada com au-mento do estresse endotelial deflagrado por aumento da expressão de receptores toll-like 2 (tlr2), nets (Neutrophyl Extracellular Traps), aumento do estresse hemodinâmico e isquemia. Já as oclusões totais do vaso coronariano se associam ao infarto do miocárdio com supradesnível do segmento St e presença de núcleo lipídico mais exuberante e com intensa infiltração de linfócitos e macrófagos associados com menor produção de anticorpos anti ldl oxidada.
Aumento de expressão de tltr2Aumento de neutrófilos
Aumento de netSinterações com ácido hialurônicoAumento da apoptose endotelial
Aumento de microparticulas endoteliais
Aumento de ldl-colesterolAumento de vias inflamatórias
formação de celulas espumosasredução de igm anti ldloxidada
inflamação de linfócitos e monócitospró-inflamatórios
TromboseOclusão parcial
TromboseOclusão Total
endotélio
Micropartículas endotéliais
IAMCSSTRuptura de placa
Trombose
IAMSSST/AIErosão endotelial
Trombose
FISIOPATOLOGIA DAS SíNDROMES CORONARIANAS AGUDAS
ativação de linfócitos TCD4 e CD8 e relacionadas com maior desenvolvimento de aterosclerose e complicações.10 Certos subtipos de linfócitos produzem anticorpos anti-LDL oxidada classe IgG e parecem atenuar a doença coronariana e são mais expressos sob melhor controle de fatores de risco.11-15
PLaCa vULNerÁveL, erosÃo eNdoteLiaL e a forMa de aPreseNtaÇÃo das síNdroMes CoroNariaNas agUdas
O infarto com supradesnível de segmento ST ocorre em associação com oclusão trombótica total do vaso, frequente-mente como complicação de placa rica em colesterol e infil-trada de leucócitos. Entretanto, com a crescente exposição a tratamento com estatinas, esta forma de apresentação clínica da síndrome coronariana aguda tem declinado, em virtude do menor conteúdo lipídico, trombótico e inflamatório.16 Por outro lado, oclusões parciais do vaso, associadas com infarto sem supradesnível do segmento ST ou com angina instável têm se tornado cada vez mais prevalentes. Seus mecanismos parecem associados com maior expressão de receptor TLR2 e da interação deste com ácido hialurônico, uma abundante substância da matriz intimal.5 Esta interação parece associada ao estresse do retículo da célula endotelial, promovendo sua apoptose e exposição da íntima aos elementos do sangue (fator tecidual e fator VII ativado), gerando trombina e ativação plaquetária. A Figura 1 mostra as características clínicas das síndromes coronarianas agudas e seus mecanismos.
reCorrÊNCia de eveNtos CoroNÁrios aPÓs iNfarto do MioCÁrdio
A necrose miocárdica deflagra intensa mobilização de leucócitos ao miocárdio. O mais surpreendente é que esta

76
onda de mobilização de linfócitos determina colonização de placas ateroscleróticas em diferentes estágios de formação, causando aumento da atividade inflamatória e mecanismos de vulnerabilidade das placas ou mesmo de apoptose endotelial.17 Em outras palavras, o infarto do miocárdio acelera a ateros-clerose e o ambiente inflamatório das placas explica as altas taxas de recorrência de eventos coronarianos principalmente ao longo do primeiro ano após o infarto do miocárdio. Este mecanismo de recorrência de eventos parece dependente do tipo de linfócito mobilizado, possivelmente de característica mais inflamatória na presença de fatores de risco não con-trolados, como diabetes, hipertensão arterial e dislipidemias.
Outro aspecto relevante foi a descoberta de como a com-plexa resposta inflamatória é deflagrada. A partir de estímulos como cristais de colesterol, infecções associadas com maior presença de neutrófilos liberando NETs, isquemia e alterações do estresse hemodinâmico, o complexo inflammasome é deflagrado a partir de ativação da interleucina 1-beta pela caspase 1, favorecendo maior expressão de cascata inflama-tória que inclui interleucina 6, fator de necrose tumoral alfa, proteína C reativa, fibrinogênio, entre outros biomarcadores associados com desfechos cardiovasculares.18,19
PersPeCtivas fUtUrasAs bases fisiopatológicas da doença coronariana pare-
cem bem estabelecidas e a necessidade do mais precoce restabelecimento de fluxo para a área infartada ou isquêmica é incontestável, mas outros fatores relevantes parecem ser a modulação da resposta inflamatória a curto e longo prazo, bem como a manutenção de baixos níveis de colesterol em longo prazo. O controle da atividade inflamatória está sendo testado em dois grandes estudos, o Cardiovascular Inflammation Reduction Trial (CIRT) por meio de baixa dose semanal do metotrexate e o Canakinumab Anti-Inflammatory Thrombosis Outcomes Study (CANTOS) pela administração de anticorpo monoclonal anti-interleucina 1-beta em dose subcutânea trimestral.20 Como estes estudos bloqueiam a inflamação praticamente sem afetar os lípides plasmá-ticos, poderão testar em definitivo a teoria inflamatória da
referÊNCias1. world Health Organization. The top 10 causes of death. http://www.
who.int/mediacentre/factsheets/fs310/en/acesso em 01/04/2016.2. Ribeiro AL, Duncan BB, Brant LC, Lotufo PA, Mill JG, Barreto
SM. Cardiovascular Health in Brazil: Trends and Perspectives. Circulation. 2016;133(4):422-33.
3. Ference BA, Yoo W, Alesh I, Mahajan N, Mirowska KK, Mewada A, et al. Effect of long-term exposure to lower low-density lipoprotein cholesterol beginning early in life on the risk of coronary heart disease: a Mendelian randomization analysis. J Am Coll Cardiol. 2012;60(25):2631-9.
4. Ference BA, Majeed F, Penumetcha R, Flack JM, Brook RD. Effect of naturally random allocation to lower low-density lipoprotein cho-lesterol on the risk of coronary heart disease mediated by polymor-phisms in NPC1L1, HMGCR, or both: a 2 × 2 factorial Mendelian randomization study. J Am Coll Cardiol. 2015;65(15):1552-61.
5. Quillard T, Araújo HA, Franck G, Shvartz E, Sukhova G, Libby P. TLR2 and neutrophils potentiate endothelial stress, apoptosis and detachment: implications for superficial erosion. Eur Heart J. 2015;36(22):1394-404.
6. Berenson GS, Wattigney WA, Tracy RE, Newman WP 3rd, Sriniva-
san SR, Webber LS, et al. Atherosclerosis of the aorta and coronary arteries and cardiovascular risk factors in persons aged 6 to 30 years and studied at necropsy (The Bogalusa Heart Study). Am J Cardiol. 1992;70(9):851-8.
7. Nordestgaard BG, Chapman MJ, Humphries SE, Ginsberg HN, Masana L, Descamps OS, et al. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: con-sensus statement of the European Atherosclerosis Society. Eur Heart J. 2013;34(45):3478-90a.
8. Wiegman A, Gidding SS, Watts GF, Chapman MJ, Ginsberg HN, Cuchel M, et al. Familial hypercholesterolaemia in children and adolescents: gaining decades of life by optimizing detection and treatment. Eur Heart J. 2015;36(36):2425-37.
9. Libby P. Mechanisms of acute coronary syndromes and their implications for therapy. N Engl J Med. 2013;368(21):2004-13.
10. Ammirati E, Moroni F, Magnoni M, Camici PG. The role of T and B cells in human atherosclerosis and atherothrombosis. Clin Exp Immunol. 2015;179(2):173-87.
11. Fonseca HA, Fonseca FA, Lins LC, Monteiro AM, Bianco HT, Bran-
aterosclerose. De fato, o estudo JUPITER21,22 embora tenha comprovado os benefícios do uso de estatina em população com colesterol relativamente normal e aumento de atividade inflamatória (estimada pelo aumento da proteína C-reativa de alta sensibilidade), reduziu não apenas este marcador infla-matório, mas também os níveis de LDL-colesterol, tornando difícil a interpretação dos benefícios, se devido ao controle da inflamação, ou pela redução do colesterol.
Além dos mecanismos de controle da aterosclerose e complicações trombóticas, a inflamação também parece modular o remodelamento ventricular, afetando adversamente quando muito pronunciada.23
Novos agentes hipolipemiantes, como os inibidores da pró-proteína convertase subtilisina kexina tipo 9 (PCSK9) estão sendo aprovados e têm se mostrado extremamen-te seguros e eficientes, permitindo notáveis reduções do LDL-colesterol.24,25 Estudos de desfechos com estes agentes em pacientes de alto risco cardiovascular estão em pleno andamento e em breve permitirão uma melhor avaliação de seus efeitos na doença coronariana.
CoNsideraÇÕes fiNaisA oclusão parcial ou total do vaso coronário determina
uma variedade de apresentação clínica das síndromes co-ronarianas agudas. Inflamação e colesterol são os mecanis-mos que levam à formação, desestabilização e desfechos aterotrombóticos. A persistência de inflamação ou de níveis elevados de LDL-colesterol se associa com recorrência de eventos. O mais pronto controle da inflamação e alcance de valores baixos de LDL-colesterol constituem os aspectos mais relevantes para diminuição das sequelas do infarto agudo do miocárdio e para estabilização da doença em longo prazo.
CoNfLitos de iNteresseOs autores declaram não possuir conflitos de inte-
resse na realização deste trabalho.
rev Soc Cardiol estado de São paulo 2016;26(2):74-7

77
dão SA, et al. Antihypertensive therapy increases natural immunity response in hypertensive patients. Life Sci. 2015;143:124-30.
12. Fonseca HA, Fonseca FA, Monteiro AM, Bianco HT, Boschcov P, Brandão SA, et al. Obesity modulates the immune response to oxidized LDL in hypertensive patients. Cell Biochem Biophys. 2013;67(3):1451-60.
13. Izar MC, Fonseca HA, Pinheiro LF, Monteiro CM, Póvoa RM, Monteiro AM, Figueiredo-Neto AM, et al. Adaptive immunity is related to coronary artery disease severity after acute coronary syndrome in subjects with metabolic syndrome. Diab Vasc Dis Res. 2013;10(1):32-9.
14. da Fonseca HA, Fonseca FA, Monteiro AM, Farias NC Jr, Bianco HT, Brandão SA, et al. Inflammatory environment and immune responses to oxidized LDL are linked to systolic and diastolic blood pressure levels in hypertensive subjects. Int J Cardiol. 2012;157(1):131-3.
15. Brandão SA, Izar MC, Fischer SM, Santos AO, Monteiro CM, Póvoa RM, et al. Early increase in autoantibodies against human oxidized low-density lipoprotein in hypertensive patients after blood pressure control. Am J Hypertens. 2010;23(2):208-14.
16. van Lammeren GW, den Ruijter HM, Vrijenhoek JE, van der Laan SW, Velema E, de Vries JP, et al. Time-dependent changes in atherosclerotic plaque composition in patients undergoing carotid surgery. Circulation. 2014;129(22):2269-76.
17. Dutta P, Courties G, Wei Y, Leuschner F, Gorbatov R, Robbins CS, et al. Myocardial infarction accelerates atherosclerosis. Nature. 2012;487(7407):325-9.
18. Duewell P, Kono H, Rayner KJ, Sirois CM, Vladimer G, Bauer-nfeind FG, et al. NLRP3 inflammasomes are required for
atherogenesis and activated by cholesterol crystals. Nature. 2010;464(7293):1357-61.
19. Ridker PM. From C-Reactive Protein to Interleukin-6 to Interleu-kin-1: Moving Upstream To Identify Novel Targets for Atheropro-tection. Circ Res. 2016;118(1):145-56.
20. Ridker PM, Lüscher TF. Anti-inflammatory therapies for cardiovas-cular disease. Eur Heart J. 2014;35(27):1782-91.
21. Ridker PM, Danielson E, Fonseca FA, Genest J, Gotto AM Jr, Kastelein JJ, et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 2008;359(21):2195-207.
22. Ridker PM, Danielson E, Fonseca FA, Genest J, Gotto AM Jr, Kastelein JJ, et al. Reduction in C-reactive protein and LDL cholesterol and cardiovascular event rates after initiation of rosuvastatin: a prospective study of the JUPITER trial. Lancet. 2009;373(9670):1175-82.
23. Ter Horst EN, Hakimzadeh N, van der Laan AM, Krijnen PA, Niessen HW, Piek JJ. Modulators of Macrophage Polarization Influence Healing of the Infarcted Myocardium. Int J Mol Sci. 2015;16(12):29583-91.
24. Cannon CP, Cariou B, Blom D, McKenney JM, Lorenzato C, Pordy R,et al. Efficacy and safety of alirocumab in high cardiovascular risk patients with inadequately controlled hypercholesterolaemia on maximally tolerated doses of statins: the ODYSSEY COMBO II randomized controlled trial. Eur Heart J. 2015;36(19):1186–94.
25. Li C, Lin L, Zhang W, Zhou L, Wang H, Luo X, et al. Efficiency and Safety of Proprotein Convertase Subtilisin/Kexin 9 Monoclonal Antibody on Hypercholesterolemia: A Meta-Analysis of 20 Ran-domized Controlled Trials. J Am Heart Assoc. 2015;4(6): e001937.
FISIOPATOLOGIA DAS SíNDROMES CORONARIANAS AGUDAS
rev Soc Cardiol estado de São paulo 2016;26(2):74-7

78
revisÃo/review
resUMoA dor torácica é o sintoma que leva o paciente ao serviço de emergência e, nesse contexto, é fundamental que se faça o diagnóstico de uma síndrome coronariana aguda (SCA). A avaliação adequada das características dos sintomas e a realização imediata de eletrocar-diograma no atendimento inicial permitem o diagnóstico e, na maioria das vezes, apontam o melhor tratamento. Pelo eletrocardiograma podemos prontamente estabelecer o diagnós-tico de SCA com supra de ST, que caracteriza infarto agudo do miocárdio e orienta para o tratamento de reperfusão o quanto antes. A ausência desse achado eletrocardiográfico caracteriza SCA sem supra de ST, que requer melhor definição prognóstica. Os marcadores de necrose miocárdica contribuem para melhor definição diagnóstica e estratificação de risco desses pacientes. Para aqueles cujos aspectos clínicos fazem suspeitar de quadro de isquemia aguda do miocárdio, mas que não apresentam um traçado eletrocardiográfico e marcadores de necrose com alterações suficientes para um diagnóstico mais definitivo, os testes isquêmicos não invasivos como o teste ergométrico, o ecocardiograma ou a cintilografia de perfusão miocárdica, de repouso ou de esforço ou ainda com estresse farmacológico, podem contribuir tanto para o diagnóstico, quanto para a estratificação de risco. Mais recentemente, com a angiotomografia das coronárias ou com protocolos de atendimento de curta duração que utilizam troponinas de alta sensibilidade, podemos confirmar a presença de SCA ou afastá-la com segurança, reduzindo significativamente a permanência hospitalar desses pacientes.
Descritores: Síndromes Coronárias Agudas; Infarto Agudo do Miocárdio;Eletrocardiograma; Marcadores de Necrose Miocárdica; Isquemia Miocárdica.
aBstraCtChest pain is the symptom that brings the patient to the emergency department and
in this context, it is essential to make the diagnosis of an acute coronary syndrome (ACS). Proper evaluation of the characteristics of the symptoms and the immediate realization of an electrocardiogram in the initial care allow the diagnosis and, in most cases, indicate the best treatment. The electrocardiogram can readily establish the diagnosis of ACS with ST elevation, featuring acute myocardial infarction, and guides for the treatment of reperfusion as soon as possible. The absence of this electrocardiographic finding is compatible with an ACS without ST elevation, which requires better prognostic definition. Myocardial necrosis markers contribute to better diagnostic definition and risk stratification of these patients. For those whose clinical aspects lead to suspicion of acute myocardial ischemia, but do not have an electrocardiographic tracing and necrosis markers with enough change for a more definitive diagnosis, non-invasive ischemic tests such as exercise test, echocardiography or stress-rest myocardial perfusion scintigraphy, or pharmacologic stress can contribute to both the diagnosis and the risk stratification. More recently, with CT angiography of the coronary or with short-term treatment protocols using high-sensitivity troponins, we can confirm the presence of ACS or rule out it safely, significantly reducing the hospital stay of these patients.
Keywords: Acute Coronary Syndromes; Acute Myocardial Infarction; Electrocardiogram; Myocardial Necrosis Biomarkers; Myocardial Ischemia.
Silvio Reggi1
Edson Stefanini1
1. Disciplina Cardiologia da Escola Paulista de Medicina da Universidade Federal de São Paulo/UNIFESP
Correspondência:Rua Pintassilgo 155 ap. 61 CEP [email protected]
diagNÓstiCo das síNdroMes CoroNariaNas agUdas e ModeLo sisteMatiZado de ateNdiMeNto eM
UNidades de dor torÁCiCa
diagNosis of aCUte CoroNarY sYNdroMe aNd sYsteMatiC ModeL iN CHest PaiN serviCes
rev Soc Cardiol estado de São paulo 2016;26(2):78-85

79
iNtrodUÇÃoA dor torácica é o principal sintoma que motiva a investigação
diagnóstica diante de um quadro de possível síndrome coronária aguda (SCA). Em alguns pacientes, como nos idosos e nos diabéticos, sintomas atípicos podem estar presentes tanto em associação, como isoladamente. Dispneia e/ou dor epigástrica se apresentam como os sintomas mais determinantes nesses pacientes. De qualquer forma, feita a suspeita de uma possível SCA, o eletrocardiograma (ECG) passa a ter papel fundamental na diferenciação de dois grandes grupos de pacientes:
(a) Pacientes com elevação do segmento ST e sintomas per-sistentes (duração da dor maior que 20 minutos): esta condição, chamada de SCA com supra-desnível do segmento ST, geral-mente reflete a oclusão completa de uma artéria coronariana, a qual se associa com correntes de lesão subepicárdicas. Neste cenário, o ponto central do atendimento é a reperfusão imediata, com agentes fibrinolíticos, ou com angioplastia percutânea.1
(b) Pacientes com sintomas intermitentes, porém sem ele-vação do segmento ST no eletrocardiograma: nestes casos a desafio diagnóstico é maior, na medida em que o eletrocardio-grama pode apresentar infradesnível do segmento ST, inversão simétrica da onda T ou mesmo ser totalmente normal. Além das variações de sintomas apresentados por estes pacientes, a gravidade do quadro clínico também é muito diversa, indo desde pacientes com dores de pequena intensidade e livre de sintomas associados, até pacientes que se apresentam em franco choque cardiogênico. A variabilidade do quadro clínico no momento do diagnóstico está intimamente relacionada aos graus de isquemia (SCA sem supra de ST) e necrose enfrentadas pelo músculo cardíaco (SCA com supra de ST).
definição universal de infarto do miocárdioO infarto agudo do miocárdio (IAM) é definido como a
morte celular miocárdica e necrose (de qualquer proporção) do músculo cardíaco, num cenário que representa a evolução de uma isquemia miocárdica aguda (SCA).2 Uma combinação de critérios é necessária para que o diagnóstico de IAM seja esta-belecido,3 sempre com alterações de marcadores de necrose miocárdica, preferencialmente a troponina, em associação com pelo menos uma das ocorrências: (a) sintomas de isquemia, (b) novas ou presumidamente novas mudanças no segmento ST ou novo bloqueio do ramo esquerdo, (c) desenvolvimento de ondas Q patológicas, (d) evidência por imagem de uma nova, ou presumidamente nova, perda de miocárdio viável ou deficiências segmentares da contratilidade e (e) evidência de trombo coronariano durante cinecoronariografia ou necropsia.
infarto tipo 1A ruptura da placa aterosclerótica ou ainda, uma ulcera-
ção, fissura, erosão ou dissecção, que leve à formação de um trombo intraluminal, em uma ou mais artérias coronárias, define o infarto tipo 1.4 Nestes casos, há uma diminuição do fluxo coronariano com subsequente isquemia ou necrose do músculo cardíaco.
infarto tipo 2No infarto tipo 2 o mecanismo não se dá pela instabilidade
da placa coronariana, mas por outros fatores externos à doença aterosclerótica mas que levam ao desequilíbrio entre a oferta
e a demanda de oxigênio.2,4 Diversos mecanismos podem estar envolvidos, como o espasmo das artérias, a disfunção endotelial, arritmias, anemia, sepse, choque ou as insuficiências de diversos órgãos. Paciente internado em unidades de terapia intensiva e aqueles submetidos a cirurgias não cardíacas de grande porte também podem ser acometidos por este tipo de infarto.
A definição universal de infarto também inclui três outros tipos de infarto: O tipo 3, IAM que resulta em morte (sem tempo para avaliação dos marcadores de necrose); O tipo 4, IAM relacionado à angioplastia, o qual se subdivide em 4a, quando ocorre elevação acima de cinco vezes o valor basal da tropo-nina e 4b, quando ocorre trombose do stent, caracterizada na angiografia ou na necropsia, além de manifestação de isquemia e elevação dos marcadores de necrose. E ainda temos o tipo 5, IAM relacionado à cirurgia de revascularização miocárdica.4
diagNÓstiCoO diagnóstico das SCA se baseia numa série de achados
que, no seu conjunto, levarão a uma conclusão definitiva. Nem sempre o diagnóstico é simples, na medida em que muitos pacientes podem apresentar sintomas atípicos e não mani-festar qualquer alteração nos exames subsidiários. Assim, a expertise, de quem faz o primeiro atendimento de um paciente com uma possível SCA, é fundamental, principalmente nos casos suspeitos,mas sem a obviedade dos sintomas.
Para um diagnóstico adequado, não é necessário ter dis-ponível toda a medicina diagnóstica, embora quanto mais recursos tivermos ao alcance das mãos, melhores seremos na definição do diagnóstico e da conduta. Contudo, é preciso deixar claro que, com a história clínica e o exame físico acu-rados, com o auxílio do eletrocardiograma e dos marcadores de necrose miocárdica, preferencialmente a troponina de alta sensibilidade, temos condições de diagnosticar e tratar a grande maioria dos pacientes, assim como estratificar o risco dos mesmos. Exames subsidiários mais complexos, como o ecocardiograma, a cintilografia miocárdica, a angiotomografia coronária e a ressonância nuclear magnética têm também espaço e enorme importância, no contexto do diagnóstico e do atendimento inicial, mas, numa minoria dos casos serão necessários nos momentos iniciais do atendimento.
História e exame físicoA dor torácica típica é o sintoma principal da doença co-
ronariana aguda, principalmente aquela em opressão, que irradia para o braço esquerdo, direito ou para a mandíbula. Pode estar associada à sudorese fria, náusea, dor abdominal ou lipotimia. Sua duração tem importância central, uma vez que as dores com duração superior a vinte minutos e sem momentos de melhora, nos direcionam para um diagnóstico de maior gravidade, já que nos fazem pensar que a possibilidade maior é de interrupção completa do fluxo sanguíneo coronaria-no. Contudo, a dor intermitente que cessa espontaneamente, principalmente aquela que se iniciou nos últimos dias ou horas, também é sugestiva de doença coronária com episódios de isquemia aguda. No entanto, é preciso lembrar que os sintomas típicos estão presentes apenas numa parcela dos pacientes. Muitos, em especial idosos, mulheres e diabéticos apresentam frequentemente sintomas atípicos que eventualmente acabam direcionando o diagnóstico para outras doenças.5-7
DIAGNÓSTICO DAS SíNDROMES CORONARIANAS AGUDAS E MODELO SISTEMATIZADO DE ATENDIMENTO EM UNIDADES DE DOR TORÁCICA
rev Soc Cardiol estado de São paulo 2016;26(2):78-85

80
sCa sem supra de st Nos casos de SCA sem supra de ST, a dor anginosa terá
uma das características abaixo relacionadas:(a) Dor prolongada em repouso;(b) Angina de início recente (“de novo”) classificada
como II ou III pela classificação da Canadian Cardiovascular Society (CCS);8
(c) Recente desestabilização de angina estável prévia, com pelo menos classificação III da CCS (“angina em crescendo”);
(d) Angina pós-IAM.Um dos sintomas mais típicos da coronariopatia crônica
é a presença da dor durante os esforços físicos com alívio no repouso. Nos casos de SCA, a dor está normalmente presente no repouso, todavia, a atividade física, ainda que de pequena intensidade, leva ao aumento de sua intensidade.
Não é incomum que o paciente que se apresenta com SCA sem supra de ST, não tenha qualquer alteração eletrocar-diográfica ou laboratorial. Diante disso, a avalição adequada da probabilidade de doença aterosclerótica é fundamental. A presença de um ou mais fatores de risco para doença ateros-clerótica coronária, eleva consideravelmente a possibilidade de ser o paciente portador de um quadro isquêmico miocárdico agudo. Idade avançada, sexo masculino, história familiar de doença coronária, diabetes, hiperlipidemia, hipertensão arte-rial, tabagismo, insuficiência renal crônica, infarto prévio ou doença aterosclerótica carotídea ou periférica são fatores de risco amplamente conhecidos.
O exame físico na SCA sem supra de ST é quase sempre pobre e não contribui, na grande maioria das vezes, para o diagnóstico. Seu papel é mais relevante no diagnóstico das complicações relacionadas ao quadro isquêmico agudo, mais comumente visto nos casos mais dramáticos e que, geralmente, estão associados ao IAM. O exame físico, pode ainda, contribuir para o diagnóstico diferencial com outras patologias como as relacionadas ao sistema digestivo e nas doenças da parede torácica. Vale lembrar que a dor torácica que se reproduz à palpação do tórax tem alto valor preditivo negativo para SCA.9
sCa com supra de st O diagnóstico inicial da SCA com supra de ST se confun-
de temporalmente com seu tratamento. Devido à gravidade e a dramaticidade da doença, o diagnóstico e o tratamento andam juntos, não sendo admitida nenhuma perda de tempo. O sintoma central da SCA com supra de ST é a dor torácica que se prolonga por mais de 20 minutos, que não cede com o repouso, tampouco com o uso de nitratos (preferencialmente de ação rápida). Como nos casos de SCA sem supra de ST, a dor geralmente é em opressão, pode irradiar para um ou para ambos os braços, mandíbula ou nuca. Também nestes casos existem aqueles que apresentam sintomas atípicos, normalmente idosos, mulheres ou diabéticos. Por este motivo, estes pacientes, que podem chegar a 30% daqueles que procuram o serviço de emergência, recebem menos frequen-temente a terapia adequada segundo algumas análises.10
Os antecedentes pessoais também têm papel impor-tante nos casos de SCA com supra de ST, apesar de que a ausência deles, não pode de maneira alguma desviar o médico da hipótese diagnóstica. Nestes casos o ECG, como será comentado a seguir, tem uma relevância altíssima, pois
o encontro das alterações pertinentes, desencadeará o tra-tamento necessário, que deve ser imediato.
O exame físico ajuda principalmente na identificação das complicações e nos diagnósticos diferenciais. Nas SCA com supra de ST, complicações como insuficiência cardíaca (IC) por disfunção do ventrículo esquerdo (VE) devido à extensão do infarto, choque cardiogênico por insuficiência mitral aguda ou comunicação interventricular, as chamadas complicações mecânicas, além de instabilidade elétrica, bem mais prevalente.
eletrocardiograma (eCg)O eletrocardiograma de 12 derivações é o primeiro exame a
ser realizado num cenário de possível SCA. (Figura 1) Nos casos com elevação do segmento ST ou bloqueio de ramo esquerdo (BRE) supostamente novo, o traçado eletrocardiográfico será provavelmente o único exame a ser realizado antes do início da terapia de reperfusão. É recomendado que o ECG seja realizado nos primeiros 10 minutos após o início do atendimento, seja num cenário pré-hospitalar ou hospitalar.11
Nas SCA sem supra de ST, um grande número de alterações podem ser encontradas no ECG, podendo mesmo ser comple-tamente normal em até 1/3 dos pacientes. Outros achados in-cluem alterações da onda T e alterações dinâmicas do segmento ST, principalmente o infradesnível.1,12 É importante enfatizar, que em pacientes com sintomas persistentes e sugestivos de oclusão de uma ou mais artérias coronárias e com alterações eletrocardiográficas não muito bem definidas, é fundamental que se procure realizar um número maior de derivações. Nos casos de oclusão da artéria circunflexa (ACx) com infarto de parede dorsal do VE, as derivações V7-9 podem contribuir para a localização da região comprometida. Nos infartos de parede inferior, as derivações V3R e V4R devem ser realizadas para o diagnóstico de infarto de ventrículo direito.2 (Tabela 1)
tabela 1. Apresentações eletrocardiográficas atípicas em pacientes com diagnóstico de síndrome coronariana aguda com provável oclusão total de uma ou mais artérias coronarianas.
Bloqueio novo do ramo esquerdo
ritmo ventricular (QrS largo, dissociação A-V)
pacientes com eCg normal e com sintomas persistentes
infarto de parede posterior isolado (St infra V1-3; St supra V7-9)
Supradesnível do segmento St em aVr
figura 1. Avaliação inicial do paciente com sídrome coronaria-na aguda baseada nos sintomas, nos achados do eCg e nos bomarcarcores.3
Baixa probabilidade Alta probabilidade
1. Apresentação
3. troponina
4. diagnóstico não cardíaco iAm sem St iAm com StCardíaca outrasAi
2. eletrocardiograma
rev Soc Cardiol estado de São paulo 2016;26(2):78-85

81
BiomarcadoresOs biomarcadores, ou marcadores de necrose miocárdi-
ca, complementam a avaliação inicial, em associação com o eletrocardiograma, dos pacientes com SCA sem supra de ST. Sua importância nos pacientes com IAM com supra de ST é menor na avaliação inicial já que, nestes casos, eles não se prestam para o diagnóstico – pelo tempo necessário para que se elevem seus níveis plasmáticos e também pela demora no processamento da amostra, tendo mais importância como critério de reperfusão, de reinfarto ou diagnóstico tardio de infarto. Assim, é nos casos sem supra de ST que os biomar-cadores têm seu papel mais relevante.
Os biomarcadores de necrose miocárdica deveriam re-presentar exclusivamente a morte de células cardíacas em decorrência de infarto por doença coronária. Contudo, na prática, sabemos que existem diversas outras condições clínicas que elevam os marcadores de necrose e, portanto, quando positivos, é fundamental que sejam interpretados mediante um cenário adequado. A simples elevação dos mesmos não significa, necessariamente, um infarto agudo do miocárdio do tipo 1.4
As troponinas cardíacas são os marcadores de necrose que preferencialmente devem ser utilizados.3 As troponinas são mais sensíveis e específicas que outros exames, como a CK, a CB-MB ou a mioglobina.13 Sua interpretação num cenário de provável SCA ajuda para o diagnóstico de IAM, sendo considerado positivo quando um valor acima do percentil 99 (para indivíduos sadios) for alcançado. Outra vantagem das troponinas, em relação aos demais marcadores, é a velocidade com que aparece com níveis elevados no plasma: em pou-cas horas já são detectáveis. Esse tempo pode ser reduzido enormemente no caso das troponinas de alta sensibilidade (em menos de 60 minutos). As troponinas podem permanecer positivas por 7 a 10 dias após o evento agudo, facilitando assim o diagnóstico tardio de um infarto agudo do miocárdio.4,13
Uma das principais vantagens da troponinas de alta sensi-bilidade, como já referido, é a velocidade com que se elevam. Isso faz com que seu uso nas unidades de dor torácica seja fundamental, pois todo e qualquer algoritmo de estratificação de risco e de critérios de internação levará em conta os re-sultados destes exames.2,13-15 Todavia, a alta sensibilidade do exame pode ser também, em algumas situações, um fator de confusão. São várias as doenças cardiológicas não isquêmicas e as doenças sistêmicas que podem levar ao aumento dos níveis de troponina. Diante do exposto, a avaliação criteriosa é mandatória. (Tabela 2)
tabela 2. outras condições cardíacas e não cardíacas que podem estar associadas à elevação dos níveis de troponina.Cardíacas Não cardíacasArritmias Sepse, choqueemergências hipertensivas tromboembolismo pulmonarmiocardite insuficiência renalSíndrome do Coração partido (tako-tsubo)
Acidente vascular cerebral agu-do (AVC)
dissecção de Aorta Hiper e hipotireoidismoespasmo coronariano toxicidade por drogasdoença cardíaca estrutural exercícios extenuantesinsuficiência cardíaca rabdomiólise
Além das troponinas, somente a creatinoquinase MB (CK-MB) e a copeptina parecem ter relevância clínica seme-lhantes.2,13,14,16-18 Apesar de a CK-MB subir mais lentamente, ela sofre um declínio mais rápido, ajudando na definição do momento da doença nos casos que chegam tardiamente. Também tem papel importante no diagnóstico de reinfarto. A copeptina é a porção C-terminal da vasopressina, pode quantificar o nível de estresse endógeno em diversas situ-ações clínicas, incluindo nos casos de IAM. Como o nível de estresse é invariavelmente alto nos casos no início do IAM, sua análise, em conjunto com as troponinas, pode ter grande valor.17, 18 Contudo seu uso só faz sentido quando não há a disponibilidade da troponina de alta sensibilidade ou quando se deseja descartar rapidamente um caso suspeito de IAM.17,18 A copeptina ainda é pouco conhecida em nosso meio e não está disponível na maioria dos hospitais.
Marcadores utilizados no passado, como CK total, tran-saminases hepáticas e DHL hoje estão completamente em desuso devido a suas baixas sensibilidades e especificidades e por isso não devem ser utilizados na prática clínica atual.
A Figura 1 resume a contribuição da avaliação clínica, do eletrocardiograma e dos marcadores de necrose miocárdica para adequada avaliação do paciente e definição diagnóstica de uma SCA sem supra ou com supra de ST.
teste ergométricoO teste ergométrico (TE) é um exame há muito tempo
conhecido e de grande relevância no diagnóstico da doença coronária crônica. Todavia este exame tem grande valor no contexto das SCA, como ferramenta para o diagnóstico e para estratificação de risco, desde que realizado com o paciente já estabilizado e com protocolo adequado.
Os critérios utilizados para o diagnóstico de doença coronária são os tradicionais: em duas derivações con-secutivas, infradesnível do segmento ST >= 1,5mm ou supradesnível >= 2,0mm.19 O TE também ajuda na estrati-ficação da gravidade do paciente, uma vez que a presença de dor durante o exame, a redução da pressão sistólica e a deficiência cronotrópica com a progressão do exercício reforçam o diagnóstico e apontam a gravidade da doença.20
Há décadas se reconhece o valor do TE no atendimento na sala de emergência. Desde 1983, quando surgiu a pri-meira unidade de dor torácica, nos EUA, os especialistas no método têm trabalhado nestas unidades. Atualmente o papel do TE se concentra nos casos de baixo risco, em que se quer descartar a possibilidade de coronariopatia. Pacientes com alterações eletrocardiográficas sugestivas de isquemia, com marcadores alterados ou com sintomas recorrentes não devem, de forma alguma, serem submetidos aos testes.21 Dado o seu alto valor preditivo negativo, nos casos em que o resultado for normal, torna-se desnecessária a realização de novos exames,22 principalmente naqueles com boa capacidade funcional.
ecocardiogramaO Ecocardiograma (ECO) tem grande utilidade na sala
de dor torácica. É um exame de baixo custo, de fácil acesso e que pode ser realizado à beira do leito. Traz informações valiosas que podem confirmar o diagnóstico de uma SCA, assim como estratificar a sua gravidade.
DIAGNÓSTICO DAS SíNDROMES CORONARIANAS AGUDAS E MODELO SISTEMATIZADO DE ATENDIMENTO EM UNIDADES DE DOR TORÁCICA
rev Soc Cardiol estado de São paulo 2016;26(2):78-85

82
A maior informação trazida pelo ecocardiograma num cenário de dor torácica é a avaliação da contratilidade re-gional das paredes do VE. O encontro de alterações seg-mentares de contração favorece grandemente o diagnóstico de SCA. Embora estas alterações, possam estar presentes em decorrência de eventos isquêmicos prévios, ou ainda por conta de outras cardiopatias não isquêmicas, como nas miocardites, quando bem indicado o ecocardiograma contribui enormemente.23-25
A avaliação da função de VE é um elemento importante na estratificação de risco dos pacientes com SCA, parti-cularmente no IAM, em que o ECO é fundamental para o diagnóstico das complicações mecânicas.
O ECO ainda nos ajuda nos diagnósticos diferenciais de dor torácica, como nos casos de dissecção da aorta, de estenose aórtica, de miocardiopatias hipertróficas ou ainda nas pericardites.21
O ECO de estresse (farmacológico ou físico) é outro exame de grande valor na avaliação dos pacientes com quadro de dor torácica de baixo risco.21 Seu resultado ajuda na definição do diagnóstico e na escolha da conduta terapêu-tica a ser implementada. Contudo, seu maior valor está nos casos em que o teste ergométrico não pode ser realizado.
Medicina nuclearA cintilografia do miocárdio tem desempenhado um papel
central no diagnóstico das doenças coronarianas há muitos anos. Recentemente, informações adicionais provenientes da capacidade de avaliação da função ventricular e da reserva fun-cional têm contribuído ainda mais. Nas unidades de dor torácica, a cintilografia tem sido usada no auxílio à tomada de decisão nos casos em que a dor tem origem indeterminada, mostran-do, neste contexto, ser um método com alta sensibilidade.26-32
Infelizmente, o custo da instalação destes equipamentos é relativamente alto o que torna inviável sua utilização na maioria dos serviços no Brasil. São equipamentos quase sempre impor-tados e que utilizam fármacos radiotraçadores, os quais também não são largamente disponíveis. Além disso, é preciso que o fármaco seja injetado preferencialmente no momento da dor ou logo após o evento e que as imagens sejam interpretadas por profissionais especializados.
Quando disponível, a cintilografia com estresse farmaco-lógico está indicada nos pacientes em que a origem da dor torácica não é muito bem determinada e que o risco de um quadro isquêmico agudo seja baixo, principalmente para os pacientes que não tem condições de realizar o TE. Para aque-les que se apresentam com dor no momento da admissão, o exame sem estresse é igualmente aceitável.
angiotomografia das coronáriasA angiotomografia coronária, realizada com tomógrafos
com multidetectores, permite uma perfeita avaliação da árvore coronariana e um resultado normal exclui o diagnóstico de doença aterosclerótica. Nove estudos reunidos numa metaná-lise, com mais de 1300 pacientes, têm demonstrado um alto valor preditivo negativo do método para excluir SCA, tendo principalmente indicação nos pacientes com probabilidade baixa ou intermediária de um quadro isquêmico agudo.33 Vários estudos randomizados têm testado o uso da tomografia coronariana em comparação com os métodos tradicionais
na avaliação da dor torácica na sala de emergência.34-37 No seguimento destes pacientes, que variou de um a seis meses, não houve mortes e os resultados mostraram resultados semelhantes para outros desfechos (IAM, retorno à unidade de emergência ou re-hospitalização). Contudo, o uso do tomó-grafo esteve associado a um menor custo e menor tempo de permanência no hospital.38 Em nenhum dos estudos citados, o marcador de necrose foi a troponina de alta sensibilidade, a qual também é capaz de reduzir significativamente o tempo de permanência hospitalar.
Por outro lado, não é aconselhável a realização da angiotomografia coronária no atendimento de emergência em pacientes com doença coronária conhecida pela maior chance de exames falso-positivos para um quadro isquêmi-co agudo. Em algumas análises, o uso do tomógrafo tam-bém esteve associado à maior probabilidade de se adotar uma estratégia de estratificação invasiva (8,4% vs. 6,3%; OR 1,36).38 Diante disso, o exame deve ser realizado com o objetivo de excluir a doença coronariana aguda, portanto não se prestando para os já sabidamente acometidos.
Uma vantagem da tomografia é a possibilidade de se realizar, ao mesmo tempo, na avaliação da dor torácica o diagnóstico de outras situações clínicas de muita gravidade, como a dissecção da aorta, o tromboembolismo pulmonar e o pneumotórax.39
Entre os fatores que não contribuem para a dissemi-nação do método nas unidades de emergência estão, o alto custo e a necessidade de profissionais treinados disponíveis nas 24 horas do dia.3
ressonância nuclear magnéticaA ressonância nuclear magnética (RNM) tem se estabele-
cido, nos últimos anos, como uma importante ferramenta para cardiologia. Através da RNM, e com a injeção de fármacos provocativos – dipiridamol e adenosina – hoje é possível se detectar a isquemia miocárdica com grande precisão, mesmo quando comparada a métodos consagrados como o ecocardiograma com estresse,40 com a cintilografia41-42 e com reserva de fluxo coronariano por técnica invasiva.43 O exame ainda é capaz de trazer informações sobre a morfo-logia e função do coração, o que resulta em diagnósticos mais precisos. Dados relacionados ao músculo cardíaco, sua massa e a presença de necrose e/ou fibrose pela técnica do realce tardio44 hoje têm enorme relevância clínica.
Apesar do papel da RNM estar estabelecido na doença arterial coronária crônica, alguns estudos, ainda pequenos, já tem demonstrado sua relevância para os pacientes que se encontram nas unidades de atendimento emergencial.45-48
Contudo, atualmente, devido ao custo e às dificuldades de se realizar o exame, seu emprego num cenário de SCA ainda é bastante incomum. Seu papel principal se concentra na avalição dos diagnósticos diferenciais de dor torácica, em que o ECG não apresenta alterações conclusivas e os marcadores de necrose são negativos.21
ModeLo de ateNdiMeNto eM UNidades de dor torÁCiCa
O atendimento sistematizado, dos pacientes que se apre-sentam com dor torácica, é fundamental. Através de algoritmos bem desenhados podemos promover um atendimento de
rev Soc Cardiol estado de São paulo 2016;26(2):78-85

83
melhor qualidade, garantindo que os realmente portadores de uma SCA sejam tratados adequadamente e que os demais, recebam alta hospitalar sem qualquer prejuízo. Atualmente, estes atendimentos se baseiam em quatro pilares: anamnese e exame físico, eletrocardiograma, marcadores de necrose e testes provocativos de isquemia não invasivos. Com as informações resultantes destas análises, podemos fazer diag-nósticos, estratificar risco e propor tratamentos.
Com o advento de troponina de alta sensibilidade, que apresenta maior acurácia na detecção do IAM, a medição da segunda amostra de troponina pode ser encurtada. Hoje, raramente intervalos maiores do que três horas são neces-sários para a nova coleta de amostra sanguínea, garantindo ao paciente um menor tempo de permanência na sala de emergência.2,12,13,16 Na Figura 2 podemos observar um algoritmo proposto baseado no uso da troponina de alta sensibilidade, hoje já largamente disponível em nosso meio. Contudo, al-goritmos baseados em troponina de alta sensibilidade num tempo ainda mais curto já têm sido propostos por algumas sociedades médicas.3 É preciso deixar claro que o ECG é fundamental em todo o processo, assim como a reavaliação dos sintomas. Qualquer anormalidade encontrada, seja no quadro clínico ou no ECG, deve precipitar a reanálise da tro-ponina ou até mesmo determinar o início do tratamento, seja medicamentoso ou invasivo.
Muitos pacientes que são admitidos pelos critérios propos-tos nestes algoritmos necessitarão de exames invasivos para a elucidação do diagnóstico. A cinecoronariografia deverá ser
considerada naqueles considerados de alto risco ou naqueles em que a SCA é altamente provável.
Para os pacientes de menor risco, a angiotomografia das coronárias pode ser uma alternativa.3 Os testes não invasivos têm grande papel na avaliação destes pacientes. Naqueles em que as alterações eletrocardiográficas são inconclusivas, em que os marcadores de necrose são negativos e em que os sintomas não recorrem, o uso destes testes pode definir a conduta. Mais importante do que a discussão sobre qual teste utilizar, se TE, ecocardiograma em repouso e/ou com estresse ou cintilografia, é saber qual deles está disponível no serviço em que se atua. A expertise da equipe, nestes casos, também tem grande relevância. Todavia, infelizmente, na maioria das unidades de emergência nenhum dos testes indicados estão disponíveis para estes pacientes. Por isso, é muito importante que os pacientes com indicação de realizá-los sejam devidamente orientados a retornar ao pronto-socorro na recorrência de qualquer sintoma suspeito. Da mesma forma, caso permaneça assintomático, a reavaliação precoce e a realização dos testes provocativos, ainda que num ambiente ambulatorial, é altamente recomendada.
CoNfLitos de iNteresseOs autores declaram não possuir conflitos de inte-
resse na realização deste trabalho.
figura 2. modelo de atendimento sistematizado do paciente com dor torácica em unidades de pronto-atendimento/pronto-socorro.
dor toracica aguda
eletrocardiograma
<10 minpresença de alterações isquêmicas agudas,
St supra ou Bre novo
não diagnóstico
tratamento
normal Alterada
Sem dor, escore grace<140, diagnósticos diferenciais excluídos
Alta; testes não invasivos, angiotomografia das coronárias
estratégia invasiva, cinecoronariografia diagnósticos diferenciais
troponina de alta sensibilidade (hs-tn): reanálise após 3horas
troponina de alta sensibilidade (hs-tn)
elevação > 5x normal, sintomas de SCA
dor < 6h
hs-tn normal, sem alterações
dor > 6h
Hs-tn sem alteraçõeselevação de HS-tn (Δ varia com o
ensaio utilizado)
DIAGNÓSTICO DAS SíNDROMES CORONARIANAS AGUDAS E MODELO SISTEMATIZADO DE ATENDIMENTO EM UNIDADES DE DOR TORÁCICA
rev Soc Cardiol estado de São paulo 2016;26(2):78-85

84
referÊNCias 1. Steg PG, James SK, Atar D, Badano LP, Blomstrom-Lundqvist C,
Borger MA, et al. ESC guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2012;33(20):2569–619.
2. Thygesen K, Alpert JS, Jaffe AS, Simoons ML, Chaitman BR, White HD, et al. Third universal definition of myocardial infarction. Eur Heart J 2012;33(20):2551-67.
3. Roffi M., Patrono C, Collet JP, Mueller C, Valgimigli M, Andreotti F, et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). European Heart Journal. 2016:37(3):267-315.
4. Thygesen K, Alpert JS, Jaffe AS, Simoons ML, Chaitman BR, White HW, et al. Third universal definition of myocardial infarction. J Am Coll Cardiol. 2012;60(16):1581-98.
5. Canto JG, Fincher C, Kiefe CI, Allison JJ, Li Q, Funkhouser E, et al. Atypical presentations among Medicare beneficiaries with unstable angina pectoris. Am J Cardiol. 2002;90(3):248-53.
6. Mackay MH, Ratner PA, Johnson JL, Humphries KH, Buller CE. Gender differences in symptoms of myocardial ischaemia. Eur Heart J. 2011;32(24):3107-311.
7. Rubini Gimenez M, Reiter M, Twerenbold R, Reichlin T, Wildi K, Haaf P, et al. Sex-specific chest pain characteristics in the ear-ly diagnosis of acute myocardial infarction. JAMA Intern Med. 2014;174(2):241-9.
8. Campeau L. Letter: grading of angina pectoris. Circulation. 1976;54(3):522-3.
9. Gräni C, Senn O, Bischof M, Cippa PE, Hauffe T, Zimmerli L, et al. Diagnostic performance of reproducible chest wall tender-ness to rule out acute coronary syndrome in acute chest pain: a prospective diagnostic study. BMJ Open. 2015;5:(1)e007442.
10. Brieger D, Eagle KA, Goodman SG, Steg PG, Budaj A, White K, et al. Acute coronary syndromes without chest pain, an underdiag-nosed and undertreated high-risk group: insights from the Global Registry of Acute Coronary Events. Chest. 2004;126(2):461-9.
11. Diercks DB, Peacock WF, Hiestand BC, Chen AY, Pollack CV Jr, Kirk JD, et al. Frequency and consequences of recording an electrocardiogram >10 minutes after arrival in an emergency room in non-ST-segment elevation acute coronary syndromes (from the CRUSADE initiative). Am J Cardiol. 2006;97(4):437-42.
12. Savonitto S, Ardissino D, Granger CB, Morando G, Prando MD, Mafrici A, et al. Prognostic value of the admission electrocardio-gram in acute coronary syndromes. JAMA. 1999;281(8):707-13.
13. Thygesen K, Mair J, Giannitsis E, Mueller C, Lindahl B, Blankenberg S, et al. How to use high-sensitivity cardiac troponins in acute cardiac care. Eur Heart J. 2012;33(18):2252-57.
14. Mueller C. Biomarkers and acute coronary syndromes: an update. Eur Heart J 2014;35(9):552-6.
15. Reichlin T, Hochholzer W, Bassetti S, Steuer S, Stelzig C, Hartwiger S, et al. Early diagnosis of myocardial infarction with sensitive cardiac troponin assays. N Engl J Med. 2009;361(9):858-67.
16. Reichlin T, Twerenbold R, Reiter M, Steuer S, Bassetti S, Balmelli C, et al. Introduction of high-sensitivity troponin assays: impact on myocardial infarction incidence and prognosis. Am J Med. 2012;125(12):1205-13.1.
17. Keller T, Tzikas S, Zeller T, Czyz E, Lillpopp L, Ojeda FM, et al. Copeptin improves early diagnosis of acute myocardial infarction. J Am Coll Cardiol. 2010;55:(19)2096-106.
18. Lipinski MJ, Escarcega RO, D’Ascenzo F, Magalhaes MA, Baker NC, Torguson R, et al. A systematic review and collaborative meta-analysis to determine the incremental value of copeptin for rapid rule-out of acute myocardial infarction. Am J Cardiol. 2014;113(9):1581-91.
19. Meneghelo RS, Araújo CGS, Stein R, Mastrocolla LE, Albuquer-que PF, Serra SM, et al; Sociedade Brasileira de Cardiologia. III
Diretrizes da Sociedade Brasileira de Cardiologia sobre teste ergométrico. Arq Bras Cardiol. 2010;95(5 supl.1):1-26.
20. Routledge HC, Townend JN. Why does the heart rate response to exercise predict adverse cardiac events? Heart. 2006;92(5):577-8.
21. Nicolau JC, Timerman A, Marin-Neto JA, Piegas LS, Barbosa CJDG, Franci A, et al. Diretrizes da Sociedade Brasileira de Car-diologia sobre angina instável e infarto agudo do miocárdio sem supradesnível do segmento ST (II Edição, 2007) – atualização 2013/2014. Arq Bras Cardiol. 2014;102(3 Supl.1):1-61.
22. Kumar A, Cannon CP. Acute coronary syndromes: diagnosis and management, part II. Mayo Clin Proc. 2009;84(11):1021-36.
23. Visser CA, Lie KI, Kan G, Meltzer R, Durrer D. Detection and quantification of acute, isolated myocardial infarction by two dimensional echocardiography. Am J Cardiol. 1981;47(5):1020-5.
24. Heger JJ, Weyman AE, Wann LS, Rogers EW, Dillon JC, Fei-genbaum H. Cross-sectional echocardiographic analysis of the extent of left ventricular asynergy in acute myocardial infarction. Circulation. 1980;61(6):1113-8.
25. Ryan T, Vasey CG, Presti CF, O’Donnell JA, Feigenbaum H, Ar-mstrong WF. Exercise echocardiography: detection of coronary artery disease in patients with normal left ventricular wall motion at rest. J Am Coll Cardiol. 1988;11(5):993-9.
26. Kontos MC, Jesse RL, Schmidt KL, Ornato JP, Tatum JL. Value of acute rest sestamibi perfusion imaging for evaluation of patients admitted to the emergency department with chest pain. J Am Coll Cardiol. 1997;30(4):976-82.
27. Iskander S, Iskandrian AE. Risk assessment using single-photon emission computed tomographic technetium-99m sestamibi imaging. J Am Coll Cardiol. 1998;32(1):57-62.
28. Heller GV, Stowers SA, Hendel RC, Herman SD, Daher E, Ahlberg AW, et al. Clinical value of acute rest technetium-99m tetrofosmin tomographic myocardial perfusion imaging in patients with acute chest pain and nondiagnostic electrocardiograms. J Am Coll Cardiol. 1998;31(5):1011-7.
29. Brown KA. Do stress echocardiography and myocardial perfusion imaging have the same ability to identify the low-risk patient with known or suspected coronary artery disease? Am J Cardiol. 1998;81(8):1050-3.
30. Polanczyk CA, Johnson PA, Hartley LH, Walls RM, Shaykevich S, Lee TH. Clinical correlates and prognostic significance of early negative exercise tolerance test in patients with acute chest pain seen in the hospital emergency department. Am J Cardiol. 1998;81(3):288-92.
31. Better N, Karthikeyan G, Vitola J, Fatima A, Peix A, Novak MD, et al. Performance of rest myocardial perfusion imaging in the mana-gement of acute chest pain in the emergency room in developing nations (PREMIER trial). J Nucl Cardiol. 2012;19(6):1146-53.
32. Dedic A, Genders TS, Nieman K, Hunink MG. Imaging strategies for acute chest pain in the emergency department. AJR Am J Roentgenol. 2013;200(1):W26-38
33. Samad Z, Hakeem A, Mahmood SS, Pieper K, Patel MR, Simel DL, Douglas PS. A meta-analysis and systematic review of computed tomography angiography as a diagnostic triage tool for patients with chest pain presenting to the emergency department. J Nucl Cardiol. 2012;19(2):364–376.
34. Goldstein JA, Gallagher MJ, O’Neill WW, Ross MA, O’Neil BJ, Raff GL. A randomized controlled trial of multi-slice coronary computed tomography for evaluation of acute chest pain. J Am Coll Cardiol. 2007;49(8):863-71.
35. Goldstein JA, Chinnaiyan KM, Abidov A, Achenbach S, Berman DS, Hayes SW, et al. The CT-STAT (coronary computed tomographic angiography for systematic triage of acute chest pain patients to treatment) trial. J Am Coll Cardiol. 2011;58(14):1414-22.
36. Hoffmann U, Truong QA, Schoenfeld DA, Chou ET, Woodard PK, Nagurney JT, et al. Coronary CT angiography versus standard evaluation in acute chest pain. N Engl J Med. 2012;367(4):299-308.
37. Litt HI, Gatsonis C, Snyder B, Singh H, Miller CD, Entrikin DW, et al. CT angiography for safe discharge of patients with possible
rev Soc Cardiol estado de São paulo 2016;26(2):78-85

85
acute coronary syndromes. N Engl J Med. 2012;366(15):1393-403.38. Hulten E, Pickett C, Bittencourt MS, Villines TC, Petrillo S, Di
Carli MF, et al. Outcomes after coronary computed tomography angiography in the emergency department: a systematic review and meta-analysis of randomized, controlled trials. J Am Coll Cardiol. 2013;61(8):880-92.
39. Ayaram D, Bellolio MF, Murad MH, Laack TA, Sadosty AT, Erwin PJ, et al. Triple rule-out computed tomographic angiography for chest pain: a diagnostic systematic review and meta-analysis. Acad Emerg Med. 2013;20(9):861-71.
40. Nagel E, Lehmkuhl HB, Bocksch W, Klein C, Vogel U, Frantz E, et al. Noninvasive diagnosis of ischemia-induced wall motion abnormalities with the use of high-dose dobutamine stress MRI: comparison with dobutamine stress echocardiography. Circulation. 1999;99(6):763-70.
41. Jaarsma C, Leiner T, Bekkers SC, Crijns HJ, Wildberger JE, Nagel E, et al. Diagnostic performance of noninvasive myocardial perfu-sion imaging using single-photon emission computed tomography, cardiac magnetic resonance, and positron emission tomography imaging for the detection of obstructive coronary artery disease: a meta-analysis. J Am Coll Cardiol. 2012;59(19):1719-28.
42. Schwitter J, Wacker CM, Wilke N, Al-Saadi N, Sauer E, Huettle K, et al; MR-IMPACT Investigators. MR-IMPACT II: Magnetic Reso-nance Imaging for Myocardial Perfusion Assessment in Coronary artery disease Trial: perfusion-cardiac magnetic resonance vs. single-photon emission computed tomography for the detection of coronary artery disease: a comparative multicentre, multivendor trial. Eur Heart J. 2013;34(10):775-81.
43. Watkins S, McGeoch R, Lyne J, Steedman T, Good R, McLaughlin MJ, et al. Validation of magnetic resonance myocardial perfusion imaging with fractional flow reserve for the detection of significant coronary heart disease. Circulation. 2009;120(22):2207-13.
44. Hundley WG, Bluemke DA, Finn JP, Flamm SD, Fogel MA, Friedrich MG, et al; American College of Cardiology Foundation Task Force on Expert Consensus Documents. ACCF/ACR/AHA/NASCI/SCMR 2010 expert consensus document on cardiovascular magnetic resonance: a report of the American College of Cardiology Foun-dation Task Force on Expert Consensus Documents. Circulation. 2010;121(22):2462-508.
45. Lockie T, Nagel E, Redwood S, Plein S. Use of cardiovascular magnetic resonance imaging in acute coronary syndromes. Cir-culation. 2009;119(12):1671-81.
46. Lerakis S, McLean DS, Anadiotis AV, Janik M, Oshinski JN, Ale-xopoulos N, et al. Prognostic value of adenosine stress cardio-vascular magnetic resonance in patients with low-risk chest pain. J Cardiovasc Magn Reson. 2009;11(1):37.
47. Hall ME, Miller CD, Hundley WG. Adenosine stress cardiovascular magnetic resonance-observation unit management of patients at intermediate risk for acute coronary syndrome: a possible strategy for reducing healthcare-related costs. Curr Treat Options Cardiovasc Med. 2012;14(1):117-25.
48. Hartlage G, Janik M, Anadiotis A, Veledar E, Oshinski J, Kremasti-nos D, et al. Prognostic value of adenosine stress cardiovascular magnetic resonance and dobutamine stress echocardiography in patients with low-risk chest pain. Int J Cardiovasc Imaging. 2012;28(4):803-12.
DIAGNÓSTICO DAS SíNDROMES CORONARIANAS AGUDAS E MODELO SISTEMATIZADO DE ATENDIMENTO EM UNIDADES DE DOR TORÁCICA
rev Soc Cardiol estado de São paulo 2016;26(2):78-85

86
resUMoO infarto agudo do miocárdio com supradesnível de ST é uma das emergências
cardiológicas mais exigentes para o sistema de saúde de qualquer país; em lugares subdesenvolvidos as dificuldades são evidentemente maiores.
A necessidade de o paciente chamar socorro rápido (atendimento pré-hospitalar) ou procurar atendimento, usualmente em hospitais gerais, e ser identificado pela clínica e ECG, ocasiona grande perda de tempo e demora na reperfusão miocárdica. Se a estrutura de atendimento não está organizada para definir trombólise ou angioplastia imediata (e há necessidade de transferência), uma ou outra necessitando ser utilizada o mais precocemente possível, ocorrem atrasos adicionais e o paciente é grandemente prejudicado, não só com aumento do número de óbitos, mas também com grande comprometimento de VE.
A trombólise pré-hospitalar e um sistema de tele-ECG (no Brasil, a maioria dos aten-dimentos de urgência em casa ou nos prontos-socorros gerais são feitos por não car-diologistas, com dificuldades na interpretação do ECG) são elementos importantes que ajudam de forma indiscutível a melhorar resultados no infarto com supradesnível, desde que inseridos em uma rede de atendimento de infarto em que todos têm função bem definida, da rapidez em reconhecer a clínica, fazer e interpretar o ECG, definir a forma de reperfusão e se há ou não necessidade e condições de transporte imediato. Quando utilizados de forma organizada e sistemática, portanto, ambos contribuem para melhorar o resultado de qualquer sistema de atendimento do infarto agudo do miocárdio com supradesnível de ST.
Descritores: Infarto do Miocárdio; Reperfusão Miocárdica; Atendimento de Emergência Pré-Hospitalar.
aBstraCtMyocardial infarction with ST segment elevation is one of the most demanding
cardiological emergencies for the health system of any country; in underdeveloped countries, the difficulties are clearly even greater.
The need for the patient to summon rapid first aid (pre-hospital care) or seek care, usually in general hospitals, and to be identified by the clinic and ECG, results in a sig-nificant loss of time and delay in myocardial reperfusion. If the emergency care structure is not organized to define thrombolysis or angioplasty immediately (and there is a need for transfer), with one or the other needing to be performed as early as possible, this can lead to additional delays, and the patient is placed at greater risk, not only due to the increase in the number of deaths, but also due to significant impairment of LV.
Pre-hospital thrombolysis and a tele-ECG system (in Brazil, most emergency care at home or in first aid departments is done by non-cardiologists, who have difficulty inter-preting the ECG) are important procedures, which undeniably help to improve the results in cases of acute MI with ST segment elevation, provided they are included as part of an emergency care network for myocardial infarction in which everybody has a clearly-defined role, with rapid clinical recognition, performing and interpreting the ECG, defining the form of reperfusion, and whether or not the patient requires, or is in a fit condition for immediate transport. Therefore, when used in a systematic and organized way, both procedures can improve the outcomes of any emergency care system for patients with acute myocardial infarction with ST segment elevation.
Descriptors: Myocardial Infarction; Myocardial Reperfusion; Emergency Medical Services.
Silvio Reggi1
Antonio Carlos Carvalho1
1. Disciplina de Cardiologia da Universidade Federal de São Paulo- UNIFESP, São Paulo, Brasil.
Correspondência:Rua Napoleão de Barros, 715. São Paulo, [email protected]
iMPortÂNCia da teLeMediCiNa e da troMBÓLise PrÉ-HosPitaLar
tHe iMPortaNCe of teLeMediCiNe aNd of Pre-HosPitaL tHroMBoLYsis
revisÃo/review
rev Soc Cardiol estado de São paulo 2016;26(2):86-92

87
o iNíCio de UMa Nova era: o trataMeNto PrÉ-HosPitaLar e a redUÇÃo Na MortaLidade
A importância do tratamento precoce do infarto agu-do do miocárdio com supradesnível do segmento ST está documentada desde 1993, quando Weaver mostrou, em 360 pacientes estudados em 19 centros, o efeito positivo da trombólise pré-hospitalar.1 Quando medicados com al-teplase dentro dos primeiros 70 minutos após o início dos sintomas, a mortalidade dos tratados pré-hospitalar, quando comparados aos tratados no hospital, sofreu uma queda relativa de quase 86% (8,7% versus 1,2%, p=0,04) e a fração de ejeção permaneceu em patamares significativamente maiores (53% versus 49%, p=0,03).1 Se considerados todos os pacientes tratados (em até 6 horas), não houve diferen-ça em nenhum dos desfechos, demonstrando o peso da precocidade do tratamento no prognóstico dos pacientes.
Em 2003 novos dados sobre o tema foram publicados, agora referentes ao CAPTIM Trial.2 Nesta análise randomi-zada, pacientes que receberam trombólise pré-hospitalar (seguida de angioplastia, se necessária) foram comparados aos submetidos à angioplastia primária. Os pacientes trom-bolisados com menos de 2 horas após o início dos sintomas tiveram mortalidade (em 30 dias) significativamente menor que aqueles submetidos à angioplastia primária (2,2% versus 5,7%, P=0,058), efeito que não ocorreu com os trombolisa-dos com mais de 2 horas (5,9% versus 3,7%, p=0,47).2 Da mesma forma, a incidência de choque cardiogênico foi menor nos pacientes com tratamento precoce (1,3 versus 5,3%, p=0,032) e semelhante nos paciente com tratamento tardio, quando comparamos os trombolisados com os pacientes submetidos a angioplastia primária.2
defiNiÇÃo de iNfarto “aBortado” e seUs Preditores
No fim da década de 90, Lamfers e Verheught iniciaram na Holanda um protocolo de trombólise pré-hospitalar em que trabalharam intimamente com os sistemas de atendi-mento de emergências médicas (ambulâncias e hospitais).3 Foi possível na ocasião reduzir em 63 minutos o início do tratamento, sendo que 28% receberam a terapia com menos de uma hora de dor3. Este mesmo grupo de pesquisadores avaliou o número de infartos “abortados” no grupo com lise pré-hospitalar versus tratamento padrão (hospitalar).4 Para inclusão, foi usado um sistema de telemedicina que trans-mitia as informações eletrocardiográficas para uma unidade hospitalar próxima, onde o diagnóstico de síndrome coro-nariana aguda (SCA) com ST supra era confirmado. Foram considerados para a análise os pacientes com sintomas entre 30 minutos e 6 horas. Ficaram estabelecidos como infarto “abortado” os casos em que: (1) os achados do ECG e os sintomas clínicos fossem compatíveis com o diagnóstico de SCA com ST supra; (2) a elevação da CK total ou da fração MB não superasse duas vezes o limite do normal; e (3) a elevação do segmento ST fosse reduzida em pelo menos 50% após 2 horas de tratamento. Os resultados mostraram uma grande superioridade nos resultados em favor do grupo pré-hospitalar (13% versus 4%, p<0,05), mostrando maior efetividade desta em conseguir infartos “abortados”, apesar
rev Soc Cardiol estado de São paulo 2016;26(2):86-92
das porcentagens absolutas não serem grandes4 pelo “n” estudado. Neste estudo também foi possível constatar uma significante redução no tempo de tratamento (85 minutos para o pré-hospitalar versus 165 minutos para o hospitalar, p<0,05), o que representa uma queda de quase 50%4 no início do tratamento.
Para o esclarecimento dos preditores de infarto “abor-tado”, os autores avaliaram, numa terceira publicação,5 os dados de pacientes de ambos os grupos, tratamento pré e intra-hospitalar que tiveram infarto “abortado” conforme os critérios definidos acima. Dos pacientes avaliados, total de 744, 17,1% do grupo pré-hospitalar tiveram seu infarto interrompido, número bem diferente dos 4,5% do grupo controle.5 Entre as características analisadas, revelaram-se como preditores os seguintes itens: (1) tratamento precoce; (2) menor elevação do ST no momento do diagnóstico; e (3) presença de angina. O entendimento é relativamente simples, já que o tratamento precoce determina uma me-nor área de isquemia e necrose, com menor elevação do ST pela área menor de miocárdio sob risco e a presença de angina leva ao acionamento do serviço de emergência mais precocemente. Vale destacar que os pacientes que tiveram o infarto interrompido precocemente apresentaram mortalidade (em 12 meses) quase seis vezes menor que o grupo controle (2,2% versus 11,6%).5
o estUdo STREAM 6 e dados Mais reCeNtes
A estratégia fármaco-invasiva (EFI) de tratamento das SCA com ST supra (uso de lítico seguido de cateterismo sis-temático após 6-24 horas e PCI imediata quando necessário) teve seu benefício mostrado pela primeira vez no CAPTIM Trial.2 Porém, uma análise direta, randomizada e prospectiva frente à angioplastia primária, avaliando a interrupção precoce do infarto (ou infarto “abortado”), assim como a mortalidade, choque cardiogênico, insuficiência cardíaca e reinfarto (em até 30 dias) não havia até então acontecido.
O estudo STREAM (STrategic Reperfusion Early After Myocardial Infarction)6 foi primeiro que se propôs a avaliar tais resultados. Pacientes com sintomas que se iniciaram há menos de 3 horas e que não poderiam ser submetidos à angioplastia primária em menos de uma hora foram sele-cionados para o estudo.
Os 1892 pacientes do STREAM foram randomizados para duas terapias: (1) angioplastia primária ou (2) tenecteplase e transporte imediato para um hospital em que um serviço de hemodinâmica estivesse disponível. Nos casos em que a terapia fibrinolítica não alcançava os critérios de sucesso de reperfusão, os pacientes eram submetidos a angioplastia de resgate. Nos demais, o estudo hemodinâmico foi realizado de forma sistemática entre 6 e 24 horas após a randomiza-ção. Ácido acetilsalicílico, clopidogrel e enoxaparina foram utilizados igualmente nos dois grupos.
O desfecho primário ocorreu em 12,4% dos pacientes do grupo fibrinólise e em 14,3% no grupo angioplastia primária (RR=0,86; IC 95%; 0,68-1,09; p=0,21). A angioplastia de resgate foi necessária em 36,3% dos pacientes randomiza-dos para o tratamento pré-hospitalar, tendo o restante sido submetido a cinecoronariografia, em média, 17 horas após a randomização. Como complicação da EFI se destacou a
IMPORTÂNCIA DA TELEMEDICINA E DA TROMBÓLISE PRÉ-HOSPITALAR

88
hemorragia intracraniana, que pela alta incidência inicial levou ao ajuste da dose de tenecteplase em pacientes acima de 75 anos para metade da dose inicial (calculada pela relação de mg de TNK/kg de peso); após esta correção, a incidência foi discretamente diferente entre os dois grupos, porém sem significância estatística (0,5% para o grupo fibrinólise versus 0,3% para o grupo angioplastia, p=0,47). (Tabela 1)
No que tange a interrupção precoce do infarto, uma segun-da publicação do mesmo grupo7 mostrou que a EFI foi capaz de promover uma maior interrupção do IAM (n=99; 11,1%) que o grupo angioplastia primária (n=59; 6,9%; p<0,01), confirmando os trabalhos iniciais de Lamfers e Verheught. Numa análise multivariada foi notado que os preditores para infarto “abortado” no STREAM foram os seguintes: (1) menor elevação do ST supra; (2) menor quantidade de ondas Q no eletrocardiograma; e (3) menor tempo de isquemia total.
Como se não bastasse, outras análises, agora com ressonância nuclear magnética, também mostraram que infartos interrompidos precocemente, por fibrinólise ou por angioplastia primária, também estavam associados com menor taxa de eventos futuros8 e menor taxa de no reflow.9
a LogístiCa do ateNdiMeNto PrÉ-HosPitaLar
A rapidez no tratamento das síndromes coronarianas agudas, em especial nas com ST supra, é fundamental para o restabelecimento da perfusão e diminuição dos desfechos.10 Quanto maior o tempo de exposição à isquemia, menor a probabilidade de interrupção precoce do infarto e maior a taxa de complicações, entre elas a insuficiência cardíaca, o choque cardiogênico e a morte.
tabela 1. desfechos clínicos, achados angiográficos e procedimen-tos realizados dentro dos 30 primeiros dias no estudo StreAm.6
Variável Fibrinólise (N=944)
Angioplastia primária (N=948)
Valor de p
desfecho composto: morte, choque, iC e reinfarto.
116/939 (12,4%) 135/943(14,3%) 0,21
morte por qualquer causa
43/939 (4,6%) 42/946 (4,4%) 0,88
Choque cardiogênico
41/939 (4,4%) 56/944 (5,9%) 0,13
insuficiência cardíaca (iC)
57/939 (6,1%) 72/943 (7,6%) 0,18
reinfarto 23/938 (2,5%) 21/944 (2,2%) 0,74
rehospitalização por causas cardíacas
45/939 (4,8%) 41/943 (4,3%) 0,64
Angioplastia de resgate
331/911 (36,3%) nA nA
necessidade de cirurgia de revascularização
44/943 (4,7) 20/947 (2,1) 0,002
Angioplastia com stent
704/736 (95,7%) 838/933 (95,6%) 0,95
A necessidade de um sistema de atendimento pré-hos-pitalar se sustenta na medida em já se foi demonstrado que, com ele, a oferta do tratamento se torna mais precoce.1,3 Nes-ta primeira intervenção, geralmente feita por um generalista que atua num sistema de atendimento médico de urgência (SAMU), é possível que o diagnóstico seja reconhecido pela história clínica e pelo eletrocardiograma e, nos casos ade-quados, o fibrinolítico seja administrado. (Figura 1)
Na Figura 1 estão demonstrados os tempos de atendimen-to nos casos de SCA com ST supra conforme proposta do último Guidelines da European Society of Cardiology11 de 2012:
• Tempo para acionamento do serviço médico: é o tempo entre o início dos sintomas e o primeiro atendimento médico. Trata-se de um tempo em que o paciente e seus familiares têm fundamental relevância, uma vez que se faz necessária a pronta percepção da condição apresentada. Pacientes com história de doenças cardiovasculares ou de alto risco para eventos coronarianos deveriam, em especial, receber treinamento adequado para reconhecer possíveis sintomas e acionar o sistema médico local. Na Europa especialmente o chamado para as unidades tipo SAMU é intenso e frequente, apenas uma minoria de pacientes chega ao PS ou hospital por conta própria.
• Tempo entre o primeiro atendimento médico e o diagnóstico: o tempo ideal é que o diagnóstico seja feito em até 10 minutos. É necessário que neste período seja obtida uma história clínica direcionada assim como seja realizado o primeiro eletrocardiograma. É muito comum que se perca um tempo precioso neste período. As emergências hospitalares não estão, na maioria das vezes, preparadas para acolher, de modo adequado, o paciente com possível SCA. Para que este tempo seja otimizado toda a equipe de atendimento médico de emergência, não só o médico, deve estar treinada e apta. Nos casos de atendimento pré-hospitalar, o qual geralmente é feito por um generalista, a interpretação do eletrocardiograma pode ser feita através de telemedicina, numa central distante do ponto de atendimento, se necessário.
• Tempo entre o primeiro atendimento médico e a re-perfusão: este é o tempo que o “sistema” leva para iniciar o tratamento do paciente. Ele é um preditor de qualidade de atendimento, assim como de desfechos.12,13 Em sistemas (atendimento pré-hospitalar e hospitais) em que a angioplastia primária é a conduta de escolha, este tempo não deveria superar os 90 minutos. Nos casos de infarto de grande ex-
Sintomas Diagnóstico
<=10 min.
Atendimento
Tempo para atendimento
Tempo para início do tratamento
Tempo para terapia de reperfusão
Reperfusão
figura 1. tempos de atendimento nos casos de SCA com St.
rev Soc Cardiol estado de São paulo 2016;26(2):86-92

89
tensão, ou naqueles em que os sintomas se iniciaram há menos de duas horas, o recomendado é um máximo de 60 minutos.2,13 Contudo, hospitais capazes de realizar angioplas-tia primária deveriam perseguir o tempo máximo porta-balão de 60 minutos para todos os casos. Por último, ainda que os tempos adequados sejam atingidos, é preciso que se mantenha vigilância e treinamento constantes para que a qualidade não se perca com o passar do tempo.
• Tempo entre a reperfusão e a transferência do pa-ciente para um centro PCI, caso o local da reperfusão não tenha hemodinâmica. Este é um dos pontos onde existe maior divergência entre as Diretrizes Europeia-Brasileira versus a do ACC/AHA. A do ACC/AHA,14 de 2013, reco-menda transferência imediata apenas para os casos sem reperfusão ou com reoclusão (como IIa B). A Europeia,11 de 2012, recomenda transferência imediata após fibrinólise, com ou sem sucesso, para um centro PCI como recomen-dação I A, realizando-se o cat como resgate ou em ate 24 horas dependendo da condição do paciente. A Diretriz Brasileira15 de 2015, recomenda transferência sistemática para centro PCI após uso de fibrinolítico, mencionando uso de resgate ou não segundo as condições do paciente, mas sem colocar tempo específico ou nível de recomen-dação neste item. Ainda na Diretriz Brasileira mais recente a indicação de trombólise pré-hospitalar é I B, a indicação de fibrinolíticos se o tempo primeiro contato médico-balão for maior que 120’ também é I B e a indicação de estratégia fármaco invasiva é IIa B.
O problema com angioplastia de resgate é que pela maior instabilidade do paciente você obtém resultados sig-nificativamente piores do tratamento. Gershlick16 e colabo-radores demonstrou no material do STREAM, e confirmando dados prévios, que após mais de 60’ de atraso para PCI, e especialmente após 90’, os casos com estratégia fármaco--invasiva têm resultados melhores (Figura 2) que os de inter-venção percutânea no objetivo composto analisado. Welsh17 mostrou resultados piores quando comparando tratamento em sistemas de emergência da periferia contra tratamento pré-hospitalar via ambulâncias pela maior demora no sistema periférico (178 x 137’) com maior número de resgates e maior número de eventos (odds ratio 2.3). Já quando os tempos de tratamento eram semelhantes não havia diferença nos resultados dos centros periféricos contra o tratamento feito nas ambulâncias. Almeida Souza18 e colaboradores, em nosso meio, mostraram como os resultados de resgate em mulheres, muito dependentes de demora na transferência de ambulância após fibrinólise sem sucesso, onera a mortalidade em 4 a 5 vezes o resultado obtido eletivamente.
sistematização de Chamadas e Local de transferência
Para que um sistema médico de atendimento emergencial e pré-hospitalar, funcione adequadamente é preciso que se tenha um número de telefone amplamente divulgado e de fácil memorização e acesso. O profissional de saúde da ponta necessita fazer apenas um chamado, rápido, efetivo, para resolver seu problema e não perder tempo falando com pessoas e locais diferentes. O telefone do IAM necessita ficar na UCO ou na Hemodinâmica com um profissional capaz de discutir necessidade e tipo de reperfusão daquele caso,
disponibilidade de vaga imediata e encaminhamento imediato para o laboratório de hemodinâmica ou não. Se necessário pode receber o ECG via celular para discutir se é ou não um caso de ST supra. Contudo, é comum em nosso meio que as unidades de atendimento não se sintam capazes de iniciar a terapia de reperfusão fibrinolítica, reflexo da falta de treinamento adequado e, possivelmente, de um sistema sólido de telemedicina que possa prover ajuda na interpreta-ção do cenário clínico e dos achados do eletrocardiograma. Se funcionasse adequadamente, as ambulâncias deixariam de ser apenas um sistema rápido de transporte e se trans-formariam em mais um local de diagnóstico e tratamento. Como falado anteriormente, o diagnóstico precoce feito por um sistema de atendimento pré-hospitalar, está associa-do a melhores tempos de atendimento, a reperfusão mais precoce, evita trombólise inadequada e propicia melhores desfechos clínicos.12,19-22 Um dos pontos mais críticos no atendimento pré-hospitalar das SCA está na interpretação do eletrocardiograma. Na figura 3 vemos o organograma de atendimento proposto pela European Society of Cardiology.11 Hoje com a facilidade de transmitir dados via skype, whats
Atra
so (m
in) p
ara
a re
aliz
ação
da
angi
opla
stia
prim
ária
2030405060708090
100110120130140
0,0 1,0 2,0 3,0
PCI melhorEFI melhor
figura 2. estratégica fármaco-invasiva (efi) versus angioplástica primária (pCi).
Hospital com angioplastia primária
Angioplastia possível em menos de 120 minutos?
Atendimento pré-hospitalar ou hopital sem angioplastia
Angioplastia primária
Angioplastia de resgate
Cinecoronariografia
Imediatamente
Melhor entre 3 e 24 h
Menos de 90 min (60 para sintomas <2h)
Fibrinólise com sucesso? Fibrinólise
Não
Não
Sim
Sim
Transferência para hospital com hermodinâmica
Menos de 30 min
Menos de 60 min
figura 3. diagnóstico e conduta em iAm com supra segundo a diretriz europeia de 2012.
IMPORTÂNCIA DA TELEMEDICINA E DA TROMBÓLISE PRÉ-HOSPITALAR
rev Soc Cardiol estado de São paulo 2016;26(2):86-92

90
app, facebook etc um ECG pode facilmente ser enviado para o médico da unidade de referência e o caso ter no mínimo uma segunda opinião. A definição clara do centro PCI que receberá o caso é fundamental para que o sistema de transporte não perca tempo procurando um local para transferência. O ideal é sempre haver vaga para um infarto com supra e a hemodinâmica funcionar 24/7.
rede de trataMeNto de sCa CoM st sUPra
Um ótimo sistema para tratamento de SCA com ST supra deveria contar com a implementação de diversas tecnologias disponíveis, conectando o atendimento pré-hospitalar às unidades hospitalares, sempre com o objetivo de otimizar o tempo de tratamento e garantir a reperfusão e sempre atendendo as necessidades específicas locais. As principais características de uma rede de atendimento bem formada são os seguintes:
a) definição clara das áreas de responsabilidade (no caso de atendimento pré-hospitalar) e dos hospitais subor-dinados (sem unidade de hemodinâmica) com definições das condutas específicas e sistemáticas para cada local.
b) amplo treinamento da equipe, através de protocolos, e com clara definição da responsabilidade de cada membro durante o atendimento.
c) adequado sistema, preferencialmente exclusivo e úni-co, de atendimento de chamadas de emergência, com ampla divulgação, fácil memorização e sem espera. O médico da “ponta” faz apenas uma chamada telefônica para discutir e transferir o caso.
d) comunicação aberta com a equipe de hemodinâmica do hospital de referência para que, nos casos de angio-plastia primária, o paciente seja admitido imediatamente no laboratório e não permaneça desnecessariamente na sala de emergência.
Para otimizar o sistema de atendimento e a sua qualidade, os hospitais habilitados para angioplastia primária deve-riam realizá-la sete dias por semana, durante as 24 hora do dia. Eventualmente, quando isso não for possível de forma permanente, um rodízio entre os hospitais de determinada região pode ser empregado, sempre com a ressalva de que tais escalas precisam ser claras e bem divulgadas. Isto tem o objetivo principal de não gerar confusões com o sistema de atendimento pré-hospitalar, o que pode, eventualmente, retardar o tempo de atendimento. Na impossibilidade de angioplastia primária em um tempo inferior a 90 ou 120’ após o primeiro contato médico a opção de fibrinolítico seguida de transferência e cateterismo cardíaco em até 24 horas deve ser oferecida.
rede sÃo PaULo de trataMeNto de iaM CoM sUPra
Após início do serviço de TeleECG da Unifesp em 2008 com 64 AMAS sob seus cuidados ficou evidente a necessidade de estruturação de um serviço tipo rede que sistematizasse o reconhecimento e tratamento rápido do IAM com supra, pois o simples diagnóstico do IAM pelo ECG não tirava o paciente de um local com recursos mínimos, sem condições de me-dicar adequadamente e tratar complicações desta doença.
Hospital sem serviço de hemodinâmica
Atendimento domiciliar (SAMU)
Menor que 90’
Menor que 90’
Maior que 90’
Trombose: tenecteplase
Trombose: Tenecteplase
Sucesso: CATE em 3-24 h
Sem sucesso: CATE imediato
Angioplastia promária
Angioplastia promária
Hospital terciário, com serviço de hemodinamica
Maior que 90’
Durante o ano de 2009 um protocolo foi desenvolvido entre a Unifesp, Prefeitura Municipal de São Paulo e na ocasião o SAMU, protocolo que praticamente não foi modificado até hoje (Figura 4) e que tem proporcionado excelentes resultados. Foi feito treinamento e capacitação das unidades participantes, com participação da Socesp,23 e o projeto evoluiu das 4 uni-dades iniciais para 11 participantes nos dias de hoje, sendo atendidos de janeiro 2010 a dezembro de 2015, 1705 casos diagnosticados e tratados inicialmente como IAM com supra (comunicação pessoal, material a ser apresentado no Con-gresso SOCESP de 2016). Vale ressaltar que estes casos foram tratados e transferidos para o hospital referência PCI (Hospital São Paulo) a partir das unidades de emergência envolvidas e não após internação hospitalar em unidades coronarianas, o que abrevia em muito o tempo total de tratamento. O importan-te é que a rede estruturada atenda as necessidades locais e que ofereça as duas opções de reperfusão de acordo com as necessidades individuais das unidades envolvidas no sistema e que realize transferências de forma organizada e sistemática para um centro PCI que funcione 24/7.
No que diz respeito a transferência pós-fibrinólise, nosso grupo tem recomendado o que a Diretriz Europeia propõe (transferência imediata e sistemática) por quatro razões princi-pais: nossos postos periféricos tem menos recursos e pessoal menos capacitado que nos países desenvolvidos, há uma taxa de não reperfusão após TNK de 30% que necessita resgate imediato, há uma taxa de 10% em nosso material de reoclusão após reperfusão inicial que também necessita resgate a curto prazo e finalmente nosso número de ambulâncias no setor público é insuficiente, levando em média de 5 a 8 horas para uma transferência, o que por si só inviabiliza bom resultado de angioplastia primária ou complica o atendimento de resgates. Na rede de infarto de SP após os primeiros 1000 pacientes tratados, chegou-se a um NNT para óbito de 11,2, ou seja, a cada 100 pacientes tratados evita-se 11 óbitos em relação ao tratamento usual de infarto com supra existente na cidade.24
Contudo, é preciso ficar claro que não existe um único modelo de rede de atendimento e que modelos que deram certo em determinados locais podem não ser aplicáveis em outros. Por outro lado esses números, apesar de excelentes, poderiam ser ainda melhores caso houvesse transporte imediato para os casos de falência do uso do trombolítico, situação que acaba geralmente em choque cardiogênico com suas ine-
figura 4. fluxograma de reperfusão na rede primaria paulistana de infarto com St supra.
rev Soc Cardiol estado de São paulo 2016;26(2):86-92

91
vitáveis complicações e elevada mortalidade. Nos casos de atendimento de SCA, notamos que as maiores dificuldades de atendimento se concentram na interpretação do eletrocar-diograma e na decisão de iniciar a terapia fibrinolítica. Assim, o suporte a distância, por especialistas, poderá ajudar nos dois grandes gargalos vistos hoje e que tem determinado um atraso substancial no início do tratamento.
Redes de atendimento bem estruturadas reduzem o tem-po de atendimento e aumentam as taxas de reperfusão19-25 e em países em desenvolvimento, diferentemente de países desenvolvidos, podem diminuir a mortalidade.26 Num sistema montado na Carolina do Norte, englobando todo o estado,25 foi notada uma diminuição no número de pacientes que não receberam reperfusão (de 5,4% para 4,0%, p=0,04). Os pacientes também foram submetidos mais rapidamente ao estudo hemodinâmico, com queda significativa nos tempos tanto nos hospitais com serviço de hemodinâmica, quanto naqueles que providenciaram a transferência do paciente.
teLeMediCiNaUm sistema de telemedicina tem como objetivos princi-
pais auxiliar no diagnóstico, na interpretação de exames e na decisão terapêutica. Nem sempre, no local do atendimento, há a possibilidade de se oferecer profissional treinado e com expertise para a tomada de decisões difíceis, muitas vezes num cenário em que a vida está sob risco.
Com a disseminação dos sistemas de atendimentos de emergência pré-hospitalar, o que garantiu atendimento mais rápido a um grande número de pessoas, foi necessário à ampliação das unidades que não contam com médicos, o que tornou o serviço apenas um sistema de triagem e transporte rápidos. Por outro lado, nas unidades em que o médico está presente, quase nunca contamos com um es-pecialista, uma vez que tal serviço não está, nem deve estar, estruturado para o atendimento de um grupo específico de doenças. Diante deste cenário passa a ser fundamental que estas equipes de atendimento na “ponta” tenham acesso a equipes especializadas, fundamentalmente para auxiliá-las em todas as etapas do atendimento.
Apesar da telemedicina poder abranger toda uma tecno-logia muito ampla já existente, nem sempre ela é necessária em sua totalidade. Nos casos cardiológicos, por exemplo, um adequado sistema de transmissão de imagens de baixa resolução e um canal telefônico para a comunicação entre as partes já cumpre grande parte da necessidade atual. Hoje, a transmissão das imagens pode ser realizada através de aplicativos de celular, tablets ou ainda por sinais telefônicos que são interpretados e traduzidos nos centros de análise. A rápida interpretação deste traçado, por um especialista, e o contato telefônico que se estabelece a seguir, são su-ficientes para que o diagnóstico seja corretamente feito, o caso discutido e a terapia adequada instituída. Portanto,
referÊNCias1. Weaver WD, Cerqueira M, Hallstrom AP, Litwin PE, Martin JS,
Kudenchuk PJ, et al. Prehospital-initiated vs Hospital-initiated Thrombolytic Therapy. The Myocardial Infartion Triage and Inter-vention Trial. JAMA. 1993;270:1211-6.
2. Steg PG, Bonnfoy E, Chabaud S, Lapostolle F, Dubien PY, Cris-
tofini P, et al. Impact of time to treatment on mortality after pre hospital fibrinolysis or primary angioplasty: data from the CAPTIM randomized clinical trial. Circulation 2003;108:2851-6.
3. Hooghoudt TEH, Lamfers EJP, Uppelschoten A, Verheugt FWA. Study of time intervals in myocardial ischemic syndromes (STIMIS).
IMPORTÂNCIA DA TELEMEDICINA E DA TROMBÓLISE PRÉ-HOSPITALAR
diante da inviabilidade de ser ter um especialista dentro de cada ambulância, é fundamental que os serviços de teleme-dicina sejam adequadamente estruturados e fomentados, para que desta forma tenhamos pacientes com diagnóstico mais precoce e melhor tratados, basicamente aumentando a taxa de reperfusão nos casos de IAMCSST. Os serviços de atendimento de tele ECG27,28 hoje já estão disseminados em vários locais do Brasil (São Paulo, Rio de Janeiro, Salvador, Belo Horizonte, Porto Alegre etc) e de modo geral atendem nichos específicos das áreas mencionadas. A expansão destes serviços, entretanto, poderia ser maior e com certeza poderiam ajudar a propiciar maior taxa de reperfusão no infarto com supra. A recente Diretriz de Telecardiologia29 da Sociedade Brasileira de Cardiologia enfatiza estes aspectos e é um grande apontador de normas e direções que esta área deve seguir nos próximos anos.
CoNsideraÇÕes fiNaisDesde os primeiro dados publicados no início da década
de 90, e desde então cada vez mais robustos, notamos que o atendimento médico pré-hospitalar leva a diminuição dos tempos de tratamento, maior taxa de reperfusão (angioplastia primária ou fibrinólise) e menor taxa de desfechos clínicos.
O maior estudo randomizado que consolidou tais achados foi o STREAM Trial, publicado em 2013, em que pacientes trombolisados antes do atendimento hospitalar tiveram des-fechos semelhantes aos submetidos a angioplastia primária.6 Além disso, mostrou que nos submetidos à terapia fármaco--invasiva (com sucesso, 70% deles) é possível que se aguarde até 24 horas para a realização do estudo hemodinâmico. Tais achados apoiam fortemente a necessidade do estabeleci-mento de uma rede bem estruturada de atendimento e que atenda as necessidades locais. O atendimento pré-hospitalar, os hospitais-referência com serviço de hemodinâmica (que idealmente devem ser próximos) e a telemedicina são elos fundamentais para que toda a rede de atendimento funcione adequadamente, garantindo o atendimento de qualidade buscado por todos em todos os lugares.
Diante disso, faz-se necessário que se estabeleça uma ampla discussão que inclua pacientes e seus representantes (ONG’s por exemplo), sociedades médicas e os diversos níveis de governos para que possamos implementar e es-truturar o serviço em todas as regiões do país, sempre com o objetivo único que une a todos: promover saúde e atendi-mento de qualidade.
CoNfLitos de iNteresseOs autores declaram não possuir conflitos de inte-
resse na realização deste trabalho.
rev Soc Cardiol estado de São paulo 2016;26(2):86-92

92
Cardiologie. 1998;5:23-30.
4. Lamfers EJP, Hooghoudt TEH, Uppelschoten A, Stolwijk PW, Verheugt FW. Effect of pre hospital thrombolysis on aborting acute myocardial infarction. Am J Cardiol. 1999;84:928-30.
5. Lamfers EJP, Hertzberger DP, Schut A, Stolwijk PW, Verheugt FW. Abortion of acute ST elevation myocardial infarction after reperfusion: incidence, patient’s characteristics and prognosis. Heart. 2003;89:496-501.
6. Armstrong PW, Gershlick AH, Goldstein P, Wilcox R, Danays T, Lambert Y, et al. Fibrinolysis or primary PCI in ST segment ele-vation myocardial infarction. N Engl J Med. 2013;368:1379-87.
7. Dianati MN, Van de Werf F, Goldstein P, Adgey JA, Lambert Y, Sulimov V, et al. Aborted myocardial infarction in ST-elevation myocardial infarction: insights from the Strategic Reperfusion Early After Myocardial Infarction Trial. Heart 2014;100(19):1543-9.
8. Eitel I, Desch S, Sareban M, Fuernau G, Gutberlet M, Schuler G, et al. Prognostic significance and magnetic resonance image findings in aborted myocardial infarction after primary angioplasty. Am Heart J. 2009;158:806-13.
9. Patel MR, Werterhout CM, Granger CB, Brener SJ, Fu Y, Siha H, et al. Aborted myocardial infarction after primary percutaneous coronary intervention: magnetic resonance imaging insights from the Assessment of Pexelizumab in Acute Myocardial Infarction (APEX-AMI) Trial. Am Heart J. 2013;165:226-33.
10. Luepker RV, Raczynski JM, Osganian S, Goldberg RJ, Finnegan JR Jr, Hedges JR, et al. Effect of a community intervention on patient delay and emergency medical service use in acute coronary heart disease: The Rapid Early Action for Coronary Treatment (REACT) Trial. JAMA 2000;284:60–7.
11. Steg G, James SK, Atar D, Badano LP, Blömstrom-Lundqvist C, Borger MA, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2012; Oct;33(20):2569-619.
12. Terkelsen CJ, Sorensen JT, Maeng M, Jensen LO, Tilsted HH, Trautner S, et al. System delay and mortality among patients with STEMI treated with primary percutaneous coronary intervention. JAMA. 2010;304:763–71.
13. Pinto DS, Kirtane AJ, Nallamothu BK, Murphy SA, Cohen DJ, Laham RJ, et al. Hospital delays in reperfusion for ST-elevation myocardial infarction: implications when selecting a reperfusion strategy. Circulation. 2006;114:2019-25.
14. O’Gara PT, Kushner FG, Ascheim DA, Kushner FG, Ascheim DD, Casey DE Jr, Chung MK, de Lemos JA, Ettinger SM, et al. 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction. Circulation. 2013;127(4):e362-e425.
15. Piegas LS, Timerman A, Feitosa GS, Nicolau JC, Mattos LAP, An-drade MD, et al. V Diretriz da Sociedade Brasileira de Cardiologia sobre Tratamento do Infarto Agudo do Miocárdio Com Supra-desnível do Segmento St. Arq Bras Cardiol. 2015; 105(2):1-105.
16. Gershlick AH, Westerhout CM, Armstrong PW,, Huber K, Halvorsen S, Steg PG, et al. Impact of a pharmacoinvasive strategy when delays to primary PCI are prolonged. Heart. 2015;101:692–8.
17. Welsh RC, Goldstein P, Carvalho AC. Impact on Clinical Outcomes
of Randomization at Community Hospitals Versus Pre-hospital location in STEMI Patients: Insights from the STREAM Study. Circulation. 2015;132(suppl 3): A13594.
18. Almeida Sousa JM,Barbosa AH, Caixeta A, Moraes PIM, Peternelli DG, Ferreira GM, et al. Fatores preditivos de intervenção coronária percutânea de resgate após estratégia fármaco-invasiva em mulheres. Rev Bras Cardiol Invasiva. 2015;23(1):11-5.
19. Huber K, De Caterina R, Kristensen SD, Verheugt FW, Montalescot G, Maestro LB, et al. Pre-hospital reperfusion therapy: a strategy to improve therapeutic outcome in patients with ST-elevation myocardial infarction. Eur Heart J. 2005;26:2063–74.
20. Kalla K, Christ G, Karnik R, Malzer R, Norman G, Prachar H, et al. Implementation of guidelines improves the standard of care: the Viennese registry on reperfusion strategies in ST-ele-vation myocardial infarction (Vienna STEMI registry). Circulation. 2006;113:2398–405.
21. Henry TD, Sharkey SW, Burke MN, Chavez IJ, Graham KJ, Henry CR, et al. A regional system to provide timely access to percuta-neous coronary intervention for ST-elevation myocardial infarction. Circulation.2007;116:721–8.
22. Le May MR, So DY, Dionne R, Glover CA, Froeschl MP, Wells GA et al. A citywide protocol for primary PCI in ST-segment elevation myocardial infarction. N Engl J Med. 2008;358:231–40.
23. Cesar LAM, Ramos R, Magalhães, Ferreira JM, Mioto BM, Oliveira N, et al.Training non-cardiologists decreases mortality due to ST elevation myocardial infarction: A program from the Socie-ty of Cardiology of Sao Paulo State, Brazil. J Am Coll Cardiol. 2016;67(13_S):625-625.
24. Moraes PI, Peternelli DG, A R. Nunes AR, e al. Pharmaco invasive strategy for ST elevation myocardial infarction is able to signifi-cantly reduce mortality with a low NNT in a very populated city –European Heart Journal poster 4410 – ESC 2015.
25. Jollis JG, Al-Khalidi HR, Monk L, Roettig ML, Garvey JL, Aluko AO, Wilson BH, et al. Expansion of a regional ST-segment-eleva-tion myocardial infarction system to an entire state. Circulation. 2012;126:189-95.
26. Caluza ACV, Barbosa AH, Gonçalves I, Oliveira CA, Matos LN, Zeefried C, et al. Rede de Infarto com Supradesnivelamento de ST: Sistematização em 205 Casos Diminui Eventos Clínicos na Rede Pública. Arq Bras Cardiol. 2012;99(5):1040-8.
27. Moraes E, Barros LP, Rodrigues AE, et al Pre hospital electrocar-diography: prevalence of clinically important ECG findings of a public health system in a developing country. In: 2nd International Conference on Global TeleHealth, Sydney, Australia, November 2012.
28. Andrade MV, Maia AC, Cardoso CS, Alkmim MB, Ribeiro AL.. Cost--benefit of the telecardiolofy service in the state of Minas Gerais: Minas Telecardio Project. Arquivos Brasileiros de Cardiologia [Internet]. 2001 [cited 2012 Aug 5];97(4):307-16. Avaiable from http://www.ncbi.nlm.nih.gov/pubmed/21808852.
29. Oliveira Junior MT, Canesin MF, Marcolino MS, Ribeiro ALP, Carva-lho ACC, Reddy S, et al. Diretriz de Telecardiologia no Cuidado de Pacientes com Síndrome Coronariana Aguda e outras Doenças Cardíacas. Arq. Bras Cardiol.. 2015; 104(5 Suppl.1):1-26.
rev Soc Cardiol estado de São paulo 2016;26(2):86-92

93
revisÃo/review
resUMoO tratamento do infarto agudo do miocárdio com supradesnível do segmento ST
está consolidado no trinômio trombólise química-angioplastia primária-angioplastia de resgate. Dependendo do local de atendimento e da conduta local, essas estratégias funcionam e levam a reduções enormes de mortes e dano no miocárdio. É fundamental que o sistema de saúde se organize para estabelecer a melhor estratégia local para que se obtenha esse enorme benefício de abrir a artéria responsável pelo infarto ocluído, no menor espaço de tempo.
Descritores: Infarto agudo do miocárdio; Doença coronária; Aterosclerose
aBstraCtThe treatment of acute myocardial infarction with ST elevation is consolidated in the trino-
mial chemical thrombolysis – primary angioplasty – rescue angioplasty. Depending on where the procedure is carried out, and the local conduct, these strategies are effective, and enable enormous reductions in mortality and myocardial damage. It is essential for the health system to organize itself, to establish the best local strategy to obtain this enormous benefit of opening the artery responsible for the occluded infarct related artery, in as short a time as possible.
Keywords: Myocardial Infarction; Coronary Diseasne; Atherosclerosis
Luiz Antonio Machado César¹Miguel Antonio Moretti¹
1. Instituto do Coração(InCor) do Hospital das Clínicas da Faculdade de Medicina da USP, São Paulo, SP
Correspondência:Av. Dr. Enéas de Carvalho Aguiar, 44. Cerqueira Cesar, São Paulo, SP. CEP 05403-000. [email protected]
aNÁLise CrítiCa da rePerfUsÃo PreCoCe No iNfarto agUdo CoM sUPradesNíveL de st:
troMBÓLise QUíMiCa e iNterveNÇÃo PerCUtÂNea PriMÁria
aNaLYsis of earLY PerfUsioN iN MYoCardiaL iNfarCtioN witH st eLevatioN: CHeMiCaL tHroMBoLYsis aNd PriMarY PerCUtaNeoUs iNterveNtioN
iNtrodUÇÃoDentro do arsenal terapêutico para o tratamento do infarto
agudo do miocárdio com supradesnivelamento do segmen-to ST (IAMCST) ao eletrocardiograma (ECG), a Intervenção coronária percutânea (ICP) primária é a estratégia de reper-fusão mais importante. Porém, a sua realização dentro dos prazos definidos nas evidências dos estudos é um grande desafio. Por isso, apesar de muitos acharem que os fibrinolí-ticos não têm lugar na era da ICP primária, outros acreditam que os fibrinolíticos são necessários porque a ICP primária não esta disponível para todos os pacientes com IAMCST dentro dos prazos necessárias para uma eficácia plena. O atraso na terapia de reperfusão tem importante impacto no prognóstico do paciente. Dessa forma na ausência da ICP ou na presença de um retardo prolongado para a realização da intervenção, o uso do fibrinolítico pode ser a melhor opção terapêutica.
O atraso para a aplicação da terapia de reperfusão pode ocorrer em qualquer um dos períodos que vão desde o início dos sintomas até a recanalização da artéria, como mostra a Figura 1 que é do SAVICO (Suporte Avançado de Vida na Doença Coronária). Esses períodos são: do início dos sintomas
até o pedido de ajuda; do início dos sintomas até o primeiro contato com o médico e do inicio dos sintomas até a trombólise química ou até a insuflação do balão na ICP. Nesses tempos estão embutidos os tempos da entrada na emergência até o início da infusão do fibrinolítico (tempo porta-agulha) e o tempo da entrada na emergência até a abertura da artéria com o balão (tempo porta-balão). Mesmo com as condições ideais para um rápido diagnóstico inicial, longos atrasos po-dem ocorrer, por exemplo, nas transferências entre serviços e/ou hospitais. E estes atrasos são prejudiciais aos pacientes. Linha do tempo, entre o início dos sintomas e a realização da ICP. Com destaque para os períodos mais suscetíveis aos atrasos. Os atrasos podem ser relacionados aos pacientes e/ou ao sistema de saúde. O atraso relacionado com o paciente pode variar substancialmente.1
A chave para a reperfusão no IAMCST é realizar a terapia o mais rápido possível para todos os doentes que possuem essa indicação. Já a escolha da estratégia depende do tempo do início do infarto e de muitos outros fatores, incluindo as características do paciente, dos recursos locais, e da organi-zação do sistema de saúde regional e nacional.
rev Soc Cardiol estado de São paulo 2016;26(2):93-8

94
figura 1. linha do tempo, entre o início dos sintomas e a realização da iCp. Com destaque para os períodos mais suscetíveis aos atrasos. os atrasos podem ser relacionados aos pacientes e/ou ao sistema de saúde. o atraso relacionado com o paciente pode variar substancialmente.1
a iMPortÂNCia do teMPoDesde 1979,2 já se sabia que a reversibilidade da
isquemia e a redução da extensão da necrose no IAMCST com a terapia de recanalização da artéria culpada são tempo dependentes, quanto mais precoce melhor. Posteriormente, outros estudos que utilizaram o fibrinolítico como terapia de reperfusão reforçaram essa relação. Os achados do GISSI-13 mostraram pouca vantagem da utilização do fibrinolítico após seis horas do início do infarto. Já os estudos EMERAS e LATE4 sugeriram que esta janela poderia ser entendida para até 12 horas. Com base nesses, outros estudos (incluindo os com ICP primária) trouxeram o suporte necessário para que as diretrizes sobre tratamento do IAMCST destacassem e ado-tassem um determinado padrão de tempo para a realização da terapia de reperfusão.5
Não se pode esquecer, que apesar de hipótese da artéria aberta ser melhor do que a da artéria fechada, e da questão tempo também estar intimamente relacionada com o prog-nóstico evolutivo, essa relação tempo-artéria aberta não é tão simples assim, pois existe também uma relação muito grande entre o prognóstico e o fluxo da artéria coronária6 após a terapia de reperfusão, mostrando que quanto melhor o fluxo melhor o prognóstico.
Assim o princípio básico para se obter o melhor resultado da terapia do IAMCST é o de reestabelecer o melhor fluxo possível no menor tempo possível. Como visto anteriormen-te, isso inclui também o tempo de chegada do paciente ao serviço médico. Pois, quanto mais cedo o paciente chega maior é o impacto do tempo para o início do tratamento de reperfusão (Figura 2). Já que um importante determinante da estratégia terapêutica ideal é o denominado tempo de isquemia total, ou seja, a duração da isquemia antes e no momento do primeiro contato médico.7
Olhando pelo aspecto de iniciar a reperfusão o mais pre-
coce possível, porque não antes mesmo do paciente chegar ao hospital. Antes do estabelecimento da ICP primária, alguns estudos já ressaltavam a importância da trombólise pré-hospi-talar e seus ótimos resultados.9,10 Porém, antes dessa proposta terapêutica se destacar como terapia padrão, os estudos já mostravam a ICP primária como a melhor opção terapêutica.11 Uma crítica a essa metanálise foi fato do benefício postulado pela ICP primária limitar-se aos pacientes que receberam a fibrinólise no ambiente hospitalar. Além disso, quando os pa-cientes com choque cardiogênico foram omitidos da análise e a comparação foi feita com apenas ativador do plasminogênio tecidual, ao contrário de todas as drogas fibrinolíticas, tais como uroquinase e estreptoquinase, a proporção de pacientes com eventos adversos cardiovasculares maiores foi similar ao da ICP primária. Apesar destas dúvidas, a ICP primária tornou-se a opção preferida de reperfusão, demonstrando importantes vantagens em relação à reperfusão química, como o estabelecimento de fluxo TIMI 3 em 70-90% dos pacientes, e redução substancial no risco de hemorragia intracraniana. Sendo definitivamente melhor nos pacientes de alto risco, com choque cardiogênico, insuficiência cardíaca congestiva grave ou instabilidade hemodinâmica ou elétrica. Para isso a ICP primária têm que ser realizada por uma equipe especializada e em ambiente hospitalar, impactando diretamente na sua disponibilidade para todos os pacientes com IAMCST.
a iCP e o teMPoO registro nacional americano12 mostra a associação de
uma maior mortalidade intra-hospitalar com o atraso na reali-zação da ICP primária (3% nos casos com tempo porta-balão < 90 min. e 7,4% nos casos com > 150 min.). Já outros estudos,13 mostram que apesar da significativa redução no tempo porta-balão (113 min em 2003 para 76 min em 2008, p < 0,001) e do maior número de pacientes revascularizados
IAM com supra de ST
Transferência < 30min
Sim
ICP disponível
Cineangiocoronariografia
ICP x RM cirúrgica ou tratamento clínico
Reperfusão sem sucesso
Reperfusão com sucesso
Trombólise em 30
Não
Tempo PCM-balão<120min
ICP não disponível no local
Primeiro contato médico
Tempo PCM-balão < 90 min
Estratégia farmacoinvasiva 3-24h
Angloplastia de resgate
rev Soc Cardiol estado de São paulo 2016;26(2):93-8

95com menos de 90 min no mesmo período (28,5% versus 67,2% com p<0,001) a mortalidade intra-hospitalar não sofreu alteração significativa (4,1% versus 3,6%). Algumas críticas aos atrasos são baseadas no fato de que a gravidade de alguns pacientes acaba por atrasar a realização da ICP, além de contribuírem para uma maior taxa de complicações. Mas ao analisarmos esses tempos é importante lembrar ape-sar do tempo porta-balão ser um parâmetro importante, ele não representa o tempo total de isquemia, que como vimos anteriormente tem um importante papel no prognóstico do paciente. Ou seja, encurtar o tempo porta-balão não neces-sariamente pode afetar a mortalidade global, é preciso que os pacientes venham mais precocemente ao hospital.
Outro aspecto importante na relação tempo versus realização da ICP primária, está na disponibilidade desse recurso para os pacientes. Pois não são todos os hospitais e todas as regiões que dispõem de um centro capacitado para a realização da ICP primária. No Reino Unido, por exemplo, a percentagem de doentes que têm acesso a ICP primária pode variar entre 80% e 95%, dependendo da localização geográfica e da disponibilidade de trans-porte. Em outras partes do mundo esse acesso é ainda mais difícil. Na Austrália apenas 40,2% da população tinha acesso a ICP primária14 (definida como população capaz de realizar ICP em < 60 min no hospital de chegada ou em < 120 min se tivesse que ser transferida). Nesse mesmo estudo observaram que a melhora dos serviços em realizar as transferências trouxe apenas um discreto aumento para a ICP primária. Os investigadores sugeri-ram que uma boa alternativa seria estimular a trombólise química pré-hospitalar. Já nos EUA, tempos porta-balão
figura 2. A associação entre o tempo de tratamento, redução da mortalidade, e a extensão do salvamento do miocárdio. o maior benefício obtido com terapia de reperfusão ocorre nas primeiras 2-3 horas após o início dos sintomas (ente pontos d e C). A duração deste período de tempo crítico pode ser modificado por fatores como grau de colaterais para os vasos ocluídos, o consumo de oxi-gênio do miocárdio, tempo de isquemia total e pré-condicionamento isquêmico. o ganho na mortalidade começa a estabilizar após este período. figura adaptada de gersh et al.8
Tempo de Reperfusão e BenefícioModificações na evolução com as
estratégias de tratamento
A-B Sem beneficioA-C BenéficoB-C BenéficoD-B DeletérioD-C Deletério
Tempo dependente: Salvamento miocárdio
Tempo independente: Abrir artéria relacionada ao IAM
Extensão miocardia salvo
Redução da mortalidade %
Tempo do início dos sintomas para terapia de reperfusão,H
AB
C
D
0 4 8 12 16 20 24
100
80
60
40
20
0
Gersh B JAMA 293:980’05
< 90 min são previstos para menos de um terço dos pa-cientes que não precisariam ser transferidos para outro serviço e menos ainda para os pacientes que precisariam ser transferidos para terem acesso a ICP primária.15 Isso significa que a ICP primária pode não ser a melhor opção em algumas partes dos EUA, uma vez que as distâncias necessárias para a transferência são difíceis de superar. No entanto, tanto nos EUA e em outras partes do mundo (por exemplo, Canadá, Rússia, e na Austrália), uma tendência de melhorias consistentes em transporte, comunicação, criação de uma rede de cuidados e treinamento de equipes de paramédicos e conscientização da população para procurar mais cedo a ajuda médica, contribuiu para uma redução nos tempos globais para a ICP primária.16
Muitas vezes o fato do paciente procurar ou ser trans-ferido para um hospital que não tem condições de realizar a ICP, acaba por acrescentar um tempo a mais no intervalo de tempo entre o infarto e a reperfusão (Figura 1). Com relação a esse tempo entre a chegada e a saída desse hospital (porta-in porta-out) Wang e cols17 relatam que 30 min ou menos estava relacionado a menores atrasos na reperfusão e uma menor mortalidade hospitalar.
Portanto, embora a ICP primária seja mais eficaz do que a trombólise química quando realizada dentro das janelas aceitas, o benefício da ICP primária é suscetível a atrasos no tratamento. E quando os tempos propostos não podem ser alcançados, vários estudos9 demonstram que o tempo de isquemia total é essencial, e que tempos mais curtos porta-balão podem ter mais efeito em pacientes que se apresentam precocemente (dentro <3 h de infarto) do que naqueles que apresentam mais tarde. Assim, encurtar o
ANÁLISE CRíTICA DA REPERFUSÃO PRECOCE NO INFARTO AGUDO COM SUPRADESNíVEL DE ST: TROMBÓLISE QUíMICA E INTERVENÇÃO PERCUTÂNEA PRIMÁRIA
rev Soc Cardiol estado de São paulo 2016;26(2):93-8

96
tempo porta-balão é fundamental no contexto da redução do tempo de isquemia total, que inclui o tempo de início dos sintomas para o primeiro contato médico e transferência (porta-in porta-out) (Figura 1).
trombólise química versus iCP primáriaAlguns autores sugerem que não há desvantagens
para a ICP primária precoce quando os resultados são comparados com os da trombólise química e que, para qualquer ponto de tempo entre o início dos sintomas até a terapia de reperfusão, a ICP primária é sempre a estratégia superior, como Boersma e cols18 demonstraram, sendo que mesmo a ICP primária sendo realizada com 55 min de atraso em relação a trombólise química ela foi capaz de reduzir, e de forma significativa, em 37% a mortalidade aos 30 dias. Além disso, mostraram também que quanto menor o atraso para a realização da ICP em relação à trombólise química maior era a redução na taxa de mor-talidade em 30 dias. Os pesquisadores concluíram que a ICP primária foi associada a uma redução significativa de mortalidade em comparação com a trombólise química, independentemente do atraso no tratamento, e, portanto, recomenda-se que, apesar das dificuldades logísticas a abordagem padrão deve ser a ICP primária para todos.
Outros autores ressaltam que a diferença na capacidade de instituir uma terapêutica no tempo adequado é importante em ambas as estratégias de reperfusão. Chakrabarti e cols19 observaram que qualquer benefício de redução da mortali-dade na ICP primária em comparação a trombólise química no local foi anulada quando o tempo de atraso para a ICP primária foi de 120 min ou mais.
Uma ressalva para a plena aceitação da proposta de que a ICP primária é sempre a melhor opção começa a ser questionada a partir do estudo CAPTIM,20 que favoreceu uma estratégia fármaco invasiva. Outra ressalva repousa no fato de que nenhum estudo comparou as opções de reperfusão em diferentes momentos entre si.19,21
trombólise química e estratégia fármaco invasiva
Estudos têm apontado que a otimização, com medidas adjuvantes, da terapia de reperfusão com trombólise química pode ser uma boa opção para igualar os resultados da ICP primária. O estudo GRACIA 122 sugere que a realização da angiografia em até 24 horas depois de uma trombólise química com sinais de sucesso ou que a realização de um ECG 90 minutos após o término do uso do fibrinolítico23 com o pro-pósito de identificar um insucesso na terapia de reperfusão química, e em ambos os casos seguir-se uma angioplastia, se indicada, poderia diminuir as diferenças entre os resultados da ICP primária e a trombólise química. Com base nesses dados o estudo CAPTIM24 testou a terapia de reperfusão química realizada pré-hospitalar e a angioplastia de resgate contra a ICP primária. Ao final de cinco anos, a taxa de mortalidade para os pacientes que receberam a terapia de recanalização com menos de duas horas de infarto foi significativamente menor no grupo trombólise química (5,8% versus 11,1% com p=0,04). Já os pacientes que receberam terapia de reperfu-são com mais de duas horas de infarto tiveram, ao final de cinco anos, taxas semelhantes de mortalidade (14,5% versus
14,4%). Porém a combinação de dois estudos semelhantes mostrou que a redução na taxa de mortalidade de um ano nos pacientes que receberam tratamento precoce (menos de duas do início do infarto) não era significativa a favor da trombólise química em relação à ICP primária. E que nos pacientes que receberam a terapia de reperfusão depois de duas horas do início do infarto tiveram a mesma taxa de mortalidade.25 Estes resultados permitiram somente inferir que a trombólise quími-ca mais angiografia e ICP (se necessário) é um comparador adequado para a ICP primária. No estudo ASSENT-426 a ICP foi realizada independente do resultado da terapia trombolítica em todos os pacientes que receberam fibrinolíticos além da terapia adjuvante antitrombótica neste braço não ter sido a ideal. Essa estratégia chamada de facilitada não demonstrou nenhum benefício, e até certa desvantagem, em relação à ICP primária. Como resultado desses estudos, a estratégia ideal para terapia de reperfusão pode ser trombólise química precoce seguida de transferência para um hospital capaz de realizar uma ICP de resgate no caso da fibrinólise não ser bem sucedida ou somente uma angiografia coronária, entre quatro e 24 horas pós terapia de reperfusão, nos pacientes com sinais de sucesso.
O estudo STREAM27 avaliou uma estratégia fármaco invasiva considerada ideal. Projetado para uma intervenção rápida apenas nos pacientes cuja terapia de trombólise quí-mica (nesse estudo utilizou o tenecteplase – TNK em bolus) tenha falhado (de acordo com os critérios eletrocardiográfi-cos de reperfusão), diferente de outros estudos onde todos pacientes foram submetidos à ICP independentemente do sucesso da terapia de reperfusão química. Os outros pa-cientes foram submetidos a intervenção de seis a 24 horas após a terapia de reperfusão química. Foram randomizados pacientes que chegaram com até três horas do início do infarto e que não conseguiriam receber ICP primária em menos de uma hora. Foi analisado após 30 dias um desfecho composto de morte, choque, reinfarto ou disfunção ventricular com insuficiência cardíaca. A de desfecho primário no grupo trombólise química foi de 12,4% e no grupo ICP primária foi 14,3% com um p=0,21. A ICP de emergência foi necessária em 36% dos pacientes do grupo trombólise química (taxa consistente com os demais estudos que utilizaram estratégia fármaco invasiva). Os demais pacientes do grupo trombólise química realizaram a angiografia em média 17 horas após a terapia. Desses 64% não precisaram de ICP. A hemorragia intracraniana foi significativamente maior no grupo trombólise química (1,0% versus 0,2% com p=0,04). Porém após os primeiros 400 pacientes a dose de fibrinolítico foi reduzida à metade nos pacientes com mais de 75 anos e com isso a taxa de hemorragia intracraniana foi semelhante nos dois grupos (0,5% versus 0,3%).
Os resultados deste estudo confirmam que existe um lugar claro para os fibrinolíticos desde que determinados critérios sejam respeitados. Iniciar, de preferência, ainda no pré-hospitalar para pacientes sem contraindicações (por exemplo, hemorragia recente ou acidente vascular cerebral) e seguido por angiografia coronária oportuna (em até 24 ho-ras) ou ICP de resgate para aqueles sem sinais de sucesso da terapia trombolítica. Ainda, a trombólise química pode ser uma estratégia importante nos pacientes incapazes de receber ICP primária antes da primeira hora da chegada ao
rev Soc Cardiol estado de São paulo 2016;26(2):93-8

97
referÊNCias1. SAVICO (suporte avançado de vida na doença coronária). Es-
tratégias de reperfusão. In Tavares, M et.al. São Paulo: Editora Manole Ltda; 2014. p. 53-62.
2. Reimer KA, Jennings RB. The “wavefront phenomenon” of myo-cardial ischemic cell death. II. Transmural progression of necrosis within the framework of ischemic bed size (myocardium at risk) and collateral flow. Lab Invest. 1979;40(6):633–44.
3. Gruppo Italiano per lo Studio della Streptochinasi nell’Infarto Mio-cardio (GISSI). Effectiveness of intravenous thrombolytic treatment in acute myocardial infarction. Lancet 1986;327(8478):397–402.
4. Langer A, Goodman SG, Topol EJ, Charlesworth A, Skene AM, Wilcox RG, et al. Late assessment of thrombolytic efficacy (LATE) study: prognosis in patients with non-Q wave myocardial infarction. J Am Coll Cardiol. 1996;27(6):1327–32.
5. Piegas LS, Feitosa G, Mattos LA, Nicolau JC, Rossi Neto JM, Timerman A, et al. Diretriz da Sociedade Brasileira de Cardiologia sobre tratamento do infarto agudo do miocárdio com supradesnível do segmento ST. Arq Bras Cardiol. 2009;93(6 Suppl 2):e179-264.
6. Gibson CM, Cannon CP, Piana RN, Breall JA, Sharaf B, Flatley M, et al. Angiographic predictors of reocclusion after thrombolysis: results from the Thrombolysis in Myocardial Infarction (TIMI) 4 trial. J Am Coll Cardiol. 1995;25(3):582-9.
7. Denktas AE, Anderson HV, McCarthy J, Smalling RW. Total ische-mic time: the correct focus of attention for optimal ST-segment elevation myocardial infarction care. JACC Cardiovasc Interv. 2011;4(6):599-604.
8. Gersh BJ, Stone GW, White HD, Holmes DR Jr. Pharmacological facilitation of primary percutaneous coronary intervention for acute myocardial infarction: is the slope of the curve the shape of the future? JAMA. 2005;293(8):979–86.
9. Gershlick AH, Banning AP, Myat A, Verheugt FW, Gersh BJ. Re-perfusion therapy for STEMI: is there still a role for thrombolysis in the era of primary percutaneous coronary intervention? Lancet. 2013;382(9892):624–32.
10. Morrison LJ, Verbeek PR, McDonald AC, Sawadsky BV, Cook DJ. Mortality and prehospital thrombolysis for acute myocardial infarction: a meta-analysis. JAMA. 2000;283(20):2686–92.
11. Keeley EC, Boura JA, Grines CL. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarc-
tion: a quantitative review of 23 randomised trials. Lancet. 2003;361(9351):13–20.
12. McNamara RL, Wang Y, Herrin J, Curtis JP, Bradley EH, Magid DJ, et al. Effect of door-to-balloon time on mortality in patients with ST-segment elevation myocardial infarction. J Am Coll Cardiol. 2006;47(11):2180–6.
13. Flynn A, Moscucci M, Share D, Smith D, LaLonde T, Changezi H, et al. Trends in door-to-balloon time and mortality in patients with ST-elevation myocardial infarction undergoing primary percutaneous coronary intervention. Arch Intern Med. 2010;170(20):1842–9.
14. Ranasinghe I, Turnbull F, Tonkin A, Clark RA, Coffee N, Brieger D. Comparative effectiveness of population interventions to im-prove access to reperfusion for ST-segment-elevation myocardial infarction in Australia. Circ Cardiovasc Qual Outcomes. 2012; 5(4):429–36.
15. McNamara RL, Herrin J, Bradley EH, Portnay EL, Curtis JP, Wang Y, et al. Hospital improvement in time to reperfusion in patients with acute myocardial infarction, 1999 to 2002. J Am Coll Cardiol. 2006;47(1):45–51.
16. Miedema MD, Newell MC, Duval S, Garberich RF, Handran CB, Larson DM, et al. Causes of delay and associated mortality in patients transferred with ST-segment elevation myocardial infarc-tion. Circulation. 2011;124(15):1636–44.
17. Wang TY, Nallamothu BK, Krumholz HM, Li S, Roe MT, Jollis JG, et al. Association of door-in to door-out time with reperfusion delays and outcomes among patients transferred for primary percutaneous coronary intervention. JAMA. 2011;305(24):2540–7.
18. Boersma E. Primary Coronary Angioplasty vs Thrombolysis Group. Does time matter? A pooled analysis of randomized clinical trials comparing primary percutaneous coronary intervention and in--hospital fibrinolysis in acute myocardial infarction patients. Eur Heart J. 2006;27(7):779–88.
19. Chakrabarti AK, Gibson CM, Pinto DS. Optimal selection of STEMI treatment strategies in the current era: benefit of transferring STEMI patients for PCI compared with administration of onsite fibrinolytic therapy. Curr Opin Cardiol. 2012;27(6):651–4.
20. Bonnefoy E, Lapostolle F, Leizorovicz A, Steg G, McFadden EP, Dubien PY, et al. Primary angioplasty versus prehospital fibrinoly-sis in acute myocardial infarction: a randomised study. Lancet.
hospital; esta abordagem superaria as desvantagens asso-ciadas à ICP primária realizada com atraso. Curiosamente, os dados sobre o fluxo coronariano dos pacientes do estudo STREAM mostrou que mais de 70% dos doentes tratados com trombólise química tinham fluxo TIMI 2 ou 3 no momento da angiografia, em comparação com 20% daqueles alocados para a ICP primária. Embora o fluxo TIMI em ambos os grupos fossem iguais após o tratamento, pode-se dizer que significa-tivamente mais pacientes no grupo fibrinolítico estavam com a artéria aberta mais cedo, o que poderia proporcionar uma melhor recuperação do miocárdio no longo prazo. A análise de seguimento de um ano do estudo STREAM28 demonstrou uma taxa de mortalidade semelhante entre os dois grupos.
CoNsideraÇÕes fiNaisA melhor opção para a terapia de reperfusão no IAMCST
é a ICP primária. Mas o atraso na realização da ICP reduz essa vantagem sobre a terapia trombolítica. Quando esse atraso é maior que 60 minutos, as vantagens se igualam. Assim uma estratégia de trombólise química pré-hospitalar seguida de uma ICP planejada (para os pacientes hemodi-namicamente estáveis) ou a ICP de resgate demonstraram
resultados equivalentes ou melhores que a ICP primária para aqueles pacientes que se apresentam precocemente ao ser-viço de emergência. Sobretudo naqueles pacientes onde a ICP primária não pode ser realizada antes de 120 minutos a partir do primeiro contato médico, ou se a trombólise química puder ser realizada 60 minutos antes da ICP.
A trombólise química ainda parece ter um papel importante a desempenhar no tratamento de pacientes com IAMCST, es-pecialmente naqueles que não conseguem chegar a um centro capaz de realizar uma ICP eficaz rapidamente. No entanto, uma estratégia de tratamento baseado em terapia fármaco invasiva depende da formação adequada de uma equipe pronta para administrar trombolíticos pré-hospitalar e da eficiência da rede de atendimento, tal qual estão determinadas e sugeridas nas diretrizes americana29 e brasileira30 sobre o tema.
CoNfLitos de iNteresseOs autores declaram não possuir conflitos de inte-
resse na realização deste trabalho.
ANÁLISE CRíTICA DA REPERFUSÃO PRECOCE NO INFARTO AGUDO COM SUPRADESNíVEL DE ST: TROMBÓLISE QUíMICA E INTERVENÇÃO PERCUTÂNEA PRIMÁRIA
rev Soc Cardiol estado de São paulo 2016;26(2):93-8

98
2002;360(9336):825–9. 21. Gersh BJ, Antman EM. Selection of the optimal reperfusion stra-
tegy for STEMI: does time matter? Eur Heart J. 2006;27(7):761–3. 22. Fernandez-Avilés F, Alonso JJ, Castro-Beiras A, Vázquez N,
Blanco J, Alonso-Briales J, et al. Routine invasive strategy within 24 hours of thrombolysis versus ischaemia-guided conserva-tive approach for acute myocardial infarction with ST-segment elevation (GRACIA-1): a randomised controlled trial. Lancet. 2004;364(9439):1045–53.
23. Gershlick AH, Stephens-Lloyd A, Hughes S, Abrams KR, Ste-vens SE, Uren NG, et al. Rescue angioplasty after failed throm-bolytic therapy for acute myocardial infarction. N Engl J Med. 2005;353(26):2758–68.
24. Bonnefoy E, Steg PG, Boutitie F, Dubien PY, Lapostolle F, Roncalli J, et al. Comparison of primary angioplasty and pre-hospital fibrinolysis in acute myocardial infarction (CAPTIM) trial: a 5-year follow-up. Eur Heart J. 2009;30(13):1598–606.
25. Westerhout CM, Bonnefoy E, Welsh RC, Steg PG, Boutitie F, Armstrong PW. The influence of time from symptom onset and reperfusion strategy on 1-year survival in ST-elevation myocardial infarction: a pooled analysis of an early fi brinolytic strategy versus primary percutaneous coronary intervention from CAPTIM and WEST. Am Heart J. 2011;161(2):283–90.
26. Assessment of the Safety and Efficacy of a New Treatment Strategy with Percutaneous Coronary Intervention (ASSENT-4 PCI) inves-tigators. Primary versus tenecteplase-facilitated percutaneous coronary intervention in patients with ST-segment elevation acute myocardial infarction (ASSENT-4 PCI): randomised trial. Lancet. 2006;367(9510):569-78.
27. Armstrong PW, Gershlick AH, Goldstein P, Wilcox R, Danays T, Lambert Y, et al. Fibrinolysis or primary PCI in ST-segment eleva-tion myocardial infarction. N Engl J Med. 2013;368:(15)1379–87.
28. Sinnaeve PR, Armstrong PW, Gershlick AH, Goldstein P, Wilcox R, Lambert Y, et al. ST–segment-elevation myocardial infarction patients randomized to a pharmaco-invasive strategy or primary percutaneous coronary intervention: Strategic Reperfusion Early After Myocardial Infarction (STREAM) 1-year mortality follow-up. Circulation. 2014;130(14):1139-45.
29. O’Connor RE. Part 9: Acute Coronary Syndromes: 2015 Ameri-can Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 2015;132(16 Suppl 1):S146-76.
30. Piegas LS, Timerman A, Feitosa GS, Nicolau JC, Mattos LAP, An-drade MD, et al. V Diretriz da Sociedade Brasileira de Cardiologia sobre Tratamento do Infarto Agudo do Miocárdio com Supra-desnível do Segmento ST. Arq Bras Cardiol. 2015;105(2):1-105.
rev Soc Cardiol estado de São paulo 2016;26(2):93-8

99
resUMoAs doenças cardiovasculares representam uma das principais causas de morbimorta-
lidade no mundo ocidental. Neste cenário, as síndromes coronarianas agudas respondem pela grande maioria dos eventos fatais. Em pacientes acometidos por síndrome coronariana sem supra-desnivelamento do segmento ST a estratificação invasiva (cinecoronariografia) ocupa papel central na tomada de conduta terapêutica, tendo como méritos: 1) determinar a presença de doença arterial coronária obstrutiva, confirmando o diagnóstico clínico e laboratorial de SCA; 2) identificar a lesão “culpada” ou responsável pelo quadro clínico apresentado; 3) fornecer informações prognósticas a respeito da ocorrência de eventos cardiovasculares como óbito e infarto, intimamente relacionados à severidade e extensão da doença coronária, à função ventricular esquerda e à presença de condições asso-ciadas (como valvopatias); 4) e estabelecer a necessidade e o tipo de revascularização miocárdica a ser empregado, seja percutânea ou cirúrgica. O momento ideal de realizar a estratificação invasiva varia de acordo com a estratificação de risco do paciente avaliado, devendo em geral ser realizada em até 72h. Estratégias muito precoces (<2h) ou precoces (<24h) são plausíveis em cenários de mais alto risco clínico.
Descritores: Síndrome coronária aguda sem supra de ST; Estratégia invasiva; Estratégia invasiva precoce; Estratégia invasiva muito precoce; Intervenção coronária percutânea; Via de acesso radial.
aBstraCt Cardiovascular diseases represent one of the main causes of morbidity and mortality in
the western world. In this scenario, acute coronary syndromes represent the vast majority of fatal events. In patients affected by coronary syndrome without ST segment elevation, the invasive strategy (cinecoronariography) plays a central role in the choice of therapeutic conduct, as it has several merits: 1) determining the presence of obstructive coronary arterial disease, confirming the clinical and laboratory diagnosis of ACS; 2) identifying the lesion responsible for the clinical symptoms presented; 3) providing prognostic informa-tion on the occurrence of cardiovascular events with such as death or stroke, which are closely related to the severity and extent of the coronary disease, the left ventricle function, and the presence of associated conditions (such as valve disease); and 4) establishing the need for and type of myocardial revascularization to be used, whether percutaneous or surgical. The ideal moment to conduct invasive stratification varies, depending on the risk level of the patient being evaluated, but in general, it should be performed within 72 hours. Very early strategies (< 2 hours) or early strategies (< 24 hours) are plausible in scenarios of greater clinical risk.
Keywords: Acute coronary syndrome without ST level elevation; Invasive strategy; early invasive strategy; very early invasive strategy; Percutaneous coronary intervention; Radial access route.
Dimytri A. Siqueira1,2
J. Ribamar Costa Jr.1,2 Alexandre Abizaid1,2,3
1. Instituto Dante Pazzanese de Cardiologia, São Paulo - Brasil2. Hospital do Coração (HCor) – Associação do Sanatório Sírio, São Paulo - Brasil3. Hospital Israelita Albert Einstein, São Paulo - Brasil
Correspondência:Dr. Alexandre AbizaidAv. Dr. Dante Pazzanese, 500, São Paulo, SPCEP: [email protected]
estratÉgia iNvasiva Nas síNdroMes CoroNariaNas agUdas seM sUPradesNiveLaMeNto do segMeNto st
iNvasive strategY iN aCUte CoroNarY sYNdroMes witHoUt st segMeNt eLevatioN
revisÃo/review
iNtrodUÇÃoAs doenças cardiovasculares (DCV) representam uma
das principais causas de morbimortalidade no mundo oci-dental.1 Estima-se que em nosso país, a DCV responda por
20% de todos os óbitos em indivíduos acima dos 30 anos, sendo a principal causa de mortalidade nessas faixas etárias, superando as neoplasias, doenças do trato respiratório e as causas externas (violência urbana, trânsito, etc.).
rev Soc Cardiol estado de São paulo 2016;26(2):99-104

100
Neste cenário, as síndromes coronarianas agudas (SCA) respondem pela grande maioria dos eventos fatais. As SCA compreendem três manifestações distintas: angina instável, infarto agudo do miocárdio (IAM) sem elevação do segmento ST e o IAM com elevação do segmento ST. Em comum, estas três apresentações clínicas possuem o mesmo substrato, a placa aterosclerótica dita “vulnerável”, que se rompe parcial ou total-mente, expondo o endotélio aos elementos trombogênicos da corrente sanguínea, iniciando assim a “cascata” da trombose.
A despeito de sua elevada letalidade, nos últimos anos tem se observado uma tendência global à redução da mor-talidade por eventos fatais na SCA. Em grande parte, isto se deve ao importante avanço no manejo fármaco-invasivo, com introdução de novos fármacos antitrombóticos e antia-gregantes plaquetários e a adoção mais ampla da estratégia invasiva precoce, com realização de cinecoronariografia seguida de intervenção coronária percutânea (ICP) nas primeiras horas após início dos sintomas da SCA.
A coronariografia é, de longa data, o método de imagem de referência para a avaliação da árvore coronária, ocupando destacado papel neste cenário. Sua indicação tem como méritos: 1) determinar a presença de doença arterial coronária obstrutiva, confirmando o diagnóstico clínico e laboratorial de SCA; 2) identificar a lesão “culpada” ou responsável pelo quadro clínico apresentado; 3) fornecer informações prognós-ticas a respeito da ocorrência de eventos cardiovasculares como óbito e infarto, intimamente relacionados à severidade e extensão da doença coronária, à função ventricular esquerda e à presença de condições associadas (como valvopatias); 4) e estabelecer a necessidade e o tipo de revascularização miocárdica a ser empregado, seja percutânea ou cirúrgica.
Em pacientes acometidos por síndrome coronariana sem supra-desnivelamento do segmento ST (SCASSST = angina instável e IAM sem supra-desnivelamento do segmento), comumente se observa ao menos uma lesão “culpada” à coronariografia, caracterizada angiograficamente por significativo porcentual de obstrução, reduzido diâmetro luminal mínimo, presença de bordas irregulares, excentri-cidade, sinais sugestivos de ulcerações e/ou pela presença de imagens de falha de enchimento indicativas de trombo intra-luminal.2 A observação de fluxo coronário reduzido também é outro importante aspecto angiográfico valorizado na identificação da lesão culpada. O achado de múltiplas lesões “instáveis” não é raro, e reflete a natureza sistêmica da doença aterosclerótica.3 Em geral, a coronariografia revela a presença de artérias coronárias normais ou sem lesões obstrutivas em 10-20% dos casos, de doença multiarterial (mais de um vaso acometido) em 40-50% dos pacientes e de lesões de tronco de coronária esquerda em 5 a 10%.4-6
Duas estratégias referentes à indicação da coronario-grafia podem ser adotadas em pacientes com SCASSST. A primeira, classicamente denominada estratégia invasiva, consiste na indicação rotineira da angiografia coronária com o intuito planejado de revascularização miocárdica percutânea ou cirúrgica, caso esta esteja indicada. A segunda estraté-gia, por sua vez, é dita conservadora – embora seja melhor compreendida como invasiva seletiva – e fundamenta-se, primeiramente, no acompanhamento clínico evolutivo dos pacientes e na indicação de testes funcionais para a detec-ção de isquemia miocárdica residual; a coronariografia é
reservada aos pacientes que experimentam recorrência de sintomas - a despeito do tratamento farmacológico - ou que apresentam isquemia residual em métodos não-invasivos (teste ergométrico, ecocardiograma de estresse, cintilografia miocárdica etc.). Nesta revisão, abordaremos as principais indicações e vantagens da estratégia invasiva, bem como o melhor momento para que esta seja implementada em pacientes acometidos por SCASSST.
BeNefíCios da estratÉgia iNvasiva freNte À estratÉgia CoNservadora
Nas últimas duas décadas, diversos estudos compararam a estratégia invasiva à estratégia conservadora (ou invasiva seletiva).7-12 Em meta-análise de Mehta e cols. (7 estudos, 9212 pacientes), a implementação de estratégia invasiva resultou em redução de 18% no risco relativo de infarto não--fatal e óbito (14,4% vs 12,2% [OR], 0,82; 95% IC 0,72-0,93;
p = 0,001).13 Bavry e cols., em meta-análise com 7 estudos e 8375 pacientes, revelaram que a estratégia invasiva se associou à redução de 25% na ocorrência de óbito (4,9% vs 6,5%, RR=0,75 IC 95% 0,63-0,90, p=0,001), de 17% nas taxas de infarto não-fatal (7,6% vs 9,1%, RR 0,83 IC 95% 0,72-0,96) e de 31% na re-hospitalização por angina instável (RR 0,69 IC 95% 0,65-0,74).14 Em meta-análise mais recente (O’Donoughe e cols., 8 estudos, n=10150) demonstrou-se, por sua vez, que a estratégia invasiva resultou em menores taxas de óbito, infarto não-fatal e de nova hospitalização por angina após um ano (21,1 vs 25,9%, OR 0,78; 95% CI 0,61–0,98), sendo tais benefícios restritos a pacientes com elevação de marcadores de necrose miocárdica.15 Com segmento de mais longo prazo, Fox e cols (3 estudos, 5467 pacientes) revelaram ainda que pacientes submetidos à estratégia invasiva apresentaram menor ocorrência de óbito ou infarto após 5 anos (14,7% vs 17,9%, RR=0,81; IC 95% 0,71-0,93, p=0,002), sendo a redução de risco absoluto mais pronunciada conforme a gravidade de cada paciente (2% nos de baixo risco, 3,8% naqueles com risco intermediário e 11,1% nos indivíduos de alto risco).16
Assim, o somatório das evidências disponíveis (provenien-tes de estudos randomizados e 4 meta-análises) suporta a opção pela estratégia invasiva, pois tal abordagem associa-se à significativa redução das taxas de óbito, infarto e isquemia recorrente, quando comparada à estratégia conservadora.
iNdiCaÇÕes da estratÉgia iNvasivaDiversos aspectos devem ser analisados para a apro-
priada tomada de decisão sobre o momento ideal de in-dicar avaliação invasiva na SCASSST. Em primeiro lugar, o diagnóstico clínico de SCASSST deve ser firmado, ou seja, os sintomas apresentados por determinado paciente devem ser bem caracterizados e compatíveis com quadro de isquemia miocárdica. Em estudos clínicos, até 20% dos pacientes incluídos como portadores de SCASSST apre-sentam coronárias normais ou com doença insignificante à coronariografia.6 Assim, a estratégia conservadora pode ser a opção inicial em pacientes com sintomas não-sugestivos de isquemia ou com dor atípica – desde que o eletrocar-diograma não revele alterações sugestivas de isquemia e não haja elevação de marcadores de necrose miocárdica.
rev Soc Cardiol estado de São paulo 2016;26(2):99-104

101
Fatores de risco como história familiar para doença coro-nária, tabagismo e diabetes mellitus são de grande valor prognóstico. Pacientes diabéticos, em geral, beneficiam-se da estratégia invasiva, com redução de desfechos combi-nados (óbito, infarto e recorrência de angina), bem como de infarto não-fatal (RR: 0,71; 95% CI: 0,55 a 0,92).
A estimativa de risco de eventos cardíacos pode ser embasada em modelos de predição de eventos, que auxi-liam na decisão sobre o tipo de estratégia a ser instituído. Diversos escores prognósticos foram validados em gran-des populações e são aplicados para a identificação de pacientes que requerem a estratégia invasiva. Dentre estes, destacam-se os escores TIMI17 (Thrombolysis in Myocardial Infarction) e GRACE18 (Global Registry of Acute Coronary Events), acurados na predição dos eventos como óbito, infarto e angina recorrente. No escore de risco TIMI, o pa-ciente é categorizado como de baixo risco (escore de 0 a 2), de risco intermediário (escore de 3 ou 4) ou de alto risco (escore de 5 a 7). No escore de risco GRACE, por sua vez, a soma de pontos < 108 categoriza o paciente como de baixo risco para ocorrência de óbito hospitalar (incidência <1%); entre 109 e 140 o paciente é classificado como de risco intermediário; quando a soma é > 140, o paciente é avaliado como de alto risco, com mortalidade estimada superior a 3%.18
estratégia invasiva precoce ou muito precoceA decisão sobre o melhor momento para se implementar
a estratégia invasiva deve ser sempre tomada individual-mente, de acordo com o risco particular de cada paciente.
Os potenciais benefícios da execução da coronariografia e da ICP muito precoces (realizadas nas primeiras horas após a admissão) estão relacionados à prevenção de eventos ad-versos de natureza isquêmica, como a evolução para infarto com supra ST, disfunção ventricular esquerda, arritmias e óbito; estes eventos são determinados pela oclusão evolutiva da artéria culpada pela SCASSST ou por isquemia miocárdica persistente e de grande extensão, e são passíveis de ocor-rência quando se posterga a coronariografia.
Por sua vez, a implementação da estratégia invasiva após um período inicial de “passivação da placa” com fármacos antitrombóticos e antiplaquetários pode resultar em menores índices de complicações peri-procedimento, como a emboliza-ção distal de conteúdo necrótico da placa, distúrbios de fluxo, trombose de stent e infarto do miocárdio após a intervenção.
Para fins didáticos, três tipos de estratégia invasiva podem ser diferenciados: I) a estratégia invasiva denomi-nada imediata ou muito precoce (implementada em menos de 2 horas da admissão); II) a estratégia invasiva precoce (indicada em menos de 24 h da admissão); e, III) a estra-tégia invasiva propriamente dita (na qual a coronariografia é realizada em menos de 72 h da internação).
estratégia invasiva muito precoce (< 2 h)Os pacientes com SCASSST e de muito alto risco são
pouco representados na maioria dos estudos randomizados publicados. Dentre estes indivíduos, incluem-se aqueles com choque cardiogênico, arritmias ventriculares comple-xas, edema agudo de pulmão, insuficiência mitral aguda e sintomas persistentes e refratários ao tratamento farmacoló-
gico instituído (Tabela 1). Por apresentarem mau prognóstico a curto prazo, recomenda-se - de forma consensual4-6 - que tais pacientes sejam submetidos à estratégia invasiva muito precoce, semelhante à implementada nas situações de infarto com supra-desnivelamento de segmento ST. Nestes casos, o objetivo principal deve ser a revascularização imediata do vaso culpado. Em hospitais que não dispõem de serviço de cardiologia intervencionista, deve-se buscar a transferência para centro equipado e habilitado.
Alto grau de suspeição é aconselhado em indivíduos com fatores de risco e dor típica e prolongada, em repou-so: é notório o conhecimento de que oclusões da artéria circunflexa comumente cursam com pouca expressão eletro-cardiográfica. A análise criteriosa do eletrocardiograma, prin-cipalmente em derivações adicionais (V7 e V8) é imperiosa.
estratégia invasiva precoce (< 24 h)As evidências a respeito das vantagens da estratégia
invasiva precoce são provenientes de estudos randomizados e meta-análises.
No estudo ISAR-COOL,19 410 pacientes com SCASSST e risco intermediário a alto e tratados com a associação de antiplaquetários (aspirina, clopidogrel e inibidores de glicoproteína IIbIIIa), foram selecionados para estratégia invasiva dita precoce ou invasiva tardia (média de tempo até a coronariografia de 2,4 vs 86 horas, respectivamente). Neste estudo, a intervenção precoce esteve associada à diminuição significativa de óbito ou IAM aos 30 dias (5.9% vs 11.6%, p = 0,04), sendo tal benefício associado à prevenção de eventos prévios ao cateterismo.
O estudo ABOARD,20 por sua vez, selecionou 352 pacientes com SCASSST e escore de risco TIMI > 3 para coronariografia imediata (média de 70 minutos) ou entre 8 e 60 horas após a randomização (média de 21 horas). O desfecho primá-rio selecionado foi o valor máximo observado de troponina I durante a hospitalização, e não diferiu entre os 2 grupos
tabela 1- Critérios valorizados para a estratificação de risco em pacientes com SCASSSt (adaptada de roffim e cols6).
Muito alto risco – estratégia invasiva muito precoce (< 2h)- instabilidade hemodinâmica, choque cardiogênico- instabilidade elétrica com taquiarritmia ventricular sustentada
ou fibrilação ventricular- Angina refratária a despeito de tratamento farmacológico máximo- insuficiência mitral aguda- edema agudo de pulmãoAlto risco – estratégia invasiva precoce (< 24 h)- escore de risco alto (grACe > 140)- elevação de marcadores de necrose miocárdica- Alterações dinâmicas de segmento StRisco intermediário – estratégia invasiva (24-72 h)- escore timi > 2, grACe 109-140- presença de diabetes ou insuficiência renal (clearance de cre-
atina < 60 ml/min)- disfunção ventricular esquerda (fe < 40%)- iCp ou CrVm préviasBaixo risco - estratégia conservadora- escores de risco baixos (timi 0-1, grACe <109)- dúvidas quanto à natureza dos sintomas
FE = fração de ejeção; ICP = intervenção coronária percutânea; CRVM = cirurgia de revascularização miocárdica.
ESTRATÉGIA INVASIVA NAS SíNDROMES CORONARIANAS AGUDAS SEM SUPRADESNIVELAMENTO DO SEGMENTO ST
rev Soc Cardiol estado de São paulo 2016;26(2):99-104

102
(2,1 [0,3-7,1] ng/mL vs 1,7 [0,3-7,2] ng/mL na estratégia ime-diata e não-imediata, respectivamente p = 0,70). Não foram notadas diferenças em relação à incidência de eventos clínicos.
No estudo TIMACS,21 3031 pacientes com SCASSST fo-ram encaminhados à coronariografia nas primeiras 24 horas (média de 14 h) ou após 36 horas (média de 50 h). Após 6 meses, os desfechos primários óbito, infarto e AVC ocorreram em 9,7% dos pacientes randomizados para coronariografia precoce e em 11,4% daqueles submetidos a coronariogra-fia mais tardia (HR 0,85; IC 95%: 0,68 a 1,06, p=0,15). O composto de óbito, infarto e isquemia refratária – desfechos secundários - foi significativamente menos frequente no grupo submetido a coronariografia precoce (9,6% vs 13,1%, HR 0,72 IC 95%: 0,58 a 0,89, p=0,002). Em análise pré-especificada, pacientes com escore de risco GRACE > 140 beneficiaram--se de coronariografia e intervenção precoces, com redução significativa dos desfechos primários combinados óbito, infarto e AVC (HR 0,65; IC 95% 0,48 a 0,88, p=0,01), quando comparados aos de risco ≤ 140. A adoção de estratégia invasiva precoce não esteve associada à redução de san-gramentos maiores (3,1% vs 3,5%).
Em meta-análise com 4 estudos randomizados e 4013 pacientes, não foi observada diferença significativa nas taxas de óbito (RR 0,85 IC 95%: 0,64-1,11) e infarto (RR 0,94 IC 95%: 0,61-1,45) em pacientes submetidos à estratégia invasiva precoce (1,16 a 14 horas após a admissão) ou prorrogada (20,8-86 horas). Entretanto, a implementação de estratégia precoce esteve, associada à redução de 41% na taxa de angina recorrente (RR 0,59, IC 95%: 0,38-0,92, p=0,02) e no tempo de hospitalização (em 28%, p < 0.001).22
Em revisão sistemática com maior número de estudos e pacientes incluídos (7 estudos randomizados com 5370 indivíduos, 4 estudos observacionais com 77499 pacientes), Navarese e cols. demonstraram que, embora não esteja re-lacionada à redução de infarto e óbito, a estratégia invasiva precoce (<24 h) resulta em menor incidência de angina refratária (3,8% vs. 7,3%, p=0,008).23
Conforme exposto, as evidências existentes apontam que a implementação de estratégia invasiva precoce é segura, e reduz a ocorrência de isquemia refratária e do tempo de internação, e pode ser considerada em pacientes de maior risco (Tabela 1). Em indivíduos de risco interme-diário e proposta de estratégia invasiva, por sua vez, a coronariografia deve ocorrer idealmente em menos de 72 horas da admissão. Tal recomendação se aplica também a pacientes com disfunção renal crônica (mesmo que preen-cham um ou dois critérios de maior risco): neste cenário, é prudente postergar a coronariografia para que as medidas que previnem a ocorrência de nefropatia induzida por con-traste (hidratação, suspensão de fármacos nefrotóxicos, metformina) possam ser implementadas.
iNdiCaÇÕes e asPeCtos tÉCNiCos da iNterveNÇÃo CoroNÁria PerCUtÂNea eM sCassst
Após a realização da coronariografia, a decisão sobre a necessidade e o tipo de revascularização a ser indicada – seja percutânea ou cirúrgica – é embasada pela esti-mativa de riscos de eventos cardíacos adversos a curto
e longo prazo, a gravidade dos sintomas, a presença de comorbidades (diabetes, disfunção renal, doença pulmonar obstrutiva crônica) e a gravidade anatômica e funcional da doença arterial coronária.
Estudos apontam que apenas 10% dos indivíduos com SCASSST são submetidos à cirurgia de revascularização miocárdica, sendo a ICP a forma predominante de tratamento nesta população.6 Um importante aspecto no processo de decisão diz respeito à possibilidade de se obter revasculari-zação completa com uma ou outra abordagem: sabe-se que a revascularização incompleta afeta sobremaneira o prognós-tico de indivíduos multiarteriais.24,25 Na ausência de estudos randomizados e específicos entre cirurgia de revascularização miocárdica e intervenção coronária percutânea em SCASST, os mesmos critérios utilizados na escolha da modalidade de revascularização em pacientes multivasculares estáveis devem ser aplicados aos indivíduos com síndromes instáveis.
Em pacientes com SCASSST, a ICP é usualmente reali-zada no mesmo procedimento, sucedendo a coronariografia diagnóstica (ICP ad hoc). O alvo primário da ICP deve ser a lesão “culpada”, reconhecida pelos critérios angiográficos já citados, pelas alterações eletrocardiográficas apresentadas ou pelos achados da ventriculografia esquerda. A ICP de outras lesões coronárias porventura identificadas pode ser executada no procedimento índice ou postergada, conforme a situação clínica do paciente, a complexidade da doença coronária, o volume de contraste utilizado e preferência do cardiologista. O emprego de stents farmacológicos de última geração em SCASSST é seguro, e associa-se à redução de complicações tardias, sobretudo reestenose.
Nas situações de SCASSST, a prescrição de fármacos antitrombóticos e antiplaquetários potentes previne a ocor-rência de eventos isquêmicos, porém pode vir acompa-nhada de complicações hemorrágicas. Neste contexto, as complicações relacionadas à punção femoral (hematomas, pseudoaneurismas, fístulas arterio-venosas e hematomas retroperitoneais) são responsáveis por significativa parcela dos eventos hemorrágicos ocorridos após a ICP, e de fato constituem as principais complicações não-cardíacas obser-vadas nesta população.26,27 Dados relacionados ao procedi-mento, como a utilização de introdutores arteriais de maior diâmetro e o uso concomitante de inibidores de glicoproteína IIbIIIa são preditores de sangramento intra-hospitalar após intervenção pela via femoral. A utilização de dispositivos de reparo vascular permite a remoção imediata do introdutor, porém as evidências mais atuais – provenientes de meta--análises de estudos randomizados - não revelam redução nas taxas de hemorragias e complicações vasculares quando tais dispositivos são comparados à compressão manual.28,29
Dentre as diferentes recomendações para a prevenção de sangramentos relacionados à ICP, a utilização da via transra-dial ocupa destacada importância. Evidências acumuladas de estudos randomizados30,31 e meta-análises32,33 demonstram que a ICP pela via radial se associa à significativa redução de complicações hemorrágicas e vasculares em indivíduos com síndromes coronárias agudas (SCA), podendo ser adotada com iguais taxas de sucesso em relação à via femoral, desde que executada por operadores experientes.34
Em ensaio randomizado, multicêntrico e comparativo entre as vias de acesso (RIVAL - Radial Versus Femoral Access
rev Soc Cardiol estado de São paulo 2016;26(2):99-104

103
for Coronary Intervention, n=7021)30 – que incluiu parcela de pacientes com SCASSST —, a ICP pela via radial esteve associada à redução significativa nas taxas de sangramentos maiores (1,9 vs 4,5%, p<0,0001) e de complicações vascula-res (1,4 vs 3,7%, p<0.0001). Ademais, pacientes tratados em centros definidos arbitrariamente como de grande volume e experiência com a via radial (mais de 138 casos/ano) apresen-taram menor incidência do desfecho primário composto por óbito, infarto, acidente vascular encefálico e sangramentos maiores não-relacionados à cirurgia de revascularização com esta técnica (1,6 vs 3,2%, p=0,015).
No estudo MATRIX (Minimizing Adverse Haemorrhagic Events by TRansradial Access Site and Systemic Implementa-tion of AngioX, n=8404),31 a ocorrência do desfecho primário
composto por óbito, infarto e AVC não diferiu entre os grupos radial e femoral (8,8% vs 10,3%, respectivamente, RR 0,85, IC 95% 0,74–0,99; p=0,03). Contudo, as taxas do desfecho co-primário (óbito, infarto, AVC e sangramento maior) e de mortalidade foram menos frequentes nos pacientes sub-metidos à ICP pela via radial (9,8% vs 11,7%, RR 0,83, IC 95% 0,73–0,96; p=0,0092, e 1,6% vs 2,2%, RR 0,72, IC 95% 0,53–0,99; p=0,045, respectivamente).
CoNfLitos de iNteresseOs autores declaram não possuir conflitos de inte-
resse na realização deste trabalho.
referÊNCias1. Anderson JL, Adams CD, Antman EM, Bridges CR, Califf RM,
Casey DE Jr, et al. ACC/AHA 2007 guidelines for the management of patients with unstable angina/non-ST-elevation myocardial infarction: a report of the American College of Cardiology/Ameri-can Heart Association Task Force on Practice Guidelines (Writing Committee to revise the 2002 Guidelines for the Management of Patients with Unstable Angina/Non-ST-Elevation Myocardial Infarction) developed in collaboration with the American College of Emergency Physicians, the Society for Cardiovascular Angio-graphy and Interventions, and the Society of Thoracic Surgeons endorsed by the American Association of Cardiovascular and Pulmonary Rehabilitation and the Society for Academic Emergency Medicine. J Am Coll Cardiol. 2007;50(7):e1-e157.
2. Kerensky RA, Wade M, Deedwania P, Boden WE, Pepine. CJ; Veterans Affairs Non-Q-Wave Infarction Stategies in-Hospital (VAN-QWISH) Trial Investigators. Revisiting the culprit lesion in non-Q--wave myocardial infarction. Results from the VANQWISH trial an-giographic core laboratory. J Am Coll Cardiol. 2002; 39(9):1456-63.
3. Rioufol G, Finet G, Ginon I, André-Fouët X, Rossi R, Vialle E, Desjoyaux E, et al. Multiple atherosclerotic plaque rupture in acute coronary syndrome: a three-vessel intravascular ultrasound study. Circulation. 2002;106(7):804-8.
4. Nicolau JC, Timerman A, Marin-Neto JA, Piegas LS, Barbosa CJ, Franci A, et al; Sociedade Brasileira de Cardiologia. [Guidelines of Sociedade Brasileira de Cardiologia for Unstable Angina and Non-ST-Segment Elevation Myocardial Infarction (II Edition, 2007) 2013-2014 Update]. Arq Bras Cardiol. 2014;102 (3Supl1):1-61.
5. Amsterdam EA, Wenger NK, Brindis RG, Casey DE Jr, Ganiats TG, Holmes DR Jr, et al. 2014 AHA/ACC Guideline for the Management of Patients With Non–ST-Elevation Acute Coronary Syndromes: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Cardiol. 2014;64(24):e139-228.
6. Roffi M, Patrono C, Collet JP, Mueller C, Valgimigli M, Andreotti F, et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). Eur Heart J. 2016;37(3):267-315.
7. Effects of tissue plasminogen activator and a comparison of early invasive and conservative strategies in unstable angina and non--Q-wave myocardial infarction. Results of the TIMI IIIB Trial. Throm-bolysis in Myocardial Ischemia. Circulation. 1994;89(4):1545-56.
8. Boden WE, O’Rourke RA, Crawford MH, Blaustein AS, Deedwania PC, Zoble RG, et al. Outcomes in patients with acute non-Q-wave myocardial infarction randomly assigned to an invasive as com-pared with a conservative management strategy. Veterans Affairs Non-Q-Wave Infarction Strategies in Hospital (VANQWISH) Trial Investigators. N Engl J Med. 1998;338(25):1785-92.
9. Wallentin L, Lagerqvist B, Husted S, Kontny F, Ståhle E, Swahn E. Outcome at 1 year after an invasive compared with a non--invasive strategy in unstable coronary-artery disease: the FRISC II invasive randomised trial. FRISC II Investigators. Fast Revas-cularisation during Instability in Coronary artery disease. Lancet 2000; 356(9223):9-16.
10. Cannon CP, Weintraub WS, Demopoulos LA, Vicari R, Frey MJ, Lakkis N, et al. TACTICS (Treat Angina with Aggrastat and Deter-mine Cost of Therapy with an Invasive or Conservative Strategy)--Thrombolysis in Myocardial Infarction 18 Investigators. Com-parison of early invasive and conservative strategies in patients with unstable coronary syndromes treated with the glycoprotein IIb/IIIa inhibitor tirofiban. N Engl J Med. 2001;344(25):1879-87.
11. Spacek R, Widimsky P, Straka Z, Jiresová E, Dvorák J, Polásek R, et al. Value of first day angiography/angioplasty In evolving Non--ST segment elevation myocardial infarction: an open multicenter randomized trial. The VINO Study. Eur Heart J. 2002; 23(3):230-8.
12. Fox K, Poole-Wilson PA, Henderson RA, Clayton TC, Chamberlain DA, Shaw TR, et al; Randomized Intervention Trial of unstable Angina Investigators. Interventional versus conservative treatment for patients with unstable angina oron-ST-elevation myocardial infarction: the British Heart Foundation RITA 3 randomised trial. Randomized Intervention Trial of unstable Angina. Lancet. 2002; 360(9335):743-51.
13. Mehta SR, Cannon CP, Fox KA, Wallentin R, Boden WE, Spacek R, et al. Routine vs selective invasive strategies in patients with acute coronary syndromes: a collaborative meta-analysis of randomized trials. JAMA 2005;293(23):2908-17.
14. Bavry AA, Kumbhani DJ, Rassi AN, Bhatt DL, Askari AT. Benefit of early invasive therapy in acute coronary syndromes: a meta--analysis of contemporary randomized clinical trials. J Am Coll Cardiol. 2006;48(7):1319-25.
15. O’Donoghue M, Boden WE, Braunwald E, Cannon CP, Clayton TC, de Winter RJ, et al. Early invasive vs conservative treatment strategies in women and men with unstable angina and non-ST--segment elevation myocardial infarction: a meta-analysis. JAMA. 2008;300(1):71-80.
16. Fox KA, Clayton TC, Damman P, Pocock SJ, de Winter RJ, Tijssen JG, et al; FIR Collaboration. Long-term outcome of a routine ver-sus selective invasive strategy in patients with non-ST-segment elevation acute coronary syndrome a meta-analysis of individual patient data. J Am Coll Cardiol. 2010;55(22):2435-45.
17. Antman EM, Cohen M, Bernink PJ, McCabe CH, Horacek T, Papuchis G, et al. The TIMI risk score for unstable angina/non--ST elevation MI: A method for prognostication and therapeutic decision making. JAMA. 2000;284(7):835-42.
18. Granger CB, Goldberg RJ, Dabbous OH, Pieper KS, Eagle KA, Cannon CP, et al. Global Registry of Acute Coronary Events In-vestigators. Predictors of hospital mortality in the global registry
ESTRATÉGIA INVASIVA NAS SíNDROMES CORONARIANAS AGUDAS SEM SUPRADESNIVELAMENTO DO SEGMENTO ST
rev Soc Cardiol estado de São paulo 2016;26(2):99-104

104
of acute coronary events. Arch Intern Med. 2003;163(19):2345-53. 19. Neumann FJ, Kastrati A, Pogatsa-Murray G, Mehilli J, Bollwein
H, Bestehorn HP, et al. Evaluation of prolonged antithrombotic pretreatment (“cooling-off” strategy) before intervention in patients with unstable coronary syndromes: a randomized controlled trial. JAMA. 2003;290(12):1593-9.
20. Montalescot G, Cayla G, Collet JP, Elhadad S, Beygui F, Le Breton H, et al. ABOARD Investigators. Immediate vs delayed intervention for acute coronary syndromes: a randomized clinical trial. JAMA. 2009;302(9):947-54.
21. Mehta SR, Granger CB, Boden WE, Steg PG, Bassand JP, Fa-xon DP, et al; TIMAX Investigators. Early versus delayed inva-sive intervention in acute coronary syndromes. N Engl J Med. 2009;360(21):2165-75.
22. Katritsis DG, Siontis GC, Kastrati A, van’t Hof AW, Neumann FJ, Siontis KC, et al. Optimal timing of coronary angiography and po-tential intervention in non-ST-elevation acute coronary syndromes. Eur Heart J. 2011;32(1):32-40.
23. Navarese EP, Gurbel PA, Andreotti F, Tantry U, Jeong YH, Kozinski M, et al. Optimal timing of coronary invasive strategy in non-ST--segment elevation acute coronary syndromes: a systematic review and meta-analysis. Ann Intern Med. 2013;158(4):261-70.
24. Farooq V, Serruys PW, Bourantas CV, Zhang Y, Muramatsu T, Feldman T, et al. Quantification of incomplete revascularization and its association with five-year mortality in the synergy betwe-en percutaneous coronary intervention with taxus and cardiac surgery (SYNTAX) trial validation of the residual SYNTAX score. Circulation. 2013;128(2):141-51.
25. Genereux P, Palmerini T, Caixeta A, Rosner G, Green P, Dressler O, et al. Quantification and impact of untreated coronary artery disease after percutaneous coronary intervention: the residual SYNTAX (SYNergy between PCI with TAxus and Cardiac Surgery) score. J Am Coll Cardiol. 2012;59(24):2165-74.
26. Chase AJ, Fretz EB, Warburton WP, Klinke WP, Carere RG, Pi D, et al. Association of the arterial access site at angioplasty with transfusion and mortality: the M.O.R.T.A.L study (Mortality benefit Of Reduced Transfusion after percutaneous coronary intervention
via the Arm or Leg). Heart. 2008;94(8);1019-25.
27. Manoukian SV, Feit F, Mehran R, Voeltz MD, Ebrahimi R, Hamon M, et al. Impact of major bleeding on 30-day mortality and clinical outcomes in patients with acute coronary syndromes: an analysis from the ACUITY Trial. J Am Coll Cardiol. 2007;49(12):1362-8.
28. Nikolsky E, Mehran R, Halkin A, Aymong ED, Mintz GS, Lasic Z, et al. Vascular complications associated with arteriotomy closure devices in patients undergoing percutaneous coronary proce-dures: a meta-analysis. J Am Coll Cardiol. 2004; 44(6):1200-9.
29. Chatterjee S, Biondi–Zoccai G, Mukherjee D. Vascular closure devices: are their use justified? Evidence from a meta–analysis of randomized trials. J Am Coll Cardiol. 2013;61(10_S):. doi:10.1016/S0735-1097(13)61681-2
30. Jolly SS, Yusuf S, Cairns J, Niemela K, Xavier D, Widimski P, et al; RIVAL trial group. Radial versus femoral access for coronary angiography and intervention in patients with acute coronary syndromes (RIVAL): a randomised, parallel group, multicentre trial. Lancet. 2011;377(9775):1409-20.
31. Valgimigli M, Gagnor A, Calabró P, Frigoli E, Leonardi S, Zaro T, et al; MATRIX Investigators. Radial versus femoral access in patients with acute coronary syndromes undergoing invasive management: a randomised multicentre trial. Lancet. 2015;385(9986):2465-76.
32. Agostoni P, Biondi-Zoccai GG, de Benedictis ML, Rigattieri S, Turri M, Anselmi M, et al. Radial versus femoral approach for percutaneous coronary diagnostic and interventional procedures; Systematic overview and meta-analysis of randomized trials. J Am Coll Cardiol. 2004;44(2):349-56.
33. Jolly SS, Amlani S,, Hamon M, Yusuf S, Mehta SR. Radial versus femoral access for coronary angiography or intervention and the impact on major bleeding and ischemic events: a systema-tic review and meta-analysis of randomized trials. Am Heart J. 2009;157(1):132-40.
34. Siqueira DA, Brito FS Jr, Abizaid AA. Angioplastia primária no Registro ACCEPT: por quê tem sido difícil aceitar e implementar a via de acesso radial como preferencial? Arq Bras Cardiol. 2014;103(4):268-71.
rev Soc Cardiol estado de São paulo 2016;26(2):99-104

105
revisÃo/review
resUMoA morbidade e a mortalidade nas síndromes coronarianas agudas – causadas principalmente pela instabilidade da placa aterosclerótica, levando à formação de trombos – foi bastante reduzida com o advento de antiplaquetários, antitrombóticos e revascularização precoce. Hoje, dispomos de quatroantitrombóticos para uso nestas condições: a heparina não fracionada, a de baixo peso molecular, o fondaparinux e a bivalirudina – sendo apenas as três primeiras disponíveis no Brasil. Como são agentes antiocoagulantes, o risco de sangramento não é desprezível e deve ser apropriadamente dosado com o fim de trazer o máximo benefício antitrombótico, sem grande risco hemorrágico. Nesta revisão sumarizamos o atual estado da arte no uso de antitrombóticos no Brasil.
Descritores: Síndrome coronariana aguda; Antitrombóticos; Antitrombínicos.
aBstraCtMorbidity and mortality in the acute coronary syndromes – caused in the majorly by atherosclerotic plaque instability, with consequent thrombus formation – was drastically reduced by the advent of antiplatelet and antithrombotic agents, and by early revascularization. Nowadays, we have 4 antithrombotic agents: unfractionated heparin, low molecular weight heparin, fondaparinux and bivalirudin – with only the first 3 available in Brazil. As they comprise anticoagulant effects, the risk of bleeding is high and must be taken into account when prescribed, in order to bring the greater benefits without higher bleeding risk. In this review we summarized the current state of the art about the use of these agents in our country.
Descriptors: Acute coronary syndrome; Antithrombotics; Anticoagulants.
Rodrigo Modolo1
Otávio Rizzi Coelho2
1. Laboratório de Cateterismo Cardíaco, Disciplina de Cardiologia, Departamento de Clínica Médica, Faculdade de Ciências Médicas – UNICAMP. Campinas, SP, Brasil2. Disciplina de Cardiologia, Departamento de Clínica Médica, Faculdade de Ciências Médicas – UNICAMP. Campinas, SP, Brasil
Correspondência:Rua Francisco Glicério, 1867, Campinas, SP, Brasil. CEP: 13012-000 [email protected]
teraPia aNtitroMBÓtiCa Na fase agUda das síNdroMes CoroNariaNas agUdas
aNtitHroMBotiC tHeraPY iN aCUte PHase of aCUte CoroNarY sYNdroMes
iNtrodUÇÃoAs síndromes coronarianas agudas (SCAs) – sejam elas
com supra ou sem supradesnivelamento do segmento ST – ocorrem primariamente por instabilidade de placa ate-rosclerótica, com sua ruptura e consequente formação de trombo luminal.1-3 O desenvolvimento de terapia adjunta no tratamento destes quadros coronarianos agudos vem crescendo e novas drogas antiplaquetárias e antitrombóticas vêm surgindo sempre com o intuito de reduzir morbidade e mortalidade, mantendo um bom perfil de segurança – sem alto risco de sangramento.
É conhecido que uma terapia antitrombótica adequada é capaz de reduzir o potencial isquêmico da coronária, sob o ônus do aumento do sangramento, inerente a estas drogas. Já é demonstrado que o sangramento maior está intimamente associado à pior evolução do paciente com SCA – incluindo aumento da mortalidade em grandes estudos observacionais e também em ensaios clínicos randomizados.4,5 Desta ma-neira, o uso parcimonioso destas drogas é imperativo para
um controle adequado da isquemia miocárdica, diminuindo os riscos de evolução desfavorável pelos efeitos adversos.
Hoje, no Brasil, estão disponíveis 3 agentes antitrombóticos para uso nas SCAs: (1) heparina não fracionada, (2) enoxa-parina e (3) fondaparinux. Nesta revisão focaremos nas suas indicações, doses e efeitos clínicos nos pacientes com SCA.
aNtitroMBÓtiCosHeparina não fracionada
A heparina não fracionada (HNF) comercialmente dispo-nível é uma mistura de diferentes glicosaminoglicanos. A HNF age através de uma sequência pentassacarídea específica em seu composto que se liga com alta afinidade à trombina, e serve como catalisador, acelerando a neutralização da trom-bina e de outros fatores de coagulação.6 A primeira heparina a ser sugerida e testada no contexto das SCAs foi a HNF. Os estudos que inicialmente a testaram são da era pré-dupla antiagregação plaquetária, bem como pré-revascularização
rev Soc Cardiol estado de São paulo 2016;26(2):105-11

106
precoce.7 O tratamento era proposto para pacientes com diagnóstico de “angina instável” e a HNF era usada apenas com ácido acetilsalicílico (AAS).8-11 Os resultados destes estudos demonstraram uma grande tendência à diminuição de eventos cardiovasculares (CV) com a adição de HNF ao AAS. No entanto, esta não era usada de forma endovenosa como hoje é recomendado.
Na sequência os grandes trials GISSI-2 e ISIS-3 testaram esta mesma associação do AAS com a HNF no contexto da trombólise química para o infarto agudo do miocárdio (IAM), mostrando resultados não satisfatórios – fato explicado pelo atraso na introdução da droga, usada apenas de forma subcutânea.12,13 O grande estudo subsequente viria para consolidar o uso da HNF nestes pacientes; o trial GUSTO-1, testou em mais de 40 mil indivíduos a fibrinólise com rTPA e/ou estreptoquinase, com diferentes administrações de HNF (subcutânera ou endovenosa), e demonstrou que o grupo que recebeu o anticoagulante por via endovenosa associado ao rTPA teve a menor mortalidade ao final de um mês, dentre os grupos avaliados.14 A diferença deste para os demais foi a dose de heparina inicial e uma padronização do controle rigoroso da dose individualizada (por peso), sendo a infusão, endovenosa. Desta maneira, concluiu-se que uma anticoagu-lação mais previsível com doses individualizadas era capaz de proporcionar maior benefício clínico.15 A HNF tem um perfil farmacocinético com enorme variabilidade individual – principalmente devido a sua ligação inespecífica a muitas proteínas plasmáticas – e uma estreita janela terapêutica, o que dificulta seu uso no cenário clínico.
A HNF, em virtude da meia-vida relativamente curta, pode ter seus efeitos hemorrágicos extintos após sua suspensão. Apresenta atividade anticoagulante reversível com o uso da protamina – uma proteína básica que neutraliza imediata-mente os seus efeitos antitrombínicos.
Heparina de baixo peso molecularA heparina de baixo peso molecular (HBPM) é hoje o
agente antitrombótico mais usado no mundo. Ela é desenvol-vida a partir da HNF, sendo realizada a despolimerização de suas moléculas produzindo partículas com cerca de um terço do tamanho original. Esta heparina possui menor ativação plaquetária comparada à HNF e é absorvida rapidamente por via subcutânea.16
Em comparação com a HNF, esta heparina apresenta ação na cascata da coagulação preferencialmente seletiva a seus efeitos na inibição do fator Xa, com pouca ação sobre o fator II (Figura 1). Pela maior seletividade para o fator Xa, as HBPMs não alteram os exames clínicos de coagulação dos pacientes (ao contrário da HNF).17,18 Também de forma diferente de sua predecessora HNF, as HBPMs ligam-se menos avidamente às proteínas plasmáticas (mesmo as de fase aguda – as quais estão aumentadas nas SCAs), tornando-se assim far-macologicamente mais estável – com farmacocinética mais favorável, maior biodisponibilidade e maior tempo de meia-vida. Dessa maneira, seu uso pode ocorrer com doses fixas e com aplicações por via subcutânea em tempos mais espaçados – contribuindo, portanto, para uma melhor posologia.
No Brasil, as apresentações clinicamente disponíveis são a: dalteparina, nadroparina e enoxaparina. A primeira avaliada nos estudos FRISC19,20 e FRISC II,21 e a segunda no trial FRAX.I.S.,22 ambas demonstrando ser equiparáveis à HNF e superiores ao placebo nas SCAs. A enoxaparina é a mais usada no Brasil, e a mais estudada em ensaios clínicos. Na mesma época das publicações dos estudos da nadro-parina e da dalteparina, grandes trials demonstravam que, ao contrário das duas primeiras, a enoxaparina apresentava superioridade à HNF, no contexto das SCAs.23-26 O estudo ESSENCE já demonstrou que estes benefícios da enoxa-parina eram mantidos no seguimento mais longo (1 ano).27
As HBPMs podem ser parcialmente revertidas com o uso da
figura 1: representação gráfica dos principais sítios de ação dos agentes antitrombóticos.
*representadas em tamanho aumentado para fins didáticos.ft= fator tecidual, cofator lipoprotéico não-enzimático, que aumenta a eficiência proteolítica do fator Vii; pl= fosfolipídios; At iii= antitrombina iii.
Células endoteliais
Células musculares lisas
Fibrinogenio
Fibrinas
FT
FT FT
x
IX a
IX
X a
X
FTFT
FT
FTFT
Macrófagos
Va+PL+Ca+2
FT+Villa+PL
+Ca+2
Villa+PL+Ca +2
xIa
II (Protrombina)
IIa (trombina)
Plaquetas*
Fondaparinux (+AT III)
Heparina de baixo peso molecular (+ At iii)
Heparina não fracionada(+At iii)
Bivalirudina
rev Soc Cardiol estado de São paulo 2016;26(2):105-11

107
TERAPIA ANTITROMBÓTICA NA FASE AGUDA DAS SíNDROMES CORONARIANAS AGUDAS
protamina (que é capaz de neutralizar os efeitos antitrombínicos das HBPMs); no entanto, a protamina não reverte a atividade anti--Xa – predominante nestes fármacos. Por isso, a HNF é tida como único antitrombótico capaz de ser neutralizado prontamente. Tanto a HNF quanto as HBPMs (estas em menor grau) podem levar, em até 15% dos pacientes, a um quadro de trombocitope-nia. Esta trombocitopenia pode ser: (i) dose-dependente, não imune e autolimitada – geralmente benigna, sem necessidade de interrupção da terapêutica; e (ii) a forma autoimune, conhecida como plaquetopenia induzida por heparina (HIT), com grande potencial trombótico e evolução desfavorável, devendo neste caso, portanto, descontinuar a terapia.28,29
fondaparinuxO fondaparinux é um composto sintético, pentassaca-
rídeo, sendo o único inibidor seletivo do fator X ativado em uso clínico no Brasil. Age ligando-se de forma reversível e não covalente à antitrombina com alta afinidade, assim im-pedindo a formação da trombina.30 Assim como as HBPM, o fondaparinux tem pouca interação com as proteínas do plasma, sem grande diferença de resposta interindividual. Administrada por via subcutânea, o composto apresenta pico plasmático já com 2 horas de administração e possui tempo de meia-vida maior que HNF e HBPM – de 17 horas – podendo, dessa forma, ser aplicada em dose única diária.
A monitorização da atividade anti-Xa não é necessária, e o fondaparinux não altera parâmetros laboratoriais de antico-agulação como TTPa ou TCA (tempo de coagulação ativado). Por suas características farmacológicas, este antitrombótico não induz a HIT. Como apresenta excreção renal, seu uso é contraindicado para pacientes com insuficiência renal com Clearence de creatinina inferior à 20mL/min.31
No contexto das SCAs, este pentassacarídeo foi avaliado no estudo PENTUA – de fase clínica 2 – que mostrou boa segurança e eficácia da droga, chegando à dose usada hoje.32 No estudo subsequente de fase 3 – OASIS 5 – o fondaparinux, que foi comparado à enoxaparina em estudo de não-inferioridade, mostrou-se equivalente à HBPM e com menor incidência de sangramentos, consolidando sua entra-da no arsenal terapêutica dos antitrombóticos para SCA.33
BivalirudinaA bivalirudina – um inibidor direto da trombina – é um
polipepetídeo sintético de 20 aminoácidos, análogo da hi-rudina, que produz forte ligação bivalente com o sítio ativo e exossítio da trombina. Assim, age ligando-se diretamente à trombina – tanto em sua parte livre (fase fluida) como na ligada à fibrina – inibindo a conversão de fibrinogênio em fibrina.34-37
Como a droga não se liga a proteínas plasmáticas – característica da HNF – seu efeito anticoagulante é mais estável e previsível. Após sua ligação com a trombina, a droga é clivada, restando apenas um inibidor de baixa afini-dade. Assim, o potente efeito anticoagulante da bivalirudina é curto, e a droga tem meia-vida de apenas 25 horas. Sua administração é realizada por via endovenosa, em infusão contínua. Apesar de não possuir um antídoto, a curtíssima meia-vida torna-a uma droga segura, sendo que sua interrup-ção leva à cessação de seu efeito hemorrágico em minutos.34 Como sua depuração é renal, em caso de insuficiência renal crônica, a dose administrada deve ser ajustada, e o efeito anticoagulante pode ser arrastado.38
O seu uso no contexto das SCAs foi avaliado nos estudos HORIZONS-AMI, nos quais foi demonstrada a superioridade da droga em relação à HNF para pacientes submetidos à angioplastia primária;39,40 além disso, no estudo ACUITY, um trial open-label em SCA sem supra, foi evidenciada equivalên-cia da bivalirudina com HNF e enoxaparina para desfechos isquêmicos, porém com grande redução de sangramento com a bivalirudina.41,42 Apesar do benefício desse antitrom-bótico, o mesmo ainda não se encontra comercialmente disponível no Brasil.
síNdroMes CoroNariaNas seM sUPradesNiveLaMeNto do segMeNto st
Sabe-se hoje que a ruptura de placa ateromatosa (geral-mente as de capa fibrosa fina) coronariana é o evento inicial para a gênese dos processos de SCA sem (SCASSST) e com supradesnivelamento do segmento ST (SCACSST).43Nas SCASSST, a fissura ou erosão da placa expõe material su-bendotelial, desencadeando, entre outros, o processo de coagulação com agregação plaquetária e ativação da trom-bina com consequente formação de trombo (na placa ou na luz do vaso). Isso associado a um estado protrombótico típico das SCAs, leva ao quadro isquêmico coronariano,44 e associa-se a mau prognóstico (Figura 1).45
Dessa maneira, o uso de agentes que atuem nesta cas-cata é imperioso para a melhor evolução do paciente com SCA. Estes agentes antitrombóticos agem inibindo a geração ou atividade da trombina, levando à diminuição de eventos relacionados à formação dos trombos. O seu uso reduz eventos isquêmicos e essa redução é potencializada quando associado a um antiagregante plaquetário.46
A dose de HNF a ser usada nas SCASSST é ataque de 60-70 UI/kg (máximo de 5000 UI) seguidos de infusão con-tínua de 12-15 UI/kg/h (máximo de 1000 UI/h), ajustando-se a infusão para manter TTPa entre 1,5 e 2,5x o controle. Esta dose é recomendada pelas sociedades internacionais de cardiologia – Europeia e Americana.2,47 A SBC preconiza que a dose seja fixa de 5000 UI de bolus seguida de infusão de 1000 UI/h, ajustando-se a infusão para um TTPa de 1,5 a 2,5x o controle.31 Esta proposta reside no fato de não se mostrar benefício da dose ajustada por peso sobre a última.48 Seu uso nas SCASSST foi inicialmente testado por um grupo de pesquisadores em 1988, que demonstraram que o uso da HNF diminuiu angina e apresentou tendência à diminuição de infarto agudo do miocárdio (IAM), às custas de maior sangramento, quando comparada à AAS e placebo.9 Anos depois com estudos maiores como ATACS a associação AAS e HNF se tornaria mais consagrada em reduzir eventos isquêmicos,49 dados corroborados por metanálise publicada em 1996, com redução de mortalidade.8
Com o advento das heparinas de baixo peso molecu-lar – enoxaparina especialmente – muitos estudos foram desenvolvidos com o intuito de se testá-la em comparação com a HNF. Estudos iniciais, como o ESSENCE,27 ACUTE II50 e TIMI 11B24 demonstravam superioridade da enoxaparina em relação à HNF.26 Então, com o intuito de se delinear um estudo clínico com a conduta antiagregante completa e de estratificação invasiva contemporânea surgiu o trial SINERGY.51 Este estudo contou com mais de 10.000 pacientes com SCA de alto risco que seriam submetidos à estratificação invasi-
rev Soc Cardiol estado de São paulo 2016;26(2):105-11

108
va. Ao final de 48 horas ou 14 dias não houve diferença em mortalidade ou IAM entre os grupos enoxaparina e HNF. Mas talvez o mais notável do estudo tenha sido uma análise post hoc comparando quem se manteve apenas com uma das heparinas durante a internação com quem fez o crossover, que demonstrou que o grupo que usou as duas heparinas durante a internação apresentou maior sangramento, sem nenhum impacto na diminuição de desfechos clínicos “duros”. Ainda, analisando-se apenas os pacientes que fizeram uso de apenas um dos antitrombóticos durante a internação, houve superioridade no grupo enoxaparina comparando-se com HNF, para os desfechos óbito e IAM aos 30 dias. Dessa forma, hoje é desencorajada a troca de HNF por enoxaparina ou vice versa em pacientes com SCA.2,47,52
As doses recomendadas de enoxaparina são de 1mg/kg de 12 em 12 horas. Nos casos de insuficiência re-nal (taxa de filtração glomerular calculada < 30 mL/min) a posologia é de apenas 1x ao dia; e para paciente acima de 75 anos, 0,75mg/kg 12/12h.
Pouco mais recente em desenvolvimento temos o antitrom-bótico sintético fondaparinux. Por surgir em uma época mais contemporânea na cardiologia, seus estudos já são realizados com um arsenal terapêutico mais robusto. O maior estudo clínico randomizado a avaliá-lo no contexto das SCASSST foi o OASIS-5.33 Este estudo randomizou mais de 20 mil pa-cientes com SCASSST para se submeterem ao tratamento com fondaparinux ou enoxaparina. Em análise realizada de não-inferioridade o fondaparinux foi equivalente (não inferior) à enoxaparina em nove dias. Na avaliação do desfecho de segurança, o fondaparinux apresentou significativamente menos sangramento grave que a enoxaparina. No seguimento maior (30 e 90 dias) houve diminuição de mortalidade no grupo fondaparinux.
No subgrupo de pacientes submetidos à intervenção coronariana percutânea (ICP) houve menor taxa de sangra-mento com fondaparinux, não influenciado pelo tempo de atraso da angioplastia. No entanto, notou-se aumento de trombos nos cateteres de ICP no grupo fondaparinux versus enoxaparina (0,9 vs. 0,4%), fato este que foi diminuído por injeção de dose empírica de HNF para lavar o cateter após uma emenda ao protocolo do estudo ainda em andamento.53 Estudos subsequentes mostraram que uma dose de HNF deve ser administrada na sala de hemodinâmica aos pacien-tes em uso de fondaparinux que serão submetidos à ICP.54
Um grande registro recentemente publicado – com 40.616 pacientes – mostrou redução de mortalidade hospitalar com fondaparinux comparando-se à enoxaparina; vantagem que não se manteve com 6 meses.55 Estudo de custo efetivida-de canadense mostrou que o fondaparinux é custo efetivo comparando-se com a enoxaparina. Este benefício é notado tanto imediatamente após o evento quanto a longo prazo.56 O fondaprinux é o antitrombótico de uso parenteral com o melhor perfil de eficácia e segurança hoje, e seu uso deve ser preferido sobre os demais, a menos que o paciente seja referenciado para abordagem percutânea imediata.2
A dose do fondaparinux é de 2,5mg por via subcutânea em 1 aplicação diária. Devido à sua eliminação renal, se a taxa de filtração glomerular calculada for menor que 20mL/min, seu uso não é recomendado (Tabela 1).
Para intervenção percutânea nas SCASSST, pode-se fazer uso desses três antitrombínicos: enoxaparina, HNF e fonda-parinux. Neste contexto, uma metanálise incluindo 23 trials e
mais de 30 mil pacientes mostrou a segurança e eficácia da enoxaparina comparando-a com HNF - denotando redução em: mortalidade, composto de mortalidade e infarto, com-plicações do infarto, e sangramentos maiores.57 Importante ressaltar que o estudo SINERGY mostrou o malefício de se trocar o antitrombínico nas SCASSST – de enoxaparina para HNF ou vice-versa.51 O fondaparinux teve seu benefício de-monstrado no estudo OASIS-5. Subgrupo de pacientes com SCASSST que realizaram intervenção tiveram significativa diminuição de sangramento com o fondaparinux comparado à enoxaparina. No entanto, foi observado aumento de trombos no cateter. Esse aumento de trombos foi abolido com uso de HNF associado ao fondaparinux, de maneira que estudos subsequentes trouxeram que a dose padrão de HNF deveria ser usada nas ICP de pacientes sob uso do fondaparinux.54
Na hemodinâmica, a heparina não fracionada é usada em bolus endovenoso, e ajustada pelo TCA. Essa dose é de 70 a 100 UI/kg, ou 50 a 70 UI/kg se usado em pacientes com inibi-dores da glicoproteína IIb/IIIa.58,59 A enoxaparina não precisa ser administrada nas ICP se a última dose aconteceu a menos de 8 horas; caso contrário, a dose de 0,3 mg/kg por via endovenosa deve ser administrada.60,61 Para pacientes com fondaparinux, a dose diária é mantida, e a complementação na sala de hemo-dinâmica com 85 UI/kg de HNF deve ser realizada, ou 60 UI/kg no caso do uso de inibidores da glicoproteína IIb/IIIa.
síNdroMes CoroNariaNas CoM sU-PradesNiveLaMeNto do segMeNto st
A demonstração do benefício dos antitrombóticos nas SCACSST precede o uso consagrado do AAS e da terapia trombolítica.7 Nas SCA com supradesnivelamento do ST, a te-rapia antitrombótica difere nos seguintes cenários: (i) pacientes submetidos à terapia trombolítica, (ii) pacientes submetidos à angioplastia primária, e (iii) pacientes que não se submeteram à qualquer terapia de reperfusão (infarto agudo do miocárdio evoluído). A terapia antitrombótica já foi amplamente estudada
tabela 1. resumo das recomendações para terapia antitrombótica nas SCASSSt.
Droga anti-trombótica Dose Ajuste para função
renal
SCA
H e p a r i n a não fracio-nada
60-70 ui/kg (máx 5.000 ui) seguidos de infusão de 12-15 ui/kg/h -(máx 1.000 ui), ajustan-do ttpa entre 1,5-2,5x o controle
enoxaparina1mg/kg 12/12h ou 1mg/kg 1x/dia se
tfg < 30ml/min0,75mg/kg 12/12h se acima de 75 anos
fondapar i-nux 2,5mg 1x/dia SC não recomendado
se tfg < 20 ml/min
iCp
H e p a r i n a não fracio-nada
70-100 ui/kg ou-50-70 ui/kg se em uso
de igp iib/iiia
enoxaparina 0,3mg/kg se última dose SC acima de 8 horas -
fondapar i-nux
Associar 85 ui/kg de Hnf ou 60ui/kg se com igp iib/iiia
-
doses recomendadas para uso em casos de SCASSSt. SCA: Síndrome coronariana aguda; iCp: intervenção coronária percutânea; ttpa: tempo de tromboplastina parcial ativado; SC: subcutâneo; igp: inibidores da glicproteína; tfg: taxa de filtração glomerular.
rev Soc Cardiol estado de São paulo 2016;26(2):105-11

109
nestes contextos e deve ser administrada até que a terapia de reperfusão seja realizada. Caso não seja, deve ser dada por 48h ou durante o período de internação do paciente, até oito dias.
No início da década de 90, para os pacientes submeti-dos à terapia trombolítica, dois grandes estudos – ISIS-3 e GISSI-2 – fatoriais, colocaram em xeque o benefício do uso da heparina nos casos de SCA com supradesnivelamento de ST. Ambos falharam em demonstrar redução de desfechos cardiovasculares na adição da HNF à terapia de reperfusão química e ao AAS.12,13 A explicação hoje para esta ausência de benefício se dá pois a terapia realizada com HNF foi por via subcutânea. O estudo subsequente GUSTO-1 – com mais de 41 mil pacientes – viria demonstrar redução da mortalidade com o uso desta mesma HNF, no entanto agora administrada por via endovenosa contínua, conjuntamente com fibrinolítico e AAS.14 A HNF aumentou patência da artéria coronária com alteplase como fibrinolítico, mas não com estreptoquinase.62,63
Estudos posteriores viriam comparar enoxaparina com HNF no cenário de trombólise para SCACSST. O estudo ASSENT-3 demonstrou benefício da enoxaparina sobre HNF em reinfarto e isquemia refratária hospitalares – com uso por 7 dias.64 Foi seguido pela grande estudo ExTRACT TIMI-25,65 que concluiu que o uso de enoxaparina em pacientes submetidos à trombolise foi capaz de reduzir mortalidade e reinfarto em 30 dias quando comparado ao uso da HNF. Mesmo com aumento de sangramento nos pacientes do gru-po enoxaparina, o benefício líquido favoreceu enoxaparina.65
Mais recentemente, o fondaparinux foi testado no estudo OASIS-6 e, em uma análise de subgrupo posteriormente pu-blicada, mostrou-se superior ao placebo e HNF em reduzir reinfarto e morte – particularmente nos pacientes que recebe-ram estreptoquinase.66 A dose de HNF a ser usada nos casos com trombólise é: dose de ataque de 60 UI/kg (máximo de 4.000 UI) seguida de infusão contínua de 12UI/kg, ajustando--se a infusão para manter TTPa entre 1,5 e 2x o controle.31 A enoxaparina deve ser usada em 30mg por via endovenosa como dose de ataque seguida de 1mg/kg a cada 12 horas por via subcutânea.31 Os ajustes para função renal e idade seguem o mesmo padrão da dose para SCASSST.
No segundo cenário citado – o de pacientes submetidos à angioplastia primária – as opções disponíveis no Brasil são apenas a HNF e a enoxaparina. O uso do fondapari-nux não é indicado na sala de hemodinâmica como único antitrombínico pelos resultados não satisfatórios do estudo OASIS-6.67 Apesar de não haver estudo robusto, controlado e randomizado para o uso de HNF na angioplastia primária, o uso deste antitrombótico é consagrado, na dose de 70 a 100 UI/kg; ou 50 a 60 UI/kg se administrado com inibidores da glicoproteína IIb/IIIa.68 Diversos estudos não randomizados sugeriram o uso da enoxaparina na angioplastia primária;57,69 Mas o estudo clínico randomizado que a testou (ATOLL70), mostrou ausência de benefício para o desfecho primário (p=0,06), mas demonstrou superioridade à HNF no desfe-cho secundário composto (morte, IAM ou SCA recorrente, ou revascularização de urgência). A diretriz Europeia de tratamento de SCACSST68 coloca preferência da enoxa-
TERAPIA ANTITROMBÓTICA NA FASE AGUDA DAS SíNDROMES CORONARIANAS AGUDAS
referÊNCias1. Amsterdam EA, Wenger NK, Brindis RG, Casey DE Jr, Ganiats TG,
Holmes DR Jr, et al. 2014 AHA/ACC guideline for the manage-ment of patients with non-ST-elevation acute coronary syndromes: a report of the American College of Cardiology/American He-
parina sobre a HNF em angioplastia primária, diferente da diretriz brasileira, que inverte o nível de escolha. Nas salas de hemodinâmica do Brasil há preferência pelo uso da HNF sobre a enoxaparina.31 A dose para uso da enoxaparina na angioplastia primária é de 0,5mg/kg endovenoso.71
Com relação ao cenário do IAM evoluído (sem reperfusão) há escassez de dados na literatura; no entanto, a diretriz européia sugere que o mesmo tratamento medicamentoso utilizado para a SCACSST com trombólise seja usado neste caso (com enoxaparina, fondaparinux ou HNF) (Tabela 2).68
CoNsideraÇÕes fiNaisOs antitrombóticos devem sempre ser usados nos pacien-
tes com SCAs, no momento do diagnóstico, respeitando-se os limites dos riscos de sangramento. A escolha deve sempre se basear no tipo de SCA (se com ou sem supradesnivela-mento do segmento ST) e em seu perfil de depuração renal, além da disponibilidade do fármaco. O manejo adequado dos antitrombóticos e sua adequada e rápida instituição são essenciais para se reduzir os riscos de isquemia sem aumentar de forma imprudente os riscos de sangramento.
CoNfLitos de iNteresseOs autores declaram não possuir conflitos de inte-
resse na realização deste trabalho.
tabela 2. resumo das recomendações para terapia antitrombótica nas SCACSSt.
Droga anti-trombótica Dose Ajuste para
função renal
Heparina não fracionada
60 ui/kg (máx 4.000 ui) seguidos de infusão de 12 ui/kg/h
-fibrinó-lise
(máx 1.000 ui), ajustando ttpa entre 1,5-2,0x o controle
ou
enoxaparina
30mg eV em bolus seguido de 1mg/kg 12/12h ou 1mg/kg 1x/
dia se tfg < 30ml/min
evoluídosem bolus inicial seguido de 0,75mg/kg 12/12h se acima de 75 anos
fondaparinux2,5mg eV em bolus seguido de 2,5mg 1x/dia SC
não reco-mendado se tfg < 20 ml/min
iCp pri-mária
Heparina não fracionada
70-100 ui/kg sem igp iib/iiia ou
-50-60 ui/kg se em uso de igp iib/iiia
enoxaparina 0,5mg/kg eV em bolus -fondaparinux nÃo reComendAdo -
doses recomendadas para uso em casos de SCACSSt. iCp: intervenção coronária percutânea; ttpa: tempo de tromboplastina parcial ativado; SC: subcutâneo; igp: inibidores da glicproteína; tfg: taxa de filtração glomerular.
rev Soc Cardiol estado de São paulo 2016;26(2):105-11

110
art Association Task Force on Practice Guidelines. Circulation. 2014;130(25):e344-426.
2. Roffi M, Patrono C, Collet JP, Mueller C, Valgimigli M, Andreotti F, et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syn-dromes in Patients Presenting without Persistent ST-Segment Ele-vation of the European Society of Cardiology (ESC). Eur Heart J. 2016;37(3): 267-315.
3. Thygesen K, Alpert JS, Jaffe AS, Simoons ML, Chaitman BR, White HD, et al. Third universal definition of myocardial infarction. J Am Coll Cardiol. 2012;60(16):1581-98.
4. De Caterina R, Husted S, Wallentin L, Agnelli G, Bachmann F, Bai-gent C, et al. Anticoagulants in heart disease: current status and perspectives. Eur Heart J. 2007;28(7):880-913.
5. Steg PG, Huber K, Andreotti F, Arnesen H, Atar D, Badimon L, et al. Bleeding in acute coronary syndromes and percutaneous coronary interventions: position paper by the Working Group on Thrombosis of the European Society of Cardiology. Eur Heart J. 2011;32(15):1854-64.
6. Hirsh J, Raschke R. Heparin and low-molecular-weight heparin: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004;126(3 Suppl):188S-203S.
7. Collins R, MacMahon S, Flather M, Baigent C, Remvig L, Mortensen S, et al. Clinical effects of anticoagulant therapy in suspected acute myocardial infarction: systematic overview of randomised trials. BMJ. 1996;313(7058):. 652-9.
8. Oler A, Whooley MA, Oler J, Grady D, Adding heparin to aspirin reduces the incidence of myocardial infarction and death in patients with unstable angina. A meta-analysis. JAMA. 1996; 276(10): 811-5.
9. Théeroux P, Ouimet H, McCans J, Latour JG, Joly P, Lévy G, et al. Aspirin, heparin, or both to treat acute unstable angina. N Engl J Med. 1988;319(17):1105-11.
10. Risk of myocardial infarction and death during treatment with low dose aspirin and intravenous heparin in men with unstable coronary artery disease. The RISC Group. Lancet. 1990;336(8719):827-30.
11. Holdright D, Patel D, Cunningham D, Thomas R, Hubbard W, Hendry G, et al. Comparison of the effect of heparin and aspirin versus aspirin alone on transient myocardial ischemia and in-hospital prognosis in patients with unstable angina. J Am Coll Cardiol. 1994;24(1):39-45.
12. GISSI-2: a factorial randomised trial of alteplase versus streptokinase and heparin versus no heparin among 12,490 patients with acute myocardial infarction. Gruppo Italiano per lo Studio della Sopravvi-venza nell’Infarto Miocardico. Lancet. 1990;336(8707):65-71.
13. ISIS-3: a randomised comparison of streptokinase vs tissue plasmi-nogen activator vs anistreplase and of aspirin plus heparin vs aspirin alone among 41,299 cases of suspected acute myocardial infarction. ISIS-3 (Third International Study of Infarct Survival) Collaborative Group. Lancet. 1992;339(8796):753-70.
14. An international randomized trial comparing four thrombolytic stra-tegies for acute myocardial infarction. The GUSTO investigators. N Engl J Med. 1993;329(10):673-82.
15. Hochman JS, Wali AU, Gavrila D, Sim MJ, Malhotra S, Palazzo AM, et al. A new regimen for heparin use in acute coronary syndromes. Am Heart J. 1999;138(2 Pt 1):313-8.
16. Garcia DA, Baglin TP, Weitz JI, Samama MM; American College of Chest Physicians. Parenteral anticoagulants: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e24S-43S.
17. Hirsh J, Levine MN. Low molecular weight heparin. Blood. 1992; 79(1):1-17.
18. Fareed J, Jeske W, Hoppensteadt D, Clarizio R, Walenga JM. . Low-molecular-weight heparins: pharmacologic profile and product differentiation. Am J Cardiol. 1998;82(5B):3L-10L.
19. Low-molecular-weight heparin during instability in coronary artery disease, Fragmin during Instability in Coronary Artery Disease (FRISC) study group. Lancet.1996;347(9001):561-8.
20. Klein W, Buchwald A, Hillis WS, Monrad S, Sanz G, Turpie AG, et al. Fragmin in unstable angina pectoris or in non-Q-wave acute myo-cardial infarction (the FRIC study). Fragmin in Unstable Coronary Artery Disease. Am J Cardiol. 1997;. 80(5A):30E-34E.
21. Invasive compared with non-invasive treatment in unstable coronary--artery disease: FRISC II prospective randomised multicentre study. FRagmin and Fast Revascularisation during InStability in Coronary artery disease Investigators. Lancet, 1999. 354(9180): p. 708-15.
22. Comparison of two treatment durations (6 days and 14 days) of a low molecular weight heparin with a 6-day treatment of unfractiona-ted heparin in the initial management of unstable angina or non-Q wave myocardial infarction: FRAX.I.S. (FRAxiparine in Ischaemic Syndrome). Eur Heart J. 1999;20(21):1553-62.
23. Cohen M, Demers C, Gurfinkel EP, Turpie AG, Fromell GJ, Goodman S, et al. A comparison of low-molecular-weight heparin with unfrac-tionated heparin for unstable coronary artery disease. Efficacy and Safety of Subcutaneous Enoxaparin in Non-Q-Wave Coronary Events Study Group. N Engl J Med. 1997;337(7):447-52.
24. Antman EM, McCabe CH, Gurfinkel EP, Turpie AG, Bernink PJ, Salein D, et al. Enoxaparin prevents death and cardiac ischemic events in unstable angina/non-Q-wave myocardial infarction. Results of the thrombolysis in myocardial infarction (TIMI) 11B trial. Circulation. 1999;100(15):1593-601.
25. Bozovich GE, Gurfinkel EP, Antman EM, McCabe CH, Mautner B. . Superiority of enoxaparin versus unfractionated heparin for unstable angina/non-Q-wave myocardial infarction regardless of activated partial thromboplastin time. Am Heart J. 2000;40(4):637-42.
26. Antman EM, Cohen M, Radley D, McCabe C, Rush J, Premmereur J, et al. Assessment of the treatment effect of enoxaparin for unsta-ble angina/non-Q-wave myocardial infarction. TIMI 11B-ESSENCE meta-analysis. Circulation. 1999;100(15):1602-8.
27. Goodman SG, Cohen M, Bigonzi F, Gurfinkel EP, Radley DR, Le Iouer V, et al. Randomized trial of low molecular weight heparin (enoxaparin) versus unfractionated heparin for unstable coronary artery disease: one-year results of the ESSENCE Study. Efficacy and Safety of Subcutaneous Enoxaparin in Non-Q Wave Coronary Events. J Am Coll Cardiol. 2000;36(3):693-8.
28. Arepally GM., Ortel TL. Clinical practice. Heparin-induced throm-bocytopenia. N Engl J Med. 2006;355(8): 809-17.
29. Poncz M. Mechanistic basis of heparin-induced thrombocytopenia. Semin Thorac Cardiovasc Surg. 2005;17(1):73-9.
30. Bauer, K.A., Fondaparinux sodium: a selective inhibitor of factor Xa. Am J Health Syst Pharm. 2001;58(Suppl 2): S14-7.
31. Sociedade Brasileira de Cardilogia; Lorga Filho AM, Azmus AD, Soeiro AM, Quadros AS, Avezum A Jr, et al. [Brazilian guidelines on platelet antiaggregants and anticoagulants in cardiology]. Arq Bras Cardiol. 2013;101(3 Suppl 3):1-95.
32. Simoons ML, Bobbink IW, Boland J, Gardien M, Klootwijk P, Lensing AW, et al. A dose-finding study of fondaparinux in patients with non-ST-segment elevation acute coronary syndromes: the Penta-saccharide in Unstable Angina (PENTUA) Study. J Am Coll Cardiol. 2004;43(12):2183-90.
33. Fifth Organization to Assess Strategies in Acute Ischemic Syndromes Investigators; Yusuf S, Mehta SR, Chrolavicius S, Afzal R, Pogue J, et al. Comparison of fondaparinux and enoxaparin in acute coronary syndromes. N Engl J Med. 2006;354(14):1464-76.
34. Capodanno D, De Caterina R. Bivalirudin for acute coronary syn-dromes: premises, promises and doubts. Thromb Haemost. 2015; 113(4):698-707.
35. De Caterina R, Husted S, Wallentin L, Andreotti F, Arnesen H, Bach-mann F, et al. Oral anticoagulants in coronary heart disease (Section IV). Position paper of the ESC Working Group on Thrombosis - Task Force on Anticoagulants in Heart Disease. Thromb Haemost, 2016. 115(4):685-711.
36. De Caterina R, Husted S, Wallentin L, Andreotti F, Arnesen H, Bach-mann F, et al. Parenteral anticoagulants in heart disease: current sta-tus and perspectives (Section II). Position paper of the ESC Working Group on Thrombosis-Task Force on Anticoagulants in Heart Disease. Thromb Haemost. 2013;109(5):769-86.
37. De Caterina R, Husted S, Wallentin L, Andreotti F, Arnesen H, Ba-chmann F, et al. General mechanisms of coagulation and targets of anticoagulants (Section I). Position Paper of the ESC Working Group on Thrombosis--Task Force on Anticoagulants in Heart Disease. Thromb Haemost. 2013;109(4):569-79.
38. Capodanno D, Angiolillo DJ. Antithrombotic therapy in patients with chronic kidney disease. Circulation. 2012; 125(21):2649-61.
39. Stone GW, Witzenbichler B, Guagliumi G, Peruga JZ, Brodie BR,
rev Soc Cardiol estado de São paulo 2016;26(2):105-11

111
Dudek D, et al. Bivalirudin during primary PCI in acute myocardial infarction. N Engl J Med. 2008;358(21):2218-30.
40. Mehran R, Lansky AJ, Witzenbichler B, Guagliumi G, Peruga JZ, Brodie BR, et al. Bivalirudin in patients undergoing primary angioplasty for acute myocardial infarction (HORIZONS-AMI): 1-year results of a randomised controlled trial. Lancet. 2009;374(9696):1149-59.
41. Stone GW, White HD, Ohman EM, Bertrand ME, Lincoff AM, McLaurin BT, et al. Bivalirudin in patients with acute coronary syndromes un-dergoing percutaneous coronary intervention: a subgroup analysis from the Acute Catheterization and Urgent Intervention Triage strategy (ACUITY) trial. Lancet. 2007;369(9565):907-19.
42. Stone GW, McLaurin BT, Cox DA, Bertrand ME, Lincoff AM, Moses JW, et al., Bivalirudin for patients with acute coronary syndromes. N Engl J Med. 2006;355(21):2203-16.
43. Libby P. Molecular bases of the acute coronary syndromes. Circu-lation. 1995;91(11):2844-50.
44. Prins MH, Hirsh J. A critical review of the relationship between impaired fibrinolysis and myocardial infarction. Am Heart J. 1991;122(2):545-51.
45. Thompson SG, Kienast J, Pyke SD, Haverkate F, van de Loo JC. Hemostatic factors and the risk of myocardial infarction or sudden death in patients with angina pectoris. European Concerted Action on Thrombosis and Disabilities Angina Pectoris Study Group. N Engl J Med. 1995;332(10): 635-41.
46. Eikelboom JW, Anand SS, Malmberg K, Weitz JI, Ginsberg JS, Yusuf S. Unfractionated heparin and low-molecular-weight heparin in acute coronary syndrome without ST elevation: a meta-analysis. Lancet. 2000;355(9219): 1936-42.
47. Amsterdam EA, Wenger NK, Brindis RG, Casey DE Jr, Ganiats TG, Holmes DR Jr, et al. 2014 AHA/ACC Guideline for the Management of Patients with Non-ST-Elevation Acute Coronary Syndromes: a report of the American College of Cardiology/American Heart As-sociation Task Force on Practice Guidelines. J Am Coll Cardiol. 2014;64(24):e139-228.
48. Raschke RA, Reilly BM, Guidry JR, Fontana JR, Srinivas S. The weight-based heparin dosing nomogram compared with a “standard care” nomogram. A randomized controlled trial. Ann Intern Med. 1993;119(9):874-81
49. Cohen M, Adams PC, Parry G, Xiong J, Chamberlain D, Wieczorek I, Fox KA et al. Combination antithrombotic therapy in unstable rest an-gina and non-Q-wave infarction in nonprior aspirin users. Primary end points analysis from the ATACS trial. Antithrombotic Therapy in Acute Coronary Syndromes Research Group. Circulation. 1994;89(1): 81-8.
50. Cohen M, Théroux P, Borzak S, Frey MJ, White HD, Van Mieghem W, et al. Randomized double-blind safety study of enoxaparin versus unfractionated heparin in patients with non-ST-segment elevation acute coronary syndromes treated with tirofiban and aspirin: the ACUTE II study. The Antithrombotic Combination Using Tirofiban and Enoxaparin. Am Heart J. 2002;144(3):470-7.
51. Ferguson JJ, Califf RM, Antman EM, Cohen M, Grines CL, Goodman S, et al. Enoxaparin vs unfractionated heparin in high-risk patients with non-ST-segment elevation acute coronary syndromes managed with an intended early invasive strategy: primary results of the SYNERGY randomized trial. JAMA. 2004;292(1):45-54.
52. Nicolau JC, Timerman A, Marin-Neto JA, Piegas LS, Barbosa CJ, Franci A, et al. [Guidelines of Sociedade Brasileira de Cardiologia for Unstable Angina and Non-ST-Segment Elevation Myocardial Infarction (II Edition, 2007) 2013-2014 Update]. Arq Bras Cardiol. 2014;102(3 Suppl 1):1-61.
53. Jolly SS, Faxon DP, Fox KA, Afzal R, Boden WE, Widimsky P, et al. Efficacy and safety of fondaparinux versus enoxaparin in patients with acute coronary syndromes treated with glycoprotein IIb/IIIa inhibitors or thienopyridines: results from the OASIS 5 (Fifth Organization to Assess Strategies in Ischemic Syndromes) trial. J Am Coll Cardiol. 2009;54(5): 468-76.
54. FUTURA/OASIS-8 Trial Group; Steg PG, Jolly SS, Mehta SR, Afzal R, Xavier D, et al. Low-dose vs standard-dose unfractionated heparin for percutaneous coronary intervention in acute coronary syndromes treated with fondaparinux: the FUTURA/OASIS-8 randomized trial. JAMA. 2010;304(12):1339-49.
55. Szummer K, Oldgren J, Lindhagen L, Carrero JJ, Evans M, Spaak J, et al. Association between the use of fondaparinux vs low-mole-cular-weight heparin and clinical outcomes in patients with non-ST--segment elevation myocardial infarction. JAMA. 2015;313(7):707-16.
56. Ross Terres JA, Lozano-Ortega G, Kendall R, Sculpher MJ. Cost--effectiveness of fondaparinux versus enoxaparin in non-ST-elevation acute coronary syndrome in Canada (OASIS-5). BMC Cardiovasc Disord. 2015;15(1):180.
57. Silvain J, Beygui F, Barthélémy O, Pollack C Jr, Cohen M, Zeymer Uet al. Efficacy and safety of enoxaparin versus unfractionated heparin during percutaneous coronary intervention: systematic review and meta-analysis. BMJ. 2012;344:e553.
58. Lee MS, Wali AU, Menon V, Berkowitz SD, Thompson TD, Califf RM, Topol EJ, et al. The determinants of activated partial thromboplastin time, relation of activated partial thromboplastin time to clinical ou-tcomes, and optimal dosing regimens for heparin treated patients with acute coronary syndromes: a review of GUSTO-IIb. J Thromb Thrombolysis. 2002;14(2):91-101.
59. Hassan WM, Flaker GC, Feutz C, Petroski GF, Smith D. Improved Anticoagulation with a Weight-Adjusted Heparin Nomogram in Pa-tients with Acute Coronary Syndromes: A Randomized Trial. J Thromb Thrombolysis. 1995;2(3):245-249.
60. Collet JP, Montalescot G, Lison L, Choussat R, Ankri A, Drobinski G, et al. Percutaneous coronary intervention after subcutaneous enoxaparin pretreatment in patients with unstable angina pectoris. Circulation. 2001;103(5): 658-63.
61. Martin JL, Fry ET, Sanderink GJ, Atherley TH, Guimart CM, Chevalier PJ, et al. Reliable anticoagulation with enoxaparin in patients under-going percutaneous coronary intervention: The pharmacokinetics of enoxaparin in PCI (PEPCI) study. Catheter Cardiovasc Interv. 2004;61(2): 163-70.
62. de Bono DP, Simoons ML, Tijssen J, Arnold AE, Betriu A, Burgersdijk C, et al. Effect of early intravenous heparin on coronary patency, infarct size, and bleeding complications after alteplase thrombolysis: results of a randomised double blind European Cooperative Study Group trial. Br Heart J. 1992;67(2):122-8.
63. The effects of tissue plasminogen activator, streptokinase, or both on coronary-artery patency, ventricular function, and survival after acute myocardial infarction. The GUSTO Angiographic Investigators. N Engl J Med. 1993;329(22):1615-22.
64. Assessment of the Safety and Efficacy of a New Thrombolytic Re-gimen (ASSENT)-3 Investigators. Efficacy of a New Thrombolytic Regimen, Efficacy and safety of tenecteplase in combination with enoxaparin, abciximab, or unfractionated heparin: the AS-SENT-3 randomised trial in acute myocardial infarction. Lancet. 2001;358(9282):605-13.
65. Giraldez RR, Nicolau JC, Corbalan R, Gurfinkel EP, Juarez U, Lopez--Sendon J, et al. Enoxaparin is superior to unfractionated heparin in patients with ST elevation myocardial infarction undergoing fibrinolysis regardless of the choice of lytic: an ExTRACT-TIMI 25 analysis. Eur Heart J. 2007;28(13):1566-73.
66. Peters RJ, Joyner C, Bassand JP, Afzal R, Chrolavicius S, Mehta SR, et al. The role of fondaparinux as an adjunct to thrombolytic therapy in acute myocardial infarction: a subgroup analysis of the OASIS-6 trial. Eur Heart J. 2008; 29(3):324-31.
67. Yusuf S, Mehta SR, Chrolavicius S, Afzal R, Pogue J, Granger CB, et al. Effects of fondaparinux on mortality and reinfarction in patients with acute ST-segment elevation myocardial infarction: the OASIS-6 randomized trial. JAMA. 2006;295(13):1519-30.
68. Task Force on the management of S.T-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC), Steg PG, James SK, Atar D, Badano LP, Blömstrom-Lundqvist C, et al. ESC Guidelines for the management of acute myocardial infarc-tion in patients presenting with ST-segment elevation. Eur Heart J. 2012;33(20):2569-619.
69. Navarese EP, De Luca G, Castriota F, Kozinski M, Gurbel PA, Gibson CM, et al. Low-molecular-weight heparins vs. unfractionated heparin in the setting of percutaneous coronary intervention for ST-elevation myocardial infarction: a meta-analysis. J Thromb Haemost. 2011; 9(10):1902-15.
70. Montalescot, G., et al., Intravenous enoxaparin or unfractionated heparin in primary percutaneous coronary intervention for ST-elevation myocardial infarction: the international randomised open-label ATOLL trial. Lancet, 2011. 378(9792): p. 693-703.
71. Avezum Junior A, Feldman A, Carvalho AC, Sousa AC, Mansur Ade P, Bozza AE, et al. [V Guideline of the Brazilian Society of Cardio-logy on Acute Myocardial Infarction Treatment with ST Segment Elevation]. Arq Bras Cardiol. 2015;105(2 Suppl 1):1-105.
TERAPIA ANTITROMBÓTICA NA FASE AGUDA DAS SíNDROMES CORONARIANAS AGUDAS
rev Soc Cardiol estado de São paulo 2016;26(2):105-11

112
revisÃo/review
resUMoDesde os primeiros estudos com ácido acetilsalicílico (AAS), até publicações mais re-
centes com novos bloqueadores de ADP e bloqueadores do receptor de trombina, pode-se afirmar que o conhecimento sobre o tratamento antiplaquetário nas síndromes coronarianas agudas (SCA) evoluiu de forma exponencial. Atualmente, a dupla antiagregação (DAP) é parte essencial do tratamento das SCA em todas as suas formas de apresentação, sendo recomendada por no mínimo um ano em todos os pacientes, independentemente da estratégia de revascularização utilizada, desde que não haja contraindicações ao seu uso.
Ao mesmo tempo que se demonstrava eficácia crescente com o uso de antitrom-bóticos de forma geral (incluindo-se os antiplaquetários), cada vez mais a comunidade científica se conscientizava da importância do sangramento que ocorria com o uso desses medicamentos e negava, ao menos parcialmente, os benefícios obtidos.
Assim sendo, os maiores desafios nos tempos atuais em termos de terapêutica antitrombótica nas SCA voltam-se para o desenvolvimento de estratégias terapêuticas personalizadas individualmente, que possam ter o máximo possível de benefício em termos de eventos isquêmicos, com o mínimo possível de sangramento. Isso inclui não apenas uma análise cuidadosa dos medicamentos a serem associados, mas também do tempo de sua utilização. Tais estratégias constituem o foco principal da presente revisão.
Descritores: Terapia antiplaquetária; Síndromes coronárias agudas; Estratégia.
aBstraCtSince the first studies with acetylsalicylic acid (ASA) up to more recent publications with
new blockers of ADP and anti-thrombin receptor blockers, it is fair to say that knowledge about antiplatelet therapy in acute coronary syndromes (ACS) has grown exponentially. Currently, dual antiplatelet (DAP) therapy is an essential part of the treatment in all presen-tation forms of ACS, and it is recommended for at least one year for all patients, regardless of the revascularization strategy used, provided there are no contraindications to its use.
Alongside the demonstration of increased efficacy of antithrombotics in general (inclu-ding antiplatelet drugs), the scientific community became increasingly aware of the impact of bleeding that occurred with the use of these drugs, and that were undermining, at least partially, the benefits obtained.
Thus, the main challenge today regarding anti-thrombotic treatment in ACS is the deve-lopment of tailored therapeutic strategies that can produce the greatest possible benefit in terms of ischemic events, with minimal bleeding. This includes not only a careful analysis of the drugs to be associated, but also the duration of their use. Such strategies are the focus of the present review.
Descriptors: Antiplatelet therapy; Acute coronary syndromes; Strategies.
José Carlos Nicolau¹Remo Holanda de Mendonça Furtado¹
1.Unidade de Coronariopatia Aguda do Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo.
Correspondência:Rua Dr. Eneas Carvalho de Aguiar 44, 2o andar, Bloco II, conjunto 12; São Paulo, SP; CEP [email protected]
estratÉgias aNtiPLaQUetÁrias orais Nas fases agUda e CrÔNiCa das síNdroMes
CoroNariaNas agUdas
oraL aNtiPLateLet strategies iN tHe aCUte aNd CHroNiC of aCUte CoroNarY sYNdroMes.
iNtrodUÇÃoO estímulo à agregação plaquetária segue diversas
vias metabólicas, como pode ser visto na Figura 1. Para fins didáticos, a presente revisão focará nos medicamentos que
bloqueiam a ciclooxigenase (ácido acetil salicílico), o receptor do ADP P2Y12 (clopidogrel, prasugrel e ticagrelor) e o receptor da trombina PAR-1 (vorapaxar).
rev Soc Cardiol estado de São paulo 2016;26(2):112-9

113
evoLUÇÃo do trataMeNto aNtiPLa-QUetÁrio Nas sCa
Ácido acetilsalicílico (aas) Data de mais de um século o uso do ácido acetilsalicílico
(AAS) como medicamento com efeitos analgésicos, antitérmi-cos e antiinflamatórios.1 A primeira descrição científica do AAS ocorreu em 1763, quando foram descritas as propriedades analgésicas da salicilina, substância obtida a partir da casca do salgueiro.1 Posteriormente, os laboratórios Bayer passa-ram a comercializar a substância com o nome comercial de Aspirina®, sendo uma das medicações mais utilizadas no mundo até os dias atuais. O mecanismo de ação do AAS é bem estabelecido e conhecido: o medicamento leva à ace-tilação irreversível com consequente inativação da enzima ciclo-oxigenase (COX), bloqueando deste modo a geração do tromboxano A2, potente indutor da agregabilidade plaque-tária.(Tabela 1) Sua ação antiplaquetária ocorre mesmo com sua utilização em doses baixas, como 81 a 150 mg/dia, sendo essas doses as recomendadas no tratamento das síndromes coronarianas agudas (SCA) por manterem excelente potência antiagregante com menor incidência de sangramento, em relação a doses maiores.2,3,4 O efeito antitrombótico do AAS foi testado clinicamente de forma adequada, somente nos últimos 30 anos. Em pacientes com angina instável, desde a década de 1980 existem evidências de que sua utilização, em relação a placebo, leva à diminuição de aproximadamente 50% na incidência do desfecho composto de infarto, óbito cardiovascular e acidente vascular cerebral (AVC).3,5
Já no infarto agudo do miocárdio com supradesnível do segmento ST (IAMCSST), o AAS foi testado no estudo ISIS-2, que incluiu >17000 pacientes e demonstrou que o medica-mento, em relação ao placebo, levou à redução de 23% na mortalidade em 35 dias, percentual bastante próximo do obtido quando da comparação (no mesmo estudo) de estreptoquinase
contra placebo (25%). Ainda mais importante, o uso do AAS em conjunto com a estreptoquinase, em relação a placebo, levou a impressionantes 42% de diminuição na mortalidade precoce.6
ClopidogrelA partir dos anos 1990, foi desenvolvida a hipótese de
que a adição de um bloqueador do receptor ao AAS poderia acrescentar benefício no tratamento de pacientes com SCA, já que estaria bloqueando um “caminho” diferente da agregação plaquetária. Essa hipótese foi testada inicialmente no estudo CURE, que demonstrou redução significativa na incidência do desfecho composto de reinfarto, óbito e AVC a favor do clopidogrel em comparação ao placebo, em população de pacientes com SCA sem supradesnível de segmento ST. O benefício do medicamento foi consistente tanto nos indivíduos tratados com intervenção coronária percutânea (ICP), como naqueles tratados com terapia médica apenas ou com cirurgia de revascularização do miocárdio. Vale ressaltar que a redução de eventos se manteve durante todo o seguimento do estudo, de 12 meses, e apesar do aparente maior benefício nos pri-meiros três meses de seguimento, houve significativo benefício adicional após o primeiro mês a partir do evento agudo. Em direção oposta ao benefício obtido, observou-se significativo aumento na incidência de sangramentos maiores.7,8
Após o beneficio demonstrado na SCA sem supradesnível do segmento ST, o clopidogrel foi testado também no IAMCSST. No estudo CLARITY, que incluiu >3.500 pacientes tratados com fibrinolítico e AAS, o clopidogrel, em relação ao placebo, levou a diminuições significativas nas incidências dos desfechos compostos de artéria ocluída, reinfarto e morte cardiovascular (principal), e de óbito cardiovascular, reinfarto ou isquemia refratária levando à necessidade de revascularização urgente (secundário).9 Já o estudo COMMIT, em que aproximadamen-te 45.000 pacientes com ou sem uso de fibrinolítico foram analisados, demonstrou redução significativa no desfecho
figura1. mecanismos de ativação plaquetária.
PAR= protease-activated receptor. TP= thromboxane A2 prostaglandin H2.Adaptado de: Story RF. Curr Pharm Des. 2006; 12:1255-1259.
αIIbβ3
Grânulo denso
Grânulo alfa
Coagulação Tromboxane Colageno
Fibrinogênio
Agregação
Antagonistas GP IIb/IIIa
AAS5HT 5HT
ADP ADP ADP
ATP ATPTrombina
Geração de trombina
Alteração da forma
Fatores da coagulaçãoMediadores inflamatórios
AtivaçãoPlaquetária
Amplificação
ticlopidinaclopidogrel
prasugrel
MetabólitoAtivo
ticagrelorcangrelor
A2
PAR-1
αIIbβ3
αIIbβ3
PAR-4TPa
GPVI 5TH2A P2Y1
P2X1
P2Y12
vorapaxar
1
Rev Soc Cardiol Estado de São Paulo 2016;26(1):21-6
REVISÃO/REVIEW
RESUMOA insuficiência cardíaca refratária e o choque cardiogênico estão relacionados a
elevadas taxas de mortalidade e a baixa qualidade de vida. As estratégias de tratamento para esses pacientes foram limitadas, nos últimos anos, às terapias farmacológicas que pouco modificaram a evolução da doença. Entretanto, com o desenvolvimento tecnológi-co em dispositivos mecânicos de suporte circulatório, diversas modalidades terapêuticas utilizando diferentes tipos de tecnologia proporcionam melhor suporte hemodinâmico, diminuição e reversão de disfunções orgânicas causadas pela insuficiência cardíaca. Esses dispositivos quando indicados corretamente melhoram os desfechos clínicos de pacientes que aguardam transplante cardíaco e dos que não são candidatos a trans-plante. Atualmente, observam-se indicações cada vez mais precoces de dispositivos de suporte circulatório, tornando-os uma terapia essencial no manejo de pacientes com insuficiência cardíaca refratária ou choque cardiogênico. Esta revisão abordará os prin-cipais tipos de dispositivos disponíveis em nosso país e suas indicações.
Descritores: Coração Auxiliar, Circulação Assistida, Suporte Circulatório Mecânico, In-suficiência Cardíaca, Choque Cardiogênico, Transplante de Coração.
ABSTRACTThe refractory heart failure and cardiogenic shock are related to high rates of mortality and
poor quality of life. Treatment strategies for these patients have been limited in the last years to pharmacological therapies that change only slightly the evolution of the disease. However, with technological advances in mechanical devices for circulatory assistance, various thera-peutic modalities using different types of technology provide better hemodynamic support, reduction and reversal of organic dysfunction caused by heart failure. When properly indi-cated, these devices can provide better clinical outcomes of patients on heart transplantation waiting list and those who are not candidates for transplantation. Contemporarily, indications for mechanical support devices are occurring increasingly earlier, making them an essential therapy in the management of patients with refractory heart failure or cardiogenic shock. This review covers the different types of devices available in our country and its indications.
Descriptors: Heart-Assist Devices, Assisted Circulation, Mechanical Circulatory Support, Heart Failure, Cardiogenic Shock, Heart Transplantation
Elias Knobel1 Bruno Biselli2 Paulo Manuel Pêgo Fernandes2
1. Hospital Israelita Albert Einstein, São Paulo,Brasil .2. Instituto do Coração do Hospital das Clínicas da Faculdade de Medicina da Universidadede São Paulo, São Paulo, Brasil.
Correspondência: Bruno Biselli. Endereço: Av. Dr Enéas Carvalho de Aguiar, 44. [email protected].
INDICAÇÕES DE DISPOSITIVOS MECÂNICOS DE SUPORTE NA INSUFICIÊNCIA CARDÍACA REFRATÁRIA
INDICATIONS OF MECHANICAL SUPPORT DEVICES IN REFRACTORY HEART FAILURE
INTRODUÇÃONos últimos 20 anos diversas terapias farmacológicas
e dispositivos como cardiodesfibrilador implantável e te-rapia de ressincronização melhoraram significativamente o prognóstico dos pacientes com insuficiência cardíaca (IC) crônica. Porém, apesar dessa terapia otimizada, nota--se em alguns pacientes uma progressão de sintomas e refratariedade ao tratamento, com comprometimento he-modinâmico e múltiplas hospitalizações.1
Essa refratariedade ao tratamento clínico otimizado é referida como IC refratária ou avançada e seus critérios são descritos na Tabela 1.2
A IC avançada representacerca de 10% dos pacientes com insuficiência cardiaca e está relacionada a uma baixa qualidade de vida e múltiplas internações. Nos últimos 15 anos, nenhuma droga nova mostrou beneficio em redu-zir a mortalidade desse tipo de paciente e a progressão da doença ainda parece ser inevitável acarretando umprognóstico pior em relação aos pacientes com IC es-táveis.3 A taxa de mortalidade desses pacientes gira em torno de 50% em 1 ano e o cenário é ainda mais dramático naqueles internados e dependentes de inotrópicos cuja a mortalidade anual chega a mais de 75%.4,5
O transplante cardíaco (TC) é o único tratamento definitivo
ESTRATÉGIAS ANTIPLAQUETÁRIAS ORAIS NAS FASES AGUDA E CRÔNICA DAS SíNDROMES CORONARIANAS AGUDAS.
rev Soc Cardiol estado de São paulo 2016;26(2):112-9

114
composto de óbito, reinfarto e AVC em relação ao placebo, quando clopidogrel foi associado ao AAS. O mesmo estudo demonstrou ainda diminuição significativa na mortalidade global (redução de risco relativo de 7%, p=0,03).10 Em ambos os estudos, o clopidogrel foi utilizado somente durante a fase de hospitalização, o que talvez explique o fato de que não se detectou aumento significativo na incidência de sangramento maior com o uso do medicamento, em relação a placebo.
Em relação à dose, o estudo CURRENT-OASIS 7 testou a hipótese de que dose dobrada do clopidogrel (600 mg dose de ataque seguida de 150 mg/dia por 1 semana) poderia ser superior à dose convencional de 300 mg dose de ataque seguida por 75 mg/dia. No total dos aproximadamente 25000 pacientes com SCA (com e sem supradesnível do segmento ST) incluídos, não foi demonstrada diferença significativa em relação ao desfecho primário de óbito cardiovascular, IAM e AVC entre as duas doses testadas. Entretanto, no subgrupo de pacientes submetido à ICP, demonstrou-se benefício significati-vo da dose maior em relação ao desfecho principal (p=0,036; NNT=167), porém, as custas de significativo aumento na incidência de sangramento maior (p=0,01; NNH=200).11
Finalmente, no longo prazo pós-IAM, com todas as limitações que se deve ter em análises de subgrupo, o estudo CHARISMA (que no geral foi neutro) sugeriu benefício do uso do clopidogrel contra placebo na subpopulação de pacientes com IAM prévio.12
Apesar das evidências a favor de sua eficácia em di-versos cenários das SCA, o clopidogrel apresenta diversas limitações. Primeiramente, por ser uma pró-droga, necessita de ativação no citocromo P450, o que implica efeito lento e incompleto na inibição da agregação plaquetária. Na realida-de, cerca de 30% dos pacientes apresentam má resposta ao medicamento inclusive durante a fase crônica de tratamento, colocando-os em risco aumentado de eventos trombóticos recorrentes.13 Por último, o clopidogrel é sujeito a diversas interações genéticas e medicamentosas por conta do seu complexo metabolismo via citocromo P450, o que contribui na diminuição da sua potência antiagregante plaquetária.14 Em resumo, sabe-se que o clopidogrel tem um lento início de ação, uma inibição média da agregabilidade aquém do ideal, e uma grande variação de resposta individual, principalmente relacionada a interações medicamentosas e presença de polimorfismos, o que levou ao desenvolvimento de novos bloqueadores do P2Y12, descritos na sequencia.15
“Novos” bloqueadores de adPOs “novos” bloqueadores do receptor P2Y12 do ADP têm
em comum o fato de que, em relação ao clopidogrel, apre-sentam início de ação mais rápido, bloqueiam a agregação plaquetária de modo mais intenso e apresentam menor va-riabilidade de resposta.
Prasugrel É um tienopiridínico de 3a geração (ticlopidina->clopidogrel-
->prasugrel) que, à semelhança dos seus antecessores, age bloqueando de maneira irreversível o receptor P2Y12. No estudo TRITON, o prasugrel foi significativamente superior ao clopi-dogrel no que se refere à redução do desfecho composto de morte cardiovascular, reinfarto e AVC (às custas de diminuição na incidência de reinfarto), em pacientes apresentando SCA com e sem supradesnível de ST tratados por ICP. Apesar do
aumento significativo encontrado na incidência de sangramento maior no grupo prasugrel, o benefício líquido (13%) foi favorável ao composto mais recente. Importante salientar que não houve benefício nos pacientes idosos (>75 anos de idade) ou com baixo peso (<60 kg) – nessas situações o medicamento deve ser utilizado com dose pela metade. Ainda, o benefício líquido foi desfavorável ao prasugrel nos indivíduos com AVC ou ata-que isquêmico transitório (AIT) prévios, sendo o medicamento contraindicado nessas duas situações.16
Já o estudo TRILOGY incluiu pacientes com SCA sem supradesnivel de ST tratados de forma clínica, portanto sem revascularização, durante a hospitalização inicial. Nesse es-tudo, ao contrário do anterior, o prasugrel não foi superior ao clopidogrel na redução de eventos trombóticos, e tampouco foi observado aumento significativo de sangramento.17
Devido ao início de ação mais rápido, seria possível que o prasugrel tivesse alguma vantagem adicional se utilizado ainda na sala de emergência, em relação ao uso somente no labora-tório de hemodinâmica após a visualização da anatomia coro-nária, conforme testado no TRITON. Essa hipótese foi testada no estudo ACCOAST, que não demonstrou qualquer vantagem dessa estratégia em relação àquela do TRITON, demonstrando, ao contrário, desvantagem ao aumentar sangramento maior.18
ticagrelorAo contrário dos tienopiridínicos, esse composto é um
bloqueador reversível do receptor P2Y12. No estudo PLATO, o ticagrelor foi superior ao clopidogrel na redução do desfe-cho composto de morte cardiovascular, reinfarto e AVC em pacientes apresentando SCA com ou sem supradesnível de ST, independente do tratamento de revascularização utilizado (ICP, cirurgia de revascularização do miocárdio ou tratamento clínico). Não houve aumento de sangramento global, embora tenha havido maior incidência de sangramento não relacionado a procedimento cirúrgico no grupo ticagrelor. Além da redução do desfecho composto, demonstrou-se também redução de reinfarto, óbito cardiovascular e óbito global individualmente. Os efeitos colaterais que tiveram incidências significativamente maiores no grupo ticagrelor incluíram: bradicardia e pausas sinu-sais, entretanto sem que houvesse aumento na necessidade de marcapasso, e dispneia, que levou à interrupção do tratamento em aproximadamente 1% dos casos.19 O achado de dispneia tem levado a grandes discussões na literatura, já que não se relaciona à piora da função ventricular. Admite-se atualmente que a dispneia observada com o ticagrelor esteja relacionada ao aumento dos níveis circulantes da adenosina, já que o medica-mento inibe a recaptação celular da adenosina, principalmente pelos glóbulos vermelhos.20 Levando-se em conta demons-trações prévias do efeito benéfico da adenosina no infarto do miocárdio21 e sub-análise do próprio estudo PLATO, admite-se que esse “efeito colateral” do ticagrelor poderia explicar parte dos benefícios encontrados com o medicamento, inclusive, ao menos a diminuição de mortalidade observada.22 Importante salientar que o estudo PLATO incluiu pacientes com todas as formas de apresentação da SCA, com exceção de pacientes com IAM com supradesnível de ST tratados com fibrinolíticos, que no momento estão sendo estudados em estudo multicêntrico internacional de iniciativa brasileira (NCT 02298088).
No IAM com supradesnível de ST submetido à ICP pri-mária, o estudo ATLANTIC testou a hipótese de que o uso
rev Soc Cardiol estado de São paulo 2016;26(2):112-9

115
do ticagrelor em ambulância, portanto antes da chegada ao hospital, poderia acrescentar benefício, em relação à sua utilização hospitalar na sala de hemodinâmica. O estudo não mostrou redução significativa nos seus dois desfechos primários, fluxo TIMI 3 na coronariografia pré-ICP e melhora >70% no supradesnível do segmento ST antes da ICP. Por outro lado, a incidência de sangramento foi baixa e igual nos dois grupos. Considera-se que a principal limitação do estudo foi o fato de que houve apenas 31 minutos de diferença em relação à utilização dos medicamentos nos dois grupos.23
Finalmente, no longo prazo pós-IAM, o estudo PEGASUS testou ticagrelor em duas doses diferentes (90 e 60 mg de 12 em 12 horas) versus placebo, associado ao AAS, em pacientes com história de IAM entre um e três anos antes da randomização. O estudo demonstrou, ao longo de dois anos e meio de seguimento médio, redução significativa no desfecho composto de morte cardiovascular, reinfarto e AVC. Ao mesmo tempo, houve aumento significativo na incidência de sangramento maior (principalmente com a dose de 90 mg) mas não de sangramento fatal (tanto na população global quanto com as diferentes doses testadas).24 Por conta desse estudo, a dose de 60 mg do ticagrelor foi aprovada para uso no longo prazo pós-IAM em diversos países, inclusive EUA.
vorapaxarAlém dos bloqueios das ações do tromboxano A2 e do
ADP, o bloqueio da ação da trombina também poderia de-sempenhar importante papel no tratamento das SCA. O vo-rapaxar é um medicamento que age bloqueando o receptor PAR-1 (protease activated receptor – receptor ativado por protease), responsável pela agregação plaquetária mediada pela trombina. Estudos de fase dois mostraram que essa via
seria especialmente atrativa, pois aparentemente quando inibida levava a importante bloqueio da agregação plaque-tária, sem aumento significativo de sangramento, sobretudo sangramento periprocedimento.25 O estudo TRACER testou a associação de vorapaxar versus placebo em cerca de 12 mil pacientes com SCA sem supradesnível de ST tratados invasivamente, adicionado ao uso de AAS e anti-ADP. O es-tudo não mostrou diferença significativa entre os grupos em relação ao desfecho primário composto de morte, reinfarto, AVC, isquemia recorrente ou necessidade de revascularização de urgência e, ao contrário do esperado, demonstrou aumento de sangramento maior, incluindo um incremento de quase quatro vezes no risco de hemorragia intracraniana.26
Já o uso do produto contra placebo, no longo prazo após IAM, foi testado no estudo TRA-2P. No total foram incluídos >26.000 pacientes, todos estáveis com IAM ou AVC isquê-mico entre 14 dias e 12 meses antes da randomização, ou doença arterial periférica (DAP). No global, demonstrou-se redução significativa no desfecho composto de morte car-diovascular, reinfarto e AVC no grupo vorapaxar, às custas de significativo aumento na incidência de sangramento maior e de hemorragia intracraniana.27 Análise secundária demonstrou ausência de interação do sangramento com o fato de o paciente utilizar AAS isoladamente ou em conjunto com um anti-ADP.28 Como os sangramentos ocorreram de forma muito mais marcante no grupo com AVC prévio, foi realizada nova análise excluindo-se pacientes com AVC prévio. Nesta análise, que incluiu 20170 pacientes com IAM prévio e/ou doença arterial periférica, o benefício líquido foi significativamente favorável ao vorapaxar (principalmente no grupo com IAM prévio), levando o produto a ser aprovado para essa indicação em diferentes países, inclusive EUA.29
ESTRATÉGIAS ANTIPLAQUETÁRIAS ORAIS NAS FASES AGUDA E CRÔNICA DAS SíNDROMES CORONARIANAS AGUDAS.
Tabela 1. Medicamentos antiplaquetários nas síndromes coronárias agudas.
Medicamento Mecanismo de ação Indicação clínica Dose
Ácido acetilsalicílico (AAS)
inibição da síntese de tromboxano A2 por bloqueio irreversível da enzima CoX-1
todos os pacientes com doença aterotrombótica, independente se agudos ou crônicos
Ataque: 165 a 325 mg
manutenção: 75 a 165 mg/dia
ClopidogrelBloqueio irreversível do receptor p2Y12, evitando a ação agonista plaquetária do Adp
todas as formas de apresentação das SCACoronariopatia crônica tratada com iCp com stents
Ataque: 300 a 600 mg
manutenção: 75 mg/dia
prasugrelBloqueio irreversível do receptor p2Y12, evitando a ação agonista plaquetária do Adp
SCA tratada com iCp oBS: contraindicado se AVC ou Ait prévios
Ataque: 60 mgmanutenção: 10 mg/diaoBS: utilizar metade da doe se peso < 60 kg ou idade >75 anos
ticagrelor Bloqueio reversível do receptor p2Y12, evitando a ação agonista plaquetária do Adp
todas as formas de apresentação das SCA, exceto iAm com supradesnível do segmento St tratado com fibrinolítico. pacientes crônicos com infarto prévio entre 1 e 3 anos (indicação pendente no Brasil)oBS: contraindicado se alto risco para bradicardia
Ataque: 180 mg
manutenção: 90 mg 2 vezes ao dia no paciente agudo; 60 mg 2x ao dia no paciente crônico
Vorapaxar Bloqueio do receptor pAr-1, impedindo a ativação plaquetária induzida pela trombina
pós iAm (pelo menos 14 dias) ou doença vascular periférica de extremidades, em associação ao AAS com ou sem anti-Adp (indicação pendente no Brasil)
manutenção: 2,5 mg/dia
rev Soc Cardiol estado de São paulo 2016;26(2):112-9

116
figura 2. Algoritmo para duração do tratamento como inibidor do p2Y12 em pacientes com doença arterial coronária tratados com dupla antiagregação plaquetária.
Sem alto risco de sangramento e sem sangramento visível com DAP
Classe IIb: 12 meses podem ser razoáveis
Classe I: Pelo menos
12 meses (clopidogrel,
ticagrelor)
Classe I: Mínimo de
14 dias e de idealmente pelo menos
12 meses (clopidogrel)
Sem alto risco de sangramento e sem sangramento visível com DAP
Classe IIb: 12 meses
podem ser razoáveis
(clopidogrel)
Classe I: Pelo menos
6 meses (clopido-
grel)
Classe I: Pelo menos 1 mês (clo-pidogrel)
Classe III: Sem benefício
12 meses
6 meses
0 mês
Classe IIb: > 1 mês pode ser
razoável
Classe IIb: > 6 meses podem ser razoáveis
Classe I: Pelo menos
12 meses (clopidogrel,
prasugrel, ticagrelor)
Classe I: Depois de CRM, reto-
mar inibidor P2Y12 para completar um ano de
DAP
Terapia clínica
Lítica (IMSST)
ICP (SMD ou SEM) CRM
Sem Ht de ICP de CRM
recente SMD SEM
DAC
SCA agudo/recente (SSDST-SCA ou IMSST)
SQ de ICP SQ de CRM
DCIE
reCoMeNdaÇÕes das diretriZesEm diferentes formas de apresentação das SCA (angina
instável, IAM com ou sem supradesnível do segmento ST), a DAP é indicada desde o início do tratamento, devendo ser mantida por pelo menos um ano, ressalvando-se aspectos de contra-indicações, tolerabilidade, disponibilidade e custo. Nas SCA com ou sem supradesnível de ST em que o inicio do trata-mento ocorre na sala de hemodinâmica após o conhecimento da anatomia coronária, o AAS pode ser associado a qualquer dos três anti-ADP anteriormente citados. Nas situações em que o tratamento se inicia antes do conhecimento da anatomia coronária, apenas o clopidogrel e o ticagrelor são indicados. No IAM com supradesnível de ST tratado com fibrinolítico, o clopidogrel é o anti-ADP de escolha.30-35 Em relação ao AAS, este deve ser mantido por tempo indeterminado. Doses bai-xas (81 a 100 mg por dia) são indicadas, pois como referido previamente doses maiores não reduzem eventos isquêmicos e aumentam as taxas de sangramento.11
dUraÇÃo ideaL da dUPLa aNtiagregaÇÃo PLaQUetÁria
Por conta basicamente do alto risco residual de eventos isquêmicos no longo prazo pós-SCA,36-38 tem havido grandes discussões na literatura sobre o tempo ideal de utilização da DAP após a fase inicial da doença.
Por conta da relevância do tema, diversas metanálises foram publicadas, mas de forma isolada não conseguiram apontar caminhos seguros, até porque os enfoques eram
bastante diferentes (pacientes com stents recobertos de primeira ou segunda geração, análise independente do uso de stent, etc).39-41
No sentido de tentar equacionar o problema, as socieda-des Norte-Americanas de Cardiologia publicaram, neste ano de 2016, uma revisão sistemática juntamente com uma diretriz sobre o assunto. Como pode ser visto na Figura 2, tal diretriz recomenda idealmente a utilização de DAP por 12 meses após um episódio de coronariopatia aguda (classe I), e tempos maiores do que 12 meses em pacientes com ausência de alto risco de sangramento e sem sangramento durante a utilização de DAP (IIb). Outras recomendações incluem a preferência de ticagrelor ou prasugrel sobre o clopidogrel em pacientes com SCA tratados com ICP (classe IIa), e a suspensão da DAP após seis meses em pacientes submetidos à ICP com alto risco de sangramento ou sangramento significativo (classe IIb).42
Em resumo, o tempo de utilização da DAP pós-SCA vai depender de uma análise cuidadosa do risco de eventos isquê-micos vs. risco de sangramento apresentado pelo paciente. No sentido de facilitar tal avaliação, no momento apenas o escore DAPT colocou numa mesma equação as duas variáveis, ana-lisando assim o benefício líquido de se manter ou não a DAP por tempo maior do que um ano.43 Entretanto, apesar de útil, a aplicação desse escore precisa ser feita com cautela, pois foram incluídos no estudo apenas pacientes aderentes ao tratamento que não tinham apresentado nenhum sangramento nos 12 me-ses iniciais de tratamento com DAP, apenas 1/3 da população apresentava SCA, e a totalidade dos pacientes foi submetido a tratamento com stent (a grande maioria farmacológico).44
Adaptado da referência 42
rev Soc Cardiol estado de São paulo 2016;26(2):112-9

117
CoNtrovÉrsias atUais e QUestÕes NÃo resoLvidas
Apesar do enorme conhecimento adquirido em tempos recen-tes sobre os antiplaquetários, várias questões permanecem não esclarecidas. Na sequência são mencionados alguns exemplos:
Qual o melhor anti-adP a ser utilizado com o aas?
Nenhum grande estudo com poder estatístico suficiente para avaliar desfechos clínicos comparou os novos anti-ADP entre si. Em estudo com desfecho farmacodinâmico, o ticagre-lor foi superior ao prasugrel na inibição da agregabilidade pa-quetária, porém o significado clínico de tal achado é incerto45.
o aas é necessário quando utilizado em conjunto com novos antitrombóticos?
Apesar da eficácia inquestionável do AAS e de seu papel estabelecido como medicamento padrão no tratamento das SCA existe, atualmente, espaço para se questionar se seu uso em conjunto com novos antitrombóticos mais potentes acrescentaria benefício, ou somente aumentaria sangramento. Estudo mecanístico recente testando ticagrelor em voluntários sadios, sugere que a segunda hipótese poderia ser a verda-deira.46 Nesta linha, o estudo TWILIGHT (NCT02270242) está testando ticagrelor + AAS versus ticagrelor isolado em 9000 pacientes submetidos à ICP de alto risco, e o estudo GEMINI--ACS 1, de fase 2, está testando em pacientes com SCA com ou sem supradesnível de ST se a rivaroxabana na dose de 2,5 mg duas vezes ao dia em associação ao ticagrelor ou clopidogrel seria mais segura, ou até mesmo mais eficaz, do que o AAS.47
Qual a importância clinica da interação medicamentosa entre inibidores de bomba de próton (iBP) e clopidogrel?
Metanálise publicada por Hulot et al., demonstrou au-mento significativo de mortalidade em pacientes utilizando IBP + clopidogrel, em relação a pacientes utilizando clopi-dogrel isolado, principalmente às custas daqueles com alto risco para eventos isquêmicos.48 A publicação mais recente sobre o assunto, sub-análise pré-especificada do estudo TRILOGY, demonstrou diminuição significativa na incidência de IAM a favor do prasugrel, em relação ao clopidogrel, no grupo de pacientes que utilizava IBP, ao contrário daqueles que não utilizavam IBPs, nos quais não se encontrou dife-rença significativa entre os grupos em relação à incidência de eventos isquêmicos aos três anos de seguimento. Os resultados obtidos foram consistentes, independentemente do IBP utilizado.38 Saliente-se que os dados mais recentes corroboram achados prévios, que já haviam levado as autoridades norte-americanas a recomendarem evitar-se a utilização de clopidogrel com omeprazol, o que coloca os bloqueadores de receptor H2, como a ranitidina, como alternativa atraente nessa situação. Os poucos estudos que avaliaram possíveis interações entre esse medicamento e clopidogrel sugerem que não exista qualquer interação entre os dois compostos, sendo, portanto, os bloqueadores do re-ceptor H2 uma boa alternativa aos IBPs, nessa situação.49,50
Qual a importância clínica da interação entre morfina e anti-adP?
Publicação do registro CRUSADE em pacientes com SCA sem supradesnível do segmento ST encontrou aumento de mortalidade nos indivíduos que haviam feito uso de morfi-na endovenosa.51 Mais recentemente o estudo ATLANTIC, citado anteriormente, que testou o uso do ticagrelor já na ambulância ou apenas no hospital, e que foi neutro no global, encontrou benefício significativo do uso precoce do ticagrelor, em relação ao uso mais tardio nos indivíduos que receberam morfina IV.23 A causa de tal interação pode estar na alteração da absorção dos medicamentos, já que os antiplaquetários são utizados por via oral e os opióides causam retardo no trânsito gastrointestinal, havendo evidência laboratorial desta hipótese com clopidogrel, prasugrel e ticagrelor.52,53
Ainda no campo das controvérsias, existe espaço para a possibilidade de terapia antiplaquetária personalizada, por meio de testes genéticos ou mesmo testes que avaliam a agregabi-lidade plaquetária. Evidências robustas ligam maior incidência de eventos clínicos em indivíduos portadores de polimorfismos genéticos que levam à perda de função do citocromo 2C19, a principal enzima envolvida no metabolismo do clopidogrel de pró-droga para forma ativa. O aumento de risco existe tanto para heterozigotos como para homozigotos, sendo mais con-tundente com os últimos, já que apresentam redução total da atividade da enzima.54 Metanálise de estudos que avaliaram a influência genética no desenvolvimento de eventos clínicos, mostraram aumento de eventos isquêmicos e mortalidade, semelhante ao que foi descrito para os IBPs.48 No entanto, existem também evidências de que os polimorfismos explicam somente 12% da variabilidade na resposta ao clopidogrel.55
Em relação aos testes de agregabilidade plaquetária, um campo em grande desenvolvimento, existem evidências de correlação entre a agregrabilidade avaliada em laboratório com eventos isquêmicos e hemorrágicos;56 entretanto; não se conseguiu provar até o momento que uma terapêutica guiada por esses testes possa modificar prognóstico.57 Estudo rando-mizado em desenvolvimento no nosso centro, com pacientes apresentando SCA e indicação de cirurgia de revascularização do miocárdio, está testando se uma estratégia de suspensão do anti-ADP guiada por exame de agregação plaquetária poderia encurtar o tempo de encaminhamento do paciente à cirurgia, em comparação aos cinco dias recomendados (NCT 02516267).
Outra dúvida, é o que fazer em caso de pacientes que necessitem de DAP e de anticoagulação oral, sobretudo em portadores de fibrilação atrial não valvar. O único estudo rando-mizado sobre o tema mostrou que a estratégia de terapia dupla (um anti-ADP mais o anticoagulante oral), foi mais segura do que a terapia tripla (aspirina, anti-ADP e anticoagulante), com redução significativa de sangramento maior e menor incidência de eventos trombóticos. Vale ressaltar que esse estudo não teve tamanho amostral suficiente para avaliar de forma defini-tiva desfechos isquêmicos, e que o número de pacientes com SCA foi muito baixo; além disso, foram estudados somente o clopidogrel como anti-ADP e a varfarina como anticoagulante oral.58 No momento, não existe resposta em relação aos novos anti-ADPs nem em relação aos novos anticoagulantes orais, rivaroxabana, dabigatrana, apixabana e edoxabana. Pelo menos três estudos randomizados em andamento, PIONEER, com rivaroxabana (NCT 01830543), REDUAL-PCI com dabigatrana
ESTRATÉGIAS ANTIPLAQUETÁRIAS ORAIS NAS FASES AGUDA E CRÔNICA DAS SíNDROMES CORONARIANAS AGUDAS.
rev Soc Cardiol estado de São paulo 2016;26(2):112-9

118
referÊNCias 1. Stone E. An Account of the Success of the Bark of the Willow in the
Cure of Agues. In a Letter to the Right Honourable George Earl of Macclesfield, President of R. S. from the Rev. Mr. Edmund Stone, of Chipping-Norton in Oxfordshire Phil Trans. 1763;(53):195-200.
2. Roth GJ, Calverley DC. Aspirin, platelets, and thrombosis: theory and practice. Blood. 1994;83(4):885-98.
3. Lewis HD Jr, Davis JW, Archibald DG, Steinke WE, Smitherman TC, Doherty JE 3rd, et al. Protective effects of aspirin against acute myocardial infarction and death in men with unstable angina. Results of a Veterans Administration Cooperative Study. N Engl J Med. 1983;309(7):396-403.
4. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ. 2002;324(7329):71-86.
5. Theroux P, Ouimet H, McCans J, Latour JG, Joly P, Levy G, et al. Aspirin, heparin, or both to treat acute unstable angina. N Engl J Med. 1988;319(17):1105-11.
6. Randomised trial of intravenous streptokinase, oral aspirin, both, or neither among 17,187 cases of suspected acute myocardial infarction: ISIS-2. ISIS-2 (Second International Study of Infarct Survival) Collaborative Group. Lancet. 1988;2(8607):349-60.
7. Yusuf S, Zhao F, Mehta SR, Chrolavicius S, Tognoni G, Fox KK; Clopidogrel in Unstable Angina to Prevent Recurrent Events Trial Investigators. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Engl J Med. 2001;345(7):494-502.
8. Yusuf S, Mehta SR, Zhao F, Gersh BJ, Commerford PJ, Blumenthal M, et al. Early and late effects of clopidogrel in patients with acute coronary syndromes. Circulation 2003;107(7):966-72.
9. Sabatine MS, Cannon CP, Gibson CM, López-Sendón JL, Mon-talescot G, Theroux P, et al. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST-segment elevation. N Engl J Med. 2005;352(12):1179-89.
10. Chen ZM, Jiang LX, Chen YP, Xie JX, Pan HC, Peto R, et al. Addition of clopidogrel to aspirin in 45,852 patients with acute myocardial infarction: randomised placebo-controlled trial. Lancet. 2005;366(9497):1607-21.
11. Mehta SR, Tanguay JF, Eikelboom JW, Jolly SS, Joyner CD, Granger CB, et al. Double-dose versus standard-dose clopidogrel and high-dose versus low-dose aspirin in individuals undergoing percutaneous coronary intervention for acute coronary syndromes (CURRENT-OA-SIS 7): a randomised factorial trial. Lancet. 2010;376(9748):1233-43.
12. Bhatt DL, Fox KA, Hacke W, Berger PB, Black HR, Boden WE, et al. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N Engl J Med. 2006;354(16):1706-17.
13. Gurbel PA, Bliden KP, Hiatt BL, O’Connor CM. Clopidogrel for coro-
nary stenting: response variability, drug resistance, and the effect of pretreatment platelet reactivity. Circulation. 2003;107(23):2908-13.
14. Siller-Matula JM, Trenk D, Krähenbühl S, Michelson AD, Delle-Karth G. Clinical implications of drug-drug interactions with P2Y12 receptor inhibitors. J Thromb Haemost. 2014;12(1):2-13.
15. James S, Akerblom A, Cannon CP, Emanuelsson H, Husted S, Katus H, et al. Comparison of ticagrelor, the first reversible oral P2Y(12) receptor antagonist, with clopidogrel in patients with acute coronary syndromes: Rationale, design, and baseline character-istics of the PLATelet inhibition and patient Outcomes (PLATO) trial Am Heart J. 2009;157(4):599-605.
16. Wiviott SD, Braunwald E, McCabe CH, Montalescot G, Ruzyllo W, Gottlieb S, et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2007;357(20):2001-15.
17. Roe MT, Armstrong PW, Fox KA, White HD, Prabhakaran D, Goodman SG, et al. Prasugrel versus clopidogrel for acute coronary syndromes without revascularization. N Engl J Med. 2012;367(14):1297-1309.
18. Montalescot G, Bolognese L, Dudek D, Goldstein P, Hamm C, Tanguay JF, et al. Pretreatment with prasugrel in non-ST segment elevation acute coronary syndromes. N Engl J Med. 2013;369(11):999-1010.
19. Wallentin L, Becker RC, Budaj A, Cannon CP, Emanuelsson H, Held C, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2009;361(11):1045-57.
20. Cattaneo M, Schulz R, Nylander S. Adenosine-mediated effects of ticagrelor: evidence and potential clinical relevance. J Am Coll Cardiol. 2014;63(23):2503-9.
21. Ross AM, Gibbons RJ, Stone GW, Kloner RA, Alexander RW; AMISTAD-II Investigators. A randomized, double-blinded, placebo-controlled multicenter trial of adenosine as an adjunct to reperfu-sion in the treatment of acute myocardial infarction (AMISTAD-II). J Am Coll Cardiol. 2005;45(11):1775-80.
22. Storey RF, Becker RC, Harrington RA, Husted S, James SK, Cools F, et al. Characterization of dyspnea in PLATO study patients treated with ticagrelor or clopidogrel and its association with clinical outcomes. Eur Heart J. 2011;32(23):2945-53.
23. Montalescot G, van’t Hof AW, Lapostolle F, Silvain J, Lassen JF, Bolognese L, et al. Prehospital Ticagrelor in ST-Segment Eleva-tion Myocardial Infarction. N Engl J Med. 2014;371(11):1016-27.
24. Bonaca MP, Bhatt DL, Cohen M, Steg PG, Storey RF, Jensen EC, et al. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med 2015;372(19):1791-800.
25. Becker RC, Moliterno DJ, Jennings LK, Pieper KS, Pei J, Nieder-man A, et al. Safety and tolerability of SCH 530348 in patients undergoing non-urgent percutaneous coronary intervention: a
(NCT 02164864) e AUGUSTUS com apixabana (NCT 02415400), se propõem a responder essa importante questão.
CoNCLUsÕes e PersPeCtivas fUtUras O tratamento antiplaquetário nas SCA, nas suas fases inicial
e tardia, sem dúvida alguma evoluiu de maneira importante nas últimas décadas. Entretanto, esse é um campo que continua apresentando enormes desafios, principalmente por conta do relativamente pouco que se sabe sobre as plaquetas, e por conta da chegada de diversos novos antitrombóticos ao mer-cado, fazendo com que a utilização adequada dos mesmos, principalmente em associação, seja um problema que se renova a cada dia. Se, por um lado, a DAP talvez tenha atingido o ápice de sua eficácia, é bem verdade que se deve aperfeiçoar a sua segurança, sobretudo em alguns subgrupos de pacientes, como aqueles em uso de anticoagulantes, com AVC prévio e em idosos. Num futuro de médio prazo, pode-se esperar que respostas para importantes questionamentos estarão sendo obtidas; por outro lado, é possível que o clopidogrel seja um antiplaquetário cada vez menos utilizado, embora isso depen-
da do equacionamento de diversas questões relacionadas principalmente a custo, disponiblidade, aceitação, experiência clínica com os novos anti-ADP e, principalmente, balanço entre o benefício antitrombótico e o risco isquêmico. Finalmente, é possível que se desenvolvam novas tecnologias, que nos permitam implementar estratégias terapêuticas personalizadas de forma mais segura em relação ao que temos atualmente.
CoNfLitos de iNteresseProf. Nicolau refere os seguintes potenciais conflitos de
interesse, relacionados à presente publicação:Coordenador Nacional e Membro do “Steering Committee” dos estudos TRITON, PLATO, TRACER e TRA-2P, citados no manuscri-to; “Grant” de pesquisa e/ou educacional e/ou honorários de consultoria/palestra: Astrazeneca, Daiichi-Sankyo, MSD, Sanofi. Dr. Remo é Investigador de estudos patrocinados pela indústria (AstraZeneca, Jansen, Boheringer, Amgem, Sanofi, Pfizer, Novartis).
rev Soc Cardiol estado de São paulo 2016;26(2):112-9

119
randomised, double-blind, placebo-controlled phase II study. Lancet. 2009;373(9667):919-28.
26. Tricoci P, Huang Z, Held C, Moliterno DJ, Armstrong PW, Van de Werf F, et al. Thrombin-receptor antagonist vorapaxar in acute coronary syndromes. N Engl J Med. 2012;366(1):20-33.
27. Morrow DA, Braunwald E, Bonaca MP, Ameriso SF,. Dalby AJ, Fish MP, et al. Vorapaxar in the secondary prevention of athero-thrombotic events. N Engl J Med. 2012;366(15):1404-13.
28. Bohula EA, Aylward PE, Bonaca MP, Corbalan RL, Kiss RG, Murphy SA, et al. Efficacy and Safety of Vorapaxar With and Without a Thieno-pyridine for Secondary Prevention in Patients With Previous Myocar-dial Infarction and No History of Stroke or Transient Ischemic Attack: Results from TRA 2°P-TIMI 50. Circulation. 2015;132(20):1871-9.
29. Magnani G, Bonaca MP, Braunwald E, Dalby AJ, Fox KA, Murphy SA, et al. Efficacy and safety of vorapaxar as approved for clinical use in the United States. J Am Heart Assoc. 2015;19;4(3):e001505.
30. Nicolau JC, Timerman A, Marin-Neto JA, Piegas LS, Barbosa CJ, Franci A. Diretrizes da Sociedade Brasileira de Cardiologia sobre angina instável e infarto agudo do miocárdio sem supradesnível do segmento ST (II edição, 2007) – atualização 2013/2014. Arq Bras Cardiol. 2014;102(3Supl 1):1–61.
31. Piegas LS, Timerman A, Feitosa GS, Nicolau JC, Mattos LAP, Andrade MD, et al. V Diretriz da Sociedade Brasileira de Cardio-logia sobre Tratamento do Infarto Agudo do Miocárdio com Su-pradesnível do Segmento ST. Arq Bras Cardiol. 2015; 105:1-105.
32. Amsterdam EA, Wenger NK, Brindis RG, Casey DE Jr, Ganiats TG, Holmes DR Jr, et al. 2014 AHA/ACC guideline for the Management of Patients with Non-ST-Elevation Acute Coronary Syndromes: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2014;64(24):e139-228.
33. O’Gara PT, Kushner FG, Ascheim DD, Casey DE Jr, Chung MK, de Lemos JA et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2013;61(4):e78-140.
34. Roffi M, Patrono C, Collet JP, Mueller C, Valgimigli M, Andreotti F, et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment eleva-tion: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC).Eur Heart J. 2016;37(3) :267-315
35. Steg PG, James SK, Atar D, Badano LP, Blömstrom-Lundqvist C, Borger MA, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2012;33(20):2569-619.
36. Fox KA, Carruthers KF, Dunbar DR, Graham C, Manning JR, De Raedt H, et al. Underestimated and under-recognized: the late consequences of acute coronary syndrome (GRACE UK-Belgian Study). Eur Heart J. 2010;31(22):2755-64.
37. Stone GW, Maehara A, Lansky AJ, de Bruyne B, Cristea E, Mintz GS, et al. A prospective natural-history study of coronary athero-sclerosis. N Engl J Med. 2011;364(3):226-35.
38. Nicolau JC, Bhatt DL, Roe MT, Lokhnygina Y, Neely B, Corbalan R, et al. Concomitant proton-pump inhibitor use, platelet activity, and clinical outcomes in patients with acute coronary syndromes treated with prasugrel versus clopidogrel and managed without revascularization: Insights from the Targeted Platelet Inhibition to Clarify the Optimal Strategy to Medically Manage Acute Coronary Syndrome trial. Am Heart J. 2015;170(4):683-94.
39. Giustino G, Baber U, Sartori S, Mehran R, Mastoris I, Kini AS et al. Duration of dual antiplatelet therapy after drug-eluting stent implantation: a systematic review and meta-analysis of random-ized controlled trials. J Am Coll Cardiol. 2015;65(13):1298-310.
40. Elmariah S, Mauri L, Doros G, Galper BZ, O’Neill KE, Steg PG, et al. Extended duration dual antiplatelet therapy and mortality: a sys-tematic review and meta-analysis. Lancet. 2014;385(9970):792-98.
41. Palmerini T, Benedetto U, Bacchi-Reggiani L, Della Riva D, Biondi-Zoccai G, Feres F, et al. Mortality in patients treated with ex-tended duration dual antiplatelet therapy after drug-eluting stent implantation: a pairwise and Bayesian network meta-analysis of randomised trials. Lancet. 2015;385(9985):2371-82.
42. Levine GN, Bates ER, Bittl JA, Brindis RG, Fihn SD, Fleisher LA, et al. 2016 ACC/AHA Guideline Focused Update on Du-
ration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease: A Report of the American College of Cardiol-ogy/American Heart Association Task Force on Clinical Prac-tice Guidelines. J Am Coll Cardiol. 2016;1097(16):01699-5.
43. Kereiakes DJ, Yeh RW, Massaro JM, Cutlip DE, Steg PG, Wiviott SD, et al. DAPT Score Utility for Risk Prediction in Patients With or Without Pre-vious Myocardial Infarction. J Am Coll Cardiol. 2016;1097(16): 01599-0.
44. Mauri L, Kereiakes DJ, Yeh RW, Driscoll-Shempp P, Cutlip DE, Steg PG, et al. Twelve or 30 months of dual antiplatelet therapy after drug-eluting stents. N Engl J Med. 2014;371(23):2155-66.
45. Alexopoulos D, Galati A, Xanthopoulou I, Mavronasiou E, Kas-simis G, Theodoropoulos KC. et al. Ticagrelor versus prasugrel in acute coronary syndrome patients with High on-clopidogrel platelet reactivity following percutaneous coronary intervention: a pharmacodynamic study. J Am Coll Cardiol. 2012;60(3):193-9.
46. Traby L, Kollars M, Kaider A, Eichinger S, Wolzt M, Kyrle PA. Effects of P2Y12 receptor inhibition with or without aspirin on hemostatic system activation: a randomized trial in healthy subjects. J Thromb Haemost. 2016; 14(2):273-81.
47. Povsic TJ, Roe MT, Ohman EM, Steg PG, James S, Plotnikov A, et al. A randomized trial to compare the safety of rivaroxaban vs aspirin in addition to either clopidogrel or ticagrelor in acute coronary syndrome: The design of the GEMINI-ACS-1 phase II study. Am Heart J. 2016;174:120-8.
48. Hulot JS, Collet JP, Silvain J, Pena A, Bellemain-Appaix A, Barthé-lémy O, et al. Cardiovascular risk in clopidogrel-treated patients according to cytochrome P450 2C19*2 loss-of-function allele or proton pump inhibitor coadministration. a systematic meta-analysis. J Am Coll Cardiol. 2010;56(2):134–43.
49. Pham JP, Ueno M, Tello-Montoliu A, Ferreiro JL, Tomasello SD, Dharmashankar K, et al. Impact of gastric acid-supressing thera-pies on platelet reactivity in patients with coronary artery disease treated with clopidogrel: results of a pharmacodynamic study. J Am Coll Cardiol. 2011;58(13):1396-8.
50. Furtado RHM, Franci A, Barbosa CJDG, Arantes FBB, Menezes FR, Filho CC, D´Amico EA, Strunz CMC, Freire BT, Nicolau JC. Drug Interaction Between Clopidogrel and Ranitidine or Omepra-zole in Patients With Coronary Heart Disease: a Double-Blind, Double-Dummy, Randomized Comparative Study. Poster comen-tado (moderated poster) apresentado no 63rd American College of Cardiology Scientific Session, 29 a 31 de março de 2014, Washington, EUA. J Am Coll Cardiol. 2014; 63(12_S): A1521.
51. Meine TJ, Roe MT, Chen AY, Patel MR, Washam JB, Ohman EM, et al. Association of intravenous morphine use and outcomes in acute coronary syndromes: results from the CRUSADE Quality Improvement Initiative. Am Heart J. 2005;149(6)0:1043-9.
52. Hobl EL, Stimpfl T, Ebner J, Schoergenhofer C, Derhaschnig U, Sunder-Plassmann R, et al. Morphine decreases clopidogrel concentrations and effects: a randomized, double-blind, placebo-controlled trial. J Am Coll Cardiol. 2014;63(7):630-5.
53. Parodi G, Bellandi B, Xanthopoulou I, Capranzano P, Capodanno D, Valenti R, et al. Morphine is associated with a delayed activ-ity of oral antiplatelet agents in patients with ST-elevation acute myocardial infarction undergoing primary percutaneous coronary intervention. Circ Cardiovasc Interv. 2014;8(1). pii: e001593.
54. Mega JL, Close SL, Wiviott SD, Shen L, Hockett RD, Brandt JT, et al. Cytochrome p-450 polymorphisms and response to clopi-dogrel. N Engl J Med. 2009;360(4):354-62.
55. Shuldiner AR, O’Connell JR, Bliden KP, Gandhi A, Ryan K, Horen-stein RB, et al. Association of cytochrome P450 2C19 genotype with the antiplatelet effect and clinical efficacy of clopidogrel therapy. JAMA. 2009;302(8):849-57.
56. Stone GW, Witzenbichler B, Weisz G, Rinaldi MJ, Neumann FJ, Metzger DC, et al. Platelet reactivity and clinical outcomes after coro-nary artery implantation of drug-eluting stents (ADAPT-DES): a pro-spective multicentre registry study. Lancet. 2013;382(9892):614–23.
57. Collet JP, Cuisset T, Rangé G, Cayla G, Elhadad S, Pouillot C, et al.; ARCTIC Investigators. Bedside monitoring to adjust antiplatelet therapy for coronary stenting. N Engl J Med. 2012;367(22):2100-9.
58. Dewilde WJ, Oirbans T, Verheugt FW, Kelder JC, De Smet BJ, Her-rman JP, et al.; WOEST study investigators. Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and undergoing percutaneous coronary intervention: an open-label, randomised, controlled trial. Lancet. 2013; 381(9872):1107-15.
ESTRATÉGIAS ANTIPLAQUETÁRIAS ORAIS NAS FASES AGUDA E CRÔNICA DAS SíNDROMES CORONARIANAS AGUDAS.
rev Soc Cardiol estado de São paulo 2016;26(2):112-9

120
revisÃo/review
resUMoApesar dos grandes avanços no tratamento médico, suporte farmacológico, técnicas de
reperfusão e o suporte mecânico, as síndromes coronarianas ainda representam uma das principais causas de morbidade e mortalidade. Abordagens agressivas de revascularização miocárdica parecem estar associadas à redução da mortalidade em pacientes com síndromes coronarianas agudas (SCA). O melhor momento da intervenção não deve apenas reduzir a mortalidade em curto prazo, mas também oferecer resultados satisfatórios em longo prazo.
Dependendo do tipo de evento, a síndrome coronariana aguda tem uma adequada modalidade terapêutica. Iremos abordar estratégias relacionadas ao infarto sem e com supra desnivelamento do segmento ST, infarto miocárdico com choque cardiogênico e as complicações mecânicas do infarto. De forma geral, a abordagem invasiva tem melhores resultados. Pacientes com infarto na fase aguda são abordados preferencialmente por técnicas percutâneas, pois a estratégia cirúrgica demanda tempo para a efetiva revascula-rização. Os resultados de seguimento em longo prazo variam de acordo com a extensão do infarto, a fração de ejeção e a anatomia coronariana. Aqueles pacientes que evoluem com choque cardiogênico têm alta mortalidade independente da estratégia utilizada. Pacientes que evoluem com complicações mecânicas, são necessariamente cirúrgicos, sendo que o melhor momento para a intervenção varia de acordo com a condição clínica e hemodinâmica.
Descritores: Síndrome coronariana aguda; Revascularização miocárdica; Mortalidade; Infarto.
aBstraCtDespite the great advances in medical treatment, pharmacological support, reperfusion techni-ques, and mechanical support, coronary syndromes are still among the main causes of morbidity and mortality. Aggressive myocardial revascularization approaches appear to be associated with reduced mortality in patients with ACS. The optimum moment of intervention should not only reduce mortality in the short term, but should also offer satisfactory results in the long term. Depending on the type of event, acute coronary syndrome has an adequate therapeutic modality. We address strategies related to infarction with and without ST segment elevation, myocardial infarction with cardiogenic shock, and mechanical complications of infarction. In general, the invasive approach has shown best results. Patients with infarction in the acute phase are preferably treated by percutaneous techniques, as the surgical approach requires time for effective revascularization. The long-term results vary, depending on the extent of the infarction, the ejection fraction, and the coronary anatomy. Patients who evolve with cardio-genic shock have high mortality, regardless of the strategy used. Patients who evolve with mechanical complications must undergo surgery, with the best moment for the intervention depending on the clinical and hemodynamic condition.
Descriptors: Acute coronary syndrome; Myocardial revascularization; Mortality; Infarction.
Alexandre C. Hueb1
Fabio B. Jatene1
1. Instituto do Coração do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, São Paulo, SP, Brasil.
Correspondência:Fabio B. Jatene, Instituto do Coração. Av. Dr. Enéas de Carvalho Aguiar, 44 - 5º andar, bloco 2, sala 5 - Cerqueira Cesar - São Paulo, SP, Brasil CEP [email protected]
aNÁLise CrítiCa do trataMeNto CirÚrgiCo Nas síNdroMes CoroNariaNas agUdas e
sUas CoMPLiCaÇÕes
CritiCaL aNaLYsis of sUrgiCaL treatMeNt iN aCUte CoroNarY sYNdroMes aNd its CoMPLiCatioNs
iNtrodUÇÃoA síndrome coronariana aguda (SCA) varia em gravidade
desde a angina instável, à evolução para o infarto agudo do
miocárdio (IAM) sem supra do segmento ST (NSTEMI), ao IAM com supra desnivelamento do segmento ST (STEMI) e o IAM com choque cardiogênico (SHOCK). Apesar dos gran-des avanços no tratamento médico, suporte farmacológico,
rev Soc Cardiol estado de São paulo 2016;26(2):120-7

121
técnicas de reperfusão e o suporte mecânico, as síndromes coronarianas ainda representam uma das principais causas de morbidade e mortalidade.1 O impacto do tratamento cirúrgico em pacientes com SCA permanece controverso.2 Abordagens agressivas de revascularização miocárdica parecem estar associadas à redução da mortalidade em pacientes com SCA. O melhor momento da intervenção não deve apenas reduzir a mortalidade em curto prazo, mas também oferecer resultados satisfatórios em longo prazo. O objetivo desse artigo é analisar as possibilidades cirúrgicas para pacientes com SCA.3
CLassifiCaÇÃo da síNdroMe CoroNariaNa agUda
É importante classificar a SCA, pois cada entidade deter-mina uma ação terapêutica adequada. Podemos estabelecer então, o NSTEMI, STEMI, SHOCK e as complicações mecâ-nicas do infarto, entre elas a ruptura do músculo papilar, a ruptura do septo interventricular e a ruptura da parede livre do ventrículo. Estudo envolvendo mais de 1.4 milhões de pacien-tes com IAM hospitalizados nos Estados Unidos, de 2001 a 2011 demonstrou uma queda no número de hospitalizações por IAM ao longo desse período, com redução da ocorrência de STEMI de 40,2% em 2001 para 26,9% em 2011, ou seja, uma redução de 33%. Em relação ao tratamento houve um aumento significativo de revascularização percutânea (PCI) em STEMI e NSTEMI. Em contraste, a porcentagem de revas-cularização cirúrgica do miocárdio (CRM), diminuiu 39% ao longo destes anos para STEMI e diminuiu 14% para NSTEMI.4
ModaLidades teraPÊUtiCasAnalisando o espectro de apresentações da SCA, de-
vemos considerar que, como são situações clínicas dife-rentes, demandam estratégias terapêuticas individualizadas direcionadas à severidade do infarto.5
Pacientes com SCA de moderado a alto risco tem re-comendação formal de abordagem invasiva, PCI ou CRM, pelas principais sociedades de cardiologia do mundo como a American Heart Association (AHA), American College of Cardiology (ACC) e European Society of Cardiology (ESC).6,7
Da mesma forma, podemos ressaltar que os eventos associados aos procedimentos percutâneos oferecem me-nos morbidade imediata quando comparados à intervenção cirúrgica, mas em longo prazo, apresentam maior recorrência de angina assim como necessidade de re-revascularização.8
Baseado nas Diretrizes e Consensos Brasileiros e inter-nacionais,5-7,9 as situações com indicação de CRM, têm sido cada vez menos frequentes e com indicações precisas. De forma clara o tempo entre o evento e a reperfusão, química, percutânea ou cirúrgica, é a variável mais importante quan-do consideramos as várias modalidades terapêuticas.10-12
Provavelmente a CRM com enxertos arteriais e sem a utilização de circulação extracorpórea seria uma ótima moda-lidade terapêutica. Mas a exequibilidade desse procedimento passa pelos obstáculos de estabelecer o diagnóstico, realizar o estudo angiográfico, solicitar exames pré-operatórios, iniciar a intervenção cirúrgica e reperfundir a artéria culpada em me-nos do que poucas horas. Nesse sentido, a CRM não constitui modalidade terapêutica preliminar para o IAM. Habitualmente, encaminha-se para intervenção cirúrgica aqueles pacientes
onde haja uma anatomia coronariana desfavorável, Syntax escore alto, tentativa falha de revascularização percutânea, SHOCK ou casos com complicações mecânicas.13
Segundo a Sociedade Brasileira de Cardiologia,9 dentre as principais indicações de CRM de urgência estão a ope-ração; após intervenção percutânea sem sucesso; angina recorrente; e revascularização associada à correção das complicações mecânicas do infarto.
tiPo de iNfatoinfarto agudo do Miocárdio sem supra desnivelamento do segmento st
A frequência e o tipo de IAM mudou nas últimas déca-das, sendo o NSTEMI o tipo mais prevalente. A recomen-dação da AHA, sugere terapia agressiva e precoce para esse grupo de pacientes.14
Existem etapas para diagnosticar e tratar esses pacien-tes. Primeiro, a indicação na admissão de realizar o estudo angiográfico, seguido pela análise e indicação do procedi-mento a seguir. Segundo, o tipo de procedimento ao qual o paciente poderá ser submetido, ou seja, PCI ou CRM. A análise do estudo TRILOGY ACS, publicado em 2015, de-monstrou que 76,2% dos pacientes com NSTEMI realizaram estudo angiográfico. Desses, um pouco mais que a metade foram submetidos a procedimentos intervencionistas, ou seja, 43,6% a PCI e 11,5% à CRM durante a mesma internação.15
Embora as estratégias intervencionistas no NSTEMI te-nham melhores resultados que o tratamento conservador, a decisão e o tipo de revascularização devem ser individualiza-dos para cada paciente.16 Entretanto, certos fatores favorecem uma modalidade terapêutica ou outra. As características anatômicas das coronárias são variáveis, que de maneira inconteste, devem ser sempre levadas em conta e são muito importantes para esta decisão. Lesões do tronco da coronária esquerda, lesões tri-arteriais ou lesão de duas artérias com doença ostial ou proximal do ramo interventricular anterior, são típicas indicações de CRM. Considerações relaciona-das aos achados anatômicos são a chave da tomada de decisões para a realização de revascularização cirúrgica ou percutânea. O registro CUSTOMIZE Registry reportou que a PCI em pacientes NSTEMI está associada a maiores riscos de eventos cardíacos adversos como: morte, IAM e maior necessidade de re-revascularização em um ano, quando comparado a CRM. Esses dados sugerem que a CRM deva ser selecionada preferencialmente naqueles pacientes com NSTEMI que tenham expectativa de menos eventos em longo prazo.17Além da análise da variável anatômica, certos grupos de pacientes também devem ser analisados de maneira diferenciada. Roe e colaboradores18 demonstraram que pa-cientes ≥ 75 anos com NSTEMI submetidos a CRM tiveram taxas de mortalidade menores que aqueles submetidos à PCI, em seguimento de cinco anos. Análises derivadas do estudo FREEDOM,19,20 sugerem que subgrupos de pacientes diabéticos com doença renal crônica e aterosclerose avan-çada com NSTEMI, devem ser encaminhados para CRM.
Apesar do aumentado risco de acidente vascular encefálico (STROKE) em seguimento de curto e médio prazo, associado a CRM em comparação com PCI, observou-se que essa di-ferença é reduzida ou anulada em pacientes com NSTEMI.18
ANÁLISE CRíTICA DO TRATAMENTO CIRúRGICO NAS SíNDROMES CORONARIANAS AGUDAS E SUAS COMPLICAÇõES
rev Soc Cardiol estado de São paulo 2016;26(2):120-7

122
Considerações OperatóriasDevemos estabelecer critérios e metas em relação às
estratégias operatórias. Se a opção terapêutica para revas-cularização no NSTEMI foi cirúrgica, a próxima decisão será em que momento será realizado o procedimento.21,22
Entretanto, o tempo ideal para esse procedimento não está totalmente estabelecido. O estudo ACUITY,23 analisou 13.819 pacientes com SCA e NSTEMI com angiografia rea-lizada até 72 horas após o evento, sendo submetidos pos-teriormente a tratamento conservador, PCI ou CRM.
No grupo PCI, observou-se maior taxa de isquemia recor-rente e maior necessidade de re-revascularização. As variáveis STROKE, sangramento pós-operatório e necessidade de transfusão e insuficiência renal foram mais frequentes em CRM. Não houve diferença em relação à mortalidade em curto e médio prazo. Fazendo uma análise crítica, algumas variáveis não foram destacadas nesse estudo. O número de artérias tratadas em PCI e CRM foram diferentes: 1,3 e 3,3 artérias tratadas, respectivamente. A possibilidade de oferecer a CRM e um tratamento mais completo certamente melhora o prognóstico em longo prazo. Outro dado interessante é o tempo em que as intervenções foram realizadas. Pacientes submetidos à PCI tiveram um tempo médio muito menor entre a admissão e a revascularização quando comparados ao grupo CRM. O tempo médio foi de 1,2 dias para PCI e 5,6 dias para CRM. Em termos de tempo, o estudo APPROACH,24 o estudo CRUSADE 8, o ACTION25 e a recente publicação de Davierwala et al,26 demonstram que nos pacientes com NSTEMI, o tempo não é a variável mais importante que determina a sobrevida. Dois estudos24,25 reportam que a mortalidade hospitalar e a mortalidade em 30 dias não diferem em relação ao tempo em que é realizada a revascularização no paciente com NSTEMI, a partir da admissão hospitalar. Outro estudo26 com seguimento de 5 anos, revela resultados similares de mortalidade no grupo revascularizado em 24 horas, 24 a 72 horas ou com mais de 72 horas, a partir da admissão.
Outra consideração é muito importante em relação à toma-da de decisão. Devido ao fato das medicações antiplaquetárias serem administradas imediatamente após o diagnóstico de NSTEMI, devemos estar atentos ao risco de trombose ou sangramento aumentado no pós-operatório em pacientes elegíveis para CRM. O uso dos inibidores P2Y12 apesar da diferente biodisponibilidade e farmacocinética, devem ser descontinuados. O estudo PLATO27 e o estudo de Hansson,28 sugerem que essas medicações devam ser descontinuadas cinco dias antes da intervenção cirúrgica, sob o risco de au-mento do sangramento pré e pós-operatório e a necessidade de re-exploração cirúrgica.
Estudo realizado em nosso meio, demonstrou que a revascularização miocárdica realizada na fase aguda do IAM, apresenta resultados semelhantes em relação à mortalidade, quando compara-se o grupo NSTEMI e STEMI. Identificamos variáveis relacionadas ao aumento da mortalidade, entre eles o choque cardiogênico, as arritmias ventriculares e as complicações mecânicas do IAM.29 Estando presentes uma dessas variáveis a mortalidade variou de oito a 32%.29,30
A logística para a revascularização cirúrgica é complexa, pois necessita que etapas obrigatórias sejam cumpridas, desde a identificação do infarto, até a admissão no hospital e o diagnóstico angiográfico, preparo da sala operatória, o
início da cirurgia e a revascularização efetiva da coronária com-prometida.31 Nesse processo, sem dúvida a possibilidade da revascularização já na sala de hemodinâmica é muito atrativa. Interessante notar que naqueles casos de SCA com STEMI na grande maioria das vezes, com padrão de lesão tri-arterial, diversos estudos sugerem que uma ótima abordagem dessas lesões de resto, seja realizada em outro momento. Nesse sentido, a CRM tem o seu espaço garantido. Um estudo da Universidade de Hannover32 analisou pacientes com STEMI e NSTEMI submetidos a CRM em um período menor que 6 horas após a realização do cateterismo cardíaco. Pacien-tes com NSTEMI tiveram uma mortalidade equiparável aos casos operados eletivamente na ausência de IAM, ou seja, 1% intra-hospitalar e 2% em 30 dias. O grupo de pacientes de STEMI apresenta mortalidade de 15% intra-hospitalar e a mesma em 30 dias. As variáveis logísticas de mortalidade foram: choque cardiogênico, fração de ejeção abaixo de 30%, STEMI e Euroscore II acima de nove. Concluíram então, que a revascularização imediata em pacientes com IAM é segura e tem excelentes resultados no NSTEMI. A mortalidade em pacientes com STEMI, especialmente aqueles com choque e disfunção do ventrículo esquerdo (VE) é substancialmente alta.
Em relação ao STEMI comprometendo o tronco da coro-nária esquerda, um importante e inédito trabalho publicado na Holanda, analisou esse grupo de pacientes. Oitenta e quatro pacientes com STEMI foram elencados para tratamento percutâneo ou cirúrgico. Os resultados foram analisados em 30 dias e um ano. No grupo PCI, analisando todas as causas de morte, observou-se uma taxa de mortalidade de 64% em 30 dias e 69% em um ano. No grupo CRM, a taxa de mortalidade foi 24% em 30 dias e a mesma em um ano.33
Dados do CUSTOMIZE Registry, que analisou pacientes com SCA e lesão desprotegida de tronco da coronária esquerda, evidenciaram que em um ano os eventos cardiovasculares ad-versos (MACE) foram significativamente maiores no grupo PCI. 34
infarto agudo do miocárdio com supra desnivelamento do segmento st
Ao longo dos anos, resultados insatisfatórios, contra-ditórios ou inconsistentes de séries de casos, fizeram com que as tentativas de abordagem cirúrgicas do STEMI não alcançassem ampla aceitação da comunidade cardiológica e cirúrgica. Estudos isolados de instituições individuais re-portam resultados ora superiores ao tratamento percutâneo, ora semelhantes. Portanto, não há um consenso em relação à melhor abordagem em relação ao STEMI.35
Interessante notar que a CRM é realizada em pequeno gru-po de pacientes com STEMI. Como exemplo, temos o estudo The TRIUMPH36 que analisou pacientes com STEMI de 2005 a 2008. Desses, 664 foram submetidos à revascularização, sendo que 88,8% a PCI e 11,2% a CRM. Os autores concluí-ram que independente da modalidade de revascularização, a revascularização multi-arterial confere melhores resultados em relação à angina e qualidade de vida em um ano.
Um estudo de 112 pacientes com STEMI elencados para CRM por rejeição do cardiologista intervencionista ou prazo maior que 48 horas após início dos sintomas demonstrou que a CRM em pacientes com STEMI pode ser realizada com resultados aceitáveis, especialmente naqueles sem SHOCK.37
rev Soc Cardiol estado de São paulo 2016;26(2):120-7

123
Outro estudo se propôs a analisar a morbidade e morta-lidade de pacientes com STEMI submetidos a CRM analisou pacientes submetidos à intervenção cirúrgica em intervalo < 24 horas ou > 24 horas após o evento isquêmico. Con-cluíram que não houve diferença em um mês e um ano em pacientes operados com STEMI antes ou depois de 24 horas do evento isquêmico.38
Se formos analisar o racional da doença, sem dúvida após alguns minutos ou poucas horas, a área infartada tem mínima possibilidade de recuperação. Essa definição patogênica clás-sica, entretanto, não considera variáveis importantes como a circulação colateral, a reserva de fluxo miocárdica, a liberação de mediadores bioquímicos e neuro-hormonais que possam viabilizar a perfusão da área infartada. A gama de variáveis é tão grande, que é difícil estabelecer um padrão de conduta acertada. Caso a teoria fosse correta, seria ilógico qualquer tipo de revascularização decorridas 3 horas do evento isquêmico, período no qual a viabilidade da área infartada é mínima. Na prática, o que vemos, é que mesmo as revascularizações tar-dias, conferem melhores prognóstico em curto e longo prazo, do que a abordagem conservadora. É bem possível que não entendamos claramente a fisiopatologia desse evento e que a complexa, delicada e intrincada circulação coronariana tenha muito que nos ensinar ainda. Esse conceito apenas reforça a ideia de que o heart time, a individualização do atendimento e a tomada de decisões deva ser individualizada.
iNfarto agUdo do MioCÁrdio CoMPLiCado CoM CHoQUe CardiogÊNiCo
A principal complicação e a maior causa de morte no IAM é o choque cardiogênico. O SHOCK é um estado em que há uma redução no débito cardíaco e evidência de hipoperfusão tecidual na presença de pressões de enchimento adequadas. O choque é definido pela persistente (>30 min) hipotensão com uma pressão arterial sistólica <90 mmHg, redução no índice cardíaco (<1.8 L/min/m2 sem suporte farmacológico ou <2.2 L/min/m2 com suporte farmacológico), e normal ou elevada pressão capilar pulmonar (>15 mmHg). O SHOCK nor-malmente se deve a uma extensa lesão do músculo miocárdico ou de complicações mecânicas como a ruptura do músculo papilar, ruptura do septo interventricular ou parede livre do VE.39
Estudos contemporâneos demonstram que 8% dos pacien-tes com STEMI e 2 a 5% com NSTEMI evoluem para SHOCK. As taxas de mortalidade declinaram ao longo das décadas, principalmente devido a abordagens invasivas mais precoces, mas recentes dados de banco de dados inglês revelam taxas de mortalidade ainda muito altas entre 37 a 48%.40
Recente publicação avaliou 1.990.486 pacientes com STEMI, no período de 2003 a 2010.41 A taxa de pacientes com SHOCK pós-IAM foi de 7,9% (157.892). No geral, 42,7% (67.481 pacientes), foram submetidos à PCI ou CRM precoce, ou seja, nas primeiras 24 horas de admissão. A taxa de PCI precoce aumentou de 26,6% para 52,8%. Em contraste, as taxas de CRM aumentaram de 4,5% para 6,2% em 2008, seguidas de declínio para 4,7% em 2010. No geral, a mortalidade intra-hos-pitalar em pacientes com SHOCK foi de 39% considerando as duas modalidades terapêuticas. A mortalidade hospitalar foi maior em pacientes ≥ 75 anos e em mulheres.
ANÁLISE CRíTICA DO TRATAMENTO CIRúRGICO NAS SíNDROMES CORONARIANAS AGUDAS E SUAS COMPLICAÇõES
Pacientes com IAM que evoluem com SHOCK devem ser submetidos à revascularização precoce do miocárdio para diminuir a taxa de mortalidade.1 A PCI tornou-se o pilar do tratamento para SHOCK, particularmente o STEMI, devido à capacidade de promover reperfusão precoce da artéria comprometida. A CRM devido à logística inerente ao pre-paro operatório e o tempo necessário para revascularizar a área infartada, fica reservada para os pacientes com IAM e SHOCK que evoluem com complicações mecânicas ou anatomia desfavorável a PCI, ou seja, Syntax escore alto, doença multiarterial e lesão de tronco da coronária esquerda. Devemos considerar a possibilidade de suporte mecânico nos pacientes onde o SHOCK é tão grave que a PCI e o suporte farmacológico não serão suficientes para reverter a situação.13
O estudo SHOCK, conduzido pela doutora Judith S. Hochman trouxe, sem dúvida, grande contribuição para o entendimento das modalidades terapêuticas possíveis para pacientes com IAM e SHOCK.42,43
Nos dados paralelos do SHOCK trial,44 884 pacientes com choque cardiogênico apresentaram falência do ventrículo esquerdo. Destes, 276 pacientes (31,2%) foram submetidos à PCI e 109 (12,3%) realizaram CRM. Os pacientes elegíveis para CRM tinham uma maior prevalência de insuficiência renal (12,3% versus 7,3%), doença arterial periférica (28,1% vs 11,7%), CRM prévia (9,3% vs 5,9%), NSTEMI (38,9% vs 32,4%) e IAM anterior (62,5% vs 50,4%). Em contraste, o sexo feminino (39,9% vs 24,8%), PCI prévia (9,3% vs 3,9%), e STEMI (88,0% vs 67,9%) foram mais comuns entre os pacientes PCI em comparação aos pacientes CRM.
A mortalidade intra-hospitalar foi menor nos pacientes sub-metidos à CRM em comparação com PCI (23,9% vs 46,4%). A mortalidade hospitalar com a doença uniarterial foi semelhante em ambos os grupos (33,3% [CRM] vs 32,9% [PCI]), mas foi significativamente menor para o grupo CRM em pacientes com lesão de 2 vasos (17,7% [CRM] vs 42,2% [PCI], p = 0,025) e triarteriais (29,6% [CRM] vs 59,4% [PCI], p= 0,0001). Assim, a mortalidade hospitalar permaneceu estável em pacientes que tiveram CRM, enquanto aumentou no grupo PCI quando o número de vasos comprometidos aumentou.
Se formos considerar o quesito tempo, vários autores demonstram claramente que o tempo adequado para a revascularização interfere significativamente na sobrevida.45
Uma interessante publicação nórdica de 2015 analisou 614 pacientes com SCA e infarto NSTEMI e STEMI, que foram submetidos a CRM de emergência ou de salvamento.46 Elen-caram pacientes no grupo emergência, aqueles que foram operados no dia seguinte após a decisão operatória e aqueles do salvamento, pacientes que precisaram de ressuscitação cardiorrespiratória a caminho da sala operatória. A taxa de mortalidade global intra-hospitalar foi de 15%, sendo 13% para aqueles operados na emergência e 41% para os procedimentos de salvamento. Um seguimento de 5 anos revelou sobrevida no grupo emergência de 79% e salvamento 46%, sendo que não houve diferença de mortalidade entre NSTEMI e STEMI.
Podemos então, identificar que pacientes com SHOCK têm extenso comprometimento miocárdico e ainda hoje as taxas de mortalidade são altas. Não existe um consenso em relação à melhor ação terapêutica ou ao melhor momento de intervenção. A tomada de decisões deve ser compartilhada entre os profissionais envolvidos, levando-se em consideração as recomendações e diretrizes sobre o tema.
rev Soc Cardiol estado de São paulo 2016;26(2):120-7

124
assistÊNCia CirCULatÓria No iaMDentre os vários dispositivos para assistência circulatória,
o balão intra-aórtico (BIA), introduzido na prática médica desde a década de 60, tornou-se um importante aliado no suporte mecânico para pacientes com patologias de diversas etiologias onde as estratégias terapêuticas clássicas não garantiriam a sobrevida.47-50 O uso desse dispositivo preenche o espaço do suporte farmacológico em situações de falência ventricular ou insuficiência coronariana, onde os efeitos colaterais das me-dicações são mais deletérios que a própria ação terapêutica medicamentosa. Por exemplo, o suporte com vasopressor, (noradrenalina) é bastante adequado para garantir uma ca-beça de pressão arterial sistêmica. Mas isso se faz à custa do aumento da pós-carga ao ventrículo esquerdo.51 Em um cenário de disfunção ventricular aguda pós infarto, o aumento da pós-carga ao ventrículo certamente não seria adequado. Portanto, o uso do BIA é um passo além na terapêutica, quando o suporte farmacológico não é suficiente. Centenas de estudos viabilizaram a utilização clínica do BIA. Mais recentemente, séries importantes de seguimento de pacientes com IAM e uso de BIA, contestaram os reais benefícios desse dispositivo.
Apesar das controvérsias, atualmente o uso do BIA, segundo metanálises envolvendo milhares de pacientes, demonstrou não trazer benefícios em relação a mortalidade precoce ou tardia, em pacientes com NSTEMI, STEMI, SHO-CK ou complicações mecânicas do infarto. Mesmo naqueles pacientes com SCA, submetidos à PCI seu uso não trouxe benefício. O único grupo de pacientes que apresentou be-nefício relacionado à mortalidade com o uso do BIA foram pacientes com SCA de alto risco submetidos a CRM. Nesse grupo, em especial, o uso do BIA diminuiu a mortalidade. Entendemos que atualmente o uso do BIA deve ter a sua indicação baseada em rigorosos critérios, para evitar possí-veis indesejáveis complicações relacionadas ao seu uso.52 Dentre os demais dispositivos de assistência circulatória alguns são mais frequentemente utilizados nas situações onde o suporte farmacológico e a assistência com o BIA não são suficientes para manter o equilíbrio cardiocirculató-rio. A preferência nesses casos recai sobre dispositivos de inserção percutânea, que oferecem assistência temporária ao VE, buscando a recuperação funcional, com melhora do débito cardíaco e diminuição da pós-carga. Nenhum estudo acumula grande experiência para sustentar o emprego dessa tecnologia, embora em séries pequenas, os resultados têm se mostrado satisfatórios e promissores.53 Contra a disse-minação do seu emprego, em nosso meio, destacamos a dificuldade de obtenção dos equipamentos e o alto custo.
estratÉgia oPeratÓria Na síNdroMe CoroNariaNa agUda
A escolha das duas principais modalidades de CRM realizada com auxílio da circulação extracorpórea (CEC) ou com o coração batendo (Off pump) para o tratamento da SCA depende de características clínicas do paciente e da experiência da equipe cirúrgica com essas técnicas. Nos dias atuais, técnicas, equipamentos e tecnologia de ponta, permitem que a maioria dos cirurgiões cardiovasculares possa utilizar essa técnica para revascularização miocárdica. No entanto, obstáculos à realização desse procedimento podem comprometer os resultados operatórios.54
Nos últimos anos, esforços têm sido realizados para identificar se pacientes com SCA, pacientes com NSTEMI, STEMI e SHOCK poderiam se beneficiar de uma ou outra modalidade operatória.
Apesar da não existência de estudos randomizados multicêntricos envolvendo grande número de pacientes, vários estudos e metanálises demonstram resultados oti-mistas em relação a eventos e mortalidade precoce e tardia quando comparam CRM com CEC e Off pump. Estudo da Universidade de Leipzig, analisando 638 pacientes com SCA, hemodinamicamente estáveis ou em SHOCK, submetidos a CRM com CEC ou Off pump, observaram uma propensão a realização da Off pump em pacientes com SHOCK. Nesse grupo houve menos sangramento, menos transfusão, menor tempo de UTI, menos Stroke, e menos insuficiência renal. No SHOCK pacientes submetidos Off pump, tiveram uma mortalidade menor quando comparados a CRM com CEC. Em seguimento de 5 anos os resultados de mortalidade, MACE e re-revascularização foi comparável no grupo CRM com CEC e Off pump.55 Outras séries de casos, demonstram benefícios da Off pump relacionados e perviabilidade dos enxertos em seguimento de curto prazo.56
CoMPLiCaÇÕes MeCÂNiCas do iNfarto agUdo do MioCÁrdio
Em alguns casos a gravidade do infarto pode levar a uma lesão estrutural miocárdica denominada de complicação me-cânica do infarto. Destacamos a comunicação interventricular (CIV), ruptura do músculo papilar, e ruptura da parede livre do VE. A CIV devido ao infarto agudo do miocárdio tornou-se infrequente nesse momento em que o diagnóstico e a tera-pia de reperfusão miocárdica são cada vez mais precoces. O tratamento cirúrgico continua a ser a terapia de escolha, embora desafiador e associado à alta taxa de mortalidade. O tratamento conservador prolongado geralmente é inútil, e inclui a redução da pós-carga e a utilização do balão intra-aórtico.
A ocorrência de CIV pós-IAM tem relação linear entre o menor tempo de reperfusão e a menor incidência de CIV ou ruptura cardíaca.57 A escolha do tipo de reperfusão, seja química ou mecânica, não tem relação com a ocorrência de ruptura cardíaca. Na verdade, a ocorrência de CIV e ruptura é maior naqueles onde o tempo porta-balão é prolongado.58,59
Em relação ao melhor momento da intervenção, obser-vou-se que a mortalidade é reduzida com o tempo entre o evento e a intervenção cirúrgica, provavelmente devido a um miocárdio mais estável e fibrosado, mas também devido ao viés de sobrevivência. Não se sabe qual a percentagem de pacientes continua a sobreviver quando a cirurgia é adiada. No estudo GUSTO-1, houve 94% de mortalidade em 30 dias sem cirurgia sugerindo que o tratamento conservador está associado à mortalidade muito elevada. A intervenção ime-diata (<24 horas) segundo dados do STS tem mortalidade em 30 dias de 60%. A cirurgia realizada entre o 7º ao 21º dia tem mortalidade de 30% e se for realizada em caráter eletivo após 21 dias a mortalidade é de aproximadamente 10%. O manejo cirúrgico desses pacientes normalmente é complexo, pois na maioria das vezes o paciente está em choque cardiogênico, com instabilidade do ritmo e excitabilidade ventricular, tem doença arterial coronariana e o músculo miocárdico está friável. Princípios do reparo
rev Soc Cardiol estado de São paulo 2016;26(2):120-7

125
bem-sucedido incluem desbridamento do tecido infartado em volta do miocárdio, evitando tensão sobre o reparo.
Uma revisão dos dados da Society of Thoracic Surgeons identificou 2876 pacientes submetidos à correção de CIV pós-IAM. A mortalidade global foi de 42,9%, o que repre-sentou a maior taxa de mortalidade de qualquer cirurgia cardíaca. A mortalidade em 30 dias está associada aos pacientes idosos, do sexo feminino, com creatinina sérica elevada e complicações relacionadas à doença (choque cardiogênico, FEVE reduzida, doença coronária triarterial, ou a exigência de BIA pré-operatório). A mortalidade operatória foi menor para procedimentos considerados eletivos (13,2% de mortalidade) versus emergentes (56,0% de mortalidade) versus resgate (80,5% de mortalidade).60
Estratégias de suporte mecânico com balão intra-aórtico não evidenciaram melhora na sobrevida. Os dispositivos de assistência ventricular uni- ou biventricular não têm dados suficientes para suportar o seu uso.61 Portanto, baseados nos estudos mais recentes, entendemos que a CIV pós IAM é um evento grave de alta mortalidade e que o tratamento definitivo é a cirurgia. Nos casos com instabilidade hemodinâmica, a intervenção precoce deve ser considerada, mesmo com taxas maiores de mortalidade. Pacientes estáveis com CIV ampla podem ser considerados para terapias de redução da pós-carga, com BIA e suporte ventricular e aqueles pacientes estáveis devem esperar ao menos 21 dias para oferecer melhores taxas de sobrevida.62
Se há evidências de necrose do músculo papilar ou há preocupações sobre possível progressão, em curso de lesão isquêmica, a substituição da válvula mitral proporciona um tratamento definitivo da valva mitral regurgitante.
A regurgitação mitral aguda devido à ruptura do mus-cular papilar por IAM é uma complicação grave e deve ser reconhecida e tratada com intervenção cirúrgica em caráter de emergência. A regurgitação leve a moderada pode ser encontrada em 15 a 45% dos pacientes com STEMI. Nessa população, a regurgitação mitral é bem tolerada e geral-mente transitória e assintomática. Mas a regurgitação mitral severa com ruptura do músculo papilar é complicação grave com risco de vida. Ela ocorre em 0,25% dos pacientes com
referÊNCias1. Amsterdam EA, Wenger NK; American College of Cardiology;
American Heart Association. The 2014 American College of Cardiology ACC/American Heart Association guideline for the management of patients with non-ST-elevation acute coronary syndromes: ten contemporary recommendations to aid clinicians in optimizing patient outcomes. Clin Cardiol. 2015;38(2):121-3.
2. Braunwald E, Antman EM, Beasley JW, Califf RM, Cheitlin MD, Hochhman JS, et al. Management of patients with unstable angina and non–ST-segment elevation myocardial infarction: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Available at: http://www.acc.org/qualityandscience/clinical/guidelines/unstable/unstable pkt.pdf. Accessed October 30, 2006
3. Stone GW, Brodie BR, Griffin JJ, Grines L, Boura J, O’Neill WW, Grines CL: Role of cardiac surgery in the hospital phase mana-gement of patients treated with primary angioplasty for acute myocardial infarction. Am J Cardiol. 2000; 85:1292–6.
4. Sugiyama T, Hasegawa K, Kobayashi Y, Takahashi O, Fukui T, Tsugawa Y. Differential Time Trends of Outcomes and Costs of Care for Acute Myocardial Infarction Hospitalizations by ST Ele-
vation and Type of Intervention in the United States, 2001–2011 J Am Heart Assoc. 2015;4(3):e 001445.
5. Amsterdam EA, Wenger NK, Brindis RG, Casey DE Jr, Ganiats TG, Holmes DR Jr, et al. ACC/AHA Task Force Members, So-ciety for Cardiovascular Angiography and Interventions and the Society of Thoracic Surgeons. 2014 AHA/ACC guideline for the management of patients with non-ST-elevation acute coronary syndromes: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014; 130(25):2354–94.
6. O’Gara PT, Kushner FG, Ascheim DD, Casey DE Jr, Chung MK, de Lemos JÁ, et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2013;61:e78–140.
7. Steg PG, James SK, Atar D, Badano LP, Blömstrom-Lundqvist C, Borger MA, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2012;33:2569–619.
ANÁLISE CRíTICA DO TRATAMENTO CIRúRGICO NAS SíNDROMES CORONARIANAS AGUDAS E SUAS COMPLICAÇõES
STEMI. O diagnóstico precoce e a terapia cirúrgica agressiva têm relação com o prognóstico. A intervenção sobre a valva mitral associada à revascularização miocárdica confere me-lhor resultado em curto e longo prazo.63 A terapia clínica que precede a intervenção operatória visa reduzir a pós-carga. Esse objetivo pode ser atingido com suporte farmacológico com drogas vasodilatadoras e inotrópicas ou com o uso do BIA. Esses doentes podem se beneficiar do suporte cardíaco mecânico com diferentes tipos de dispositivos. A terapia mé-dica e o suporte mecânico estão associados a uma sobrevida pobre, a sua utilização apenas assegura uma ponte para a intervenção que é a pedra angular do tratamento.
A ruptura do músculo papilar após IAM está associada a uma alta mortalidade hospitalar que varia de 70% a 80% com tratamento clínico.
Em uma série de pacientes submetidos à intervenção cirúrgica por ruptura do músculo papilar, a mortalidade ope-ratória foi de 26,9%, com uma sobrevida em 15 anos de 39%. Nos pacientes submetidos a tratamento cirúrgico da valva mitral e revascularização miocárdica, a taxa de mortalidade em curto prazo não diferiu, mas em longo prazo, aqueles sub-metidos ao tratamento concomitante tiveram uma sobrevida melhor do que aqueles submetidos somente a substituição valvar em seguimento de 15 anos.64
Outro estudo demonstrou que o tratamento concomitante da valva mitral e a revascularização do miocárdio obteve melhora da mortalidade operatória. No entanto, não houve diferença significativa na sobrevida em cinco anos entre o tipo de técnica utilizada, reparo da valva mitral ou substituição da válvula mitral nesse grupo de pacientes.65
Em relação à ruptura da parede livre do VE, destacamos que é uma patologia grave com altas taxas de mortalidade e não existem estudos amplos sobre essa ocorrência.
CoNfLitos de iNteresseOs autores declaram não possuir conflitos de inte-
resse na realização deste trabalho.
rev Soc Cardiol estado de São paulo 2016;26(2):120-7

126
8. Bhatt DL, Roe MT, Peterson ED, Li Y, Chen AY, Harrington RA, et al. CRUSADE Investigators. Utilization of early invasive management strategies for high-risk patients with non-ST-segment elevation acute coronary syndromes: results from the CRUSADE Quality Improvement Initiative. JAMA. 2004; 292:2096–104.
9. Nicolau JC, Timerman A, Marin-Neto JA, Piegas LS, Barbosa CJDG, Franci A, Sociedade Brasileira de Cardiologia. Diretrizes da Sociedade Brasileira de Cardiologia sobre Angina Instável e Infarto Agudo do Miocárdio sem Supradesnível do Segmento ST. Arq Bras Cardiol. 2014;102(3Supl.1):1-61.
10. Friedberg CK. Cardiogenic SHOCK in acute myocardial infarction. Circulation. 1961;23:325-30.
11. Awad HH, Anderson FA Jr, Gore JM, Goodman SG, Goldberg RJ.. Cardiogenic SHOCK complicating acute coronary syndromes: Insights from the Global Registry of Acute Coronary Events. Am Heart J. 2012;163(6):963-71.
12. Comas GM, Esrig BC, Oz MC. Surgery for myocardial salvage in acute myocardial infarction and acute coronary syndromes. Heart Fail Clin. 2007, 3:181–210.
13. Mohr FW, Morice MC, Kappetein AP, Feldman TE, Ståhle E, Colombo A, et al. Coronary artery bypass graft surgery versus percutaneous coronary intervention in patients with three-vessel disease and left main coronary disease: 5-year follow-up of the randomised, clinical SYNTAX trial. Lancet. 2013; 381:629–38.
14. Amsterdam EA, Wenger NK, Brindis RG, Casey DE Jr, Ganiats TG, Holmes DR Jr, et al. ACC/AHA Task Force Members, So-ciety for Cardiovascular Angiography and Interventions and the Society of Thoracic Surgeons. 2014 AHA/ACC guideline for the management of patients with non-ST-elevation acute coronary syndromes: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014; 13025:2354–94.
15. Clemmensen P, Roe MT, Hochman JS, Cyr DD, Neely ML, McGuire DK, et al; TRILOGY ACS Investigators. Long-term outcomes for women versus men with unstable angina/non-ST segment elevation myocardial infarction managed medically without re-vascularization: insights from the TaRgeted platelet Inhibition to cLarify the Optimal strateGy to medicallY manage Acute Coronary Syndromes trial. Am Heart J. 2015; 170:695-705.e5.
16. Rosenschein U, Nagler RM, Rofe A. The heart team approach to coronary revascularization – have we crossed the lines of evidence-based medicine? Am J Cardiol.2013; 112:1516–9.
17. Caggegi A, Capodanno D, Capranzano P, Chisari A, Ministeri M, Mangiameli A, et al. Comparison of one-year outcomes of per-cutaneous coronary intervention versus coronary artery bypass grafting in patients with unprotected left main coronary artery disease and acute coronary syndromes (from the CUSTOMIZE Registry). Am J Cardiol. 2011; 108:355–9.
18. Roe MT, Li S, Thomas L, Wang TY, Alexander KP, Ohman EM, Peterson ED. Long-term outcomes after invasive management for older patients with non-ST-segment elevation myocardial infarction. Circ Cardiovasc Qual Outcomes. 2013;6(3):323-32.
19. Farkouh ME, Domanski M, Sleeper LA, Siami FS, Dangas G, Mack M, et al; FREEDOM Trial Investigators. Strategies for mul-tivessel revascularization in patients with diabetes. N Engl J Med. 2012;367(25):2375-84.
20. Burgess SN, Mussap CJ, French JK. Management of acute coronary syndromes in patients with diabetes: implications of the FREEDOM trial. Clin Ther. 2013;35(8):1069-75.
21. Bhatt DL, Roe MT, Peterson ED, Li Y, Chen AY, Harrington RA, et al.; CRUSADE Investigators. Utilization of early invasive ma-nagement strategies for high-risk patients with non-ST-segment elevation acute coronary syndromes: results from the CRUSADE Quality Improvement Initiative. JAMA. 2004; 292(17):2096–104.
22. Mehta SR, Granger CB, Boden WE, Steg PG, Bassand JP, Faxon DP, et al.; TIMACS Investigators. Early versus delayed invasive intervention in acute coronary syndromes. N Engl J Med. 2009; 360:2165–2175.
23. Ben-Gal Y, Moses JW, Mehran R, Lansky AJ, Weisz G, Nikolsky E, et al. Surgical versus percutaneous revascularization for multives-sel disease in patients with acute coronary syndromes: analysis from the ACUITY (Acute Catheterization and Urgent Intervention Triage Strategy) trial. JACC Cardiovasc Interv. 2010;3(10):1059-67.
24. Deyell MW, Ghali WA, Ross DB, Zhang J, Hemmelgarn BR; Alberta Provincial Project for Outcome Assessment in Coronary Heart Disease (APPROACH) Investigators. Timing of nonemergent coronary artery by-pass grafting and mortality after non-ST ele-vation acute coronary syndrome. Am Heart J. 2010; 159:490–6.
25. Parikh SV, de Lemos JA, Jessen ME, Brilakis ES, Ohman EM, Chen AY, et al.; CRUSADE and ACTION Registry-GWTG Participants. Timing of in-hospital coronary artery bypass graft surgery for non--ST-segment elevation myocardial infarction patients results from the National Cardiovascular Data Registry ACTION Registry-GWTG (Acute Coronary Treatment and Intervention Outcomes Network Registry--Get With The Guidelines). JACC Cardiovasc Interv. 2010; 3:419–27.
26. Davierwala PM, Verevkin A, Leontyev S, Misfeld M, Borger MA, Mohr FW. Does timing of coronary artery bypass surgery affect early and long-term outcomes in patients with non-ST-segment--elevation myocardial infarction? Circulation. 2015; 132:731–40.
27. Becker RC, Bassand JP, Budaj A, Wojdyla DM, James SK, Cornel JH, et al. Bleeding complications with the P2Y12 receptor anta-gonists clopidogrel and ticagrelor in the PLATelet inhibition and patient Outcomes (PLATO) trial. Eur Heart J. 2011; 32:2933–44.
28. Hansson EC, Jidéus L, Aberg B, Bjursten H, Dreifaldt M, Holm-gren A, et al. Coronary artery bypass grafting-related bleeding complications in patients treated with ticagrelor or clopidogrel: a nationwide study. Eur Heart J. 2016; 37:189–97.
29. Jatene FB, Jatene, MB.; Monteiro, AC; Silva, A.; Ariê, S; Oliveira, SA; Jatene, AD. Revascularização miocárdica após reperfusão na fase aguda do infarto do miocárdio. Arq Bras Cardiol. 1991;56(4):295-8.
30. Ladeira RT, Jatene FB, Monteiro R, Zucato SP, Baracioli LM, Hueb AC, et al. Cirurgia de revascularização na fase aguda do infarto do miocárdio: análise dos fatores pré-operatórios preditores de mortalidade. Arq Bras Cardiol. 2006;87(3):254-9.
31. Favaloro RG, Effler DB, Cheanvechai C, Quint RA, Sones FM Jr. Acute coronary insufficiency (impending myocardial infarction and myocardial infarction): surgical treatment by the saphenous vein graft technique. Am J Cardiol. 1971;28:598–607.
32. Khaladj N, Bobylev D, Peterss S, Guenther S, Pichlmaier M, Bagaev E, et al. Immediate surgical coronary revascularisation in patients presenting with acute myocardial infarction. J Car-diothorac Surg. 2013;8:167.
33. Grundeken MJ, Vis MM, Beijk MA, Kikkert WJ, Damman P, Kloek JJ, et al. Clinical outcomes after percutaneous or surgical revascularisa-tion of unprotected left main coronary artery-related acute myocardial infarction: a single-centre experience Heart. 2013;99(10):690-9.
34. Caggegi A, Capodanno D, Capranzano P, Chisari A, Ministeri M, Mangiameli A, et al. Comparison of one-year outcomes of per-cutaneous coronary intervention versus coronary artery bypass grafting in patients with unprotected left main coronary artery disease and acute coronary syndromes (from the CUSTOMIZE Registry). Am J Cardiol. 2011;108(3):355-9.
35. Jang JS, Spertus JA, Arnold SV, Shafiq A, Grodzinsky A, Fendler TJ, et al. Impact of multivessel revascularization on health status outcomes in patients with ST-segment elevation myocardial infarction and multivessel coronary artery disease. J Am Coll Cardiol. 201510;66(19):2104-13.
36. Arnold SV, Chan PS, Jones PG, Decker C, Buchanan DM, Kru-mholz HM, et al; Cardiovascular Outcomes Research Consortium. Translational Research Investigating Underlying Disparities in Acute Myocardial Infarction Patients' Health Status (TRIUMPH): design and rationale of a prospective multicenter registry. Circ Cardiovasc Qual Outcomes. 2011;4(4):467-76.
37. Hagl C, Khaladj N, Peterss S, Martens A, Kutschka I, Goerler H, et al. Acute treatment of ST-segment-elevation myocardial infarction: is there a role for the cardiac surgeon? Ann Thorac Surg. 2009;88(6):1786-92.
rev Soc Cardiol estado de São paulo 2016;26(2):120-7

127
38. Khan AN, Sabbagh S, Ittaman S, Abrich V, Narayan A, Austin B, et al. Outcome of early revascularization surgery in patients with ST--elevation myocardial infarction. J Interv Cardiol. 2015;28(1):14-23.
39. Rihal CS, Naidu SS, Givertz MM, Szeto WY, Burke JA, Kapur NK, et al. 2015 SCAI/ACC/HFSA/STS clinical expert consensus statement on the use of percutaneous mechanical circulatory support devices in cardiovascular care (endorsed by the American Heart Association, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interven-tional Cardiology- Association Canadienne de Cardiologie d’intervention). J Card Fail. 2015;21:499–518.
40. Kunadian V, Qiu W, Ludman P, Redwood S, Curzen N, Stables R, et al. Outcomes in patients with cardiogenic SHOCK following percutaneous coronary intervention in the contemporary era: na analysis from the BCIS database (British Cardiovascular Intervention Society). J Am Coll Cardiol Intv. 2014;7:1374–85.
41. Kolte D, Khera S, Aronow WS, Mujib M, Palaniswamy C, Sule S, et al.. Trends in Incidence, Management, and Outcomes of Car-diogenic SHOCK Complicating ST-Elevation Myocardial Infarction in the United States. J Am Heart Assoc. 2014;3(1):e000590.
42. White HD, Assmann SF, Sanborn TA, Jacobs AK, Webb JG, Sleeper LA, et al. Comparison of percutaneous coronary intervention and coronary artery bypass grafting after acute myocardial infarction complicated by cardiogenic SHOCK: results from the Should We Emergently Revascularize Oc-cluded Coronaries for Cardiogenic SHOCK (SHOCK) trial. Circulation. 2005;112:1992–2001.
43. Hochman JS, Sleeper LA, Webb JG, Dzavik V, Buller CE, Aylward P, et al. Early revascularization and long-term survival in cardio-genic SHOCK complicating acute myocardial infarction. JAMA. 2006; 295 (21): 2511-5.
44. Webb JG, Sanborn TA, Sleeper LA, Carere RG, Buller CE, Slater JN, et al. Percutaneous coronary intervention for cardiogenic shock in SHOCK trial registry. Am Heart J. 2001;141:964-70.
45. Spence N, Abbott JD. Coronary Revascularization in Cardiogenic SHOCK. Curr Treat Options Cardio Med. 2016;18(1): 1.
46. Axelsson TA, Mennander A, Malmberg M, Gunn J, Jeppsson A, Gudbjartsson T. Is emergency and salvage coronary artery bypass grafting justified? The Nordic Emergency/Salvage co-ronary artery bypass grafting study. Eur J Cardiothorac Surg. 2016; 49(5):1451-6.
47. Romeo F, Acconcia MC, Sergi D, Romeo A, Muscoli S, Valente S, et al. The outcome of intra-aortic balloon pump support in acute myocardial infarction complicated by cardiogenic SHOCK according to the type of revascularization: a comprehensive meta-analysis. Am Heart J. 2013; 165(5):679–92.
48. Prondzinsky R, Lemm H, Swyter M, Wegener N, Unverzagt S, Carter JM, et al. Intra-aortic balloon counterpulsation in patients with acute myocardial infarction complicated by cardiogenic SHOCK: the prospective, randomized IABP SHOCK Trial for attenuation of multiorgan dysfunction syndrome. Crit Care Med. 2010; 38(1): 152–60.
49. Patel MR, Smalling RW, Thiele H, Barnhart HX, Zhou Y, Chan-dra P, et al. Intra aortic balloon counterpulsation and infarct size in patients with acute anterior myocardial infarction wi-thout SHOCK: the CRISP AMI randomized trial. JAMA. 2011; 306(12):1329–37.
50. Perera D, Stables R, Thomas M, Booth J, Pitt M, Blackman D, et al. Elective intra-aortic balloon counterpulsation during high-risk percutaneous coronary intervention: a randomized controlled trial.JAMA. 2010; 304(8):867–74.
51. Thiele H, Zeymer U, Neumann FJ, Ferenc M, Olbrich HG, Haus-leiter J, et al. Intraaortic balloon support for myocardial infarction
with cardiogenic SHOCK. N Engl J Med. 2012; 367(14):1287–96. 52. Thiele H, Zeymer U, Neumann FJ, Ferenc M, Olbrich HG, Haus-
leiter J, et al. Intra-aortic balloon counterpulsation in acute myo-cardial infarction complicated by cardiogenic SHOCK (IABP--SHOCK II): final 12 month results of a randomised, open-label trial. Lancet. 2013; 382(9905):1638–45.
53. Lee JM, Park J, Kang J, Jeon KH, Jung JH, Lee SE, et al. The efficacy and safety of mechanical hemodynamic support in patients undergoing high-risk percutaneous coronary interven-tion with or without cardiogenic SHOCK: Bayesian approach network meta-analysis of 13 randomized controlled trials. Int J Cardiol.2015; 184:36–46.
54. Puskas JD, Williams WH, Duke PG, Staples JR, Glas KE, Marshall JJ, et al. Off-pump coronary artery bypass grafting provides complete revascularization with reduced myocar-dial injury, transfusion requirements, and length of stay: A prospective randomized comparison of two hundred unse-lected patients undergoing off-pump versus conventional coronary artery by-pass grafting. J Thorac Cardiovasc Surg. 2003;125:797– 808.
55. Rastan AJ1, Eckenstein JI, Hentschel B, Funkat AK, Gummert JF, Doll N, et al.. Emergency Coronary Artery Bypass Graft Surgery for Acute Coronary Syndrome Beating Heart Versus Conventional Cardioplegic Cardiac Arrest Strategies. Circulation. 2006 Jul 4;114(1 Suppl):I477-85.
56. Ferrari E, Stalder N, von Segesser LK. On-pump beating heart coronary surgery for high risk patients requiring emergency multiple coronary artery bypass grafting. J Cardiothorac Surg. 2008 2;3:38.
57. Moreyra AE, Huang MS, Wilson AC, Deng Y, Cosgrove NM, Kostis JB, at al. Trends in incidence and mortality rates of ventricular septal rupture during acute myocardial infarction. Am J Cardiol. 2010;106:1095-100.
58. Lopez-Sendon J, Gurfinkel EP, Lopez de Sa E, Agnelli G, Gore JM, Steg PG, et al. Factors related to heart rupture in acute coronary syndromes in the Global Registry of Acute Coronary Events. Eur Heart J. 2010;31:1449-56.
59. French JK, Hellkamp AS, Armstrong PW, Cohen E, Kleiman NS, O'Connor CM, et al. Mechanical complications after percutaneous coronary intervention in ST-elevation myocardial infarction (from APEX-AMI). Am J Cardiol. 2010;105:59-63.
60. Arnaoutakis GJ, Zhao Y, George TJ, Sciortino CM, McCarthy PM, Conte JV. Surgical repair of ventricular septal defect after myocardial infarction: outcomes from the Society of Thoracic Surgeons National Database. Ann Thoracic Surg. 2012;94:436-43; discussion 443–4.
61. Fukushima S, Tesar PJ, Jalali H, Clarke AJ, Sharma H, Chou-dhary J, et al. Determinants of in-hospital and long-term surgical outcomes after repair of postinfarction ventricular septal rupture. J Thoracic Cardiovasc Surg. 2010;140:59-65.
62. Papalexopoulou N, Young CP, Attia RQ. What is the best timing of surgery in patients with post-infarct ventricular septal rupture? Interactive Cardiovasc Thoracic Surg. 2013;16:193-6.
63. Kishon Y, Oh JK, Schaff HV, Mullany CJ, Tajik AJ, Gersh BJ. Mitral valve operation in postinfarction rupture of a papillary muscle: immediate results and long-term follow up of 22 patients. Mayo Clin Proc.1992;67:1023–30.
64. Chevalier P, Burri H, Fahrat F, Cucherat M, Jegaden O, Obadia JF, et al. Perioperative outcome and long-term survival of surgery for acute post-infarction mitral regurgitation. Eur J Cardiothorac Surg. 2004;26(2):330–5.
65. Russo A, Suri RM, Grigioni F, Roger VL, Oh JK, Mahoney DW, et al. Clinical outcome after surgical correction of mitral regurgitation due to papillary muscle rupture. Circulation. 2008;118:1528–34.
ANÁLISE CRíTICA DO TRATAMENTO CIRúRGICO NAS SíNDROMES CORONARIANAS AGUDAS E SUAS COMPLICAÇõES
rev Soc Cardiol estado de São paulo 2016;26(2):120-7

128
resUMoAproximadamente 30% dos pacientes que se apresentam com quadro de síndrome
coronariana aguda têm revascularização prévia do miocárdio. Os eventos coronarianos subsequentes à revascularização do miocárdio podem ocorrer por progressão da do-ença aterosclerótica no leito coronário nativo, evento relacionado ao stent (reestenose, trombose ou neoaterosclerose) ou evento relacionado à cirurgia de revascularização do miocárdio (degeneração ou oclusão de enxertos cirúrgicos). Esses pacientes que neces-sitam de um novo procedimento de revascularização têm perfil de alto risco, geralmente associado a doença renal crônica, diabetes mellitus, doença arterial periférica, além de elevada carga aterosclerótica no leito coronariano nativo, degeneração de enxertos de veia safena e reestenose de stents. Este cenário faz com que o segundo procedimento de revascularização tenha maior risco e maior complexidade.
Neste artigo discutiremos as características clínicas e as possibilidades terapêuticas de pacientes com SCA e revascularização percutânea ou cirúrgica prévias.
Descritores: Síndrome Coronariana Aguda; Intervenção Coronária Percutânea; Stents, Reestenose Coronária, Ponte de Artéria Coronária
aBstraCtAround 30% of patients who present acute coronary syndrome have undergone previous myocardial revascularization. Coronary events following myocardial revascularization can occur due to progression of atherosclerotic disease in the native coronary bed, an event related to the stent (restenosis, thrombosis or neoatherosclerosis) or to the myocardial revascularization surgery (degeneration or occlusion of surgical grafts). These patients who need a new revascularization procedure have a high-risk profile, generally associated with chronic kidney disease, diabetes mellitus, and peripheral arterial disease, as well as a high atherosclerotic burden in the native coronary bed, degeneration of grafts of the saphenous vein, and restenosis of stents. This scenario confers a higher risk and greater complexity on the second revascularization procedure.In this article, we discuss the clinical characteristics and therapeutic possibilities of patients with ACS and previous percutaneous or surgical revascularization.
Descriptors: Acute coronary syndrome; Percutaneous coronary intervention; Stents; Co-ronary restenosis; Coronary artery by-pass.
Cristiano Guedes Bezerra1
Fábio Augusto Pinton1
Pedro Alves Lemos Neto1
1. Instituto do Coração do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (InCor – HCFMUSP).
Correspondência:Av. Dr. Enéas de Carvalho Aguiar, 44, bloco I, 3o andar, Hemodinamica, Cerqueira César, CEP: 05403-000, São Paulo, SP, Brasil. [email protected]
síNdroMe CoroNariaNa agUda eM iNdivídUos CoM revasCULariZaÇÃo CirÚrgiCa
oU PerCUtÂNea PrÉvia
aCUte CoroNarY sYNdroMe iN iNdividUaLs witH PrevioUs sUrgiCaL or PerCUtaNeoUs revasCULariZatioN
revisÃo/review
iNtrodUÇÃoA doença aterosclerótica coronária (DAC) é a principal
causa de mortalidade no mundo. Embora o tratamento clínico tenha evoluído muito nos últimos anos com novas drogas antiplaquetárias, anticoagulantes e estatinas mais potentes, muitos pacientes necessitam de revascularização percutânea ou cirúrgica do miocárdio. No entanto, mesmo com o trata-mento intervencionista realizado com sucesso, os pacientes
continuam sob risco de novos eventos coronários adversos.Aproximadamente 30% dos pacientes que se apresentam
com quadro de síndrome coronária aguda (SCA) possuem revascularização do miocárdio prévia. Em estudo envolvendo 12483 pacientes com SCA, 14,2% tinham intervenção corona-riana percutânea (ICP) prévia, 9,6% cirurgia de revasculariza-ção do miocárdio (CRM) prévia e 5,1% ICP e CRM prévias.1
Em outro estudo que analisou pacientes com SCA de
rev Soc Cardiol estado de São paulo 2016;26(2):128-33

129
acordo com o quadro clínico, nos pacientes com infarto agu-do do miocárdio com supradesnivelamento do segmento ST (IAMCSST), cerca de 5% dos pacientes tinham ICP ou CRM prévias, enquanto que nos pacientes com IAM sem supra-desnivelamento do segmento ST (IAMSSST) e com angina instável, esse número foi de 13% e 20%, respectivamente.2
Os eventos subsequentes a revascularização do mio-cárdio podem ser por progressão da doença aterosclerótica em leito coronário nativo, evento relacionado ao stent (par-ticularmente, reestenose, trombose ou neoaterosclerose) ou evento relacionado à CRM (degeneração ou oclusão de enxertos cirúrgicos).
O aumento no número de procedimentos de revasculariza-ção miocárdica de forma percutânea ou cirúrgica, assim como o aumento na expectativa de vida se associa à um aumento na taxa de novos procedimentos de revascularização, sobretudo devido a natureza crônica da doença coronária aterosclerótica.
Esses pacientes que necessitam de um novo proce-dimento de revascularização, compõem um perfil de alto risco, geralmente associado à doença renal crônica, diabetes melitus, doença arterial periférica, além de uma elevada carga aterosclerótica no leito coronário nativo, degeneração de enxertos de veia safena e reestenose de stents. Este cenário torna o segundo procedimento de revascularização de maior risco e complexidade. Portanto, é fundamental a decisão conjunta do chamado “Heart Team” que envolve cardiologistas clínicos, cardiologistas intervencionistas e cirurgiões cardíacos, para definição da melhor estratégia terapêutica a ser adotada. Neste artigo discutiremos as características clínicas e as possibilidades terapêuticas de pacientes com SCA e revascularização percutânea ou cirúrgica prévias.
eveNto adverso CoroNÁrio eM PaCieNtes CoM revasCULariZaÇÃo CirÚrgiCa PrÉvia
A necessidade de nova revascularização após CRM cresce dramaticamente na segunda década após a cirurgia. Comparativamente ao primeiro procedimento de revascu-larização, a mortalidade em cinco anos é o dobro tanto se o segundo procedimento for percutâneo (25% vs 16%) ou cirúrgico (21% vs 14%).3 Uma nova cirurgia cardíaca é um preditor isolado de risco para esses pacientes devido a uma nova esternotomia, aderências pericárdicas e manipulação de enxertos prévios de mamária e safena. Por outro lado, incisões minimamente invasivas, cirurgias sem circulação extra-corpórea, novas modalidades de proteção miocárdica tentam diminuir esse risco da reoperação.4
Portanto, é mister considerar diversos aspectos na esco-lha da modalidade terapêutica quando for necessária uma reintervenção no paciente com CRM prévia. Deve-se dar preferência a nova CRM nos pacientes de maior risco, com poucos enxertos funcionantes, mais oclusões coronárias crônicas e baixa fração de ejeção de ventrículo esquerdo (FEVE) ao passo que ICP é a modalidade de escolha nos casos com anatomia favorável, sobretudo se a mamária in-terna esquerda para artéria descendente anterior for patente. Abaixo, apresentamos as recomendações do Guideline da Sociedade Européia de Cardiologia (ESC 2010) para ICP em pacientes com CRM prévia.(Tabela 1)
Tabela 1. Recomendações do guideline da sociedade euro-péia de cardiologia (ESC 2010) para ICP.
Recomendação Classe Nível de evidência
iCp ou reoperação de Crm está indicada em caso de sintomas limi-tantes ou isquemia extensa a despeito do tratamento clínico otimizado.
i B
iCp é recomendada como primeira es-colha ao invés de reoperação de Crm. i B
em caso de reoperação utilizar enxer-tos de mamária. i B
reoperação de Crm deve ser consi-derada em casos de doença de múl-tiplos enxertos, disfunção ventricular esquerda, oclusões crônicas e ausên-cia de enxerto de mamária para des-cendente anterior patente.
iia C
iCp deve ser considerada em pacien-tes com enxerto de mamária para descendente anterior patente e ana-tomia favorável.
iia C
É preferível abordar o vaso nativo co-ronário por iCp quando os enxertos de safena tem mais do que 3 anos.
i B
aNgioPLastia eM eNxertos de veia safeNa
A patência de um enxerto de veia safena (PVS) para artérias coronárias em 10 – 15 anos é de 25 a 50% apenas, sendo que até 10% dos enxertos estão ocluídos antes da alta hospitalar.5 A história natural da degeneração dos enxertos de veia safena envolve três mecanismos fisiopatológicos interligados: trombose, hiperplasia intimal e aterosclerose. A trombose é um fenômeno precoce relacionado a aspec-tos técnicos peri-operatórios. A hiperplasia intimal ocorre nos primeiros meses após CRM e representa a base para aterosclerose tardia. O processo relacionado à doença do enxerto venoso dominante após um ano é a aterosclerose, ocorrendo manifestação de sintomas geralmente três anos após CRM. A aterosclerose que acomete esses enxertos se caracteriza pelo seu aspecto difuso e concêntrico. São placas friáveis com fina ou ausente capa fibrosa e pouca calcificação. Em caso de ocorrência de SCA em pacientes já submetidos a CRM, é importante levar em consideração todos esses aspectos fisiopatológicos avaliando a melhor forma de revascularização, caso esta esteja indicada. Sabe-se que a necessidade de ICP em enxertos de safena é uma situação clínica comum em pacientes com SCA após CRM. No entanto, a ICP em enxertos de safena está relacionada a inúmeras complicações, dentre elas se sobressaem: ris-co de ruptura devido a parede delgada da veia safena e o ateroembolismo.6 A embolização de debris aterotrombóticos para circulação coronária nativa pode resultar em redução do fluxo anterógrado (“No-Reflow”) ou infarto peri-procedimento. Comparada a ICP em artérias nativas, a ICP em enxertos de veia safena se associa a maior taxa de mortalidade, infarto peri-procedimento e re-estenose.
SíNDROME CORONARIANA AGUDA EM INDIVíDUOS COM REVASCULARIZAÇÃO CIRúRGICA OU PERCUTÂNEA PRÉVIA
rev Soc Cardiol estado de São paulo 2016;26(2):128-33

130
Para tentar minimizar essas potenciais complicações, as diretrizes recomendam o uso de dispositivos de proteção embólica distal para prevenção de ateroembolismo duran-te a angioplastia (filtros de safena).7 Para esta finalidade, pode ser recomendado também o uso de stents revestidos (stent Mguard).8
Em relação ao tipo de stent (convencional vs farmaco-lógico), uma metanálise recente de 22 estudos sugere que os stents farmacológicos são superiores na ICP em enxertos de safena com diminuição de taxas de revascularização do vaso-alvo e mortalidade cardíaca (OR 0.71, p = 0,04) e sem diferença de risco de trombose de stent e infarto do miocárdio.9
Infarto agudo do miocárdio relacionado a enxerto de veia safena está relacionada a elevada taxa de mortalidade intra--hospitalar e prognóstico ruim a longo prazo. Nesses casos, deve-se considerar trombectomia manual aspirativa uma vez que há grande associação com trombo visível e em grande quantidade, assim como, considerar estadiar o procedimento terapêutico mantendo um regime farmacológico agressivo (associar AAS, clopidogrel e inibidores da glicoproteína IIb/IIIa, manter anticoagulação plena, por exemplo).
aNgioPLastia eM eNxertos de artÉria MaMÁria
O mecanismo de obstrução luminal da artéria mamária é totalmente diferente em relação à degeneração dos enxertos de safena e é resultante da hiperplasia neointimal secundária ao trauma vascular durante a preparação do enxerto e anas-tomose. Aproximadamente em 60% dos casos, a estenose se desenvolve no local da anastomose e responde favora-velmente à angioplastia convencional com balão (sucesso primário em torno de 90%).10
iNterveNÇÃo CoroNÁria PerCUtÂNea eM Leito Nativo de PaCieNtes CoM CrM PrÉvia
Em geral, o leito nativo coronário desses pacientes já submetidos a CRM prévia apresentam uma elevada carga aterosclerótica, calcificação acentuada, doença de tronco de coronária esquerda associada e oclusões crônicas totais caracterizando um cenário de ICP de abordagem complexa.
Portanto, além de expertise do operador, é real a neces-sidade de aterectomia rotacional (Rotablator) para permitir expansão adequada dos stents, de imagem intravascular (ultrassom intra-coronário e/ou tomografia de coerência óptica) para guiar o procedimento e otimizar o implante dos stents, sendo fortemente recomendado o uso de stents farmacológicos para diminuir as taxas de re-estenose.
reesteNose iNtra-STEnT (ris)A reestenose angiográfica é definida como presença
de obstrução superior a 50% do diâmetro do segmento da artéria tratada, dentro do stent ou até 5 mm de suas bordas. A reestenose clínica consiste no retorno dos sintomas de isquemia miocárdica, associado à confirmação angiográfica, necessitando de nova revascularização da lesão-alvo quer seja por intervenção percutânea ou cirúrgica.11
A reestenose dos stents pode ser classificada em quatro
Tabela 2. Classificação da reestenose intra-stent.
tipo i ou focal: lesão menor que 10 mm de comprimento
tipo ii ou difusa intra-stent: lesão maior que 10 mm de comprimento, porém restrita ao stenttipo iii ou proliferativa: lesão maior que 10 mm de comprimento ultrapassando as margens do stenttipo iV ou oclusiva: ausência de fluxo anterógrado
tipos, conforme Tabela 2.12
O padrão mais comum de reestenose após implante de stent convencional é o difuso, enquanto que após stent farmacológico o mais comum é o focal.
Os mecanismos envolvidos na reestenose coronariana após o tratamento percutâneo com balão são deposição plaquetária, formação de trombo, retração elástica e remode-lamento negativo. Com o advento do stent, houve o bloqueio da retração elástica e do remodelamento negativo, reduzindo as taxas de reestenose por estes mecanismos.
O mecanismo da reestenose dos stents convencionais é a hiperplasia neointimal, que foi reduzida drasticamente com o uso de stents farmacológicos. As taxas de reestenose após balão são de 32-42%, dos stents convencionais 16-32% e dos stents farmacológicos inferiores a 10%.
Embora inicialmente descrita como benigna, estudos recentes têm demostrado uma maior incidência de SCA como apresentação clínica da reestenose, tanto de stents convencionais como de farmacológicos.
Em estudo que comparou a apresentação clínica de pacientes com reestenose de acordo com o tipo de stent, cerca de 65 a 70% dos casos eram SCA, sendo 5 a 10% de IAM, sem diferenças entre os tipos de stent. Neste estudo, os fatores de risco relacionados a IAM como forma de apresentação do quadro de reestenose foram tabagismo ativo e insuficiência renal crônica. Estes achados sugerem que a apresentação clínica da reestenose intra-stent está associada aos fatores de risco relacionados ao paciente e não aos fatores relacionados ao dispositivo. Com relação aos desfechos em longo prazo, a SCA como forma de apresentação de RIS foi preditor independente de eventos cardiovasculares adversos maiores aos seis meses, quan-do comparada ao quadro de angina estável ou isquemia silenciosas causada pela reestenose.13
Os principais fatores de risco associados à ocorrência de reestenose são: diabetes, idade inferior a 55-60 anos, SCA, angioplastia prévia, sexo feminino, lesões multiarteriais, lesão de tronco de coronária esquerda, lesões em enxertos venosos, oclusões crônicas, stents com diâmetros iguais ou inferiores a 2,5 e comprimento maior ou igual a 40 mm, lesões calcificadas, expansão inadequada do stent e perda geográfica.
Embora os stents farmacológicos tenham reduzido de forma significativa as taxas de reestenose, esta ainda pode ocorrer devido, principalmente aos seguintes fatores: hi-persensibilidade ao polímero e/ou à plataforma metálica, resistência à droga atiproliferativa, sub-expansão do stent, fratura do stent e perda geográfica da lesão.
O uso de métodos de imagem intravascular, como o ultrassom intracoronário e a tomografia de coerência óptica podem auxiliar de maneira fundamental na avaliação do mecanismo da reestenose e ajudar a guiar tratamento.
O prognóstico do tratamento da reestenose depende de
rev Soc Cardiol estado de São paulo 2016;26(2):128-33

131
sua classificação. Quanto maior a proliferação neointimal maior será a recorrência de reestenose.
O tratamento de pacientes com reestenose clínica trata-dos anteriormente com balão é feito utilizando-se um stent convencional ou farmacológico. Pacientes com reestenose clínica tratados anteriormente com stent convencional devem ser tratados com stent farmacológico.
O tratamento da restenose de um stent farmacológico ainda é controverso e desanimador, pois a reestenose após o tratamento com um novo stent farmacológico com a mes-ma droga ou droga diferente ocorre em 25-30% dos casos. Deve-se tentar avaliar o mecanismo de reestenose. Se for detectado perda angiográfica da lesão ou fratura de stent, um novo stent farmacológico deverá ser implantado. No caso de hipoexpansão do stent, deve-se tentar corrigir com o uso de balões adequados. A hiperplasia neointimal pode ser corrigida com implante de um outro stent farmacológi-co ou com o emprego de balão farmacológico, que tem se mostrado superior ao balão convencional e com resultados semelhantes quando comparado ao implante de outro stent farmacológico.
Em pacientes com reestenoses intra-stent recorrentes, principalmente difusa e associada à doença multiarterial e/ou lesões complexas, a cirurgia de revascularização do miocárdio deve ser considerada.
Um dos diagnósticos diferencias da reestenose intra-stent é a neoaterosclerose, definida como presença de placa ateros-clerótica dentro de um stent implantado. Seu diagnóstico in vivo é feito pela tomografia de coerência óptica. Até o momento, poucos trabalhos estão disponíveis na literatura sobre a melhor abordagem da neoaterosclerose, sendo geralmente utilizada a estratégia de tratamento em lesões de novo.
troMBose de STEnTA trombose de stent, embora relativamente incomum, é
uma das complicações mais temidas em pacientes subme-tidos à ICP, pois apresenta taxas de mortalidade de 10-20% ao final de um ano.
A trombose de stent pode ser classificada de acordo com o tempo de ocorrência ou de acordo com o grau de suspeita clínica.14 (Tabela 3)
A trombose de stent geralmente se apresenta com quadro de infarto agudo do miocárdio com supradesnivelamento do segmento ST (IAMCSST) e está associada a piores desfechos clínicos a curto e longo prazo.
Em uma série de 430 casos de trombose de stent defi-nitiva, a ocorrência de óbito e nova trombose de stent foi de 18% aos 30 dias de seguimento. Estes pacientes apresentam maior risco de trombose de stent recorrente, IAM recorrente e óbito em até três anos.15
Com relação ao tempo de ocorrência, a trombose de stent precoce está associada a maior mortalidade hospitalar quando comparada a trombose tardia ou muito tardia.16
O IAM devido a trombose de stent difere do IAM causado por uma placa aterosclerótica em uma coronária nativa por estar associado à maior carga trombótica, embolização distal mais frequente e menores taxas de reperfusão.
A trombose de stent é uma complicação rara. Em uma metanálise de 30 estudos que incluiu 220000 pacientes e 4300 tromboses de stent, após uma mediana de 22 meses
Tabela 3. Classificação de trombose de stent.
De acordo com o momento em que ocorre
precoce: < 30 dias (aguda < 24h e sub-aguda 1-30 dias)
tardia: 30 dias a 1 ano
muito tardia: > 1 ano
De acordo com o grau de suspeita clínicadefinitiva: SCA comprovada pela cinecoronariografia ou anatomia patológicaprovável: morte inexplicada nos primeiros 30 dias após implante do stent ou SCA envolvendo território no qual foi implantado o stent sem confirmação angiográfica, independentemente do tempo
possível: morte inexplicada > 30 dias após o implante do stent
de seguimento, a ocorrência de trombose de stent foi de 2,4%, sendo 0,4% aguda, 1,1%, sub-aguda, 0,5% tardia e 0,6% muito tardia.17
Com a melhora das técnicas de implante dos stents e com a utilização de terapia antiplaquetária dupla, as taxas atuais de trombose precoce de stent reduziram para menos de 1% e após 30 dias para 0,2 a 0,6% por ano.
Os fatores de risco para sua ocorrência podem estar rela-cionados ao paciente, ao procedimento e/ou ao tipo de stent utilizado. Os principais fatores relacionados ao paciente são: tamanho do vaso e comprimento da lesão, SCA, disfunção ventricular, diabetes, insuficiência renal crônica, resistência ou descontinuação do clopidogrel. Os relacionados ao procedi-mento são: subdimensionamento ou expansão inadequada do stent, dissecção de bordas, presença de trombo na lesão, múltiplos stents, comprimento do stent, lesão em bifurcação e terapia antitrombótica peri-procedimento. Os relacionados ao stent são: tipo de stent, tipo de droga antiproliferativa e o polímero carreador da droga.
Apesar dos inúmeros fatores de risco possíveis, os predi-tores de trombose de stent mais comuns e mais consistentes são descontinuação precoce da terapia antiplaquetária, doença coronariana extensa e número/comprimento do stent. Outros preditores comuns porém menos consistentes foram SCA como quadro clínico na admissão, diabetes, tabagismo ativo e lesão em bifurcação.17
Como o quadro clínico na maioria dos pacientes com trombose de stent é o IAMCSST, os pacientes devem ser encaminhados preferencialmente para angioplastia primária, objetivando a reperfusão coronariana precoce.
Devido ao seu quadro infrequente, a estratégia interven-cionista de escolha para o tratamento desta complicação permanece incerta. Por se tratar de um cenário geralmente com alta carga trombótica, os inibidores da glicoproteína IIb/IIIa e os cateteres de tromboaspiração manual podem contri-buir para a melhora dos resultados. A dilatação do stent com balões de alta pressão deve ser usada para corrigir possíveis mecanismos relacionados ao stent. O uso de métodos de imagem intravascular, como o ultrassom intracoronário e a tomografia de coerência óptica, podem auxiliar na identificação da causa da trombose e otimizar os resultados da angioplastia.
A utilização de outro stent para tratar trombose de stent é um tema controverso, ficando reservado para casos de dissecção de borda ou lesões adjacentes ao stent prévio e/ou resultados inadequados apenas com o uso de balão.
SíNDROME CORONARIANA AGUDA EM INDIVíDUOS COM REVASCULARIZAÇÃO CIRúRGICA OU PERCUTÂNEA PRÉVIA
rev Soc Cardiol estado de São paulo 2016;26(2):128-33

132
Em um estudo observacional que avaliou o manejo dos pacientes com trombose de stent, a maioria dos pacientes com trombose precoce de stent foi tratada apenas com balão, enquanto que pacientes com trombose muito tardia foram tratados com implante de stent farmacológico. A utilização de tromboaspiração e de inibidores da glicoproteína IIb/IIIa foi de 30-35% e 65-75%, respectivamente.16
O uso da terapia antiplaquetária adequada é de fundamen-tal importância para minimizar o risco de trombose de stent e de sua recorrência. Deve-se dar preferência ao prasugrel ou ticagrelor, desde que indicado, pois estes, além de reduzirem eventos cardíacos adversos maiores, reduzem também as taxas de trombose de stent.18,19 Estes medicamentos devem ser utilizados por pelo menos 12 meses após SCA, podendo o tratamento ser prolongado principalmente nos pacientes de alto risco trombótico, se bem tolerado.
resULtados CLíNiCos da iCP eM PaCieNtes CoM sCa e iCP oU CrM PrÉvias
Os pacientes que se apresentam com SCA sem supra de ST e que possuem antecedentes de CRM ou ICP prévias apresentam um maior risco de eventos adversos. As diretrizes brasileira, americana e européia de SCASST mais recentes recomendam estratificação invasiva nestes pacientes. No entanto, na prática, os pacientes com CRM prévia tendem a ser tratados de maneira mais conservadora.
Em um estudo observacional, pacientes com história prévia de ICP que se apresentaram com quadro de SCASST tiveram uma maior probabilidade de serem tratados inva-sivamente, o que é consistente com as recomendações das diretrizes atuais. Inversamente, os pacientes com CRM prévia foram menos frequentemente submetidos a cine-coronariografia e a revascularização miocárdica, além de receberem menos medicações antitrombóticas precoce-mente, mesmo sendo pacientes de alto risco de eventos cardíacos pelos escores de risco.1
Os pacientes que se apresentam com quadro isquêmico agudo de trombose de stent ou oclusão de enxertos venosos
referÊNCias 1. Elbarasi E, Goodman SG, Yan RT, Welsh RC, Kornder J, Wong GC,
et al. Management patterns of non-ST segment elevation acute coronary syndromes in relation to prior coronary revascularization. Am Heart J. 2010;159:40-6.
2. Steg PG, Goldberg RJ, Gore JM, Fox KAA, Eagle KA, Flather MD, et al. Baseline Characteristics, Management Practices, and In-Hospital Outcomes of Patients Hospitalized With Acute Coro-nary Syndromes in the Global Registry of Acute Coronary Events (GRACE). Am J Cardiol. 2002;90:358–363.
3. Brener SJ, Lytle BW, Casserly IP, Schneider JP, Topol EJ, Lauer MS. Propensity analysis of long-term survival after surgical or percutaneous revascularization in patients with multivessel coro-nary artery disease and high-risk features.Circulation. 2004 May 18;109(19):2290-5. Epub 2004 Apr 26.
4. Sabik JF 3rd, Blackstone EH, Houghtaling PL, Walts PA, Lytle BW. Is reoperation still a risk factor in coronary artery bypass surgery? Ann Thorac Surg. 2005 Nov;80(5):1719-27.
5. Tatoulis J, Buxton BF, Fuller JA. Patencies of 2127 arterial to coronary conduits over 15 years. Ann Thorac Surg. 2004 Jan;77(1):93-101.
6. Lorusso R, De Cicco G, Ettori F, Curello S, Gelsomino S, Fucci C. Emergency surgery after saphenous vein graft perforation complicated by catheter balloon entrapment and hemorrhagic shock. Ann Thorac Surg. 2008 Sep;86(3):1002-4.
7. Morís C, Lozano I, Martín M, Rondán J, Avanzas P. Embolic pro-tection devices in saphenous percutaneous intervention. EuroIn-tervention. 2009 May;5 Suppl D:D45-50.
8. Vaknin-Assa H, Assali A, Kornowski R. Preliminary experiences using the Mguard stent platform in saphenous vein graft lesions. Catheter Cardiovasc Interv. 2009 Dec 1;74(7):1055-7.
9. Sanchez-Recalde A, Jiménez Valero S, Moreno R, Barreales L, Lozano I, Galeote G, Martín Reyes R, Calvo L, Lopez-Sendon JL. Safety and efficacy of drug-eluting stents versus bare-metal stents in saphenous vein grafts lesions: a meta-analysis. EuroIn-tervention. 2010 May;6(1):149-60.
10. Shimshak TM, Giorgi LV, Johnson WL, McConahay DR, Rutherford BD, Ligon R, Hartzler GO. Application of percutaneous transluminal coronary angioplasty to the internal mammary artery graft. J Am Coll Cardiol. 1988 Nov;12(5):1205-14.
representam um dos maiores subgrupos de risco para a ICP.Um estudo retrospectivo analisou 415 pacientes sub-
metidos à ICP por SCA decorrente de trombose de stent ou oclusão de enxerto venoso. O grupo oclusão de enxerto venoso foi subdividido em ICP realizada no enxerto venoso ou ICP realizada na artéria coronária nativa. Os pacientes do grupo ICP em trombose de stent tiveram maiores taxas de eventos adversos em 30 dias quando comparados aos pacientes que realizaram ICP na artéria coronária nativa. Não houve diferença na ocorrência de eventos entre os pacien-tes do grupo trombose de stent e o grupo ICP no enxerto venoso em 30 dias. Ao final de 1 ano de seguimento, a taxa de eventos foi semelhante entre os 3 grupos.20
Em uma análise post-hoc do estudo SYNTAX, embora as taxas de trombose de stent e oclusão de enxerto definitiva/provável tenham sido semelhantes (aproximadamente 10%) ao final de 5 anos, o impacto clínico da trombose de stent parece ser maior, com uma mortalidade de 41,3% versus 23,1% quando comparada aos pacientes com oclusão do enxerto.21
CoNsideraÇÕes fiNaisCom o aumento da expectativa de vida e do número de
procedimentos de angioplastias ou revascularização cirúr-gica do miocárdio, a necessidade de novas intervenções devido a SCA é real, uma vez que o substrato aterogênico persiste. É imperativo o controle dos fatores de risco, mu-dança de estilo de vida e tratamento clínico otimizado para diminuir a chance de evolução desfavorável. Outrossim, a qualidade da primeira intervenção é muito importante, visto que frequentemente os eventos adversos se relacionam a aspectos técnicos cirúrgicos ou do implante do stent. A indicação de novo procedimento de revascularização e qual procedimento a ser adotado precisa ser amplamente discutida entre os membros do “Heart Team”.
CoNfLitos de iNteresseOs autores declaram não possuir conflitos de
interesse na realização deste trabalho.
rev Soc Cardiol estado de São paulo 2016;26(2):128-33

133
11. Dangas GD, Claessen BE, Caixeta A, Sanidas EA, Mintz GS, Mehran R. In-stent restenosis in the drug-eluting stent era. Journal of the American College of Cardiology. 2010;56(23):1897-907.
12. Mehran R, Dangas G, Abizaid AS, Mintz GS, Lansky AJ, Satler LF, et al. Angiographic patterns of in-stent restenosis: classi-fication and implications for long-term outcome. Circulation. 1999;100(18):1872-8.
13. Magalhaes MA, Minha S, Chen F, Torguson R, Omar AF, Loh JP, et al. Clinical Presentation and Outcomes of Coronary In-stent Restenosis Across 3-stent Generations. Circ Cardiovasc Interv. 2014;7:768-776
14. Cutlip DE, Windecker S, Mehran R, Boam A, Cohen DJ, van Es GA, et al. Clinical end points in coronary stent trials: a case for standardized definitions. Circulation. 2007;115(17):2344-51.
15. van Werkum JW, Heestermans AA, de Korte FI, et al. Long--term clinical outcome after a first angiographically confirmed coronary stent thrombosis: an analysis of 431 cases. Circulation 2009;119:828–34.
16. Armstrong EJ, Feldman DN, Wang TY, Kaltenbach LA, Yeo KK, Wong SC, et al. Clinical Presentation, Management, and Outcomes of Angiographically Documented Early, Late, and Very Late stent Thrombosis. J Am Coll Cardiol Intv 2012;5:131–40.
17. D’Ascenzo F, Bollati M, Clementi F, Castagno D, Lagerqvist Bo, Hernandez JMT, et al. Incidence and predictors of coronary stent thrombosis: Evidence from an international collaborative meta-analysis including 30 studies, 221,066 patients, and 4276 thromboses. Int J Cardiol. 2013 Jul 31;167(2):575-84.
18. Wiviott SD, Braunwald E, McCabe CH, Montalescot G, Ruzyllo W, Gottlieb S, et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2007 Nov 15;357(20):2001-15.
19. Wallentin L, Becker RC, Budaj A, Cannon CP, Emanuelsson H, Held C, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2009 Sep 10;361(11):1045-57
20. Ota H, Mahmoudi M, Lhermusier T, Magalhaes MA, Torguson R, Satler LF, et al. Comparison of clinical outcomes in patients presenting with an acute coronary syndrome due to stent throm-bosis or saphenous vein graft occlusion and undergoing percu-taneous coronary intervention. Cardiovasc Revasc Med. 2015 Dec;16(8):441-6.
21. Farooq V, Serruys PW, Zhang Y, Mack M, Ståhle E, Holmes DR, et al. Short-term and long-term clinical impact of stent thrombosis and graft occlusion in the SYNTAX trial at 5 years: Synergy Betwe-en Percutaneous Coronary Intervention with Taxus and Cardiac Surgery trial. J Am Coll Cardiol. 2013 Dec 24;62(25):2360-9.
SíNDROME CORONARIANA AGUDA EM INDIVíDUOS COM REVASCULARIZAÇÃO CIRúRGICA OU PERCUTÂNEA PRÉVIA
rev Soc Cardiol estado de São paulo 2016;26(2):128-33

134
revisÃo/review
resUMoO tratamento da síndrome coronariana aguda obteve expressiva redução da mortalidade
graças ao desenvolvimento de novos fármacos e da angioplastia coronariana primária. Entretanto, apesar desta terapêutica ser eficiente e oferecer resultados adequados no tratamento do infarto agudo do miocárdio (IAM), o choque cardiogênico ainda ocorre em 5 a 10% dos casos e continua a ser a principal causa de mortalidade intra-hospitalar. Portanto, temos um desfecho clínico insatisfatório neste grupo de pacientes com prog-nóstico reservado a curto e longo prazo.
O balão intra-aórtico, embora empregado de forma rotineira no tratamento do choque cardiogênico refratário, apresenta benefícios limitados e não apresenta impacto no prognóstico destes pacientes, como demonstrado em ensaios randomizados recentes.
Os sistemas de suporte de vida extracorpóreo (ECLS) são considerados dispositi-vos eficazes para o tratamento do choque cardiogênico refratário no IAM, uma vez que oferecem fluxo sanguíneo adequado e são instalados rapidamente pela canulação de vasos periféricos. Deste modo, permitem a tomada de decisões médicas para a realização de intervenções diagnósticas e terapêuticas – ponte para decisão – para tratamento da causa clínica e anatômica, com resultados clínicos consistentes e encorajadores para a utilização deste tipo de tecnologia.
Descritores: Infarto do miocárdio; Choque cardiogênico; Insuficiência cardíaca sistólica; Circulação extracorpórea; Oxigenação por membrana extracorpórea.
aBstraCtThe treatment of acute coronary syndrome has achieved a significant reduction in mor-
tality, thanks to the development of new drugs and primary coronary angioplasty. However, although this therapy is efficient and offers adequate results in the treatment of acute myo-cardial infarction (AMI), cardiogenic shock still occurs in 5% to 10% of cases, and continues to be the main cause of intrahospital mortality. Therefore, we have an unsatisfactory clinical outcome in this group of patients, with a reserved prognosis in the short and long terms.
The intra-aortic balloon pump, although used routinely in the treatment of refractory cardiogenic shock, has limited benefits and does not have any impact on patient prognosis, as demonstrated in recent randomized trials.
Extracorporeal life support systems (ECLS) are considered effective devices for the treatment of refractory cardiogenic shock in AMI, as they offer adequate blood flow and are rapidly installed through cannulation of the peripheral veins. They therefore enable medical decision-making for diagnostic and therapeutic interventions – decision-making bridge – for treatment of the clinical and anatomical cause, with consistent and encourag-ing clinical results for the use of this type of technology.
Descriptors: Myocardial infarction; Shock cardiogenic; Heart failure, systolic; Extracorporeal circulation; Extracorporeal Membrane Oxygenation
Eduardo Gregório Chamlian1
Nelson Americo Hossne Junior1
Walter José Gomes1
1. Disciplina de Cirurgia Cardiovascular da UNIFESP – Escola Paulista de Medicina, São Paulo, Brasil
Correspondência:Rua Napoleão de Barros, 715, 3° andar, São Paulo, [email protected]
PaPeL do sUPorte CirCULatÓrio Nas síNdroMes CoroNariaNas agUdas
tHe roLe of CirCULatorY sUPPort iN aCUte CoroNarY sYNdroMes
iNtrodUÇÃoO tratamento da síndrome coronariana aguda (SCA) teve
enorme avanço com o desenvolvimento de novos fármacos e da angioplastia primária, com expressiva redução da mor-talidade. No entanto, apesar da eficiência e bons resultados
no tratamento precoce no infarto agudo do miocárdio (IAM), o choque cardiogênico ainda ocorre em 5 a 10%, e continua a ser a principal causa de mortalidade intra-hospitalar nestes pacientes.1 Portanto, o desfecho clínico dos pacientes com SCA que cursam com choque cardiogênico continua a ser
rev Soc Cardiol estado de São paulo 2016;26(2):134-40

135
insatisfatório; e o prognóstico daqueles que desenvolvem parada cardíaca permanece extremamente reservado.
Embora comumente empregado no tratamento do cho-que cardiogênico refratário, devido à disponibilidade e fa-miliaridade do médico, o balão intra-aórtico tem benefícios limitados e não melhora o prognóstico destes pacientes, como demonstrado em recentes ensaios randomizados.2-4
Portanto, novos dispositivos mais eficazes de manterem su-porte circulatório tem emergindo e encontrado maior aplicação.
Atualmente existem vários dispositivos disponíveis de suporte circulatório mecânico, como suporte de vida extra-corpórea (ECLS), ventrículos artificiais para-corpóreos ou extracorpóreos (VAD) e o coração artificial total.
Os sistemas de suporte de vida extracorpórea (ECLS) são considerados dispositivos eficazes para tratar o choque cardiogênico refratário ou a parada cardíaca no IAM devido à sua capacidade de fornecer um eficiente suporte circulatório e com a possibilidade de serem rapidamente executados através de canulação de vasos periféricos.
No entanto, os ECLS, isoladamente, são insuficientes para a resolução do choque cardiogênico após IAM. O objetivo principal da instalação do ECLS, nestes casos, é manter os pacientes vivos temporariamente para permitir raciocínio e tomada de decisões médicas, com o escopo de ponte de decisão para intervenções diagnósticas e terapêuticas, a fim de elucidar e tratar a condição clinica e anatômica que desencadeou a situação. (Figuras 1 e 2)
Isto é particularmente importante em pacientes com cho-que cardiogênico consequente a um IAM extenso; nos quais, embora a reperfusão possa ter sido eficaz, a recuperação da função contrátil devido ao miocárdio atordoado (stunned myocardium) possa demorar vários dias. Outra situação ocor-re quando há parada cardíaca refratária, onde a instalação de ECLS permite estabilizar hemodinamicamente o paciente e proceder com métodos diagnósticos e de tratamento da condição desencadeadora.
O grande desenvolvimento dos sistemas de ECLS permite atualmente a implantação rápida com canulação percutâ-nea periférica e utilização de oxigenadores de membrana e bombas centrifugas, com resultados clínicos cada vez mais consistentes e encorajadores.
estratÉgia Para assistÊNCia CirCULatÓria MeCÂNiCa
Na última década, a taxa de mortalidade de pacientes com infarto agudo do miocárdio com supradesnivelamento do segmento ST (IAMSST) submetidos à terapia de reperfusão coronariana via angioplastia, ou trombólise intravenosa, dimi-nuiu de forma significativa, quando comparada com o período em que este tipo de terapia não era possível.5 Os principais fatores que contribuem para este resultado são: avanços na terapia farmacológica,6-8 melhora contínua de dispositivos para intervenção coronária percutânea (ICP), 9-11 dedicação continua para diminuição do tempo porta-balão no IAMSST,12,13 utilização de suporte circulatório mecânico nos casos de instabilidade hemodinâmica14,15 e programas de reabilitação cardiovascu-lar.16,17 No entanto, quando analisamos o subgrupo de pacientes com IAMSST que desenvolveu choque cardiogênico – 7 a 10% dos casos -, a mortalidade intra-hospitalar ainda permanece extremamente elevada, apesar da terapia de reperfusão coro-nariana,18-20 com evolução clínica gravemente comprometida21,22 e mortalidade entre 40-50%.23 Os resultados do estudo SHOCK em 1999 evidenciaram que o melhor tratamento para o choque cardiogênico pós IAMSST é a revascularização precoce.24 Apesar da revascularização precoce ser essencial para a re-cuperação da função ventricular, a disfunção de múltiplos órgãos é a principal causa de morte. Deste modo, a estabili-zação hemodinâmica também deve desempenhar um papel fundamental na estratégia de tratamento.25
O balão intra-aórtico (BIA) historicamente tem sido usado e considerado um tipo de dispositivo de assistência circula-tória mecânica (DACM) efetivo para pacientes com IAMSST com choque cardiogênico.26,27 Entretanto, estudos clínicos recentes, randomizados, controlados e multicêntricos de-monstraram que o BIA não oferece benefício adicional na evolução de pacientes com choque cardiogênico submetidos a ICP.2-3 Como resultado, existe uma intensa controvérsia no uso do BIA neste perfil de pacientes.28-30
oxigenação por membrana extracorpórea (eCMo) A utilização de ECMO (sistema de suporte de vida extra-
corpórea) têm sido reportada na literatura de modo crescente para pacientes com choque cardiogênico,31-38 com taxas de sobrevida entre 32,7% a 76,2%, sendo, as maiores taxas, em centros com expertise em implantes de dispositivo de assistência ventricular (DAV) ou transplante cardíaco. Bermudez
figura 2. Centrimag® utilizada em suporte ventricular esquerdo (canulação ventrículo esquerdo – aorta ascendente) como ponte para decisão.
PAPEL DO SUPORTE CIRCULATÓRIO NAS SíNDROMES CORONARIANAS AGUDAS
figura 1 – Centrimag® com detalhe da bomba centrífuga.
rev Soc Cardiol estado de São paulo 2016;26(2):134-40

136
et al.32 e Tayara et al.34 relatam taxas de implante de DAV de 45% e 100%, com sobrevida de 64% e 66,7%, respectivamente.
impella®
Os usos de dispositivos de assistência ventricular tem-porários têm sido utilizados de forma rotineira em pacientes com choque cardiogênico mesmo em vigência de parada cardiorrespiratória (PCR),39-45 com taxa de alta hospitalar entre 26% e 55%. A porcentagem de pacientes que receberam um DAV foi de 1,7% a 5,6%, e, nesta série, nenhum paciente foi submetido a transplante cardíaco.
revasCULariZaÇÃoA revascularização adequada variou entre 20% a 100%
nos pacientes submetidos a ECMO e, entre 58% e 100% naqueles submetidos a DAV. Na literatura, poucos autores relataram o valor da revascularização na vigência de choque cardiogênico após um IAMSST. Sakamoto at al.31, Chen at al..35 e Anderson et al.46 encontraram diferenças significativas nas taxas de revascularização em sobreviventes quando com-parados aos não sobreviventes (84,4% vs. 57,6%, p=0,005; 100% vs. 67%, p=0,033; e 100% vs. 67%, p<0,01).
estratifiCaÇÃo de risCoAnálises multivariadas de risco foram realizados em cinco
estudos.31,33,37,42,45 O estudo de Sakamoto et al. avaliou 98 pacientes submetidos a ECMO após síndrome coronariana aguda (SCA) e os preditores independentes de mortalidade intra-hospitalar foram: angioplastia sem sucesso (Odds Ratio (OR): 6,7), assistolia ou atividade elétrica sem pulso (OR: 6,3) e complicações relacionadas a ECMO (OR: 4,6).31 Sheu et al. estudaram 71 pacientes com choque cardiogênico após IAMSST e identificou os seguintes preditores independentes de sobrevida: angioplastia sem sucesso (OR: 4,1), insuficiên-cia cardíaca avançada (NYHA ≥ 3) (OR: 13,3) e suporte com ECMO (OR: 0,2).33 Kim et al. reportaram 27 pacientes submeti-dos a ECMO após IAMSST, e somente o nível sérico de lactato antes da instalação de ECMO foi um fator independente associado com maior mortalidade hospitalar (p=0,007).37 Aiba et al. analisaram 64 pacientes com choque cardiogênico pós IAMSST que receberam BIA (38 pacientes) ou ECMO (26 pacientes), e identificaram um sistema de escore de choque baseado na frequência cardíaca, pressão arterial, débito uri-nário, excesso de bases e estado mental como um preditor independente de mortalidade hospitalar (OR:2,2).42 Lauten et al. avaliaram 120 pacientes com choque cardiogênico pós IAMSST derivados do Registro Impella-EUROSHOCK e identificaram como preditores independentes de mortalidade a idade acima de 65 anos (OR:5,2) e nível sérico de lactato maior que 3,8 mmol/L (OR:5,2).45
Análises univariadas foram demonstradas em dois estu-dos. 35,46 Chen et al. reportaram 36 pacientes submetidos a ECMO de resgate após PCR devido a IAMSST e encontraram os seguintes fatores com diferença estatística significativa no desfecho de mortalidade: escore inotrópico, nível sérico de lactato, duração da PCR, Escore SOFA (Sepsis-related Organ Failure Assessment Score), falência hepática, falência renal e falência do sistema nervoso central.35 Da mesma forma, Anderson et al. estudaram 100 pacientes com choque cardio-gênico pós IAMSST e identificaram a gravidade do choque,
insucesso na revascularização e disfunção de múltiplos órgãos como preditores de maior mortalidade hospitalar.46
MoMeNto do iMPLaNteA assistência circulatória mecânica no choque cardio-
gênico pós IAMSST tem sido utilizada primariamente como terapia de resgate após a intervenção coronária percutânea que evolui com necessidade de suporte inotrópico sem resposta hemodinâmica adequada. (Figuras 3 e 4)
Sakamoto et al. reportaram 98 pacientes submetidos a ECMO por choque cardiogênico ou PCR. A ICP foi realizada com sucesso em 66,3% e a ECMO foi instituída antes ou durante a ICP em 83,7% dos casos. Houve retirada da ECMO em 55,1% dos casos, com sobrevida hospitalar de 32,7%.31
Sheu et al. analisaram 46 pacientes submetidos a ECMO simultaneamente à ICP após IAMSST. Nessa casuística, a retirada da ECMO foi possível em 78,3% dos casos, com so-brevida hospitalar de 60,9%. Este estudo mostra uma taxa de sobrevida significativa com o uso da ECMO associada a ICP em um grupo de pacientes críticos, com grande probabilidade de óbito sem o uso da assistência circulatória mecânica.33
Kim et al. apresentaram 27 pacientes nos quais 70,4% foram submetidos a ECMO antes da ICP ou cirurgia de re-vascularização miocárdica, demonstrando uma sobrevida hospitalar de 59,3%.37
A utilização da ECMO e dos DAV não implantáveis devem
figura 3. Canulação em artéria femoral direita e veia femoral direita por punção percutânea com irrigação distal do membro inferior direito em paciente com fração de ejeção de 8% pós-infarto agudo do miocárdio.
rev Soc Cardiol estado de São paulo 2016;26(2):134-40

137
ser iniciados prontamente, uma vez que têm a capacidade de fornecer uma rápida normalização das variáveis hemodi-nâmicas encontradas no choque cardiogênico.
reCUPeraÇÃo MioCÁrdiCaNa literatura, a taxa de retirada dos DACM variou de
0% a 81,5% para ECMO, 32,4% a 76,9% para DAV não implantáveis e de 0% a 47,1% para DAV implantáveis,46-47 em comparação com a menor retirada dos DAV implantá-veis de longa duração, por exemplo o HeartMate I®.48-50A retirada da ECMO e dos DAV não implantáveis foi maior (> 70%) em estudos com maiores taxas de revasculariza-ção (> 80%),33,37,40,43 e consistentemente menor (< 70%) em estudos com menores taxas de revascularização (< 80%).31,32,34,39,42A ECMO geralmente é colocada de forma precoce e ocasionalmente antes da revasculari-zação miocárdica, enquanto os DAV não implantáveis são colocados no laboratório de hemodinâmica após a ICP. Os DAV implantáveis necessitam de ambiente cirúr-gico para sua instalação e são geralmente utilizados nas
falhas de revascularização percutânea ou após cirurgia de revascularização miocárdica, fato este que acarreta um maior tempo para o início de sua terapêutica, além de um maior custo.
resULtados de soBrevidaNotavelmente, oito estudos que utilizaram dispositi-
vos de ACM no tratamento do choque cardiogênico pós IAMSST mostraram uma sobrevida maior que 60%, resul-tado este favorável, considerando que o quadro agudo de sua apresentação clínica neste subgrupo de pacientes é significativamente maior quando comparado com estudos que não incluíram dispositivos de ACM.32-34,38,48-51
aLgoritMo de assistÊNCia CirCULatÓria MeCÂNiCa No CHoQUe CardiogÊNiCo Na síNdroMe CoroNariaNa agUda
As análises de fatores de risco demonstram que o tempo para intervenção coronária e a gravidade do choque são os principais preditores de sobrevida principais neste grupo de pacientes.31,33,35,42,46 A intervenção coronariana rápida previne o dano miocárdico irreversível enquanto a ACM diminui a disfunção de múltiplos órgãos.25 Diretrizes atuais recomendam a revascularização de emergência no choque cardiogênico após um infarto agudo do mio-cárdio,52 entretanto a ocorrência de choque cardiogênico grave pode colocar em risco uma recuperação favorável.
Deste modo, propomos um algoritmo modificado de Caceres et al.22 baseado em três elementos principais: iden-tificação do estado de choque cardiogênico grave, revascu-larização miocárdica e tempo para instalação de dispositivos de assistência circulatória mecânica. (Figuras 5 e 6)
figura 4. detalhe da Centrimag® com 4.500 rpm e fluxo de 5 l/min.
figura5. Algoritmo de tratamento de choque cardiogênico na síndrome coronariana aguda – i.
PAPEL DO SUPORTE CIRCULATÓRIO NAS SíNDROMES CORONARIANAS AGUDAS
IAM: Infarto Agudo do MiocárdioCC: Choque CardiogênicoBIA: Balão Intra-AórticoECMO: Oxigenação por Membrana ExtracorpóreaICP: Intervenção Coronária PercutâneaARI: Artéria Relacionada ao InfartoACM: Assitência Circulatória MecânicaCRM: Cirurgia de Revascularização MiocárdicaDAV: Dispositivo de Assistência Ventricular
Não
IAM<6 hr
Considerar CRM com ACM de back-up
• ECMO• Centrimag
Considerar CRM com ACM de back-up, com suspeita de miocárdio viável e melhora a hipoperfusão:
• Diminuição do edema pulmonar
• Bilirrubina < 3 mg/dl• Creatinina < 2 mg/dl
IAM>6 hr
Continuar estabilização com ACM
ECMO/Centrimag/ Impella 5.0 LP
Continuar ACM até retirada
• Considerar DAV de longa duração• Considerar transplante cardíaco
Sim
• Continuar ACM até retirada• Mudança de dispositivo de ACM se necessário até recupe-ração do miocádio atordoado
IAM/CC
Choque Cardiogênico Grave
Alternativa Impella 5.0 LP
Pas<75 mmhg apesar de:• BIA• Altas doses de Inotrópicos• Uso de Vasopressores
ECMO
ICP Imediata
Sim
ICP com Sucesso da ARI
rev Soc Cardiol estado de São paulo 2016;26(2):134-40

138
IAM/CC
Choque Cardiogênico Grave
Não
Sim
IAM < 6 hr IAM > 6 hr
Sim
Considerar DAV de curta duração
Monitorar lesão por reperfusão
Continuar estabilização com ACM ECMO/Centrimag/Impella 5.0 LP
Continuar ACM até retirada
• Considerar DAV de longa duração• Cinsiderar transplante cardíaco
Uso de 2 ou mais inotrópicos para manter IC> 2,2 I/min/m2
Consideração CRM com ACM de back-up
• ECMO• Centrimag Considerar CRM com de back-up,
com suspeita de miocárdia viavel e melhora da hipoperfusão:• Diminuição do edema pumonar• Bilirrubina < 3 mg/dl• Creatinina < 2 mg/dl
Não
ICP Imediata
ICP com sucesso da ARI
PAS< 75 mmhg apesar de :• BIA• Altas doses de inotrópicos• Uso de vasopressores
IAM: Infarto Agudo do MiocárdioCC: Choque CardiogênicoBIA: Balão Intra-AórticoECMO: Oxigenação por Membrana ExtracorpóriaICP: Intervenção Coronária PercutâneaARI: Artéria Relacionada ao InfartoACM: Assitência Circulatória MecânicaCRM: Cirurgia de Revascularização MiocárdicaDAV: Dispositivo de Assistência Ventricular
CoNsideraÇÕes fiNaisApesar do desenvolvimento importante dos materiais
utilizados na angioplastia coronária percutânea e do avanço tecnológico dos stents, o choque cardiogênico permanece como a principal causa de morte após o infarto agudo do miocárdio.
A utilização precoce de dispositivos de assistência cir-culatória mecânica, em conjunto ou logo após a intervenção
coronária percutânea, é uma opção terapêutica atual e com resultados favoráveis na diminuição da mortalidade.
CoNfLitos de iNteresseOs autores declaram não possuir conflitos de inte-
resse na realização deste trabalho.
figura 6. Algoritmo de tratamento de choque cardiogênico na síndrome coronariana aguda – ii.
referÊNCias1. Westaby S, Kharbanda R, Banning AP. Cardiogenic shock in
ACS. Part 1: prediction, presentation and medical therapy. Nat Rev Cardiol. 2011;9(3):158–71.
2. ISIS-2 (Second International Study of Infarct Survival) Collaborative Group. Randomised trial of intravenous streptokinase, oral aspirin, both, or neither among 17,187 cases of suspected acute myocardial infarction: ISIS-2. Lancet. 1988;2(8607):349-360.
3. Thiele H, Schindler K, Friedenberger J, Eitel I, Furnau G, Grebe E, et al. Intracoronary compared with intravenous bolus abciximab application in patients with ST-elevation myocardial infarction undergoing primary percutaneous coronary intervention: the randomized Leipzig immediate percutaneous coronary intervention abciximab IV versus IC in ST-elevation myocardial infarction trial. Circulation 2008;118(1):49–57.
4. Yusuf S, Zhao F, Mehta SR, Chrolavicius S, Tognoni G, Fox KK. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Engl J Med. 2001;345(7):494–502.
5. Wallentin L, Becker RC, Budaj A, Cannon CP, Emanuelsson H, Held C, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2009;361(11):1045–57.
6. Stone GW, Maehara A, Witzenbichler B, Godlewski J, Parise H,
Dambrink JH, et al. Intracoronary abciximab and aspiration throm--bectomy in patients with large anterior myocardial infarction: The INFUSE-AMI randomized trial. JAMA. 2012; 307(17):1817–26.
7. Stone GW, Grines CL, Cox DA, Garcia E, Tcheng JE, Griffin JJ, et al. Comparison of angioplasty with stenting, with or without abciximab, in acute myocardial infarction. N Engl J Med. 2002;346(13):957–66.
8. Youssef AA, Wu CJ, Hang CL, Cheng CI, Yang CH, Chen CJ, et al. Impact of PercuSurge device conjugative with intracoronary administration of nitroprusside on no-reflow phenomenon follo-wing primary percutaneous coronary intervention. Circ J. 2006; 70(12):1538–42.
9. Steq PG, James SK, Atar D, Badano LP, Blömstrom-Lundqvist C, Borger MA, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2012;33(20):2569–619.
10. Steg PG, James SK, Atar D, Badano LP, Blomstrom-Lundqvist C, Borger MA, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2012; 33: 2569 – 2619.
11. Sanborn TA, Sleeper LA, Bates ER, Jacobs AK, Boland J, Fren-ch JK, et al. Impact of thrombolysis, intra-aortic balloon pump counterpulsation, and their combination in cardiogenic shock
rev Soc Cardiol estado de São paulo 2016;26(2):134-40

139
complicating acute myocardial infarction: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK? J Am Coll Cardiol. 2000;36(3 Suppl A):11239.
12. Abdel-Wahab M, Saad M, Kynast J, Geist V, Sherif MA, Richardt G, et al. Comparison of hospital mortality with intra-aortic balloon counterpulsation insertion before versus after primary percuta-neous coronary intervention for cardiogenic shock complicating acute myocardial infarction. Am J Cardiol. 2010; 105(7):967–71.
13. Lawler PR, Filion KB, Eisenberg MJ. Efcacy of exercise-based cardiac rehabilitation post-myocardial infarction: a systematic review and meta-analysis of randomized controlled trials. Am Heart J. 2011;162(4):571–84.e2. doi:10.1016/j.ahj.2011.07.017.
14. Levine GN, Bates ER, Blankenship JC, Bailey SR, Bittl JA, Cercek B, et al. 2015 ACC/AHA/SCAI Focused Update on Primary Per-cutaneous Coronary Intervention for Patients With ST-Elevation Myocardial Infarction: An Update of the 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention and the 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myo-cardial Infarction: A report of the American College of Cardiolo-gy/American Heart Association Task Force on Clinical Practice Guidelines and the Society for Cardiovascular Angiography and Interventions. Circulation. 2016 133(11):1135-47. doi:10.1161/CIR.0000000000000336.
15. Antoniucci D, Valenti R, Santoro GM, Bolognese L, Trapani M, Moschi G, et al. Systematic direct angioplasty and stent-supported direct angioplasty therapy for cardiogenic shock complicating acute myocardial infarction: in-hospital and long-term survival. J Am Coll Cardiol. 1998;31(2):294–300.
16. Thiele H, Zeymer U, Neumann FJ, Ferenc M, Olbrich HG, Haus-leiter J, et al. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med. 2012; 367(14):1287–96.
17. Hochman JS, Sleeper LA, Webb JG, Sanborn TA, White HD, Talley JD, et al. Early revascularization in acute myocardial infarction com-plicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N Engl J Med. 1999;341(9):625–34.
18. Hochman JS, Buller CE, Sleeper LA, Boland J, Dzavik V, San-born TA, et al. Cardiogenic shock complicating acute myocardial infarction-etiologies, management and outcome: A report from the SHOCK Trial Registry: Should we emergently revascularize Occluded Coronaries for cardiogenic shocK? J Am Coll Cardiol. 2000;36(3 Suppl A): 1063–70.
19. Sheu JJ, Tsai TH, Lee FY, Fang HY, Sun CK, Leu S, et al. Early extracorporeal membrane oxygenator-assisted primary percu-taneous coronary intervention improved 30-day clinical outco-mes in patients with ST-segment elevation myocardial infarction complicated with profound cardiogenic shock. Crit Care Med. 2010;38(9):1810–17.
20. Jeger RV, Radovanovic D, Hunziker PR, Pfisterer ME, Stauffer JC, Erne P, et al. Ten-year trends in the incidence and treatment of cardiogenic shock. Ann Intern Med. 2008;149(9):618–26.
21. Hochman JS, Sleeper LA, Webb JG, Sanborn TA, White HD, Talley JD, et al. Early revascularization in acute myocardial infarction com-plicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N Engl J Med. 1999;341(9):625–34.
22. Caceres M, Esmailian F, Moriguchi JD, Arabia FA, Czer LS. Me-chanical circulatory support in cardiogenic shock following an acute myocardial infarction: a systematic review. J Card Surg. 2014;29(5):743-51.
23. Scholz KH. [Reperfusion therapy and mechanical circulatory su-pport in patients in cardiogenic shock]. Herz. 1999; 24:(6):448-64.
24. Hasdai D, Holmes DR Jr, Topol EJ, Berger PB, Criger DA, Hochman JS, et al. Frequency and clinical outcome of cardio-genic shock during acute myocardial infarction among patients receiving reteplase or alteplase: Results from GUSTO-III: Global Use of Strategies to Open Occluded Coronary Arteries. Eur Heart J. 1999;20(2):128-35.
25. Thiele H, Zeymer U, Neumann FJ, Ferenc M, Olbrich HG, Hausleiter J, et al. Intra-aortic balloon counterpulsation in acute myocardial infarction complicated by cardiogenic shock (IABP-SHOCK II): final 12 month results of a randomised, open-label trial. Lancet. 2013;382:(9905):1638-45.
26. Thiele H, Schuler G, Neumann FJ, Hausleiter J, Olbrich HG, Schwarz B, et al. Intraaortic balloon counterpulsation in acute myocardial infarction complicated by cardiogenic shock: Design and rationale of the Intraaortic Balloon Pump in Cardiogenic Shock II (IABP-SHOCK II) trial. Am Heart J. 2015;169(4):e7–8. doi:10.1016/j.ahj.2015.01.009.
27. Unverzagt S, Buerke M, de Waha A, Haerting J, Pietzner D, Seyfarth M, et al. Intra-aortic balloon pump counterpulsation (IABP) for myocardial infarction complicated by cardiogenic shock. Cochrane Database Syst Rev. 2015;27;3:CD007398.
28. Levine GN, O’Gara PT, Bates ER, Blankenship JC, Kushner FG, Bailey SR, et al. 2015 ACC/AHA/SCAI Focused Update on Primary Percutaneous Coronary Intervention for Patients With ST-Elevation Myocardial Infarction: An Update of the 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention and the 2013 ACCF/AHA Guideline for the Management of ST--Elevation Myocardial Infarction: A Report of the American Col-lege of Cardiology/ American Heart Association Task Force on Clinical Practice Guidelines and the Society for Cardiovascular Angiography and Interventions. J Am Coll Cardiol. 2015 Octber 21, doi:10.1016/j.jacc.2015. 10.005.
29. de Waha S, Desch S, Eitel I, Fuernau G, Lurz P, de Waha A, et al. What is the evidence for IABP in STEMI with and without cardiogenic shock? Ther Adv Cardiovasc Dis. 2012; 6(3):123-32.
30. Acharji S, Mathur A, Lakshmanadoss U, Prasad H, Singh M, Ka-luski E. Have we given up on intra-aortic balloon counterpulsation in post-myocardial infarction cardiogenic shock? Clin Cardiol. 2013;36(11):704-10.
31. Sakamoto S, Taniguchi N, Nakajima S. Extracorporeal life support for cardiogenic shock or cardiac arrest due to acute coronary syndrome. Ann Thorac Surg. 2012;94(1):1–7.
32. Bermudez CA, Rocha RV, Toyoda Y, Zaldonis D, Sappington PL, Mulukutla S, et al. Extracorporeal membrane oxygenation for advanced refractory shock in acute and chronic cardiomyopathy. Ann Thorac Surg. 2011;92(6):2125–31.
33. Sheu JJ, Tsai TH, Lee FY, Fang HY, Sun CK, Leu S, et al. Early extracorporeal membrane oxygenator-assisted primary percu-taneous coronary intervention improved 30-day clinical outco-mes in patients with ST-segment elevation myocardial infarction complicated with profound cardiogenic shock. Crit Care Med. 2010;38(9):1810–17.
34. Tayara W, Starling RC, Yamani MH, Wazni O, Jubran F, Smedira N. Improved survival after acute myocardial infarction complicated by cardiogenic shock with circulatory support and transplantation: comparing aggressive intervention with conservative treatment. J Heart Lung Transplant. 2006;25(5):504-9.
35. Chen JS, Ko WJ, Yu HY, Lai LP, Huang SC, Chi NH, et al. Analysis of the outcome for patients experiencing myocardial infarction and cardiopulmonary resuscitation refractory to conventional therapies necessitating extracorporeal life support rescue. Crit Care Med. 2006;34(4):950–7.
36. Jaski BE, Lingle RJ, Overlie P, Favrot LK, Willms DC, Chillcott S, et al. Long-term survival with use of percutaneous extracorporeal life support in patients presenting with acute myocardial infarction and cardiovascular collapse. ASAIO J. 1999;45(6):615–8.
37. Kim H, Lim SH, Hong J, Hong YS, Lee CJ, Jung JH, et al. Efficacy of veno-arterial extracorporeal membrane oxygenation in acu-te myocardial infarction with cardiogenic shock. Resuscitation 2012;83(8):971–5.
38. Tang GH, Malekan R, Kai M, Lansman SL, Spielvogel D. Peripheral venoarterial extracorporeal membrane oxygenation improves survival in myocardial infarction with cardiogenic shock. J Thorac Cardiovasc Surg. 2013;145(3):e32–3.
39. Engström AE, Cocchieri R, Driessen AH, Sjauw KD, Vis MM,
PAPEL DO SUPORTE CIRCULATÓRIO NAS SíNDROMES CORONARIANAS AGUDAS
rev Soc Cardiol estado de São paulo 2016;26(2):134-40

140
Baan J, et al. The Impella 2.5 and 5.0 devices for ST-elevation myocardial infarction patients presenting with severe and profound cardiogenic shock: the Academic Medical Center intensive care unit experience. Crit Care Med. 2011;39(9):2072–9.
40. Seyfarth M, Sibbing D, Bauer I, Fröhlich G, Bott-Flügel L, Byrne R, et al. A randomized clinical trial to evaluate the safety and efficacy of a percutaneous left ventricular assist device versus intra-aortic balloon pumping for treatment of cardiogenic shock caused by myocardial infarction. J Am Coll Cardiol. 2008;52(19):1584–8.
41. Thiele H, Sick P, Boudriot E, Diederich KW, Hambrecht R, Niebauer J, et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by car-diogenic shock. Eur Heart J. 2005;26(13):1276–83.
42. Aiba T, Nonogi H, Itoh T, Morii I, Daikoku S, Goto Y, et al. Appro-priate indications for the use of a percutaneous cardiopulmonary support system in cases with cardiogenic shock complicating acute myocardial infarction. Jpn Circ J. 2001;65(3):145–9.
43. Thiele H, Lauer B, Hambrecht R, Boudriot E, Cohen HA, Schuler G. Reversal of cardiogenic shock by percutaneous left atrial-to-femo-ral arterial bypass assistance. Circulation. 2001;104(24):2917– 22.
44. Smalling RW, Sweeney M, Lachterman B, Hess MJ, Morris R, Anderson HV, et al. Transvalvular left ventricular assistance in cardiogenic shock secondary to acute myocardial infarction. Evidence for recovery from near fatal myocardial stunning. J Am Coll Cardiol. 1994;23(3):637–44.
45. Lauten A, Engström AE, Jung C, Empen K, Erne P, Cook S, et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EURO-
-SHOCK-registry. Circ Heart Fail. 2013;6(1):23–30.
46. Anderson M, Smedira N, Samuels L, Madani M, Naka Y, Acker M, et al. Use of the AB5000 ventricular assist device in cardio-genic shock after acute myocardial infarction. Ann Thorac Surg. 2010;90(3):706–12.
47. Entwistle JW 3rd, Bolno PB, Holmes E, Samuels LE. Improved survival with ventricular assist device support in cardiogenic shock after myocardial infarction. Heart Surg Forum. 2003;6:316–19.
48. Leshnower BG, Gleason TG, O’Hara ML, Pochettino A, Woo YJ, Morris RJ, et al. Safety and efficacy of left ventricular assist device support in postmyocardial infarction cardiogenic shock. Ann Thorac Surg. 2006;81(4):1365–70.
49. Dang NC, Topkara VK, Leacche M, John R, Byrne JG, Naka Y. Left ventricular assist device implantation after acute anterior wall myocardial infarction and cardiogenic shock: a two-center study. J Thorac Cardiovasc Surg. 2005;130(3):693–8.
50. Chen JM, DeRose JJ, Slater JP, Spanier TB, Dewey TM, Catanese KA, et al. Improved survival rates support left ventricular assist device implantation early after myocardial infarction. J Am Coll Cardiol. 1999;33(7):1903–8.
51. Hendry PJ, Masters RG, Mussivand TV, Smith S, Davies RA, Finlay S, et al. Circulatory support for cardiogenic shock due to acute myocardial infarction: a Canadian experience. Can J Cardiol. 1999;15(10):1090–4.
52. O’Gara PT, Kushner FG, Ascheim DD, Casey DE Jr, Chung MK, de Lemos JA, et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American Col-lege of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013;127(4):e362–425.
rev Soc Cardiol estado de São paulo 2016;26(2):134-40



Com objetivo de treinar profissionais da saúde e a população leiga para reconhecer e lidar com situações de emergência cardíaca, os treinamentos ministrados pelo centro utilizam equipamentos e salas modernas, o que garante o máximo realismo à situação simulada. Os instrutores são altamente capacidados e credenciados, de acordo com as regras e especificações da American Heart Association (AHA).Conheça mais sobre os cursos e inscreva-se!
Credenciamento:
ACLS – Suporte Avançado de Vida em Cardiologia
ACLS EP (EXPERIENCED PROVIDER)
BLS – Suporte Básico de Vida
FIRST AID – Primeiros Socorros e Salva-Corações com DEA / DAE
PALS – Suporte Básico de Vida em Pediatria
SAVIC – Suporte Avançado de Vida em Insuficiência Cardíaca
ESTEJA PREPARADO PARA SITUAÇÕES DE EMERGÊNCIA
WWW.SOCESP.ORG.BR/CENTRO_TREINAMENTO/Saiba mais e inscreva-se em:
Participe dos cursos do Centro de Treinamento
Socesp_CentroTreinamento2015_Anuncio_Aprovado.indd 1 13/02/15 13:23