4. aminoacidos
-
Upload
neils-jean-pol-loayza-delgado -
Category
Education
-
view
176 -
download
1
Transcript of 4. aminoacidos

AMINOACIDOS

Aminoácido• Los aminoácidos son los monómeros de las
proteínas.• Los aminoácidos están formados por:
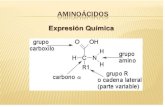
– Un carbono unido a un grupo carboxilo.– Un grupo amino– Un hidrógeno y – Una cadena R de composición variable
• En los aminoácidos naturales, el grupo amino y el grupo carboxil se unen al mismo carbono que recibe el nombre de alfa asimétrico.
• Existen unos 20 aminoácidos distintos componiendo las proteínas.
• Técnicamente hablando, se les denomina alfa-aminoácidos, debido a que el grupo amino (–NH2) se encuentra a un átomo de distancia del grupo carboxilo (–COOH).

Fórmula general
• Carbono α, es un carbono quiral por lo tanto hay enantiomeros (isomeros ópticos).

Alanina
Acido Aspártico
Arginina
Ejemplos de cadenas residuales
• Fenilalanina

Aminoácidos estándar
• Hay veinte α-aminoácidos, denominados aminoácidos estándar, que prácticamente se encuentran en todas las proteínas
• Los aminoácidos estándar difieren unos de otros en la estructura de las cadenas laterales enlazadas a los átomos de carbono α.



Clasificación de AA• Existen muchas formas de clasificar los aminoácidos.
– Según las propiedades de su cadena. (características químicas)– Según su obtención.
SEGÚN LA CADENA
• Neutros polares, polares o hidrófilos : Serina (Ser,S), Treonina (Thr,T), Cisteína (Cys,C), Asparagina (Asn,N), Glutamina (Gln,Q) y Tirosina (Tyr,Y).
• Neutros no polares, apolares o hidrófobos: Glicina (Gly,G), Alanina (Ala,A), Valina (Val,V), Leucina (Leu,L), Isoleucina (Ile,I), Metionina (Met,M), Prolina (Pro,P), Fenilalanina (Phe,F) y Triptófano (Trp,W).
• Con carga negativa, o ácidos: Ácido aspártico (Asp,D) y Ácido glutámico (Glu,E).
• Con carga positiva, o básicos: Lisina (Lys,K), Arginina (Arg,R) e Histidina (His,H).
• Aromáticos: Fenilalanina (Phe,F), Tirosina (Tyr,Y) y Triptofano (Trp,W) (ya incluidos en los grupos neutros polares y neutros no polares).

9
CLASIFICACIÓN DE LOS AMINOÁCIDOS. 1
aa
NO POLARES
CON N BÁSICO
ALIFÁTICOS
AROMÁTICOS
POLARES SIN CARGA
CON GRUPOS ÁCIDOS
POLARES CON CARGA

10
No polares alifáticos
H2N CH C
H
OH
O
H2N CH C
CH3
OH
O
H2N CH C
CH
OH
O
CH3
CH3
H2N CH C
CH2
OH
O
CH CH3
CH3
GLICINA Gli
ALANINA Ala VALINA Val
LEUCINA Leu
H2N CH C
CH
OH
O
CH3
CH2
CH3
ISOLEUCINA Ile
HN
C OH
O
PROLINA Pro

11
No polares aromáticos
H2N CH C
CH2
OH
O
H2N CH C
CH2
OH
O
OH
H2N CH C OH
O
FENILALANINA Phe
TIROSINA Tyr
TRIPTOFANO Trp
CH2
HN

12
Polares sin carga
H2N CH C
CH2
OH
O
OH
H2N CH C
CH
OH
O
OH
CH3
H2N CH C
CH2
OH
O
SH
H2N CH C
CH2
OH
O
CH2
C
NH2
O
H2N CH C
CH2
OH
O
C
NH2
O
SERINA Ser
TREONINA Tre
CISTEÍNA Cys
GLUTAMINA Gln
ASPARRAGINA Asn
H2N CH C
CH2
OH
O
CH2
S
CH3
METIONINA Met

13
Con carga
H2N CH C
CH2
OH
O
CH2
CH2
CH2
NH2
H2N CH C
CH2
OH
O
CH2
CH2
NH
C
NH2
NH
H2N CH C
CH2
OH
O
N
NH
LISINA Lis ARGININA
Arg
HISTIDINA Hys
H2N CH C
CH2
OH
O
C
OH
O
H2N CH C
CH2
OH
O
CH2
C
OH
O
ACIDO GLUTÁMICO Glu
ÁCIDO ASPÁRTICO Asp
BÁSICOS (O CARGADOS +)ÁCIDOS (O CARGADOS -)

Según su obtención• No pueden ser obtenidos por biotransformacion propia.
Deben ser ingeridos.
• Para humanos, los aminoácidos esenciales son:• Valina (Val) • Leucina (Leu) • Treonina (Thr) • Lisina (Lys) • Triptófano (Trp) • Histidina (His) • Fenilalanina (Phe) • Isoleucina (Ile) • Arginina (Arg) (Requerida en niños y tal vez ancianos) • Metionina (Met)

Valor biologico de las proteinas• El grado de utilidad de una proteína no sólo depende de su digestión y
absorción, sino de su uso después de la absorción. Una medida común de evaluar las proteínas es en base a su Valor Biológico (VB). La fórmula es:
• VB= N consumido - (N fecal +N urinario) X 100• N consumido- N fecal• N=nitrógeno• El valor biológico se define como el porcentaje de Nitrógeno (N)
absorbido en el tubo digestivo, y que se halla disponible para las funciones corporales relacionadas con la producción. Los números más próximos a 100, indican un mayor valor biológico
• Determinación: Se mide el consumo total de Nitrógeno (N), y se mide la excreción del N tanto en la orina como en el excremento.
• Existen otras medidas menos usuales de la calidad de una proteína y son la Relación de eficiencia proteínica (REP), Aprovechamiento neto de la proteína (ANP), y el valor proteico neto (VPN).

Aminoácidos no proteicos• Son derivados de otros aminoácidos, es decir, se incorporan a la proteína
como uno de los aminoácidos proteicos y, después de haber sido formada la proteína, se modifican químicamente; por ejemplo, la hidroxiprolina.

Serotonina.• La serotonina (5-hidroxitriptamina o 5-HT) es una monoamina
neurotransmisora sintetizada en las neuronas serotoninérgicas del sistema nervioso central (SNC) y en las células enterocromafines del tracto gastrointestinal de animales. La serotonina también se encuentra en varias setas y plantas.
• Entre las principales funciones de la serotonina está la de regular el apetito mediante la saciedad, equilibrar el deseo sexual, controlar la temperatura corporal, la actividad motora y las funciones perceptivas y cognitivas.

Carboxiglutamato • Principal componente de la
protrombina• Contiene 6 residuos de g-
carboxiglutamato en la región aminoterminal, a los que se unen iones calcio para facilitar la unión de la proteína a su complejo de activación sobre la membrana de la célula en los sitios lesionados.
• La protrombina se encuentra en plasma circulante en forma de grános de zimógeno protrombínico, una proteína de contiene 582 residuos de aminoácidos. También se la denomina factor II de la coagulación.

Tipos de proteinas
•Proteinas simples. solo están compuestas de aminoácidos•Composición: C= 50%, O=23%, N=16%, H=7%, S=3%.•Ejplo. Gluten.•Analisis de Kjeldhal. P = Np(100/16)•Proteinas conjugadas. Ej. hemoglobina

PROPIEDADES DE AMINOACIDOS• Ácido-básicas.
– Cualquier aminoácido puede comportarse como ácido y como base, se denominan sustancias anfóteras.
– Cuando una molécula presenta carga neta cero está en su punto isoeléctrico.
– Se comportan como sustancias tampón. • Ópticas.
– Todos los aminoácidos excepto la glicina, tienen el carbono alfa asimétrico lo que les confiere actividad óptica.
• Químicas. – Las que afectan al grupo carboxilo (descarboxilación). – Las que afectan al grupo amino (desaminación). – Las que afectan al grupo R.

• En medio acido, los aminoácidos están totalmente protonados y tienen carga positiva (forma catiónica).
• En Solución casi neutra, los aminoácidos existen como iones dipolares. estos iones también se conocen como zwitteriones.
• Para pH altos, los aminoácidos se cargan negativamente (forma aniónica) porque los iones hidróxido sacan los H+ de las moléculas.
1.- Propiedades ionicas

Curvas de titulacion
• Para un amicoacido monoaminico y monocarboxilo

Curva de valoración de la glicina
El pH controla la carga de la glicina: catiónica por debajo de pH = 2.3; aniónica por encima de pH = 9.6 y zwitteriónica entre pH = 2.3 y 9.6. El pH isoeléctrico es 6.0.
El punto isoeléctrico es el pH al que el aminoácido se encuentra en equilibrio entre las dos formas, como el zwitterión dipolar con una carga neta de cero.

Ejemplo, la valina:• a pH 1: carboxilo como -COOH y amino como -
NH3+. El aminoácido tiene carga positiva neta.
• A pH 7, el carboxilo se disocia (-COO-) y el amino sigue protonado (-NH3
+); (zwitterion). • A pH 13, el carboxilo sigue disociado (-COO-) y el
amino pierde el protón ( -NH2); el aminoácido queda con una carga negativa.

pKa•Es una forma simplificada de observar la constante de equilibrio K•La ecuación de Henderson-Hasselbach rige la disociación de cualquier ácido o base débil a un pH determinado. •La ecuación implica el uso de las concentraciones de equilibrio del ácido y su base conjugada. Para el cálculo del pH en soluciones buffer.
Donde, HA H+ + A- Ka = [ H+][A-]
[HA]
pH = -log [ H+]


Punto isoelectrico
• pH en el cual un aminoácido tiende a adoptar una forma dipolar neutra.
• La solubilidad en agua de un aminoácido es mínima en su punto isoeléctrico.

PROPIEDADES QUIMICAS
• Formación de enlaces peptidicos.• Reacciones del grupo amino.• Reacciones del grupo carboxilo.• Reacciones del grupo R• Estereoisomerismo,

29
Formación de enlaces PEPTÍDICOS:

Los aminoácidos se pueden unir por enlaces peptídicos
Dos aminoácidos
Eliminación de unamolécula de agua
... Formación del enlace CO- ‐NH
Enlace peptidico
Extremo aminoExtremo carboxilo

Reacciones del grupo amino
• La ninhidrina reacciona con el grupo amino, lo oxida y libera amonio el cual se condensa con la ninhidrina reducida, y con otra molécula de ninhidrina libre, para producir un producto púrpura.

reacción de la ninhidrina• Es una de la reacciones más importantes, la cual se ha
utilizado durante muchos años para detectar y cuantificar a.a. en cantidades del orden del microgramo.
• La ninhidrina descarboxila por oxidación los -a.a. a CO2 y un aldehído, formándose un complejo de color azul-púrpura (l : 570 nm).
• Los a.a. Como la, prolina e hidroxiprolina, producen un color amarillo con ninhidrina.

Otras reacciones
• Prolina e hidroxiprolina, producen color amarillo con ninhidrina.
• REACCION CON DINITROFLUOROBENCENO. • Principal aplicación. Determinación del residuo N-terminal
de cadenas peptidicas.• El complejo formado es el dinitrofenil (DNP) de color
amarillo.
• REACCION CON FENILISOTIOCIANATO.• Reacción de Edman. Con cloruro de dansilo.• Aplicación principal: determinar la secuencia de cadenas
peptídicas desde el extremo N-terminal.

Reacciones del grupo COO-•Con bromohidruro de litio.
•REACCIONES DEL GRUPO R.•Reacciones específicas:•Reacción de Millon.(mercurio en acido nítrico fumante) Tirosina- rosado•Reacción de Sullivan.(cianuro sódico al 5%). Cisteina- rojo•Reacción de Folin.(1,2-naftoquinon-4-sulfonato sódico al 0,2%, hidróxido sódico al 10%). Metionina. Rojo.•Reacción de Sakaguchi: (arginina) •El grupo guanidino del aminoácido arginina se condensa con el alfa-naftol del reactivo, y luego forma un complejo coloreado con el hipoclorito de sodio

Reacción de los aminoácidos azufrados• Se basa en la separación mediante un álcali, del azufre de los
aminoácidos, el cual al reaccionar con una solución de acetato de plomo, forma el sulfuro de plomo (negro).
• Técnica:• Poner en tubo de ensayo de 2 a 3ml de albúmina de huevo (clara).• Añadir 2ml de solución de hidróxido sódico al 20%.• Añadir 10 gotas de solución de acetato de plomo al 5%.• Calentar el tubo hasta ebullición.• Si se forma un precipitado de color negruzco nos indica que se ha
formado sulfuro de plomo, utilizándose el azufre de los aminoácidos, lo que nos sirve para identificar proteínas que tienen en su composición aminoácidos con azufre.

Estereoismerismo de aminoácidos• Isómeros: dos o mas compuestos que tienen el mismo
numero, clase de átomos y PM.• Isomería estructural.• Estereoisomería.
– Isómeros geométricos. Cis- trans.– Enantiomeros. Isómeros ópticos. L. D

Enantiomeros• Los aminoácidos que tienen un centro asimétrico en el carbono
alfa pueden existir en dos formas, (D y L), las cuales son imágenes al espejo una de la otra.
• Las dos formas enantiómeras tienen las mismas propiedades físicas excepto la interacción con la luz polarizada en un plano: un isómero desvía el plano de polarización hacia la derecha, mientras el otro isómero lo desvía en la dirección contraria.
• Las dos formas en cada par son denominadas estereoisómeros, isómeros ópticos o enantiómeros.
• Todos los aminoácidos que se encuentran en las proteínas son de configuración L.
• No obstante los aminoácidos de configuración D son encontrados en algunos antibióticos y en paredes de células bacterianas.

Aminoacidos D• Un grupo de científicos de la Universidad de Harvard, con
la colaboración de investigadores del Centro Biología Molecular Severo Ochoa del Consejo Superior de Investigaciones Científicas (CSIC), ha descubierto que las bacterias liberan D-aminoácidos, que son capaces de modular la biosíntesis del peptidoglicano --principal componente de la pared celular bacteriana-- para adaptarse a los cambios ambientales y a "condiciones adversas".
• Los priones tienen aminoacidos DEXTROGIROS, y estan presentes en los hongos Streptomyces y Actinomyces, tambien en las bacterias llamadas Bacillus esporulados.

PROPIEDADES OPTICAS•Cromóforo. Molécula capaz de absorber luz a cierta longitud de onda
•Los aromáticos absorben a 280 nm•Los demás a 220 nm

Determinacion espectrometrica
• La espectroscopia ultravioleta-visible o espectrofotometría ultravioleta-visible (UV/VIS) es una espectroscopia de emisión de fotones y una espectrofotometría.
• Utiliza radiación electromagnética (luz) de las regiones visible, ultravioleta cercana (UV) e infrarroja cercana (NIR) del espectro electromagnético, es decir, una longitud de onda entre 380nm y 780nm.
• La radiación absorbida por las moléculas desde esta región del espectro provoca transiciones electrónicas que pueden ser cuantificadas.
• Deben formarse complejos con ninhidrina, etc.

SEPARACION DE AMINOACIDOS
• Destrucción de proteínas.• Los a.a. son liberados de las proteínas mediante una
hidrólisis, obtenido por cocción con HCl 6N.
Cromatografía:• En todas las separaciones cromatográficas, las
moléculas son separadas dentro de una fase estacionaria y una móvil.
• Dependiéndo del tipo de fase estacionaria podemos distinguir: cromatografía en papel, cromatografía en capa fina, o cromatografía en columna.
• La separación depende de la tendencia relativa de las moléculas en la mezcla de asociarse con más fuerza a una o a otra fase.

Cromatografía en papel
• Las muestras se aplican en un punto marcado aprox. A 5 cm del extremo de una tira de papel filtro, y ésta se suspende en un recipiente sellado que contiene el solvente cromatográfico (para a.a. son mezclas de agua, alcoholes y ácidos o bases, constituyendo la fase móvil).
• La fase movil asciende por capilaridad. Cuando ha avanzado hasta el otro extremo, la tira se seca y se trata para permitir la visualización de las moléculas de interés (ej.: para a.a. se trata con ninhidrina al 0.5% en acetona, seguida de calentamiento de 90-100° C durante unos minutos).

• La relación entre la distancia recorrida por un a.a. con la distancia que viaja el solvente, medidas ambas desde el sitio marcado para la aplicación de la mezcla de a.a., se asigna como valor Rf (movilidad relativa con el sustrato) de ese a.a.
• La movilidad puede expresarse en relación a la de un estandar

Rf: La relación entre las distancias recorridas por incompuesto dado y el frente de la fase móvil, desde el origen del cromatograma se conoce como Rf (rate factor), y tiene un valor constante para cada sustancia en unas condiciones cromatográficas dadas (temperatura, composición de fase móvil, tamaño de la cubeta...etc). El cálculo del Rf se realiza según:

Fundamento • Los a.a. con grandes cadenas laterales no polares (Leu, Ileu, Fen, Trip, Val,
Met, Tir) migran más que que aquellos con cadenas laterales mas cortas no polares (Pro, Ala, Gli) o con cadenas laterales polares (Thr, Glu, Ser, Arg, Asp, His, Lis, Cis).
• Esto refleja la mayor solubilidad relativa de las moléculas polares en la fase estacionaria hidrofílica, y de las moléculas no polares en solventes orgánicos.

Cromatografía en capa fina. Es muy similar a la
cromatografía en papel, pero se utiliza como fase estacionaria unos soportes adsorbentes como celulosa pulverizada o gel de sílica, incorporados en capa fina sobre una placa de vidrio.
La cromatografía en capa fina de adsorción se aplica a sustancias apolares, como lípidos, no así a a.a. ni la mayoría de los péptidos.

Cromatografía de intercambio iónico
• La columna cromatográfica consiste en un tubo largo relleno de partículas de una resina sintética, que contiene grupos cargados fijos; las que contienen grupos aniónicos se denominan resinas de intercambio catiónico (ej.: resina con grupos –SO3-) y las que contienen grupos catiónicos, resinas de intercambio aniónico.
• La afinidad de cada a.a. por la resina está afectada por el pH (que determinará el estado de ionización de la molécula) y la concentración de iones salinos, que pueda competir con la resina por asociación con el a.a.
• Se puede, por lo tanto, conseguir la separación óptima de los a.a. mediante un cambio gradual del pH o de la concentración salina de la solución que se pase a través de la columna, de manera que se cree un gradiente de pH o de sal.
• Una mejora moderna de ésta y otras técnicas cromatográficas se denomina cromatografía líquida de alta resolución (HPLC).




ElectroforesisCuando una mezcla de moléculas ionizadas y con carga neta son colocadas en un campo eléctrico, estas experimentan una fuerza de atracción hacia el polo que posee carga opuestaDejando transcurrir cierto tiempo las moléculas cargadas positivamente se desplazaran hacia el cátodo (el polo negativo) y aquellas cargadas negativamente se desplazaran hacia el ánodo (el polo positivo).

Separación electroforética.
Representación simplificada de la separación electroforética de la alanina, lisina y ácido aspártico a pH = 6. La lisina catiónica es atraída hacia el cátodo, el ácido aspártico aniónico es atraído hacia el ánodo y la alanina se encuentra en su punto isoeléctrico, por lo que no se mueve

Electroforesis vertical

Determinación de la composición de los aminoácidos.
En el analizador de aminoácidos, el hidrolizado pasa a través de una columna de intercambio iónico. La solución que emerge de la columna se trata con ninhidrina y su absorbancia se registra en función del tiempo. Cada aminoácido se identifica por el tiempo de retención necesario para pasar a través de la columna.