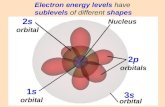
2. Enlace químico e interacciones no covalentes. 1s 1s 2s 2p 2p 2p 1s H He Li Be B C N O F Ne 1s 2s...
-
Upload
edelmira-atencio -
Category
Documents
-
view
32 -
download
4
Transcript of 2. Enlace químico e interacciones no covalentes. 1s 1s 2s 2p 2p 2p 1s H He Li Be B C N O F Ne 1s 2s...

2. Enlace químico e interaccionesno covalentes

1s
1s 2s 2p 2p 2p
1s 2s 2p 2p 2p
1s 2s 2p 2p 2p
1s 2s 2p 2p 2p
1s 2s 2p 2p 2p
1s 2s 2p 2p 2p
1s 2s 2p 2p 2p
1s
H
He
Li
Be
B
C
N
O
F
Ne1s 2s 2p 2p 2p
Estructura electrónica de algunos elementos

A• + B • A+ + :B-
Enlaces iónicos
1. Fuertes (>50 kcal/mol)2. Propios del estado cristalino3. Elementos extremos en la Tabla Periódica

Enlace iónico
Cristal de ClNa

Enlaces covalentes
1. Compartición de electrones en orbitales moleculares2. Estado sólido, líquido y gas3. Fuertes (>50 kcal/mol)4. Tantos como orbitales con electrones desapareados

1s 2s 2p 2p 2p
C
C1s sp3 sp3 sp3 sp3
Hibridación de orbitales
C
1s sp2 sp2 sp2 2p
C1s sp sp 2p 2p
Sin hibridación
sp3: tetraedro
sp2: triángulo
sp: lineal
H2C CH2
H3C CH3
HC CH

H-H 103H-Cl 102HO-H 119H2N-H 107H3C-H 102
Energía de enlaces covalentes, kcal/mol

Enlaces de coordinación
Orbital molecular formado por:- Un orbital vacío- Un par electrónico
Dador: átomos con pares electrónicos: N, OAceptor: orbital vacío (átomos metálicos)

N
N
N
N
N
Fe++
Fe++N
CH3
CHH2C
N
CH2 CH2
CH3
COO-
N
CH
CH2
H3C
N
H3C CH2
CH2
COO-
Complejo octaédrico de Fe++: Grupo hemo

Fe++S
SS
S
CH2
CHNC
O H
CH2
CH2
CH2CH CH
CH
C
N N
NC
O H
C O
H
O
H
H
HH
H
Complejo tetraédricode Fe++/Fe+++: Rubredoxina

Interacciones débiles
1. Fuerzas de van der Waals
2. Enlaces de hidrógeno
3. Interacciones iónicas o salinas

nRT = PV (Gas perfecto)
nRT = (P + a/V2)(V- b) (Gas real)
Fuerzas de van der Waals
a: Atracción intermolecularb: Volumen de la molécula
1. Dipolos transitorios2. Dipolos inducidos3. Dipolos permanentes

Momento dipolar,
H2 0Cl2 0HF 1.91HCl 1.08H2O 1.85NH3 1.47CH4 0

Fuerzas de van der Waals
- Son interacciones muy débiles- En el medio biológico tienen importancia en ausencia de agua- Rotas por detergentes

Compuestos hidrofóbicos
ColesterolBenceno
Decano

Compuestos polaresAgua
D-GlucosaATP
L-Arginina

Compuestoanfipático
(Gangliósido GM1)

Bicapa lipídica Micela

Enlaces de hidrógeno
- Compartición de un protón entre dos pares electrónicos
- Dador: Grupo X-H con cierto momento dipolar- Aceptor: Grupo Y: con un par electrónico- Débil (mucho más fuerte que int. de van der Waals)- Rotas por urea 6M, guanidina 8M

N H :O
H
O H :O
N H :N
H
O H :N
Algunos enlaces de hidrógeno

DNAconformación B
Estructuramantenida porenlaces de H

N
NN
N N H
H
O
N
N
O
R
R
CH3
H
Par Adenina-Timina

N
NN
N
R
N H
H
O
N
NHO
H
R
H
Par Guanina-Citosina

Proteínas:Estructura en -hélice
C
O
H
NC
O
N
H
C
C
C
C

Proteínas:Estructura en hoja plegada
C
O
H
NC
O
N
H
C
C
C
C

Interacciones iónicas o salinas(No confundir con enlace iónico)
- Entre grupos de carga opuesta en solución- Débiles (más fuertes que int. de van der Waals)- Los iones participantes aparecen solvatados- Rotas por altas concentraciones salinas, extremos de pH

Solvatación de iones en solución

Nucleosoma:
AsociaciónDNA-histonas












![Electron Configuration Na: 1s 2 2s 2 2p 6 3s 1 Na: [Ne] 3s 1.](https://static.fdocuments.net/doc/165x107/56649cdc5503460f949a747c/electron-configuration-na-1s-2-2s-2-2p-6-3s-1-na-ne-3s-1.jpg)
![Q: 1.The lowest first ionisation energy would be associated with which of the following structures? a] 1s 2 2s 2 2p 6 3s 1 b] 1s 2 2s 2 2p 5 c] 1s 2 2s.](https://static.fdocuments.net/doc/165x107/551c0547550346a34f8b4e1b/q-1the-lowest-first-ionisation-energy-would-be-associated-with-which-of-the-following-structures-a-1s-2-2s-2-2p-6-3s-1-b-1s-2-2s-2-2p-5-c-1s-2-2s.jpg)




