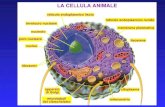
1 La struttura delle proteine (questa versione è priva delle immagini)
-
Upload
ulisse-del-vecchio -
Category
Documents
-
view
218 -
download
0
Transcript of 1 La struttura delle proteine (questa versione è priva delle immagini)

1
La struttura delle proteine
(questa versione è priva delle immagini)

2
Ora ci occuperemo della struttura delle proteine
• La lista di funzioni proposta è uno schema indicativo ed incompleto, che ci aiuta a comprendere un fatto molto generale:
• Le proteine sono gli strumenti che tutte le cellule hanno a disposizione per svolgere le loro attività.
• Le proteine offrono una grande varietà di funzioni, derivanti da una grande varietà di strutture: come sono fatte le proteine?

3
Le proteine sono polimeri
• Una proteina è formata dai seguenti componenti:
• - una o più catene polipeptidiche (catene lineari formate da amminoacidi legati con legami peptidici)
• - alcune proteine contengono un gruppo prostetico di natura non amminoacidica.

4
Struttura generale di un amminoacido
• Un amminoacido è formato da:
• 1) un atomo di carbonio centrale (carbonio α)
• 2) un gruppo carbossilico (acido)
• 3) un gruppo amminico
• 4) un atomo di idrogeno
• 5) un gruppo “R” specifico

5
Gli amminoacidi sono i monomeri delle proteine
• Gli amminoacidi sono molecole adatte a formare lunghe catene.
• Il gruppo amminico di un amminoacido si lega con il gruppo carbossilico di un altro amminoacido, il quale a sua volta si può legare ad un terzo amminoacido mediante il proprio gruppo amminico, e così via.
• Questo legame fra amminoacidi si chiama legame peptidico.

6
Il legame peptidico è una condensazione
• (il carbonio in colore è il carbonio α di ciascun amminoacido)
• Abbiamo ottenuto un dipeptide.
+
+ H20

7
dipeptide + amminoacido = tripeptide
+
+ H20

8
Il polimero si chiama polipeptide
• Aggiungendo altri amminoacidi uno alla volta otteniamo un polipeptide della dimensione voluta.
• I polipeptidi delle proteine sono formati da decine o anche centinaia di amminoacidi.
• Come vedremo ogni proteina è formata da un preciso numero di amminoacidi (nei polisaccaridi invece il numero dei monomeri è variabile).

9
Il polipeptide ha due estremità diverse
• Uno dei due amminoacidi terminali possiede un gruppo amminico libero, l’altro possiede un gruppo carbossilico libero.
• Il primo rappresenta l’estremità ammino-terminale (N-terminale) del polipeptide.
• Il secondo è l’estremità carbossi-terminale del polipeptide (C-terminale).
• I polipeptidi si accrescono in direzione N-terminale → C-terminale.

10
I gruppi R
• Gli amminoacidi possono essere diversi fra loro a seconda della struttura chimica del residuo R.
• Per formare le proteine le cellule utilizzano 20 amminoacidi diversi.
• I gruppi R pertanto sono di 20 specie.
• Questi venti amminoacidi sono gli stessi per tutte le specie di organismi.

11

12
Quante proteine diverse si possono formare?
• Se leghiamo due amminoacidi possiamo avere 20 x 20 = 400 specie di dipeptidi diversi.
• Se leghiamo tre amminoacidi possiamo avere 20 x 20 x 20 = 8000 specie di tripeptidi diversi.
• Provate a calcolare il numero di peptidi diversi formati da 10 amminoacidi.

13
La variabilità delle proteine determina la varietà biologica
• Quante proteine diverse si possono ottenere legando centinaia di amminoacidi per formare dei polipeptidi?
• Il numero è praticamente infinito, e da questa varietà di strutture deriva una varietà di funzioni.
• Questo rende possibile l’esistenza di un grande numero di forme di vita, la maggior parte delle quali formate da tipi diversi di cellule, e nelle quali ciascuna cellula svolge diverse attività a seconda del momento.

14
Studiare la biologia significa soprattutto studiare il funzionamento delle proteine
• Ogni altro tipo di biomolecola si ottiene mediante l’azione di determinate proteine, interagisce con delle proteine, e le stesse proteine interagiscono con altre proteine.
• Oggi si parla molto del DNA, che è una molecola importante per comprendere il funzionamento di un organismo: come vedremo il DNA non ha una propria funzione operativa, ma serve in definitiva per costruire determinate proteine, in determinate cellule, in una determinata fase della vita cellulare: il DNA è un progetto, le proteine sono la realizzazione del progetto.

15
Un esempio di proteina
• Val His Leu Thr Pro Glu Glu Lys Ser Ala Val Thr Ala Leu Trp Gly Lys Val Asn Val Asp Glu Val Gly Gly Glu Ala Leu Gly Arg Leu Leu Val Val Tyr Pro Trp Thr Gln Arg Phe Phe Glu Ser Phe Gly Asp Leu Ser Thr Pro Asp Ala Val Met Gly Asn Pro Lys Val Lys Ala His Gly Lys Lys Val Leu Gly Ala Phe Ser Asp Gly Leu Ala His Leu Asp Asn Leu Lys Gly Thr Phe Ala Thr Leu Ser Glu Leu His Cys Asp Lys Leu His Val Asp Pro Glu Asn Phe Arg Leu Leu Gly Asn Val Leu Val Cys Val Leu Ala His His Phe Gly Lys Glu Phe Thr Pro Pro Val Gln Ala Ala Tyr Gln Lys Val Val Ala Gly Val Ala Asn Ala Leu Ala His Lys Tyr His

16
Questa è la catena β dell’emoglobina umana
• La serie di simboli che abbiamo appena visto è la sequenza di amminoacidi che formano una delle quattro catene (polipeptidi) dell’emoglobina umana.
• Ogni amminoacido è rappresentato da una sigla a tre lettere. Ad esempio il primo amminoacido è la valina (Val), il secondo si chiama istidina (His), e così via.

17
I simboli a lettera unica
• Nei laboratori di biologia si fa molto prima a scrivere le proteine con simboli a una lettera piuttosto che a tre lettere (v. tabella a pag. 45 sul libro). Questo è possibile perché gli amminoacidi sono 20, le lettere dell’alfabeto sono più di 20. La catena β dell’emoglobina umana diventa così:
• V H L T P E E K S A V T A L W G K V N V D E V G G E A L G R L L V V Y P W T Q R F F E S F G D L S T P D A V M G N P K V K A H G K K V L G A F S D G L A H L D N L K G T F A T L S E L H C D K L H V D P E N F R L L G N V L V C V L A H H F G K E F T P P V Q A A Y Q K V V A G V A N A L A H K Y H

18
La sequenza di amminoacidi
• La sequenza di amminoacidi descrive completamente un polipeptide: essa ne rappresenta la formula chimica. È necessario indicare il numero totale di amminoacidi e la specie di amminoacido in ciascuna posizione della catena.
• La sequenza determina tutte le caratteristiche di un polipeptide, strutturali e funzionali.

19
La sequenza è la struttura primaria.
• In base a tutto ciò che abbiamo affermato sulle proteine, è chiara l’importanza della sequenza di amminoacidi: essa determina le caratteristiche di ogni proteina e di conseguenza le caratteristiche della cellula.
• La sequenza di amminoacidi si chiama struttura primaria.

20

21
La mioglobina è una proteina globulare

22

23

24

25
La struttura terziaria
• Essa rappresenta la descrizione completa della conformazione del polipeptide nello spazio.
• Si possono riconoscere due categorie principali.
• - Proteine globulari, generalmente solubili.
• - Proteine fibrose.

26
La cheratina è una proteina fibrosa

27
La struttura quaternaria
• Alcune proteine sono formate non da uno solo ma da più polipeptidi, la descrizione dei legami fra di essi costituisce la struttura quaternaria.
• Si tratta dunque di una struttura “facoltativa”, tuttavia le proteine più interessanti sono quaternarie, il loro funzionamento dipende dal movimento reciproco dei polipeptidi di cui sono formate: queste si chiamano proteine allosteriche.

L’emoglobina è una proteina quaternaria
• Un esempio molto comune di proteina quaternaria (ed allosterica) è l’emoglobina, che si vede nella prossima immagine.
• L’emoglobina è formata da:• - 2 catene α (alfa)• - 2 catene β (beta)• - ogni catena si lega ad un gruppo “eme”, una
molecola non aminoacidica che rappresenta il “cuore” della proteina, cioè il punto dove si lega l’ossigeno; ogni molecola di emoglobina può legare al massimo 4 molecole di ossigeno.

29

30
I venti amminoacidi
Ogni amminoacido nella proteina possiede una sua specificità ed un suo ruolo, in modo che la proteina nel suo insieme sia in grado di svolgere la sua funzione.
• Sostituire anche un solo amminoacido con un altro determina un diverso funzionamento della proteina.

31
Sostituzione puntiforme
• Il sesto amminoacido della catena β dell’emoglobina umana si chiama acido glutammico (Glu, o E).
• Proviamo a sostituire questo acido glutammico, uno dei 146 amminoacidi, con una valina (Val, o V).

32
Una piccola differenza
• V H L T P E E K S A V T A L W G K V N V D E V G G E A L G R L L V V Y P W T Q R F F E S F G D L S T P D A V M G N P K V K A H G K K V L G A F S D G L A H L D N L K G T F A T L S E L H C D K L H V D P E N F R L L G N V L V C V L A H H F G K E F T P P V Q A A Y Q K V V A G V A N A L A H K Y H
• V H L T P V E K S A V T A L W G K V N V D E V G G E A L G R L L V V Y P W T Q R F F E S F G D L S T P D A V M G N P K V K A H G K K V L G A F S D G L A H L D N L K G T F A T L S E L H C D K L H V D P E N F R L L G N V L V C V L A H H F G K E F T P P V Q A A Y Q K V V A G V A N A L A H K Y H

33
• La sostituzione dell’acido glutammico in posizione 6, determina la formazione di legami anomali fra le molecole di emoglobina.

34
• Le particelle di emoglobina, invece di essere solubili nel liquido cellulare, formano dei bastoncini, o fibre, all’interno della cellula.

35
• Le fibre di emoglobina a loro volta modificano la forma della cellula.

36
• Il globulo rosso (eritrocita),assume la forma di una falce con due punte. Questa forma ostacola il passaggio dei globuli rossi nei sottili capillari. Ciò determina una malattia molto grave chiamata anemia falciforme.

37
L’anemia falciforme
• La malattia è molto diffusa nonostante le conseguenze negli omozigoti siano gravi: perché?
• Gli eterozigoti non presentano sintomi, inoltre sono protetti contro il plasmodio della malaria, quindi nelle zone malariche viene favorita la diffusione di questo gene anziché la sua selezione (eliminazione) .

• Le funzioni di una cellula dipendono dalle funzioni delle proteine che essa contiene.
• In particolare sappiamo che ogni cellula controlla le proprie attività mediante l’attività degli enzimi metabolici.

Da cosa dipende la funzione di una proteina?
LA FUNZIONE DI OGNI PROTEINA DIPENDE DALLA SUA STRUTTURA

STRUTTURA QUATERNARIA
• È IL LEGAME FRA PIU’ POLIPEPTIDI NELLA FORMAZIONE DI UNA SINGOLA PROTEINA.
• NON TUTTE LE PROTEINE SONO QUATERNARIE, ALCUNE SONO FORMATE DA UN SOLO POLIPEPTIDE.

41

STRUTTURA TERZIARIA
• È LA FORMA GENERALE DELLA PROTEINA, DIPENDE DAL MODO CON CUI IL POLIPEPTIDE SI RIPIEGA NELLO SPAZIO, STABILIZZATO DA LEGAMI CHE SI FORMANO FRA AMINOACIDI ANCHE LONTANI NELLA SEQUENZA.

43

44
La mioglobina è una proteina globulare

STRUTTURA SECONDARIA
• Alcuni tratti del polipeptide assumono delle forme particolari, in particolare:
• 1) alfa elica
• 2) beta foglietto
• Questo livello di struttura è stabilizzato da legami fra amminoacidi vicini nella sequenza.

Da cosa dipende la struttura di una proteina?
• La struttura quaternaria, terziaria, secondaria dipendono dalla struttura primaria, cioè dalla sequenza di amminoacidi.

cellule diverse in organismi diversi
cellule diverse nello stesso organismo
fasi diverse nella stessa cellulafunzioni delle
proteine
strutture secondaria, terziaria, quaternaria delle proteine
struttura primaria delle proteine
?

• Questo schema ci fa vedere che tutto ciò che avviene in una cellula vivente si riconduce alla struttura primaria (sequenza) delle sue proteine.
• In particolare le proteine che maggiormente influiscono nella modulazione delle attività cellulari sono gli enzimi metabolici.

A questo punto la domanda è: da cosa dipende la struttura
primaria delle proteine presenti in una
cellula?

Questo è il prossimo
argomento che dobbiamo affrontare

fine
51